促红细胞生成素对大鼠肾脏缺血-再灌注损伤的保护作用研究
2017-11-02张炯王佳王芳李贵森
张炯 王佳 王芳 李贵森
·实验研究·
促红细胞生成素对大鼠肾脏缺血-再灌注损伤的保护作用研究
张炯 王佳 王芳 李贵森
目的探讨促红细胞生成素(erythropoietin,EPO)对大鼠肾脏缺血-再灌注损伤(ischemia-reperfusion injury, IRI)的保护作用及机制。方法将30只雄性SD大鼠随机均分成假手术组、模型组和EPO组,每组10只。EPO组在术前1 h给予腹腔注射促红细胞生成素(1 000 U/kg),假手术组和模型组则给予等体积生理盐水腹腔注射。EPO组和模型组夹闭左侧肾蒂45 min,去除右肾,再灌注24 h构建大鼠肾脏IRI模型;假手术组操作同上,但不夹闭左侧肾蒂。恢复肾脏血流灌注24 h后收集大鼠肾脏和血清。采用酶联接免疫吸附剂检测血肌酐(SCr),尿素氮(BUN)、白细胞介素6(interleukin-6,IL-6)、干扰素(inteferon gamma,IFN-γ)、肿瘤坏死因子(tumor necrosis factors-α,TNF-α)以及抗炎细胞因子白介素10(IL-10)和转化细胞生长因子β(transforming growth factor-β,TGF-β)的表达;逆转录聚合酶链反应检测肾脏IL-6、IFN-γ、TNF-α、IL-10和TGF-β的mRNA水平;免疫蛋白印记法检测促红细胞生成素受体(erythropoietin receptor,EPOR)、磷酸化促红细胞生成素受体(p-EPOR)、酪氨酸激酶-2(JAK2)、信号转导及转录激活子3(STAT3)、磷酸化酪氨酸激酶-2(p- JAK2)、磷酸化信号转导及转录激活子3(p-STAT3)表达水平;过雪夫染色检测肾组织病理形态。结果与假手术组相比,模型组p-EPOR、p-JAK2、p-STAT3、SCr、BUN、IL-6、TNF-α、IFN-γ表达水平以及肾组织病理改变均明显增加,而IL-10和TGF-β表达明显减少以及EPOR、JAK2和 STAT3表达无差异;与模型组相比,EPO组p-EPOR、p-JAK2、p-STAT3、IL-10和TGF-β表达增加,而SCr、BUN、IL-6、TNF-α、IFN-γ表达水平以及肾组织病理改变明显减少,而EPOR、JAK2和STAT3表达依然无差异。结论EPO预处理可通过抑制炎症减轻肾脏IRI,其作用机制与进一步促进EPOR/JAK2/STAT3信号途径活化相关。
促红细胞生成素;缺血-再灌注损伤;炎症;肾脏;大鼠
肾脏缺血-再灌注损伤(ischemia-reperfusion injury, IRI)是继发于休克,肾移植和心肺体外大循环手术等的临床危重情况,其发病率高,可严重影响患者肾脏功能及长期预后[1-4]。促红细胞生成素(erythropoietin,EPO)是主要由肾脏分泌的一种激素样物质,因其具有改善肾性贫血的作用而被广泛应用于临床[5-7]。目前有研究证实EPO具有减轻IRI的作用[8],但具体作用目前尚不清楚,因此本研究通过构建肾脏IRI模型来分析、探讨EPO对肾脏IRI的保护作用和机制。
材料与方法
一、材料
1.实验试剂及仪器 促红细胞生成素EPO(四环制药),水合氯醛(谷歌生物);酪氨酸激酶-2(JAK2)、磷酸化酪氨酸激酶-2(p-JAK2)、磷酸化信号转导及转录激活子3 (CST,USA),信号转导及转录激活子3(STAT3)、促红细胞生成素受体(erythropoietin receptor,EPOR)、磷酸化促红细胞生成素受体(p-EPOR) (均来自美国CST公司),白细胞介素6(interleukin-6,IL-6)、肿瘤坏死因子(tumor necrosis factors-α,TNF-α)、干扰素(inteferon gamma,IFN-γ)、转化细胞生长因子β(transforming growth factor-β,TGF-β)、白细胞介素10(IL-10)、ELISA试剂盒(均来自美国Ebioscience公司);β-actin(abgent公司,美国),TRIzol (Invitrogen公司,美国),引物(擎科生物序列见表1)。显微镜(Olympus BX51)及成像系统(HITMAS-30)均为四川省人民医院肾内科病理实验室提供。

表1 为实时定量PCR检测的引物序列
2.实验动物 30只健康雄性SD大鼠(北京华福康),体质量220~250 g,周龄6~8周。动物饲养于四川省人民医院实验动物中心SPF级动物房, 温度为20~25 ℃, 湿度为40%~70%, 光照明暗各12 h, 换气次数为10~20次/h。饲料为SPF级鼠灭菌饲料, 购自四川省医学实验动物中心, 符合GB-15921.2-2014 标准。饮水为经121 ℃ (1.0 kg·cm-2)、30 min 灭菌自来水, 由动物经饮水瓶自由摄取。
二、分组
将SD大鼠按体质量随机分为假手术组、模型组和EPO组。EPO组术前1 h给予EPO(1 000 U/kg)腹腔注射,具体剂量参考相关文献[8];假手术组和模型组则给予等体积腹腔注射生理盐水。模型组和EPO组制备大鼠肾脏IRI模型,假手术组操作同上,但不夹闭左侧肾蒂。具体IRI模型制备方法参考文献[9]:大鼠采用1%戊巴比妥钠(60 mg/kg)腹腔注射麻醉,仰位固定,用无创血管夹夹闭大鼠左侧肾蒂,夹闭45 min后松开无创血管夹恢复灌注,肾脏由暗红色恢复红润表明再灌注成功,同时去除右肾,然后逐层缝合切口。
三、方法
1.标本收集 各组大鼠在肾脏再灌注24 h后, 行腹主动脉取血,室温下3 000 r/min离心10 min后取上清液送医院检验科检测尿素氮(BUN)和血肌酐(SCr)。开腹取左肾,三分之一左肾置于多聚甲醛做石蜡切片,其余组织冻于-80 ℃冰箱。
2.肾脏病理检查 左肾下极组织采用10%多聚甲醛固定,常规脱水浸蜡(Thermo Fisher),石蜡包埋,4 μm切片,脱蜡透明后由肾内科实验室HE试剂进行PAS染色,光镜下观察形态结构并评分。分级评分标准:0,<10%;1,10%~25%;2,25%~50%;3,50%~75%;4,75%~100%[9]
3.Western印迹检测 取肾脏组织,按照每50 mg组织中加入1 ml RIPA裂解液(以1∶50加入50×cocktail),冰上匀浆,裂解30 min后,4 ℃ 12 000 r/min离心30 min后取上清,BCA法测定蛋白浓度,然后上样,电泳,转膜,洗涤,孵育,显影,检测JAK2,STAT3,p-JAK2,p-STAT3,EPOR,p-EPOR表达,具体方法参考相关文献[10]。
4.RT-PCR检测mRNA表达 取适量肾脏,于液氮中研磨成粉末状提取总RNA,紫外分光光度计测定RNA含量。采用TaqMan Reverse Transcription Reagents试剂盒,将mRNA反转录成cDNA。取反转录产物采用Power SYBR Green PCR Master Mix试剂盒进行实时定量PCR反应。PCR以β-actin为内参,具体方法参考相关文献[7],引物序列如表1所示,扩增条件为:95 ℃(10 min)→95 ℃(10 s)→60 ℃(1 min)×40个循环,利用图像分析仪器上进行扫描分析,将IL-6,TNF-α,IFN-γ,IL-10和TGF-β基因扩增产物的密度与β-actin基因扩增产物的密度之比作为基因表达值。
5.ELISA检测细胞因子分泌 按照ELISA试剂盒说明书操作步骤检测血清中IL-6,TNF-α,IFN-γ,IL-10和TGF-β表达水平
四、统计学处理
采用SPSS 12.0统计软件进行分析,实验结果采用均数±标准差表示,资料采用单因素方差分析,多个样本之间的两两比较采用t检验,P<0.05为差异有统计学意义。
结 果
一、EPO预处理对SCr和BUN的影响
与假手术组相比,模型组SCr和BUN表达明显增加(P<0.05),而EPO组与模型组相比,SCr和BUN表达明显降低(P<0.05),结果显示EPO对肾脏IRI有保护作用。(表2)

表2 EPO对肌酐和尿素氮的影响
注:与假手术组比较,aP<0.01;与模型组比较,bP<0.05
二、EPO对肾脏病理结构影响
与假手术组相比,模型组大量肾小管细胞肿胀,空泡变性,坏死,刷状缘脱落和炎症细胞浸润,其损伤评分(3.0±0.5)分,而假手术组为(0.5±0.5)分,IRI可导致肾脏明显病理改变(P<0.05)。EPO组与模型组相比,经EPO预处理后,肾小管细胞肿胀,空泡变性,坏死,刷状缘脱落和炎症细胞浸润明显减少,其损伤评分(1.5±0.5)分。提示,EPO预处理能明显减轻IRI导致的肾脏病理结构改变。(图1)
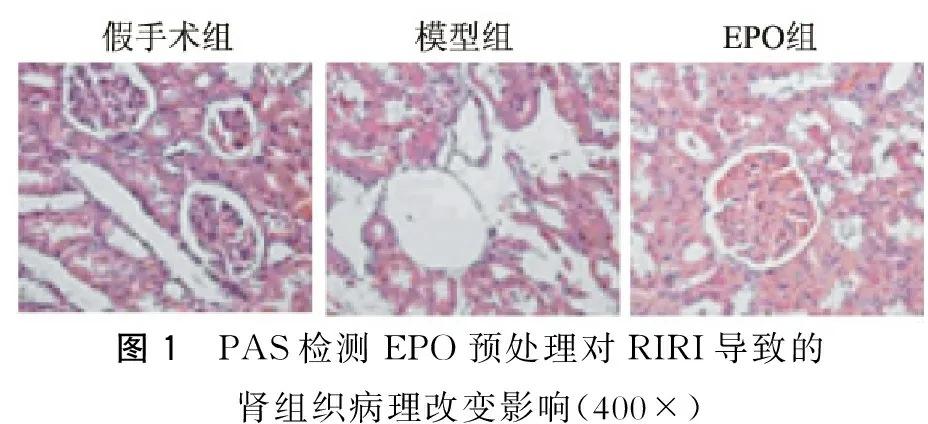
图1 PAS检测EPO预处理对RIRI导致的肾组织病理改变影响(400×)
三、EPO预处理对EPOR/JAK2/STAT3信号通路的影响
与假手术组相比,模型组(p-EPOR,p-JAK2,p-STAT3)表达水平明显增高(P<0.05),而EPOR,JAK2和STAT3表达水平无差异(P>0.05)。与模型组相比,EPO组(p-EPOR,p-JAK2,p-STAT3)表达水平进一步升高(P<0.05)。但EPOR,JAK2和STAT3表达无明显差异(P>0.05)。(图2)
四、EPO对促炎症细胞因子TNF-α,IFN-γ和IL-6的表达影响
RT-PCR和ELISA检测显示模型组与假手术组相比,促炎症细胞因子TNF-α,IFN-γ和IL-6水平明显增高(P<0.05),而EPO组与模型组相比,促炎症细胞因子TNF-α,IFN-γ和IL-6表达水平明显降低(P<0.05)。(图3)
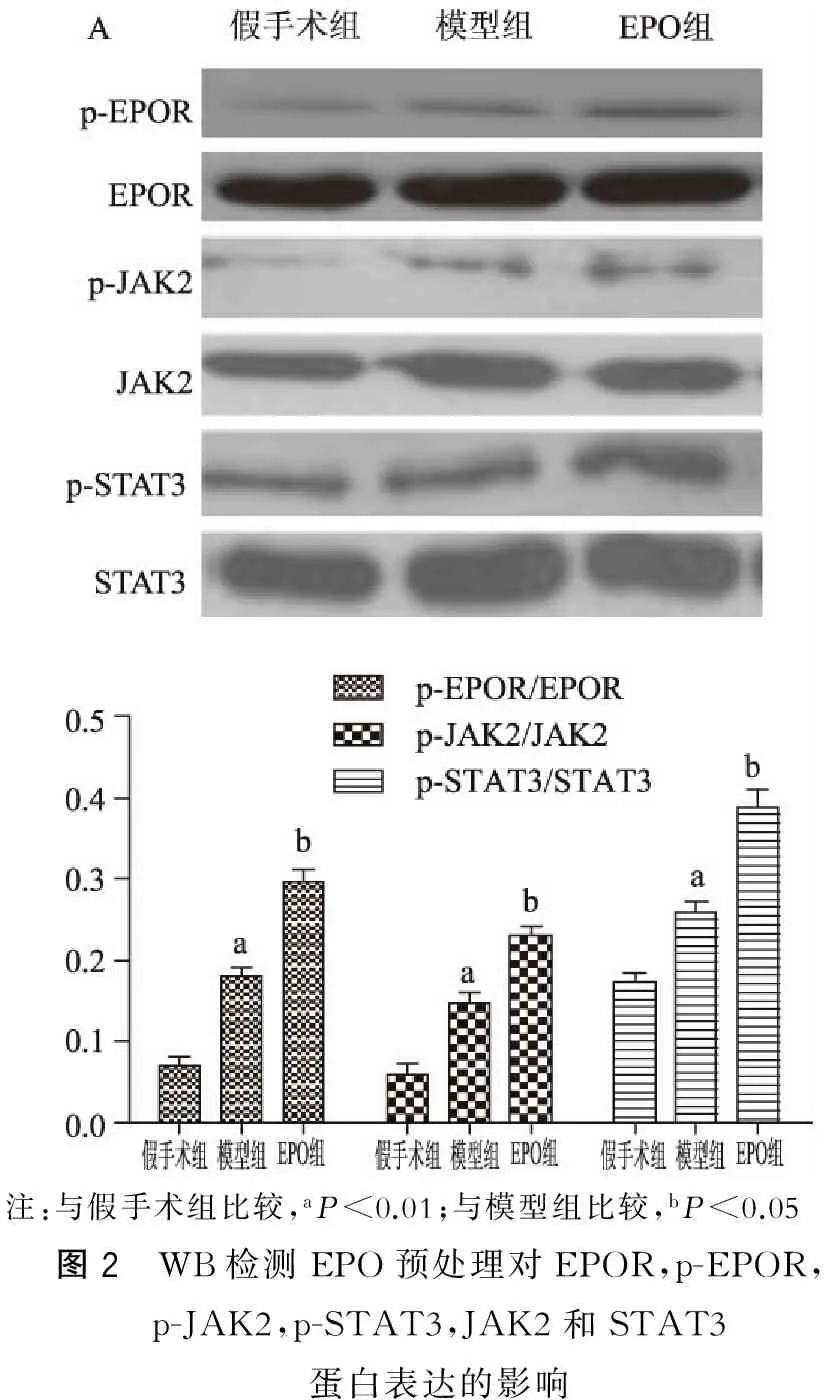
注:与假手术组比较,aP<0.01;与模型组比较,bP<0.05图2 WB检测EPO预处理对EPOR,p-EPOR,p-JAK2,p-STAT3,JAK2和STAT3蛋白表达的影响
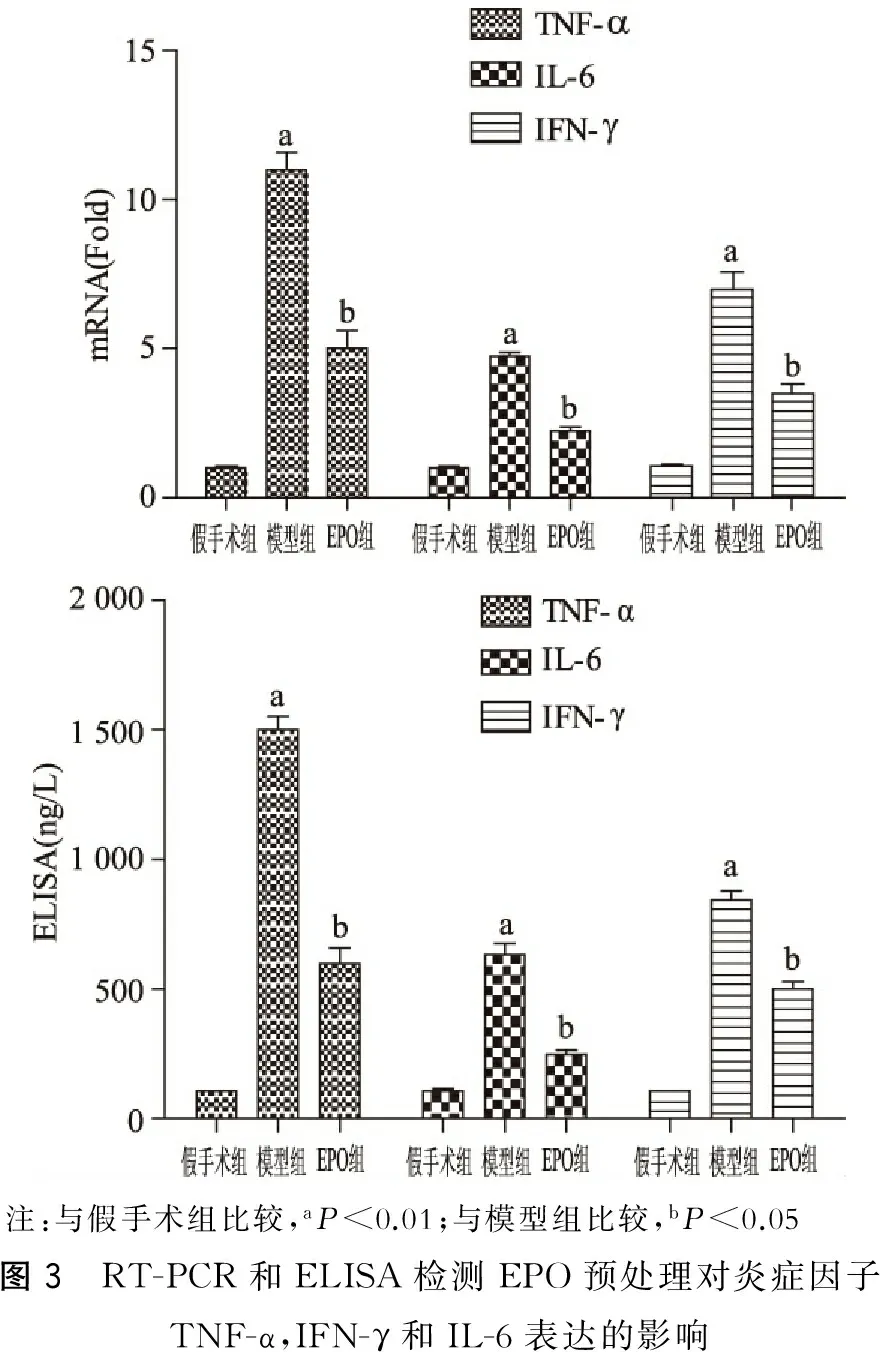
注:与假手术组比较,aP<0.01;与模型组比较,bP<0.05图3 RT-PCR和ELISA检测EPO预处理对炎症因子TNF-α,IFN-γ和IL-6表达的影响
五、EPO对抗炎症细胞因子IL-10和TGF-β的表达影响
RT-PCR和ELISA检测显示:模型组与假手术组相比,抗炎症细胞因子IL-10和TGF-β表达水平明显降低(P<0.05),而EPO组与模型组相比,促炎症细胞因子IL-10和TGF-β表达水平明显增高(P<0.05)。(图4)
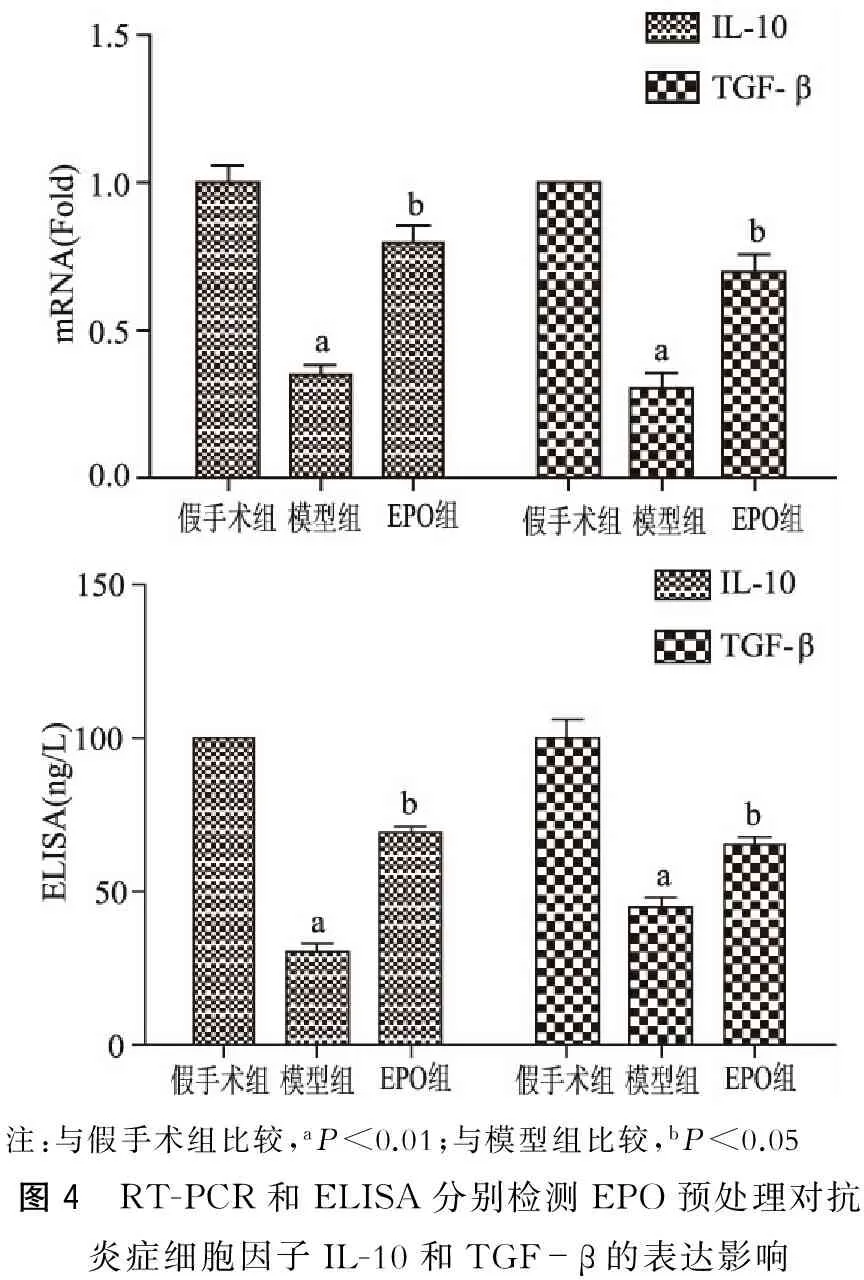
注:与假手术组比较,aP<0.01;与模型组比较,bP<0.05图4 RT-PCR和ELISA分别检测EPO预处理对抗炎症细胞因子IL-10和TGF-β的表达影响
讨 论
实验结果显示,肾脏IRI可导致肾小管扩张,肾小管上皮细胞广泛肿胀,空泡严重变性,坏死,刷状缘的大量脱落,肾间质大量炎症细胞浸润,从而导致肾脏损伤评分明显增加以及SCr、BUN表达明显升高。EPO预处理可明显减低肾脏IRI导致的肾小管扩张,肾小管细胞肿胀,空泡变性,坏死,刷状缘的脱落,肾间质大量炎症细胞浸润,从而使肾脏损伤评分、SCr和BUN明显降低,说明EPO预处理可明显减轻IRI。
近年来的研究表明,肾脏IRI过程中引发的缺氧、氧自由基的大量生成可能参与了肾脏炎性介质的广泛表达,而炎症在IRI的发病中起重要的作用,炎症可加速肾脏IRI的进程并影响其临床转归[11]。肾脏IRI可使机体单核/巨噬细胞、中性粒细胞等处于致敏状态,激发机体产生和释放各种炎性细胞因子及炎性介质,从而进一步加重肾脏损伤。如TNF-α,IL-6,IFN-γ是强有力的促炎症细胞因子,可加强炎症反应、促进肾脏细胞凋亡,肾组织坏死。与TNF-α,IL-6,IFN-γ等促炎症细胞因子不同, IL-10和TGF-β是由多种细胞产生的炎症抑制因子,能够明显下调炎症反应,降低炎症因子对细胞增殖的刺激作用[12],本研究结果显示,肾脏IRI可促进TNF-α,IL-6,IFN-γ的表达,减少IL-10和TGF-β的表达,这与既往的研究结果提示相一致[1]。有实验发现EPO在IRI中可以抑制TNF-α,IL-6,IFN-γ等促炎症细胞因子释放以及增加抗炎细胞因子的表达[12]。本研究结果显示EPO预处理可明显降低TNF-α,IL-6,IFN-γ表达水平以及增加IL-10和TGF-β表达,提示EPO可通过抑制促进抗炎因子的释放和增加抗炎症细胞因子表达,继而控制持续扩大的炎症反应,减轻肾脏IRI。EPO对肾脏IRI的保护作用与抗炎作用相关。
JAK2/STAT3信号通路在机体抗炎症方面发挥重要作用, 越来越多的研究表明JAK2/STAT3通路已成为肾脏疾病治疗的潜在靶点[13]。JAK2是一种与细胞自我保护作用相关的重要转录因子,正常生理状态下,JAK2处于无活性状态, 在缺氧,损伤和氧化应激等有害刺激情况下,可被磷酸化修饰途径激活,进而并识别并结合DNA 上的STAT3, 促进下游炎症基因的转录表达[14-15]。结果显示RIRI可通过磷酸化修饰激活JAK2/STAT3信号通路,促进炎症信号通路的激活。而EPO预处理可进一步激活JAK2/STAT3信号通路,进而诱导下游抗炎细胞因子的表达上调以及促炎细胞因子的表达降低,因既往有研究显示阻断JAK2/STAT3信号通路可加重肾脏IRI,因此该实验未进一步探讨JAK2阻断剂对肾脏IRI的影响,这将是我们需要进一步研究解决的问题。
综上所述,EPO能保护肾脏IRI,其保护机制可能与激活JAK2/STAT3信号通路抑制炎症有关, 本研究结果为临床使用EPO防治肾脏IRI提供了实验依据。
[1] Kusch A, Hoff U, Bubalo G, et al. Novel signalling mechanisms and targets in renal ischaemia and reperfusion injury[J]. Acta Physiol(Oxf), 2013, 208(1): 25-40.
[2] Yang Y, Song M, Liu Y, et al. Renoprotective approaches and strategies in acute kidney injury[J]. Pharmacol Ther, 2016, 163: 58-73.
[3] de Haan JE, Hoorn EJ, de Geus HRH. Acute kidney injury after liver transplantation: Recent insights and future perspectives[J]. Best Pract Res Clin Gastroenterol, 2017, 31(2): 161-169.
[4] Francis A, Baynosa R. Ischaemia-reperfusion injury and hyperbaric oxygen pathways: a review of cellular mechanisms[J]. Diving Hyperb Med, 2017, 47(2): 110-117.
[5] Yang J, Xiao Z, Li T, et al. Erythropoietin promotes the growth of pituitary adenomas by enhancing angiogenesis[J]. Int J Oncol, 2012, 40(4): 1230-1237.
[6] Bartnicki P, Kowalczyk M, Rysz J. The influence of the pleiotropic action of erythropoietin and its derivatives on nephroprotection[J]. Med Sci Monit, 2013, 19(1): 599-605.
[7] Nairz M, Sonnweber T, Schroll A, et al. The pleiotropic effects of erythropoietin in infection and inflammation[J]. Microbes Infect, 2012, 14(3): 238-246.
[8] Zhang J, Zou YR, Zhong X, et al. Erythropoietin pretreatment ameliorates renal ischaemia-reperfusion injury by activating PI3K/Akt signalling[J]. Nephrology (Carlton), 2015, 20(4): 266-272.
[9] Ardalan MR, Estakhri R, Hajipour B, et al. Erythropoietin ameliorates oxidative stress and tissue injury following renal ischemia/reperfusion in rat kidney and lung[J]. Med Princ Pract. 2013, 22(1): 70-74.
[10] Li Y, Zhu W, Tao J, et al. Fasudil protects the heart against ischemia-reperfusion injury by attenuating endoplasmic reticulum stress and modulating SERCA activity: the differential role for PI3K/Akt and JAK2/STAT3 signaling pathways[J]. PloS One, 2012, 7(10): e48115.
[11] Bamgbola OF. Spectrum of anemia after kidney transplantation: pathophysiology and therapeutic implications[J]. Clin Transplant, 2016, 30(10): 1185-1194.
[12] Doi K, Rabb H. Impact of acute kidney injury on distant organ function: recent findings and potential therapeutic targets[J]. Kidney Int, 2016, 89(3): 555-564.
[13] Palagani V, Bozko P, El Khatib M, et al. Combined inhibition of Notch and JAK/STAT is superior to monotherapies and impairs pancreatic cancer progression[J]. Carcinogenesis, 2014, 35(4): 859-866.
[14] Yu HC, Qin HY, He F, et al. Canonical notch pathway protects hepatocytes from ischemia/reperfusion injury in mice by repressing reactive oxygen species production through JAK2/STAT3 signaling[J]. Hepatology, 2011, 54(3): 979-988.
[15] Zhu H, Zou L, Tian J, et al. SMND-309, a novel derivative of salvianolic acid B, protects rat brains ischemia and reperfusion injury by targeting the JAK2/STAT3 pathway[J]. Eur J Pharmacol, 2013, 714(1-3): 23-31.
Protective effect of erythropoietin preconditioning on kidney ischemia-reperfusion injury
ZHANGJiong,WANGJia,WANGFang,LIGui-sen.
DepartmentofNephrology,SichuanProvincialPeople’sHospital,Chengdu610072,China
Correspondingauthor:LIGuisen,E-mail:guisenli@163.com
ObjectiveTo explore the protective effect of erythropoietin (EPO) on renal ischemia-reperfusion injury (IRI) in rats.MethodsThirty male SD rats were randomly divided into sham operation group (Sham), renal IRI group (IRI) and EPO pretreatment group (EPO), 10 rats in each group. The renal IRI model was constructed by clamping the left renal pedicle for 1 h, removing the right kidney, and reperfusion for 24 h. In EPO group, EPO (1 000 U/kg) was intraperitoneally injected at 1 h before operation, while Sham group and IRI group were intraperitoneally injected with equal volume of normal saline. The left renal pedicle was clamped for 45 min in EPO and IRI groups, but not in Sham group. Renal perfusion was restored for 24 h, and then kidneys and serum were obtained. Enzyme linked immunosorbent assay (ELISA) was used to detect serum creatinine (SCr), blood urea nitrogen (BUN), pro-inflammatory cytokines [interleukin-6 (IL-6); interferon gamma (IFN-γ) and tumor necrosis factor alpha (TNF-α)] and anti-inflammatory cytokine (IL-10 and TGF-β). The reverse transcriptase polymerase chain reaction (RT-PCR) was used to detect renal pro-inflammatory cytokines (IL-6, IFN- γ and TNF-α) and anti-inflammatory cytokines [IL-10 and transforming growth factor beta (TGF-β)] mRNA expression levels. Western blotting was used to detect EPO receptor (EPOR), phosphorylated EPOR (p-EPOR), tyrosine kinase-2 (JAK2), signal transducer and activator of transcription 3 (STAT3), phosphorylated JAK2 (p-JAK2), phosphorylated STAT3 (p-STAT3) protein expression levels. Periodic acid Schiff staining (PAS) was used to examine the pathological changes of renal tissues.ResultsAs compared with Sham group, the expression levels of p-EPOR, p-JAK2, p-STAT3, SCr, BUN, IL-6, TNF-α and IFN-γ were significantly increased, pathological changes of renal tissues obviously alleviated, and expression levels of IL-10 and TGF-β were markedly reduced in IRI group. There was no significant difference in EPOR, JAK2 and STAT3 levels between Sham group and IRI group. As compared with IRI group, the expression levels of p-EPOR, p-JAK2, p-STAT3, IL-10 and TGF-β were significantly increased, the levels of SCr, BUN, IL-6, TNF-α and IFN-γ were significantly reduced, and the pathological changes of renal tissues were significantly alleviated in EPO group, but there was no significant difference in EPOR, JAK2 and STAT3 expression between IRI group and EPO group.ConclusionsEPO preconditioning can alleviate inflammation by inhibiting renal IRI, which may be related with the activation of EPOR/JAK2/STAT3 signaling pathway.
Erythropoietin; Ischemia-reperfusion injury; Inflammation; Kidney; Rat
2016-11-22
2017-08-15)
10.3969/j.issn.1671-2390.2017.09.012
国家自然科学基金(No.81401362, 81100575)
610072 成都,四川省人民医院肾内科(张炯,王芳,李贵森),全科(王佳)
李贵森,E-mail:guisenli@163.com
