铁蛋白评估铁储备对治疗维持性血液透析患者贫血的临床价值
2017-11-02黄雁
黄雁
·短篇论著·
铁蛋白评估铁储备对治疗维持性血液透析患者贫血的临床价值
黄雁
贫血是终末期肾病患者常见的并发症,严重影响患者的生活质量。重组人促红细胞生成素(rec-ombinant human erythropietin, r-HuEPO)和铁剂的临床应用,已显著改善了大部分终末期肾病患者的贫血状态,明显改善患者生存率及生活质量,但有研究报道大约10%患者仍表现为难治性贫血,目前认为这与机体微炎性反应状态有关[1]。血清铁蛋白(serum ferrin,SF)不仅反映机体铁储备情况,同时也是反映炎症的指标,本研究目的观察维持性血液透析(maintenance hemodialysis,MHD)患者贫血的治疗有效性,并探讨难治性贫血患者SF水平及其与白细胞介素6(interleukin-6,IL-6)、C反应蛋白(C-reactive protein,CRP)相关性,以评价SF作为贫血患者铁储备标志物的临床价值。
资料与方法
一、研究资料
选择2013年4月至2015年10月武汉大学中南医院血液净化中心MHD患者78例,其中男53例,女25例,年龄(56.1±15.3)岁,透析时间3~12个月。78例MHD患者原发病分别为慢性肾炎35例,慢性间质性肾炎3例,糖尿病肾病14例,多囊肾3例,高血压肾损害21例,梗阻性肾病2例。全部病例以上肢动静脉内瘘或隧道式颈内静脉置管作为血管通路,每周透析12 h。纳入标准:终末期肾病行MHD患者,病情稳定≥3个月,血红蛋白(hemoglobin,Hb)≤90 g/L,持续使用r-HuEPO治疗时间≥3个月。排除标准:患者有肿瘤、严重心脏疾病、血液系统疾病、活动性肝病、出血、手术或创伤、4周内有输血及急性感染史。
二、研究方法
1.治疗方案 遵从KDIGO指南[2]纠正患者贫血:r-HuEPO初始剂量每周100~150 IU·kg-1,透析结束时静脉一次性使用,目标Hb≥110 g/L;每4周监测Hb,根据Hb情况调整r-HuEPO剂量,Hb增加<10 g/L,r-HuEPO增加25%,Hb增加>20 g/L,r-HuEPO减少25%。缺铁患者给予口服多糖铁复合物胶囊或静脉蔗糖铁补铁治疗。静脉补铁剂量按照公式计算:静脉铁剂剂量(mg)= (目标Hb-实际Hb)×体质量(kg)×0.24+500,总剂量≤1 000 mg。补铁目标:铁蛋白>100 μg/L,转铁蛋白饱和度(transferrin saturation,TSAT)>20%。适当予以叶酸、维生素B12 治疗。根据每4周监测Hb结果及时调整r-HuEPO剂量、补铁方案及营养指导。临床观察共24周。
2.分组 KDIGO指南建议MHD患者目标Hb≥110 g/L,因我国贫血达标率低,且本研究主要目的是观察贫血疗效不佳时铁蛋白作为铁储备评判临床价值,故将Hb≥100 g/L作为达标值。根据治疗后Hb值将入选患者分为达标组(Hb≥100 g/L)及未达标组(Hb<100 g/L),为排除年龄、性别、维持透析时间、方式及基础疾病的干扰,最终达标组共入选18人,未达标组15人。
达标组18例,其中男10例,女8例,年龄47~75岁,平均年龄(59. 6±11.4)岁,平均透析时间(7.44±3.26)个月;原发病分别为慢性肾炎8例,糖尿病肾病6例,高血压肾损害3例,梗阻性肾病1例。未达标组15例,其中男9例,女6例,年龄51~73岁,平均年龄(60.6±13.5)岁,平均透析时间(8.87±3.02)个月;原发病分别为慢性肾炎7例,糖尿病肾病5例,多囊肾1例,高血压肾损害2例。2组一般资料比较,差异无统计学意义(P>0.05)。
3.观察指标 检测观察初时、12周末及24周末甲状旁腺激素(parathyroid hormone,PTH)、肾功能、白蛋白(albumin,Alb)、SF、TSAT、CRP及IL-6水平。MHD患者均于血液透析前,采空腹外周静脉血6 ml,其中3 ml分离血清后-20 ℃冰箱保存备检IL-6;另3 ml送检生化及免疫学检查。血清IL-6选用双抗体夹心酶联免疫吸附法,试剂盒是使用Bender MedSytems Gmbh公司试剂盒,试验方法遵照说明书讲解进行使用。CRP采纳比浊法,血清铁、总铁结合力采用比色法,TSAT即为血清铁/总铁结合力×100%,铁蛋白、叶酸、维生素B12采用化学发光法,常规实验室方法检测Hb。
三、统计学处理
采用SPSS 17.0统计软件进行分析,计量数据采用均数士标准差方式表示;组间均数比较用t检验,相关性分析行Pearson统计,P<0.05表示差异有统计学意义。
结 果
一、MHD患者贫血治疗效果
以Hb≥100 g/L为达标值,治疗12周末时达标率74.36%(58例),24周末时达标率80.77%(63例)。随着疗程进展,患者平均Hb逐渐升高。(图1)
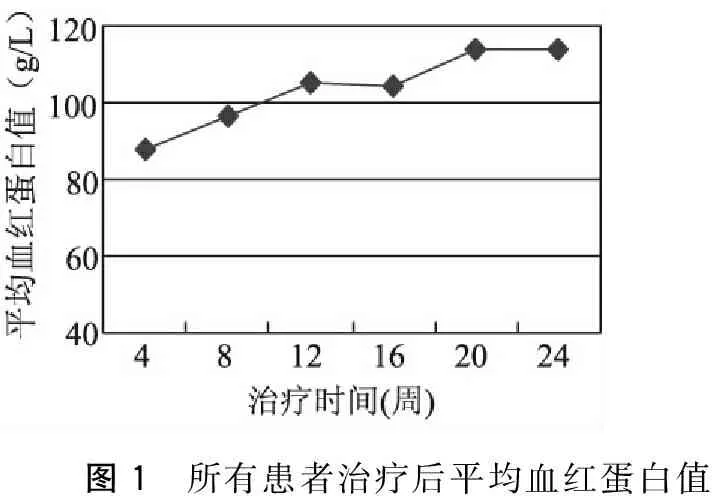
图1 所有患者治疗后平均血红蛋白值
二、2组贫血相关指标比较
与达标组比较,未达标组24周末时SF明显升高(P<0.01);TAST、叶酸及维生素B12的组间比较,差异无统计学意义(P>0.05)。(表1)
三、2组炎症反应相关指标及Alb、PTH水平比较
与达标组比较,24周末未达标组CRP及IL-6水平升高(P<0.01);2组Alb、PTH组间比较,差异无统计学意义(P>0.05)。(表2)
四、2组患者铁蛋白与相关指标的相关性分析
相关分析显示未达标组铁蛋白与CRP (r=0.542,P<0.05)、IL-6(r=0.615,P<0.01)呈正相关;达标组铁蛋白与CRP、IL-6水平相关无统计学意义。2组均未显示铁蛋白与Alb、PTH有相关性。
讨 论
MHD患者给予r-HuEPO及铁剂等治疗后贫血明显改善,本研究结果显示,治疗12周末时贫血达标率74.36%,24周末时达标率80.77%,高于国内文献报道[3],可能与我们略降低了贫血达标的标准有一定关系,但仍有部分患者贫血不能很好改善。研究表明,有5%~10%接受r-HuEPO 治疗患者存在促红细胞生成素(erythropoietin,EPO)低反应性,其原因包括炎症、甲状旁腺功能亢进、透析不充分、铝负荷过重、肿瘤、营养不良等可能降低了骨髓对EPO的敏感性[4],其中铁缺乏是主要因素。
在MHD患者中,由于存在透析管路失血、频繁采血等因素导致铁丢失,某些药物(如血管紧张素转换酶抑制剂)和炎症状态会影响铁的吸收,以及使用红细胞刺激生成素促进红细胞生成时需要消耗大量的铁,因此,铁缺乏在MHD患者中十分普遍,因此,对于MHD患者的贫血治疗,补充铁剂十分重要。
目前临床常用的评估铁贮备的标准是SF[5],但有研究观察,SF与Hb高低无显著相关,认为SF不仅仅是反映铁储备情况[6],还是肿瘤标志物,同时也是反映炎症的指标,MHD患者体内存在微炎症状态,这时SF值不能完全反映铁储备情况。当机体处于炎症状态而实际铁储备不足时,SF也可显著增高,从而影响铁代谢的评估。研究显示,持续性EPO受体激活剂治疗慢性肾脏病透析患者肾性贫血也有一定的疗效[7]。美国将近一半的MHD患者SF≥500 μg/L[8],因此,如果仅仅只是使用SF指标是无法精确反映体内铁储备的情况。SF在500~1 200 μg/L范围间可能与铁储备情况无关[9]。给予这些患者铁剂治疗可以促进肾性贫血改善[10]。此外,炎性反应诱发的高血清铁蛋白可导致功能性铁缺乏症,急慢性炎症可利用网状内皮系统对铁抑制,慢性炎症最终会导致难治性的贫血发生。
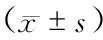
表1 各组患者贫血检查指标比较
注:与相同时间点达标组比较,aP<0.05;与相同时间点达标组比较,bP<0.01
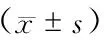
表2 各组患者血清IL-6、CRP、Alb、PTH比较
注:与相同时间点达标组比较,aP<0.05;与相同时间点达标组比较,bP<0.01
CRP、中性粒细胞计数、IL-6、TNF-α、纤维素原升高都是目前明确的炎性标志物。卫刚等[11]观察显示多数患者在透析间期呈现了高炎性细胞因子血症,经透析治疗之后,IL-1、6、12, TNF-a等炎症性细胞因子水平呈现了明显下降的趋势。我们在临床治疗中发现对贫血治疗效果未达标者,通过改变血液净化方式(增加血液灌流及血液滤过时间),部分患者有一定效果。
本研究中,与达标组比较,贫血未达标组24周末SF明显升高,CRP及IL-6水平同时升高,相关分析显示未达标组SF与CRP水平(r=0.542,P<0.05)及IL-6水平(r=0.615,P<0.01)呈正相关;达标组SF与CRP及IL-6水平相关性分析无统计学意义。TAST、叶酸及维生素B12两组间比较差异无统计学意义。另外,本研究发现,SF与TAST不平行时,其临床价值可能同CRP,可作为炎症指标,不能反映机体铁水平,文献有类似报道[12]。MHD患者在临床上贫血治疗效果不理想时,是不可以过量补充静脉铁剂,铁超负荷可引起机体氧化应激反应、动脉粥样硬化以及感染风险增加。但也不能仅仅因SF升高减停铁剂应用,应参考CRP、IL-6等炎症指标水平,为临床正确评估铁储备状态提供帮助。
总之,MHD患者贫血患病率极高,虽然大部分患者都接受贫血治疗,但贫血治疗仍不充分,特别是静脉铁剂应用不足,造成总体贫血治疗的达标率较低,如何正确评估机体铁储备状态对铁剂使用有重要临床指导意义。SF升高评估铁储备状态应考虑机体炎性反应因素,我们的观察结果还需要更大样本进一步验证。
[1] Kanbay M,Perazella MA,Kasapoglu B, et al.Erythropoiesis stimulatory agent-resistant anemia in dialysis patientsat:review of causes and management[J]. Blood Purif, 2010, 29(1):1-12.
[2] KDIGO. Summary of Recommendation Statements[J]. Kidney International Supplements, 2012, 2(4): 283-287.
[3] 陈桑, 黄雯. 2008年北京市新增血液透析患者肾性贫血治疗达标率及年龄和性别对其影响[J]. 中国全科医学, 2011, 14(8): 2625-2627.
[4] Liu WS, Wu YL, Li SY, et al. The waveform fluctuation and the clinical factors of the initial and sustained erythropoietic response to continuous erythropoietin receptor activator in hemodialysis patients[J]. Scientific World Journal, 2012, 20(12): 1574-1577.
[5] Spinowitz BS, Kausz AT, Baptista J, et al. Ferumoxytolfor treating iron deficiency anemia in CKD[J]. J Am Soc Nephrol, 2008, 19(8): 1599-1605.
[6] 孙婧, 吴灏, 丁琳, 等. 维持性血液透析患者贫血治疗达标情况及其影响因素分析[J]. 中国中西医结合肾病杂志, 2013, 14(7): 606-608.
[7] 宫柏琪, 高凌根, 吕俊刚. 持续性促红细胞生成素受体激活剂联合铁剂治疗慢性肾脏病透析患者肾性贫血的疗效观察[J]. 安徽医药, 2015, 19(10): 2014-2015.
[8] Kalantar-Zadeh K, Regidor DL, McAllister CJ, et al. Time-dependent associations between iron and mortality in hemodialysis patients[J]. J Am Soc Nephrol, 2005, 16(10): 3070-3080.
[9] Dukkipati R, Kalantar-Zadeh K. Should we limit the ferritin upper threshold to 500ng/ml in CKD patient?[J]. Nephrol News Issues, 2007, 21(1): 34-38.
[10] Coyne DW, Kapoian T, Suki W, et al. Ferric gluconate is highly efficacious in anemic hemodialysis patients with high serum ferritin and low transferrin saturation: results of the dialysis patients response to iron with elevated ferritin study [J]. J Am Soc Nephrol, 2007, 18(3): 975-984.
[11] 卫刚, 顾一峰, 张春菘. 终末期肾衰竭的维持血液透析患者透析前后血中IL-1、 IL-6、 IL-12及TNF-a水平的变化[J]. 中国血液净化, 2005, 4(10): 564-565.
[12] Rambod M, Kovesdy CP, Kalantar-Zadeh K. Combined high serum ferritin and low iron saturation in hemodialysis patients: therol of inflammation[J]. Clin J Am Soc Nephrol, 2008, 3(6): 1691-1701.
2016-10-24
2017-04-18)
10.3969/j.issn.1671-2390.2017.09.011
430071 武汉,武汉大学中南医院肾内科
