氧化铈纳米材料合成方法的研究进展
2017-11-02刘玉娟佟宇飞刘道胜张财顺
刘玉娟, 许 骥, 佟宇飞, 张 娜, 张 磊, 刘道胜, 韩 蛟, 张财顺
(1.辽宁石油化工大学 化学化工与环境学部,辽宁 抚顺 113001; 2.中化泉州石化有限公司 质检中心,福建 泉州 362000;3.抚顺职业技术学院 化学工程系,辽宁 抚顺 113122)
氧化铈纳米材料合成方法的研究进展
刘玉娟1, 许 骥2, 佟宇飞1, 张 娜3, 张 磊1, 刘道胜1, 韩 蛟1, 张财顺1
(1.辽宁石油化工大学 化学化工与环境学部,辽宁 抚顺 113001; 2.中化泉州石化有限公司 质检中心,福建 泉州 362000;3.抚顺职业技术学院 化学工程系,辽宁 抚顺 113122)
氧化铈是一种应用十分广泛的稀土氧化物,主要在紫外吸收、发光材料、催化剂等方面。纳米氧化铈具有特殊的性质,能广泛应用于各种领域。结合近年来国内外氧化铈研究进展,综述了水热法、沉淀法、溶胶凝胶法、微乳液法、微波法等氧化铈纳米材料的合成方法及研究现状,并总结了各种制备方法的优缺点。
氧化铈; 纳米材料; 液相法
稀土氧化物氧化铈目前应用广泛,其在紫外吸收材料、发光材料、玻璃抛光剂、催化剂、陶瓷和汽车尾气的净化方面得到了广泛的应用[1-2]。近年来随着人们对纳米材料研究的不断突破和创新,发现纳米氧化铈表现出特殊的性质[3],其不仅具有纳米材料的性质,而且还具有稀土氧化物的优点。但是不同形貌、结构的氧化铈纳米材料具有不同的性质,例如氧化铈纳米棒主要活性部位{110}和{001}对一氧化碳的氧化能力大于具有{111}弱活性界面的氧化铈纳米颗粒[3]。因此,制备具有特定功能的纳米材料是十分重要的研究课题。
氧化铈纳米材料的制备方法一般有固相法、气相法、液相法[4-5]。其中应用最广泛的方法为液相法,该方法具有其他方法无法比拟的优点,例如:产物尺寸分布均匀,成分单一,产物在液相中分散均匀等,因此其既能够克服固相法合成过程中产物粒子大、分散不均匀的缺点,又能克服气相法合成过程中使用的设备昂贵、产量较低、不宜大量普及的不足[6]。因此重点讨论液相法,但是液相法反应受液相中各向生长同性的限制,需要采用特殊的制备方法来控制产物的形貌。因此液相法中各种材料制备方法就相当重要,目前液相法制备纳米材料主要有水热法、溶胶凝胶法、微乳液法、沉淀法、微波法等[7-10]。制备的氧化铈纳米材料主要有纳米球状、棒状、管状、片状、纳米粉体,及其一些特殊的形貌。
影响氧化铈纳米材料合成的因素主要有反应温度、反应时间、反应原料等。如何选择合适的反应条件直接影响反应产物纳米氧化铈的形貌、结构、性质等特点。文章主要总结了液相法合成氧化铈纳米材料的一些方法。
1 液相法合成纳米氧化铈
1.1 水热法
近年来人们对水热合成法的研究,已取得了很大的进展。水热反应的主要装置是高压釜。反应过程是在一定压力和温度下,在水溶液或蒸汽等流体中所进行的有关化学反应。在沸点和高压条件下处于高临界状态,水作为介质具有能够传递压力和溶剂的作用,加速固相间反应。水热反应中水解速率和金属氧化物的溶解度直接影响产物的晶粒大小。体系的压强和溶液的物理性质受反应温度的影响。在一定的温度下,可以通过反应液的pH、反应物的浓度和种类控制产物的粒径和形貌[11]。
L.Qin等[12]以CeCl3·7H2O和NH4HCO3为原料,采用水热法合成了纳米立方萤石型的氧化铈。结果表明,随反应温度的升高,氧化铈长度增加,但是其立方形貌不发生变化,并且其表面具有丰富的Ce3+和氧空位,因此在室温下具有较好的光学性质。J.Gong等[13]以CeCl3·7H2O和NH4HCO3水热合成了花状的氧化铈。结果表明,该花状的氧化铈具有立方萤石结构,氧化铈表面具有丰富的Ce3+和氧空位,其在NOx转化反应中具有较高的活性。K.B.Zhou等[14]以Ce2(SO4)3·9H2O为铈源,与NaOH水热合成得到Ce(OH)3纳米管,在H2O2溶液中超声反应,即得到氧化铈纳米管。该方法不同于传统的煅烧Ce(OH)3的方法,而是采用了H2O2氧化Ce(OH)3的方法,避免了煅烧过程带来的危险和污染,而且操作简便、耗时少。
表面活性剂在合成氧化铈纳米材料时被广泛地应用,它有利于产物的稳定,避免产物在合成过程中团聚。J.B.Ni等[15]以Ce(NO3)3·6H2O和NH4HCO3为原料,乙二胺和聚乙烯吡咯烷酮为表面活性剂,经水热合成法合成纳米立方萤石型结构的氧化铈。结果表明,使用两种表面活性剂时分别得到表面粗糙长度为200 nm和表面光滑长度为70 nm的氧化铈。室温下,两种氧化铈均表现了相似的光致发光发射峰。随着氧空位浓度增加,峰强度增加。孙庆堂[16]以CeCl3为铈源,六亚甲基四胺为沉淀剂,聚乙烯吡咯烷酮为表面活性剂,水热合成了结构均匀的六方形截面的CeO2纳米管。沉淀剂改为乙二胺,合成了氧化铈纳米棒。C.W.Sun等[17]将CeCl3·7H2O溶解到硬脂胺溶液中,乙二胺调节溶液pH为9~10,通过调节不同表面活性剂、铈源、反应温度、反应时间,得到氧化铈纳米棒在形成过程中的各个形貌的变化和最适合的反应条件。杨儒等[18-19]将硬脂胺和HNO3加入到硝酸铈溶液中,分别滴加NH3·H2O和尿素,合成了结构均匀的氧化铈纳米线和氧化铈纳米管。W.Q.Han等[20]将NH3·H2O加入Ce(NO3)3·6H2O水溶液中,经过沉淀老化,合成了纳米颗粒、纳米线、纳米管3种纳米材料。C.S.Pan等[21]使用同样的铈源和沉淀剂,以十六烷基三甲基溴化铵(CTAB)为表面活性剂,水热合成CeO2纳米材料。通过改变反应时间、CTAB与Ce3+的物质的量比,能够分别得到片状、管状和棒状的氧化铈纳米材料。
水热法能够较容易地合成管状结构纳米材料,并且合成过程中不需要模板,这是其他方法都难以达到的。水热法合成的纳米氧化铈纯度高、分散性好,但实验过程要求耐压耐高温的钢材和耐腐蚀的内衬,成本较高,技术要求严格,并且实验过程中无法观察材料合成和晶体生长过程,反应机理有待进一步考察。
1.2 沉淀法
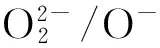
沉淀法合成纳米氧化铈的过程较简便,首先将金属离子形成金属氢氧化物沉淀出来,然后经煅烧得到目标氧化物。该实验成本低,并且能够得到纯度较高的产物,该方法在工业化生产中易于普及。但是粒子形成过程中分散不均匀,易于团聚。
1.3 溶胶凝胶法
溶胶凝胶法的基本原理是将原料均匀混合经水解、缩合等化学反应形成稳定的透明溶胶,然后溶质聚合凝胶化形成湿凝胶,湿凝胶经干燥、焙烧得到目标产物。反应原料一般为金属醇盐或者可溶盐。
I.V.Zagaynov等[25]以水和乙醇混合液为溶剂,分别采用硝酸铈、醋酸铈和乙酰丙酮铈为原料,N,N-二甲基正辛胺(DMOA)、乙醇胺(TEAH)和四乙基氢氧化铵(MEA)为稳定剂,合成了氧化铈粉末。以DMOA和TEAH为稳定剂,硝酸铈和醋酸铈为原料时得到的氧化铈尺寸大小相同,比用MEA合成的晶粒小,这是由于DMOA和TEAH属于大分子结构,具有较长的烃链,能够阻止氧化铈粒子在溶胶中团聚,而以乙酰丙酮铈为原料时,稳定剂的烃链越短,得到的氧化铈晶粒越小,比表面积越大。Y.Qin等[26]以Ce(NO3)3·6H2O和柠檬酸为原料溶于去离子水中形成凝胶,煅烧后得到氧化铈。该过程合成氧化铈溶液操作简单。S.Gnanam等[27]以甲醇为溶剂,氯化铈为原料,反应过程中加入少量的氨水形成凝胶,经洗涤、干燥、煅烧得到立方萤石型氧化铈。Y.J.Acosta-Silva等[28]以硝酸铈为原料,乳酸为助剂,采用溶胶凝胶法合成了氧化铈,实验考察了不同焙烧温度对反应的影响,当焙烧温度增加时,氧化铈的晶粒尺寸由4.8 nm增加到18.6 nm,并且其表面粗糙度和光学性质随之增加。
该方法工艺过程简单、条件容易控制、产物颗粒细、单分散性好,能较好地控制材料的尺寸、表面结构和形貌,并且溶胶凝胶法能够容纳不溶性组分或不沉淀组分。该方法的不足之处是反应时间较长、产物烧结性不好、产物干燥后收缩性大。
1.4 微乳液法
常用的微乳液有W/O型和O/W型。在纳米材料的制备过程中常用的是W/O型,又称为反相微乳液。该方法能够有效地控制纳米材料的尺寸。反应中表面活性剂和助表面活性剂能够降低油水界面的界面张力,并且在界面形成界面膜,从而使乳化液能够稳定存在。微乳液法合成纳米材料时受众多因素的影响,如反应物的浓度、表面活性剂、表面活性剂在水相中的浓度比等,通过控制影响反应的外界因素合成孔径均匀的纳米材料。
R.Pournajaf等[29]以月桂醇聚氧乙烯醚为表面活性剂,采用反相微乳液法合成了面心立方型氧化铈纳米材料。实验中第一个微乳液将铈盐逐滴加入环己烷/表面活性剂/正丁醇混合溶液中,第二个微乳液将上述微乳液中的金属溶液换成NH4OH,将两微乳液混合、干燥、煅烧得到氧化铈。讨论了不同煅烧温度对氧化铈性能的影响。结果表明,当煅烧温度由80 ℃上升到700 ℃时,氧化铈的带隙能量由3.77 eV降到3.61 eV。温度为300 ℃时表面积最大,温度升高时表面积降低,晶粒尺寸增加。当煅烧温度为400 ℃时,与沉淀法相比,微乳液法合成的氧化铈单分散性较好,晶粒尺寸较小,达到15 nm。朱文庆等[30]以十六烷基三甲基溴化铵/正丁醇/正辛烷/硝酸铈溶液(氨水)形成反相微乳液为反应介质,并辅以溶剂热法合成纳米氧化铈。探讨了反应温度、油相和助表面活性剂的质量比对氧化铈的影响。结果表明,当反应温度逐渐增加,氧化铈颗粒的粒径逐渐增大,油相和助表面活性剂质量比增大,得到分散性较好、团聚较轻的氧化铈。
微乳液法合成氧化铈纳米材料较其他方法相比,反应条件简便,能够合成尺寸、形貌可控的纳米材料。微乳液法中表面活性剂具有十分重要的作用,因为表面活性剂不仅能够避免由于表面介电效应引起的粒子团聚现象,而且能够控制晶粒的大小。但是实验中需要表面活性剂的量比较多,导致实验成本较高。因此找到经济、高效的表面活性剂是今后微乳液法合成纳米材料研究的重点。
1.5 微波法
微波在合成纳米材料的过程中代替了传统的加热方法,微波加热法具有产物加热均匀、加速速率较快、极大地节约加热时间、操作过程容易控制等特点,因此比传统加热法更受欢迎。由于微波法在合成氧化铈纳米材料过程中的不同作用,将微波法分为微波辅助水热法、微波辅助化学沉淀法、微波辅助溶胶凝胶法和微波辅助加热法等[31]。
O.S.Bezkrovnyi等[32]利用微波辅助水热合成法制备了氧化铈纳米晶体。通过控制OH-/Ce3+的物质的量比来控制氧化铈的形态和结构。结果表明,氧化铈粒子尺寸随OH-/Ce3+的物质的量比增加而逐渐增加,当晶粒尺寸小于10 nm时,得到球形氧化铈;OH-/Ce3+的物质的量比较高时,氧化铈为立方形。与传统水热法相比,该方法快捷、简便。D.D.He等[33]采用微波辅助溶胶凝胶法以Ce(NO3)3·6H2O和柠檬酸为原料,微波加热得到干凝胶,再煅烧合成氧化铈纳米粒子,从反应温度、铈盐/柠檬酸的物质的量比、微波加热时间、煅烧时间和温度等方面探讨了反应条件对产物结构、形貌的影响,并且得到的氧化铈在催化分解CH3SH方面具有较好的作用。C.R.Michel等[34]采用微波辅助共沉淀法合成了三维层状结构的氧化铈。通过改变铈源的含量得到不同形貌和尺寸的氧化铈。用传统加热方法加热得到的氧化铈具有不规则的形状和不同的晶粒尺寸,实验表明,微波加热对于形成三维层状氧化铈具有重要作用。
微波加热法作为一种新兴的加热方法,其加热快捷、无污染等特点是其他方法无法比拟的,微波法制备的纳米材料晶型生长完整,晶粒尺寸分布均匀、无团聚。除此之外,微波法合成氧化铈作为催化剂时具有较高的催化活性和稳定性。微波法的不足之处是无法很好地应用于工业生产。
1.6 其他制备方法
除了以上方法,氧化铈纳米材料的合成方法还有电化学法、燃烧法等。C.Zhang等[35]在三电极系统中以Ce(NO3)3、NH4Cl和KCl为电解液,电流密度为0.44 mA/cm2,70 ℃下反应2 h得到了分层氧化铈纳米棒,当电流密度设为0.88 mA/cm2时,得到分层氧化铈纳米线。结果表明,氧化铈纳米棒是由大量小尺寸的纳米线组合而成,由于纳米棒和纳米线的一维结构和高的表面积,在光催化过程中能够提供大量的界面面积和减少载流子的扩散作用。氧化铈纳米棒和氧化铈纳米线在降解甲基橙方面比商业催化剂具有更好的效果。张辉等[36]采用燃烧法合成氧化铈粉体。以六水硝酸铈为铈源,甘氨酸为燃烧剂,聚乙二醇20000为分散剂,讨论了燃烧温度、pH、铈源和燃烧剂的物质的量比对产物的影响。结果表明,燃烧温度为350 ℃、pH为5、铈源和燃烧剂的物质的量比为1.0∶1.6为最佳反应条件,合成的氧化铈的平均粒径为6.5 nm,产物粒度均匀。燃烧法中的燃烧剂除了甘氨酸外还可以为尿素、甘油、抗坏血酸、柠檬酸等[37-39]。电化学法和燃烧法在合成氧化铈时均具有反应周期短、耗能少等优点,并且电化学法合成氧化铈时不需要煅烧,合成过程既清洁又安全。但是,电化学法合成过程较复杂,不容易合成具有特殊微观结构要求的氧化铈。燃烧法合成过程中产生的气体对环境污染较严重,所以该方法仍需不断改进。
2 结束语
氧化铈由于其独特的性质在稀土氧化物中占有十分重要地位,具有广阔的应用前景。各种氧化铈的合成方法中,水热法合成氧化铈产物纯度高,分散性较好,但是设备要求严格;沉淀法较水热法合成过程简便,容易操作,但是产物团聚严重;溶胶凝胶法产物纯度高、粒径小,但是反应时间较长;微乳液法合成氧化铈粒径可控,但是表面活性剂用量大,成本高;微波法以高效、无污染受广大研究者的青睐;燃烧法和电化学法合成周期短,无污染而被广泛应用于合成纳米材料。不同形貌、结构的氧化铈对其应用性能具有很大影响,不同合成方法各有其优缺点,因此选择合适的合成方法对于制备具有特殊用途的氧化铈十分重要。
[1] Wang Q L, Huang X Y, Yin J. Influence of CeO2doping on property of SnO2ceramics[J]. Key Engineering Materials, 2017, 726:287-291.
[2] Liu H J, Feng Z Y, Huang X W, et al. Study on purification and application of novel precipitant for ceria-based polishing powder[J]. Journal of Rare Earths, 2013, 31(2):174-179.
[3] Zhou K B, Wang X, Sun X M, et al. Enhanced catalytic activity of ceria nanorods from well-defined reactive crystal planes[J]. Journal of Catalysis, 2005, 229(1):206-212.
[4] Jiang H, Zhao T, Li C Z, et al. Hierarchical self-assembly of ultrathin nickel hydroxide nanoflakes for high-performance supercapacitors[J]. J. Mater. Chem., 2011, 21(11):3818-3823.
[5] Gao W, Zhang Z Y, Li J, et al. Surface engineering on CeO2nanorods by chemical redox etching and their enhanced catalytic activity for CO oxidation[J]. Nanoscale, 2015, 7(27):11686-11691.
[6] 王竹红. 氧化铈微纳米材料的水热法制备及性能研究[D]. 南京:南京理工大学, 2012.
[7] Pal P, Pahari S K, Sinhamahapatra A, et al. CeO2nanowires with high aspect ratio and excellent catalytic activity for selective oxidation of styrene by molecular oxygen[J]. Rsc Advances, 2013, 3(27):10837-10847.
[8] Davara F, Hassankhani A, Loghman-Estarki M R. Controllable synthesis of metastable tetragonal zirconia nanocrystals using citric acid assisted sol-gel method[J]. Ceramics International, 2013, 39(3):2933-2941.
[9] Samai B, Sarkar S, Chall S, et al. Polymer-fabricated synthesis of cerium oxide nanoparticles and applications as a green catalyst towards multicomponent transformation with size-dependent activity studies[J]. Crystengcomm, 2016, 18(40):7873-7882.
[10] 李秀萍, 董航, 李楚佳, 等. 络合沉淀法制备高纯白色二氧化铈及其光催化的研究[J]. 石油化工高等学校学报, 2013, 26(5):15-18.
[11] 解安然. 水热法合成纳米氧化铈及其CO催化性能的研究[D]. 济南:山东大学, 2015.
[12] Qin L, Niu X F. Controlled hydrothermal synthesis, excellent optical and magnetic properties of CeO2nanocubes[J]. Journal of Materials Science:Materials in Electronics, 2016, 27:12233-12239.
[13] Gong J, Meng F, Fan Z, et al. Template-free controlled hydrothermal synthesis for monodisperse flowerlike porous CeO2, microspheres and their superior catalytic reduction of NO with NH3[J]. Journal of Alloys & Compounds, 2017, 690:677-687.
[14] Zhou K B, Yang Z Q, Yang S. Highly reducible CeO2nanotubes [J]. Cheminform, 2007, 38(24):1215-1217.
[15] Ni J B, Gao J, Wei H, et al. Controlled hydrothermal synthesis and excellent optical properties of two defferent kinds of CeO2nanocubes[J]. Journal of Materials Science:Materials in Electronics, 2017, 28(15):11029-11033.
[16] 孙庆堂. 二氧化铈基微纳米材料的制备与表征[D]. 杭州:浙江理工大学, 2012.
[17] Sun C W, Li H, Zhang H R, et al. Controlled synthesis of CeO2nanorods by a solvothermal method[J]. Nanotechnology, 2005, 16(9):1454-1463.
[18] Yang R, Guo L. Synthesis of cubic fluorite CeO2nanowires[J]. Journal of Materials Science, 2005, 40(5):1305-1307.
[19] 杨儒, 郭亮. 纳米管状结构萤石型的合成[J]. 无机化学学报, 2004, 20(2):152-158.
[20] Han W Q, Wu L J, Zhu Y M. Formation and oxidation state of CeO2-xnanotubes[J]. Journal of the American Chemica Society, 2005, 127(37):12814-12815.
[21] Pan C S, Zhang D S, Shi L Y. CTAB assiated hydrothermal synthesis, controlled conversion and CO oxidation properties of CeO2nanoplates, nanotubes, and nanorods[J]. Journal of Solid State Chemistry, 2008, 181(6):1298-1306.
[22] Liu H W, Liu H F. Preparing micro/nano dumbbell-shaped CeO2for high performance electrode materials[J]. Journal of Alloys & Compounds, 2016, 681:342-349.
[23] Suresh R, Ponnuswamy V, Mariappan R. Effect of annealing temperature on the microstructural, optical and electrical propertiesof CeO2nanoparticles by chemical precipitation method[J]. Applied Surface Science, 2013, 273(273):457-464.
[24] Liang F L, Yu Y, Zhou W. Highly defective CeO2as a promoter for efficient and stable water oxidation[J]. Journal of Materials Science:Materials in Electronics, 2015, 3(2):634-640.
[25] Zagaynov I V, Kutsev S V. Formation of mesoporous nanocrystalline ceria from cerium nitrate, acetate or acetylacetonate[J]. Applied Nanoscience, 2014, 4(3):339-345.
[26] Qin Y, Ye H, Li F Z, et al. Nano-gold particles on oxide for catalytic combustion of formaldehyde[J]. Applied Mechanics & Materials, 2014, 525:150-153.
[27] Gnanam S, Rajendran V. Synthesis of CeO2or α-MnO2nanoparticles via sol-gel process and their optical properties[J]. Journal of Sol-Gel Science and Technology, 2011, 58(1):62-69.
[28] Acosta-Silva Y J, Castaedo-Perez R, Torres-Delgado, et al. Effect of annealing temperature on structural, morphological and optical properties of CeO2thin films obtained from a simple precursor solution[J]. Journal of Sol-Gel Science and Technology, 2017, 82:20-27.
[29] Pournajaf R, Hassanzadeh-Tabrizi S A, Jafari M.Reverse microemulsion synthesis of CeO2nanopowder using polyoxyethylene(23)lauryl ether as surfactant[J]. Ceramics International, 2014, 40(8):8687-8692.
[30] 朱文庆, 瞿芳, 袁煜昆, 等. 微乳辅助溶剂热法纳米氧化铈的合成和标准[J]. 纺织高校基础科学学报, 2013, 26(3):406-409.
[31] 司伟, 黄妙言, 丁思齐, 等. 微波法辅助合成无机纳米材料的研究进展[J]. 硅酸盐通报, 2013, 32(5):868-872.
[32] Bezkrovnyi O S, Lisiecki R, Kepinski L. Relationship between morphology and structure of shape-controlled CeO2nanocrystals synthesized by microwave-assisted hydrothermal method[J]. Crystal Research & Technology, 2016, 51(10):554-560.
[33] He D D, Wan G P, Hao H S, et al. Microwave-assisted rapid synthesis of CeO2nanoparticles and its desulfurization processes for CH3SH catalytic decomposition[J]. Chemical Engineering Journal, 2016, 289:161-169.
[34] Michel C R, Martínez-Preciado A H. CO sensor based on thick films of 3D hierarchical CeO2architectures[J]. Sensors & Actuators B Chemical, 2014, 197(1):177-184.
[35] Zhang C, Zhang X Y, Wang Y C, et al. Facile electrochemical synthesis of CeO2hierarchical nanorods and with excellent photocatalytic activities[J]. New Journal of Chemistry, 2014, 38(6):2581-2586.
[36] 张辉, 王亚娇, 郭琴, 等. 燃烧法制备纳米氧化铈[J]. 稀土, 2012, 33(5):43-46.
[37] 李秀萍, 赵荣祥. 燃烧法快速合成黄色可控轻质纳米氧化铈[J]. 化工科技, 2012, 20(3):14-l7.
[38] 李秀萍, 赵荣祥, 李秀荣, 等. 燃烧法快速合成轻质纳米氧化铈及其脱色性能[J]. 中国粉体技术, 2012, 18(4):10-14.
[39] 郭立峰, 李丽华, 张金生. 制备纳米二氧化铈粉体新工艺的研究[J]. 石油化工高等学校学报, 2011, 24(6):9-13.
Progress in Research of the Synthesis Methods of Nanometer Ceria
Liu Yujuan1, Xu Ji2, Tong Yufei1, Zhang Na3, Zhang Lei1, Liu Daosheng1, Han Jiao1, Zhang Caishun1
(1.CollegeofChemistry,ChemicalEngineeringandEnvironmentalEngineering,LiaoningShihuaUniversity,FushunLiaoning113001,China;2.QualityInspectionCenter,SinochemQuanzhouPetrochemicalCo.,Ltd.,QuanzhouFujian362000,China;3.DepartmentofChemicalEngineering,FushunVocationalTechnologyInstitute,FushunLiaoning113122,China)
Cerium oxide is a kind of rare earth oxides of extensive uses. It has a wide range of applications in ultraviolet absorption, luminescent materials, catalysts and so on. Nano cerium oxide has special properties and can be widely used in various fields. This paper combined the research of preparation of cerium oxide based on domestic and international literature including hydrothermal, precipitation, sol-gel, microemulsion, microwave and so on, and summarized the advantages and disadvantages of various preparation methods.
Cerium oxide; Nanomaterial; Liquid phase method
1672-6952(2017)05-0008-05
投稿网址:http://journal.lnpu.edu.cn
2017-04-25
2017-07-12
国家自然科学基金项目(21376237);辽宁省博士科研启动基金项目(201601322)。
刘玉娟(1991-),女,硕士研究生,从事纳米催化材料研究;E-mail:yjliu09@163.com。
张磊(1983-),男,博士,副教授,从事催化新材料方面的研究;E-mail:lnpuzhanglei@163.com。
O643.3
A
10.3969/j.issn.1672-6952.2017.05.002
(编辑 宋官龙)
