后腹腔镜肾部分切除术个体化方案在小肾癌治疗中的应用
2017-11-02邵四海汤建儿沈悦凡向安平王伟高王荣江
邵四海,汤建儿,沈悦凡,向安平,王伟高,王荣江
[浙江省湖州市第一人民医院(湖州师范学院附属第一医院) 泌尿外科,浙江 湖州 313000]
后腹腔镜肾部分切除术个体化方案在小肾癌治疗中的应用
邵四海,汤建儿,沈悦凡,向安平,王伟高,王荣江
[浙江省湖州市第一人民医院(湖州师范学院附属第一医院) 泌尿外科,浙江 湖州 313000]
目的探讨后腹腔镜下肾部分切除术(RLPN)个体化方案治疗小肾癌的可行性、安全性。方法回顾性分析2012年6月-2016年6月收治的98例实行RLPN治疗的小肾癌患者,男57例,女41例,年龄28~75岁,平均52岁,肿瘤位于左肾46例,右肾52例,直径0.8~4.5 cm,平均3.1 cm。87例(A组)小肾癌采用标准阻断肾动脉的状态下实施肾部分切除;7例(B组)外突性生长的小肾癌采用术中游离肾动脉,套橡皮条备用,试行不阻断肾动脉零缺血的状态下实施肾部分切除;4例(C组)影像学检查提示内生性小肾癌,采用腔内超声术中精确探查定位肾动脉阻断下实施肾部分切除。从术中情况、术后随访结果等分析其可行性、安全性。结果A组87例中2例转开放手术,1例切缘阳性,改腹腔镜下肾根治性切除术,术中出血量30~350 ml,平均93 ml,手术时间70~245 min,平均127 min,术中热缺血时间20~42 min,平均26 min。B组7例外突性生长的肾癌,6例未阻断肾动脉,1例出血明显,切除肿瘤过程中,再阻断肾动脉15 min,完成肾部分切除术,出血量160~380 ml,平均220 ml,手术时间85~215 min,平均143 min。C组4例中内生性小肾癌全部手术过程顺利,出血量35~250 ml,平均85 ml,手术时间110~235 min,平均175 min,术中热缺血时间25~40 min,平均28 min。随访6~48个月,中位时间26个月,1例(肾门处3.0 cm透明细胞癌)术后18个月发现局部复发及肺部转移,予索拉非尼分子靶向治疗。结论RLPN个体化方案治疗小肾癌安全、有效,但尚需增加例数和长期随访观察明确其远期疗效。
腹腔镜;肾部分切除术;肾肿瘤
近年来,随着影像检查技术如CT、磁共振成像(magnetic resonance imaging,MRI)等的不断发展,体检的普及,小肾癌的检出率明显增加[1]。对于T1a期肾癌,保留肾单位的肾部分切除术(nephron sparing surgery,NSS)成为标准的手术方式[2],减少或避免热缺血时间、保证肿瘤完整切除,更好地保护肾功能一直是泌尿外科医师探索的目标[3]。为此,笔者近年来在临床实践中,对不同情况的患者实施后腹腔镜肾部分切除术(retroperitoneal laparoscopic partial nephrectomy,RLPN)个体化方案来治疗小肾癌。现报道如下:
1 资料与方法
1.1 一般资料
回顾性分析2012年6月-2016年6月在本科接受102例行泌尿系B超、双肾增强CT或MRI检查诊断单发肾肿瘤并行NSS的患者的数据。除外2例合并同侧肾囊肿行同期肾囊肿去顶术、开放肾部分切除术2例,共纳入行RLPN 98例。男57例,女41例。年龄28~75岁,平均52岁。肿瘤位于左肾46例,右肾52例;直径0.8~4.5 cm,平均3.1 cm。根据RLPN的肾癌患者临床资料,阻断肾动脉共91例。其中,标准RLPN 87例(A组),直径1.6~4.5 cm,Renal评分6~10分;接受腔内超声术中精确探查定位肾动脉阻断下实施肾部分切除4例(C组),直径0.8~1.6 cm,Renal评分7~9分。接受试行不阻断肾动脉零缺血的状态下实施肾部分切除术7例(B组),直径0.9~1.5 cm,Renal评分4~5分。入组标准:术前均泌尿系B超、平扫及增强CT或MRI、肾动脉CT血管造影(CT angiography,CTA)或磁共振血管成像(magnetic resonance angiography,MRA)。检查明确诊断,并由胸部X线、腹部B超等检查排除转移、临床分期T1aN0M0和术后病理为肾细胞癌。排除标准:多发肾癌,遗传性肾癌,孤立性肾癌,临床资料不全或合并其他重大疾病者。
1.2 手术方法
98例均采取后腹腔镜下操作。全身麻醉,健侧卧位,腰部垫高。气囊法扩张腹膜后间隙建立腹膜后腔。第12肋下、腋前线肋缘下、腋中线髂嵴上分别置入套管,置入30°腹腔镜、超声刀及分离钳。充二氧化碳CO2至压力为14 mmHg(1 mmHg=0.133 kPa)。清除腹膜外脂肪,沿腰大肌表面肾脂肪囊外游离出肾动脉,切开Gerota筋膜。沿肾脂肪囊与肾被膜之间的疏松间隙分离,通过仔细阅读泌尿系CT或MRI,充分显露肿瘤和周围的肾实质或者肿瘤最可能的区域。切除肿瘤表面及周围的肾脂肪囊然后根据不同情况实施个体化方案。
A组87例,肿瘤较大,肾表面可以看见肾肿瘤轮廓或可见局部隆起,以动脉夹常规阻断肾动脉。距肿瘤边缘0.5 cm用剪刀从正常肾实质开始切割,将肿瘤表层正常肾实质与肿瘤一起切除。取1根2-0倒刺线(美国Angiotech公司),如创面破坏集合系统,先用倒刺线进行内层缝合。在缝线尾处留置1个Hemo-lok,第1针从肿瘤床的顶端开始,自肾包膜外进针,穿过肾包膜和肿瘤床,于肿瘤床基底连续缝合肾髓质,关闭肾集合系统,最后于肾缺损底部穿出肾包膜,线尾留置1个Hem-o-lok加强固定。外层缝合同样采用倒刺缝线连续缝合方法,连续穿过两侧肾包膜及肾皮质全层,收紧,最后1针穿出肾包膜后,线尾留置1个Hem-o-lok固定。松开阻断,记录阻断时间,观察有无渗血情况,必要时再倒刺线加固缝合。取出标本,放置引流管,关闭穿刺切口。
B组7例,肿瘤较小,外向生长,术中游离肾动脉套橡皮条备用(图1),试行不阻断肾动脉,零缺血的状态下实施RLPN,距肿瘤边缘0.5 cm用剪刀从正常肾实质开始切割,一边吸引器吸引创面,一边剪刀切割,将肿瘤表层正常肾实质与肿瘤一起切除(图2)。若术中出血较多,明显影响视野,则牵拉橡皮条,迅速寻及肾动脉并阻断,再继续切除肿瘤,其余步骤同A组。
C组4例,肿瘤较小,内生性,肾表面仅见正常肾组织,通过仔细阅读泌尿系CT或MRI,粗略估计肾肿瘤在肾脏表面的投影位置,再将腔内超声探头(丹麦BK公司BK Pro Focous 2202超声成像系统)置于投影位置表面以明确肿瘤准确位置。调整探头弯曲度对病变进行扫查,判断肿瘤位置、形态、大小、边界、周围有无微小卫星转移灶及血供等。用电凝钩在肾表面勾勒标志线,形成肾肿瘤边界在肾表面的投影环(图3)。然后动脉夹阻断、沿标志线切除肿瘤(图4),切除深度依据术中肉眼对切除界面的观察结合术前影像学估计为主,必要时再超声实时探查监测,明确切割界面。缝合肿瘤床,取标本,关闭切口(同A组)。
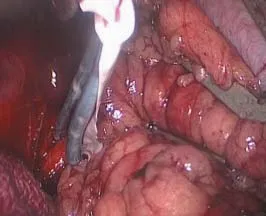
图1 游离肾动脉套橡皮条备用Fig.1 Separate and ring the renal artery with rubber band prepared for possible use
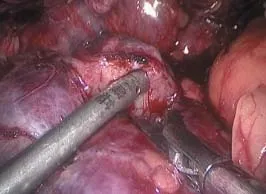
图2 边吸引创面边切除肿瘤Fig.2 Cut tumor while sucking blood on the wound
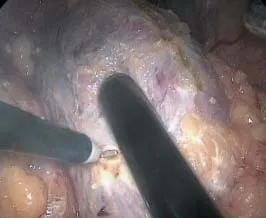
图3 在腔内超声监测下标记肿瘤范围Fig.3 Mark tumor range under ultrosound monitoring

图4 沿标志线切除肿瘤Fig.4 Cut tumor along the mark
1.3 随访情况
首次随访在术后1个月进行,之后每3个月随访1次,3年后每年随访1次。随访检查主要内容包括生化(肾功能)、腹部B超和/或腹部CT,胸部X线片或胸部CT检查。
2 结果
A组87例小肾癌中1例因肾下极肿瘤,腔镜下创面缝合困难,中转开放肾部分切除术缝合创面。2例肾门处肿瘤阻断血管后,创面出血仍多,严重影响视野及肿瘤界面的判断,其中1例填塞纱布后改开放肾部分切除术,1例术中冰冻切缘阳性,改腹腔镜下肾根治性切除术。术中出血量30~350 ml,平均93 ml,手术时间70~245 min,平均127 min,术中热缺血时间20~42 min,平均26 min。
B组7例外突性生长的肾癌,6例未阻断肾动脉,1例出血明显,切除肿瘤过程中,再阻断肾动脉15 min,完成肾部分切除术,出血量160~380 ml,平均220 ml,手术时间85~215 min,平均143 min。
C组4例中内生性小肾癌全部手术过程顺利,出血量35~250 ml,平均85 ml,手术时110~235 min,平均175 min,术中热缺血时间25~40 min,平均28 min。术后病理报告肾透明细胞癌89例,乳头状肾细胞癌5例,嫌色细胞癌3例,多房囊性肾细胞癌1例。
术后随访6~48个月,中位时间26个月,除1例(肾门处3.0 cm透明细胞癌)术后18个月发现腹膜后及肺部肿瘤,考虑复发和转移,予索拉非尼分子靶向治疗之外,其余术后肾功能均正常。
3 讨论
随着医学影像学技术的发展,越来越多的新发肾癌主要是肾脏小肿块和低级别局限性肿瘤,这是导致肾癌治疗方案的革命性改变的主要原因之一。肾部分切除术作为目前治疗局限性肾癌的金标准,疗效与根治性肾切除术相当[4]。肾部分切除术的最大优势在于可以最大限度地保留功能肾单位。随着腹腔镜技术及器械的不断发展,腹腔镜下保留肾单位肾部分切除术(laparoscopic nephron sparing surgery,LNSS)开展数量越来越多,适应证越来越宽,其同开放手术的疗效相当,已成为T1a期肾肿瘤的首选治疗方案[3-7]。传统的肾部分切除术需要解剖肾门和阻断肾动、静脉,尤其在一些肿瘤位置比较深或者向心性生长的肿瘤切除术中,以便于充分及安全切除肿瘤,并尽量减少失血量。术中出血可影响手术视野、肿瘤边界的判断和肾脏重建。本院对于Renal评分>5的直径1.5 cm以上的肾肿瘤(A组,Renal评分6~10分)和所有内生性肿瘤(C组,Renal评分7~9分)仍然采用传统的阻断肾动脉的方法,以保证良好的视野和减少出血,但A组仍有2例阻断肾动脉后,创面出血多,影响视野及肿瘤界面的判断而被迫更改手术方案。考虑与存在肾动脉分支血管有关,术前仔细阅读CTA或MRA检查很重要,对于有分支血管存在的可 以同时分离阻断或供应肿瘤分支阻断,A组中有3例术前CTA发现有2支血管供应,2例予以同时阻断,1例Renal评分低患者仅予以肿瘤分支血管阻断,创面出血明显减少。
在寻求最佳外科治疗手段的过程中,阻断肾动脉所致的肾缺血对肾部分切除术后肾功能的影响一直存在争议[4]。为明确影响术后肾功能的主要因素,曹靖等[8]回顾性分析76例行腹腔镜下肾部分切除术患者的临床资料,根据术中不同热缺血时间分成3组:A组28例,热缺血时间<20 min;B组34例,20 min≤热缺血时间<30 min;C组14例,热缺血时间≥30 min。术中所有患者均行单独肾动脉阻断。3组术后不同时间点患侧肾小球滤过率(glomerular filtration rate,GFR)较术前基础值均有不同程度的下降,术后1周、1个月、3个月C组患侧GFR差值较A组和B组下降明显,差异有统计学意义。回归分析结果显示热缺血时间是术后早期肾功能损害的独立危险因子。热缺血时间≥30 min,对术后肾功能损害程度大,并且早期总肾功能恢复缓慢。于俊杰等[9]采用前瞻性研究的方法,分析39例T1期肾癌行腹腔镜下肾部分切除术治疗患者的临床及手术资料也有类似结果,39例患者术后3和12个月时患侧肾单侧GFR值与术前基础值比较差异有统计学意义,术后3和12个月单侧GFR值与热缺血时间呈明显负相关关系。热缺血时间在30 min以内时对肾功能影响相对较小,随着热缺血时间的延长,患肾功能及总体肾功能损害程度明显增加。总之,在保证肿瘤完整切除基础上减少热缺血时间一直是NSS的关键技术。
目前缩短或避免热缺血时间,更好地保护肾功能的方法包括 低温保护技术和肾蒂血管阻断技术。低温保护技术是使用腹腔镜下外敷冰盐水、经输尿管逆行灌注冰盐水、经 肾动脉灌注4~8℃平衡液等方法实现原位肾低温保护。而肾蒂血管阻断技术包括:①不阻断肾蒂血管的LNSS;②肾段动脉阻断的LNSS,SHAO等[10]采用腹腔镜下肾段动脉阻断来减少“缺血再灌注”损伤。与 肾动脉主干阻断相比较,肾段动脉阻断组的热缺血时间和术中出血量稍有增加,但术后肾功能恢复具有明显优势;③“零缺血”的LNSS,主要包括术前超选择性肿瘤动脉栓塞和肾动脉高级分支阻断的LNSS。SIMONE等[11]对于直径>4.0 cm和侵入深度>1.5 cm的肾实质内肿瘤以及肾门肿瘤,术前通过动脉微导管对3或4级肾动脉分支进行超选择性栓塞,术中不阻断肾动脉,应用切割止血工具进行LNSS手术。避免了热缺血对肾功能的影响,突破了缺血时间对手术操作的限制性,术中术后并发症发生率低,肿瘤疗效满意。GILL等[12]首次报道了肾动脉高级分支阻断的LNSS,术中精细解剖肾动脉至3或4级分支,实施肿瘤供应血管阻断,实现了零缺血LNSS。另外,也有一些研究集中在肿瘤床关闭缝合方法的改进上,以最大限度地缩短热缺血时间,保护肾功能[3,13]。
但如果能实现不阻断肾动脉的手术应该是最理想的。有学者尝试采用各种不同的方法,在不阻断肾动脉的情况下切除肿瘤组织以达到理想的“零缺血”[14-15]。也有学者采用双向倒刺缝合线贯穿缝合肾脏,实现了在不阻断肾动脉的前提下的肾部分切除,且不增加手术难度,取得了传统手术的效果[16]。由于肾实质浅表部位无大血管,对于外向生长的Renal评分不大于5分浅表肿瘤(B组),笔者采用试行后腹腔镜下不阻断肾动脉的方法实现了肾部分切除术,做到完全零缺血,避免了对肾脏“缺血再灌注”损伤。能最大限度保护肾功 能,术后无再出血及尿漏发生。但术中出血量明显增加,可以用吸引器持续吸引创面,加快气腹气体的流入速度来相应处理。由于肿瘤小,位置浅,此7例患者均未切到肾盂集合系统,大部分无需内层缝合,以缩短缝合时间,减少出血,B组7例中5例未予深层缝合。但1例在切除肿瘤过程中因出血影响了手术视野及对肿瘤边界的判断,故先及时寻及预先放置的橡皮条,迅速使用血管阻断钳阻断肾动脉后再继续手术,以保障手术安全及肿瘤切除的完整性。由于笔者并不能完全估计术中的出血情况,所以仍然常规游离肾动脉,并套好橡皮条,以便必要时迅速寻及,同时血管阻断钳备用,灵活机动,有备无患。尽管出血有所增加,但笔者认为患者可以减少保留肾单位的肾功能损伤,利大于弊。但由于本组选择做不阻断肾动脉肾部分切除术的患者从RENAL评分来看难度是相对较小的,所有肿瘤直径均<1.5 cm,位置表浅,远离肾门侧,界限清晰。随着难度的增加是否会有相同的效果需要进一步观察比较。
C组4例病例尽管肿瘤小,但位置深,属于内生性肿瘤,以前被认为肾部分切除的禁忌,但近期研究认为,经验丰富的手术医师为内生型或肾门旁肿瘤患者行LNSS是安全可行的[17]。但内生型肿瘤外凸率小,难以判断肿瘤范围,术中完整切除和重建肾脏具有较高的挑战性。完整切除肿瘤需要损伤更多的正常肾组织,术中预计出血更多。因此,多选择肾蒂或单纯肾动脉阻断方式[18]。腔内B超可以较精确地定位肿瘤位置、深度以及与肾脏的解剖关系,通过辨认血流信号,判断是否存在分支血管,以降低术中动脉出血风险。可能发现术前常规影像学检查无法发现的肿瘤周围卫星灶,肾肿瘤行超声造影,对于极少数术中定位困难的病例,可选择超声造影协助定位[18]。本研究4例(C组)病例借助腔内B超快速找到肿瘤并精准定位后再在肾动脉阻断下顺利完成肿瘤切除,未使用超声造影。笔者体会:术前影像学检查和术中超声监测的联合尤其重要,术前仔细阅片影像学资料,特别是增强CT,先估计肾肿瘤在肾脏表面的投影位置及肾动脉的支数和供应肿瘤的动脉,这将大大节约时间;再将超声探头置于投影位置表面,并请超声科医生协助以精准定位,并务必做好表面标记,退出超声探头。以肾表面标记切除范围为主,切除深度主要依据术中肉眼对切除界面的观察结合术前影像学估计为主,必要时再超声实时探查监测,以完整切除肿瘤,最大限度保留肾单位。由于肿瘤位置深,往往会切穿肾盂集合系统,此4例全部切穿集合系统,均予以缝合集合系统及内层缝合。4例患者切缘均阴性,术后均无尿漏及术后出血,与4例患者肿瘤相对较小有关,需积累更多病例以观疗效。
综上所述,对于Renal评分不大于5分直径<1.5 cm外生性小肾癌可以试行在腹腔镜下不阻断肾动脉零缺血的状态下实施肾部分切除,能最大限度保护肾功能,但术中出血量明显增加,需慎重选择;但Renal评分大于5分的直径>1.5 cm的肾癌及内生性小肾癌仍宜选择肾动脉阻断下肾部分切除,而部分内生性小肾癌采用腔内超声术中精确探查定位的方案可帮助快速定位,精准切除。RLPN个体化方案治疗小肾癌安全、有效,但尚需增加例数和长期随访观察明确其远期疗效。
[1]邢念增, 王明帅. 高选择性肾动脉分支阻断术在腹腔镜肾部分切除术中的应用[J]. 中华医学杂志, 2012, 92(18): 1275-1277.
[1]XING N Z, WANG M S. Laparoscopic partial nephrectomy with highly selective clamping of renal arterial branches[J]. National Medical Journal of China, 2012, 92(18): 1275-1277. Chinese
[2]方群鹰. 低温保护技术在腹腔镜肾部分切除术中的应用进展[J].中国微创外科杂志, 2013, 13(5): 461-463.
[2]FANG Q Y. Progress in the application of low temperature protection technology in laparoscopic partial nephrectomy[J].Chinese Journal of Minimally Invasive Surgery, 2013, 13(5): 461-463. Chinese
[3]田晓军, 马潞林, 庄申榕, 等. 后腹腔镜下创面不缝合肾部分切除术的疗效观察[J]. 中华医学杂志, 2014, 35(11): 807-810.
[3]TIAN X J, MA L L, ZHUANG S R, et al. Ef fi cacy of laparoscopic nephron-sparing surgery without renal wound suturing[J]. Chinese Journal of Urology, 2014, 35(11): 807-810. Chinese
[4]吴旭红, 郭宏骞. 解剖性零缺血肾部分切除术及术后肾功能[J].东南大学学报(医学版), 2014, 33(4): 527-530.
[4]WU X H, GUO H Q. Zero ischemia anatomical partial nephrectomy and postoperative renal function[J]. J Southeast Univ(Med Sci Edi), 2014, 33(4): 527-530. Chinese
[5]ZHAO P T, RICHSTONE L, KAVOUSSI L R. Laparoscopic partial nephretomy[J]. Int J Surg, 2016, 36(Pt C): 548-553.
[6]HADJIPAVLOU M, KHAN F, FOWLER S, et al. Partial vs radical nephrectomy for T1renal tumors: an analysis from the British Association of Urological Surgeons Nephrectomy Audit[J]. BJU Int,2016, 117(1): 62-71.
[7]陈勇辉, 吴小荣, 陈伟, 等. 后腹腔镜下肾部分切除术在完全内生性肾肿瘤治疗中的应用[J]. 中华泌尿外科杂志, 2016, 37(10):726-729.
[7]CHEN Y H, WU X R, CHEN W, et al. Retroperitoneal laparoscopic partial nephrectomy for completely endophytic renal cell carcinoma[J]. Chin J Urol, 2016, 37(10): 726-729. Chinese
[8]曹靖, 陈文军, 文甲明, 等. 热缺血时间对腹腔镜下肾部分切除术后早期肾功能的影响分析[J]. 中华泌尿外科杂志, 2015,36(6): 414-418.
[8]CAO J, CHEN W J, WEN J M, et al. The effect of warm ischemia duration on renal function early after laparoscopic partial nephrectomy[J]. Chin J Urol, 2015, 36(6): 414-418. Chinese
[9]于俊杰, 温儒民. 腹腔镜肾部分切除术中热缺血时间对肾功能的影响[J]. 中华外科杂志, 2014, 52(4): 267-270.
[9]YU J J, WEN R M. The effects of warm ischaemia time on renal function after laparoscopic partial nephrectomy in patients[J]. Chin J Surg, 2014, 52(4): 267-270. Chinese
[10]SHAO P, TANG L, LI P, et al. Application of a vasculature model and standardization of the renal hilar approach in laparoscopic partial nephrectomy for precise segmental artery clamping[J]. Eur Urol, 2013, 63(6): 1072-1081.
[11]SIMONE G, PAPALIA R, GUALIANUNE S, et a1. Zero ischemia laparoscopic partial nephrectomy after superselective transarterial tumor embolization for tumors with moderate nephrometry score:long-term results of a single center experience[J]. J Endourol,2011, 25(9): 1443-1446.
[12]GILL I S, EISENBERG M S, ARON M, et al. “Zero ischemia”partial nephrectomy:novel laparoscopic and robotic technique[J].Eur Urol, 2011, 59(1): 128-134.
[13]李伟, 张开颜, 陈斌, 等. 单向免打结倒刺缝线双层连续缝合在后腹腔镜肾部分切除术中的应用[J]. 中国内镜杂志, 2016,22(4): 34-38.
[13]LI W, ZHANG K Y, CHEN B, et al. Application of one-way twolayer barbed running suture in retroperitoneal laparoscopic partial nephrectomy[J]. China Journal of Endoscopy, 2016, 22(4): 34-38.Chinese
[14]魏辉, 黄英, 翁潭潭, 等. 采用2μm激光不阻断肾动脉行腹腔镜肾部分切除术[J]. 中国微创外科杂志, 2013, 13(8): 749-750.
[14]WEI H, HUANG Y, WENG T T, et al. “Zero Ischemia” laproscopic partial nephrectomy with 2-micron laser[J]. Chinese Journal of Minimally Invasive Surgery, 2013, 13(8): 749-750. Chinese
[15]马文松, 江文生, 毕学成. 腹腔镜下不阻断肾动脉的肾部分切除术20例[J]. 中国现代医生, 2014, 52(6): 132-133.
[15]MA W S, JIANG W S, BI X C. Laparoscopic renal pedicle without blocking the partial nephrectomy[J]. China Modern Doctor, 2014,52(6): 132-133. Chinese
[16]刘清学, 高飞, 彭洪, 等. 双向倒刺缝合线在不阻断肾动脉的后腹腔镜肾部分切除术中的应用[J]. 四川医学, 2015, 36(10):1407-1409.
[16]LIU Q X, GAO F, PENG H, et al. Use of bidirectional barbed suture in retroperitoneal laparoscopic partial nephrectomy without blocking renal artery[J]. Sichuan Medical Journal, 2015, 36(10):1407-1409. Chinese
[17]DI PIERRO G B, TARTAGLIA N, ARESU L, et al. Laparoscopic partial nephrectomy for endophytic hilar tumors: feasibility and outcomes[J]. Eur J Surg Oncol, 2014, 40(6): 769-774.
[18]刘茁, 孟一森, 范宇, 等. 后腹腔镜下肾部分切除术治疗内生型肾肿瘤的临床分析[J]. 中华泌尿外科杂志, 2015, 36(10):726-731.
[18]LIU Z, MENG Y S, FAN Y, et al. Outcomes of retroperitoneal laparoscopic partial nephrectomy in patients with endophytic renal tumors[J]. Chin J Urol, 2015, 36(10): 726-731. Chinese
Application of laparoscopic partial nephrectomy with individual operation plan in treatment of small renal cell carcinoma
Si-hai Shao, Jian-er Tang, Yue-fan Shen, An-ping Xiang, Wei-gao Wang, Rong-jiang Wang
(Department of Urology, the First People’s Hospital of Huzhou, the First Af i liated Hospital of Huzhou University, Huzhou, Zhejiang 313000, China)
ObjectiveTo evaluate the feasibility and clinical efficacy of retroperitoneal laparoscopic partial nephrectomy (RLPN) with individual operation plan in treatment of small renal cell carcinoma (RCC).Methods98 patients with small RCC who was treated by RLPN from June 2012 to June 2016 were retrospectively analyzed.There were 57 males and 41 females with a mean age of 52 years old (ranging 28 ~ 75 years old). 52 cases were located on the right side while 46 cases were left. The mean tumor size was 3.1 cm in diameter (ranging 0.8 ~ 4.5 cm).87 patients (A group) were underwent standard RLPN with clamping main renal artery. 7 patients (B group) with exophytic RCC were performed without clamping renal artery, but with separating main renal artery and prepared for possible clamping. 4 patients (C group) with endophytic RCC were performed with clamping renal artery underultrosound monitoring. The feasibility and outcomes were evaluated by surgical and oncological outcomes.Results84 cases among A group were underwent standard RLPN successfully, with 2 cases converted to open surgery and 1 case failed to excising tumor completely and converted to laparoscopic radical nephrectomy. The amount of bleeding during operation was 30 ~ 350 ml, average 93 ml, operation time was 70 ~ 245 min, average 127 min, warm ischemia time 20 ~ 42 min, average 26 min. 6 cases among B group were performed successfully without clamping renal artery with 1 case converted to clamp renal artery for 15 min during the operation because of obvious bleeding. The amount of bleeding was 160 ~ 380 ml, average 220 ml, operation time was 85 ~ 215 min, average143 min. 4 cases of C group were all performed successfully, The amount of bleeding was 35 ~ 250 ml, average 85 ml, operation time was 110 ~ 235 min, average 175 min, warm ischemia time 25 ~ 40 min, average 28 min. With a mean follow up of 28 months (ranging 18 ~ 42 months), there was only 1 case of A group occured local recurrence and lung metastases and accepted molecular targeted therapy with Sorafenib.ConclusionRLPN with individual operation plan in treatment of small RCC is safe and effective, the long-term effect of the procedure needs further investigation.
laparoscopy; partial nephrectomy; renal tumor
R737.11
B
10.3969/j.issn.1007-1989.2017.08.022
1007-1989(2017)08-0105-06
2017-01-16
(吴静 编辑)
