2型糖尿病大鼠膀胱逼尿肌中膜结合型前列腺素E2合酶1的表达及意义
2017-11-02王彦彬李瑞鹏诸靖宇徐侃
王彦彬 李瑞鹏 诸靖宇 徐侃
2型糖尿病大鼠膀胱逼尿肌中膜结合型前列腺素E2合酶1的表达及意义
王彦彬 李瑞鹏 诸靖宇 徐侃
目的 探讨2型糖尿病大鼠膀胱逼尿肌中膜结合型前列腺素E2合酶1(mPGES-1)的表达及意义。方法 将36只雌性SD大鼠随机分成糖尿病组与对照组,每组18只。使用链脲佐菌素(STZ)建立2型糖尿病大鼠动物模型。造模成功后12周,观察并比较两组大鼠一般生理体征;在光镜下观察膀胱逼尿肌组织HE染色结果,在透射电镜下观察组织超微结构变化,采用免疫组化法检测组织中mPGES-1表达水平,并使用前列腺素E2(PGE2)酶联免疫试剂盒检测24h尿液中PGE2含量,所得结果进行组间比较。结果 与对照组比较,糖尿病组大鼠终末体重明显降低(P<0.05),终末血糖、膀胱湿重和24h尿量均明显增加(均P<0.05)。与对照组比较,糖尿病组大鼠在光镜下可见逼尿肌肌束结构排列紊乱,肌束间隙变宽;在透射电镜下可见逼尿肌细胞间距变宽,胞质内线粒体肿胀破裂呈空泡状。糖尿病组大鼠24h尿液PGE2含量、膀胱逼尿肌组织中mPGES-1表达水平较对照组均明显下降(P<0.05)。结论 2型糖尿病大鼠膀胱逼尿肌组织中mPGES-1表达水平及尿液PGE2含量均明显降低,可能与糖尿病性膀胱病的进展有关。
2型糖尿病 膀胱 膜结合型前列腺素E2合酶1 前列腺素E2
糖尿病性膀胱病(diabetic cystopathy,DCP)是一种糖尿病泌尿系统的并发症,主要是由糖尿病周围神经病变引起的膀胱功能障碍[1]。有研究发现前列腺素E2(prostaglandin E2,PGE2)是一种重要的细胞生长和调节因子,它是逼尿肌收缩的重要控制介质,在排尿反射中扮演着重要角色[2]。目前关于PGE2与DCP的关系研究国内较少,因此笔者通过建立2型糖尿病大鼠模型,应用酶联免疫吸附法与免疫组化技术检测PGE2及其同工酶膜结合型前列腺素E2合酶1(mPGES-1)的表达,以探讨2型糖尿病大鼠膀胱逼尿肌组织中mPGES-1的表达及意义,为深入研究DCP的发病机制提供线索。
1 材料和方法
1.1 实验动物及材料 实验动物选用SPF级健康雌性SD 大鼠 36只(10周),体重(230.35±21.26)g,购于上海斯莱克[合格证号:SCXK(沪):2012-002];所有动物饲养于浙江中医药大学实验动物中心SPF实验室。链脲佐菌素(STZ)由美国Sigma公司生产;枸椽酸盐购自上海驰为实业有限公司;血糖测定仪、血糖试纸由美国强生公司生产;免疫组化试剂盒购自福州脉新生物技术开发有限公司;大鼠PGE2酶联免疫试剂盒购自上海雅吉生物科技有限公司。
1.2 方法
1.2.1 动物分组、造模及一般生理体征观察 36只SD大鼠禁食12h后,随机分为糖尿病组与对照组,每组18只。将STZ溶解于pH 4.2、浓度0.1mol/L的枸橼酸缓冲液中,按50mg/kg剂量予以单次腹腔注射[3],注射1次/d,注射至第4周确认大鼠空腹血糖均>11.1mmol/L,即造模成功;对照组予以腹腔注射等剂量的枸橼酸缓冲液。两组大鼠继续予以饲料喂养,于造模成功后第12周(糖尿病组空腹血糖均>11.1mmol/L)测量两组大鼠代谢笼24h尿量,并留取所有大鼠24h尿液用于PGE2含量检测,测定大鼠空腹血糖为终末血糖,测定大鼠体重为终末体重,并按0.3ml/100g剂量予以10%水合氯醛腹腔注射麻醉,仰卧位固定并处死大鼠,完整切除膀胱,排净残余尿液后称取膀胱湿重。
1.2.2 常规HE染色 取膀胱逼尿肌条投入10%中性
甲醛溶液同定,石蜡包埋组织切片,作HE染色。
1.2.3 透射电镜下观察超微结构 取大鼠膀胱逼尿肌组织,剪成1mm×1mm×1mm大小的组织块,常规包埋,超薄切片(120nm),2%醋酸铀染色及枸橼酸铅染色,在透射电镜(×8 900)下观察两组大鼠膀胱逼尿肌超微结构。1.2.4 免疫组化检测 蜡块连续切片,厚3μm。采用En vision免疫组化二步法染色,用已知阳性的大鼠膀胱逼尿肌组织作为阳性对照,用PBS代替一抗作为阴性对照,DAB显色。在光镜下mPGES-1阳性反应部位为棕黄染色,利用计算机图像分析软件(Imagepro-plus 6.0)计算平均吸光度(A值),即大鼠膀胱逼尿肌组织mPGES-1表达水平。
1.2.5 尿液PGE2含量检测 使用PGE2酶联免疫试剂盒,测定24h尿液中PGE2含量,实验步骤严格按照试剂盒中说明书进行操作。
1.3 统计学处理 建立Excel数据库,应用SPSS17.0统计软件。计量资料用表示,两组间比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组大鼠一般生理体征比较 两组大鼠初始体重比较,差异无统计学意义(PP>0.05)。与对照组比较,糖尿病组大鼠终末体重明显减少,终末血糖、膀胱湿重和24h尿量均明显增加,差异均有统计学意义(均P<0.05),见表1。
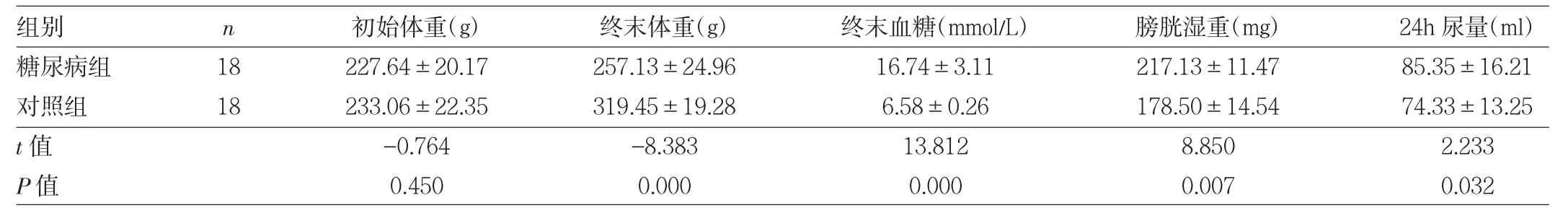
表1 两组大鼠一般生理体征比较
2.2 两组大鼠膀胱逼尿肌组织HE染色结果比较 糖尿病组大鼠膀胱逼尿肌组织HE染色结果在光镜下可见:黏膜下炎细胞浸润,肌束纵横交错,排列紊乱,逼尿肌细胞肥大,形态不规则,见图1a;对照组可见膀胱肌束纤维整齐排列,逼尿肌细胞大小一致,见图1b。
2.3 两组大鼠膀胱逼尿肌超微结构比较 在透射电镜下,糖尿病组大鼠逼尿肌细胞间距变宽,外形、大小不一致,分布不均匀,排列走行紊乱,有部分凹陷,胞质内线粒体肿胀破裂呈空泡状,细胞连接纤维化、成纤维细胞变性及胶原纤维排列紊乱,见图2a;对照组大鼠逼尿肌细胞表面平滑,排列均匀,胞质内有少量线粒体,且结构较完整,见图2b。
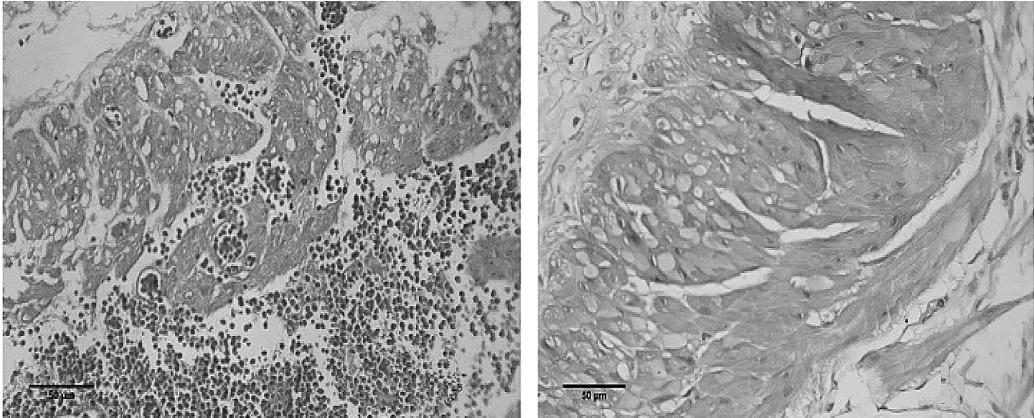
图1 两组大鼠膀胱逼尿肌组织HE染色所见比较(a:糖尿病组;b:对照组;×400)
2.4 两组大鼠尿液PGE2含量及膀胱逼尿肌组织中mPGES-1表达水平比较 与对照组比较,糖尿病组大鼠尿液PGE2含量、膀胱逼尿肌组织中mPGES-1表达水平均明显下降,差异均有统计学意义(均P<0.05),见表2和图3。
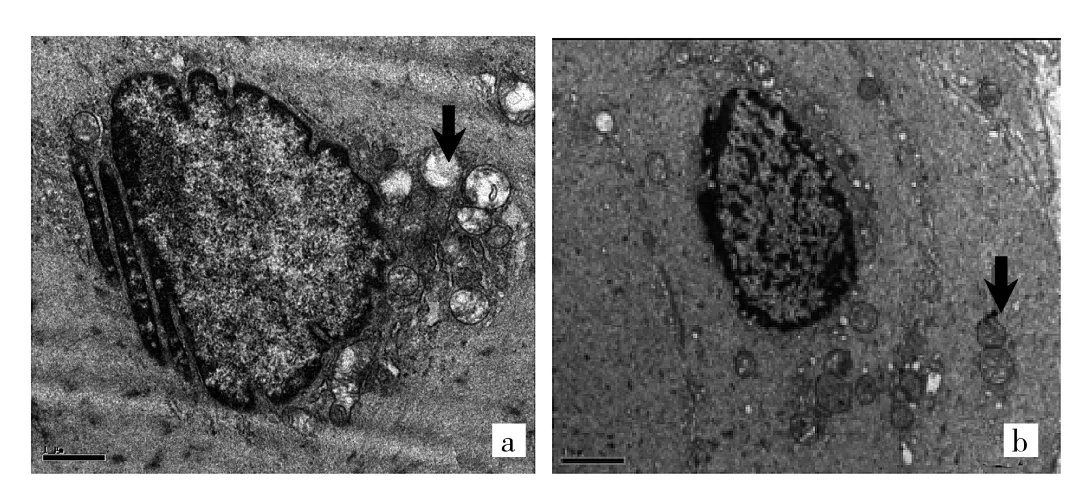
图2 两组大鼠膀胱逼尿肌超微结构比较(a:糖尿病组,箭头所示为肿胀线粒体;b:对照组,箭头所示为正常线粒体;×8 900)
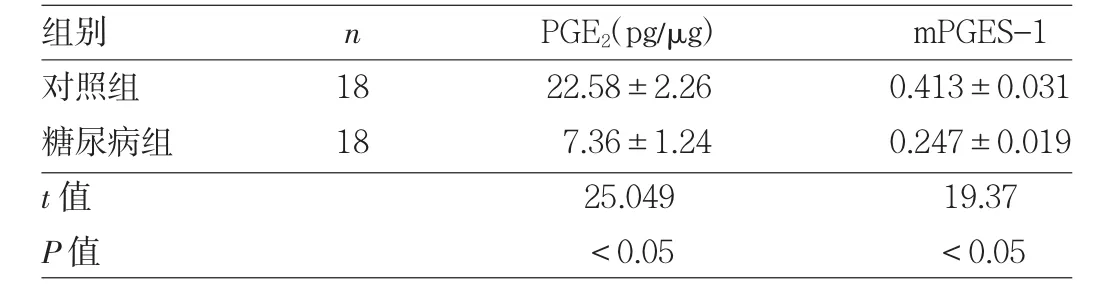
表2 两组大鼠尿液PGE2含量及膀胱逼尿肌组织中mPGES-1表达水平比较
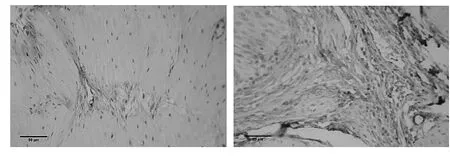
图3 两组大鼠膀胱逼尿肌免疫组化结果比较(a:糖尿病组;b:对照组;En vision免疫组化二步法,×400)
3 讨论
近年来糖尿病发病率逐渐升高,且呈年轻化趋势。而DCP发生率高达40%~85%[4],主要是由糖尿病神经病变导致自主神经功能障碍引起的。DCP发病初期以排尿次数增多、膀胱顺应性增高为特征,随着病程进展,排尿间隔延长、次数减少,后期逼尿肌收缩功能受损导致排尿无力,最终引起尿潴留、肾功能不全等严重并发症[5]。但目前关于其膀胱功能损害的具体机制尚不清楚,临床治疗缺乏针对性,疗效欠佳。参考当前文献,笔者总结DCP的发病机制,大致可分为以下3个方面:(1)肌源性因素。包括逼尿肌形态改变、逼尿肌细胞萎缩等,最终导致逼尿肌功能丧失[6-7];(2)血管因素。包括血管供应减少、血管内皮功能障碍、炎症等,最终影响膀胱功能[8];(3)神经源性因素。包括神经生长因子(NGF)[9]、胰岛素生长因子(IGF-1)[10-11]、PGE2水平下降[12],内皮型一氧化氮合酶增加[13]等。
PGE2是花生四烯酸的代谢产物,花生四烯酸在环氧酶的作用下生成中间产物PGH2;但PGH2不稳定,随后可在PGE合酶(PGES)的作用下生成PGE2。目前已发现有3种PGES同工酶,其中最主要的是mPGES-1,它们在不同条件下调控PGE2的合成,发挥着重要的生物学功能[14]。例如在排尿功能方面,PGE2是逼尿肌收缩重要的控制介质,参与膀胱的排尿反射[2];它也可直接激活膀胱组织中辣椒素敏感性神经纤维即C纤维引起排尿反射[15]。PGE2在胃肠道能通过激活鸟苷酸环化酶促进黏液分泌,保护胃黏膜的完整,防止溃疡发生;而PGE2能在泌尿系上皮大量合成,故PGE2在维持膀胱黏膜完整性方面也可能发挥着相似的作用。因此,当患者发生糖尿病时,PGE2的合成下降就可能引起尿液对膀胱、尿道黏膜组织的损害。其次,PGE2可以调节膀胱平滑肌肌细胞增生和组织塑形,所以PGE2很可能参与了糖尿病膀胱、尿道平滑肌细胞增生与肥大的适应过程。
糖尿病组大鼠24h尿液中PGE2含量及膀胱逼尿肌组织中mPGES-1表达水平较对照组均明显降低,与Nirmal等[12]研究结果一致。Nirmal等[12]通过测定糖尿病大鼠尿液中PGE2含量发现,所有大鼠出现膀胱功能障碍,且尿液中PGE2含量明显下降;可能机制是糖尿病膀胱组织中分子信号通路失调,膀胱组织结构重建,膀胱上皮细胞功能损伤且数量减少,导致分泌PGE2减少,从而加重膀胱功能障碍[13]。而本实验证实DCP大鼠PGE2合成的关键酶mPGES-1表达水平也降低,可能是PGE2含量减少的原因之一。一项对离断的膀胱逼尿肌的体外研究发现,糖尿病逼尿肌肌条对外源性花生四烯酸的刺激反应被抑制,说明若PGE2下降,则逼尿肌反射强度下降或被抑制[4],可见PGE2在膀胱逼尿肌收缩功能方面扮演着重要的角色。
综上所述,2型糖尿病大鼠膀胱逼尿肌组织中mPGES-1表达水平及尿液PGE2含量均明显降低,可能与DCP的进展有关,但具体的作用机制有待进一步探讨。
[1] Olapade-Olaopa E O,Morley R N,Carter C J,et al.Diabetic cystopathy presenting as primary acute urinary retention in a previously undiagnosed young male diabetic patient[J].Journal of diabetes and its complications,1997,11(6):350-351.
[2] Van Koeveringe G,VahabiB,Andersson K,et al.Detrusor underactivity:A plea for new approaches to a common bladder dys-function[J].Neurourology and urodynamics,2011,30(5):723-728.[3] JiE S,Ko I G,Cho J W,et al.Treadmill exercise inhibits apoptotic neuronal cell death with suppressed vascular endothelial growth factor expression in the retinas of the diabetic rats[J].Journal of exercise rehabilitation,2013,9(3):348-353.
[4] Mumtaz F,Thompson C,Khan M,et al.Alterations in the formation of cyclic nucleotides and prostaglandins in the lower urinary tract of the diabetic rabbit[J].Urological research,1999,27(6):470-475.
[5] Sasaki K,Yoshimura N,Chancellor M B.Implications of diabetes mellitus in urology[J].Urologic Clinics of North America,2003,30(1):1-12.
[6] Leiria L,Monica F,Carvalho F,et al.Functional,morphological and molecular characterization of bladder dysfunction in streptozotocin-induced diabetic mice:Evidence of a role for l-type voltage-operated Ca2+channels[J].British journal of pharmacology,2011,163(6):1276-1288.
[7] Kanika N D,Chang J,Tong Y,et al.Oxidative stress status accompanying diabetic bladder cystopathy results in the activation of protein degradation pathways[J].BJU international,2011,107(10):1676-1684.
[8] Liu R T,Chung MS,Lee WC,et al.Prevalence ofoveractive bladder and associated risk factors in 1359 patients with type 2 diabetes[J].Urology,2011,78(5):1040-1045.
[9] 罗广承,何志华,罗建珍,等.构建糖尿病膀胱病豚鼠模型及其尿动力学评价[J].中国组织工程研究,2014,18(7):1063-1068.
[10] 蒋玉清,孙海滨,王秀丽,等.胰岛素生长因子-1 mRNA在糖尿病大鼠膀胱的表达[J].中华实验外科杂志,2014,31(6):1175-1177.
[11] 何朝辉,曹石金,潘卫兵,等.腺相关病毒介导胰岛素样生长因子-1对糖尿病大鼠膀胱病变的治疗作用[J].中华实验外科杂志,2013,30(6):1157-1160.
[12] Nirmal J,Tyagi P,Chuang Y C,et al.Functional and molecular characterization of hyposensitive underactive bladder tissue and urine in streptozotocin-induced diabetic rat[J].PloS one,2014,9(7):e102644.
[13] 姜元军,周泓旭,杨春明,等.内皮型一氧化氮合酶在大鼠糖尿病膀胱病变中的作用[J].中华泌尿外科杂志,2010,4(4):265-268.
[14] Park J Y,Pillinger M H,Abramson S B.Prostaglandin E2synthesis and secretion:The role of pge2synthases[J].Clinical immunology,2006,119(3):229-240.
[15] Lee T,Andersson K E,Streng T,et al.Simultaneous registration of intraabdominal and intravesical pressures during cystometry in conscious rats-effects of bladder outlet obstruction and intravesical pge2[J].Neurourology and urodynamics,2008,27(1):88-95.
Expression of mPGES-1 in bladder of streptozotocin-induced diabetic rats
WANG Yanbin,LI Ruipeng,ZHU Jingyu,et al.
Department of Urology,the Third Affiliated Hospital of Zhejiang Chinese Medical University,Hangzhou 310009,China
Objective To investigate the expression of membrane-associated prostaglandin synthase 1(mPGES-1)in urinary bladder of streptozotocin(STZ)-induced diabetic rats. Methods Thirty six female SD rats were randomly divided into model and control groups with 18 in each.Diabetic cystopathy(DCP)model was induced by intraperitonieal injection of streptozotocin(STZ).After 12 weeks,the animals were sacrificed and the bladder samples were harvested.The histological changes were observed by light microscopic and electron microscopic examination,and the expression of mPGES-1 in bladder tissue was detected by immunohistochemistry and the contents of PGE2in 24h urine were measured by ELISA method. Results Compared with the control group,diabetic rats showed disorder of detrusor smooth muscle structure and wider muscle gap under light microscope.Electron microscopy showed that intercellular space of detrusor was wider and detrusor cells was irregular in shape,the swelling and rupture of mitochondria,and vacuolization were found in cytoplasm.Compared to control group,the contents of PGE2in the urine and the expression of mPGES-1 in bladder detrusor tissue of DCP group were significantly decreased. Conclusion The down-regulated expression of mPGES-1 may play an important role in the occurrence and development of diabetic cystopathy in rats.
Type 2 diabets Bladder mPGES-1 Prostaglandin E2
2016-07-15)
(本文编辑:陈丹)
10.12056/j.issn.1006-2785.2017.39.18.2016-1085
浙江省医学会临床科研基金项目(2013ZYC-A41);杭州市医学重点学科基金资助项目(2014-13-65、2017-51-84)
310009 浙江中医药大学附属杭州第三医院(杭州市第三人民医院)泌尿外科(王彦彬、李瑞鹏、诸靖宇),外科(徐侃)
徐侃,E-mail:hzxk.zj@163.com
