硬 皮 病 肾 脏 损 伤
2017-11-01梁丹丹曾彩虹
梁丹丹 曾彩虹
·肾活检·
硬 皮 病 肾 脏 损 伤
梁丹丹 曾彩虹
中年男性,临床表现为多系统损害,肾脏损伤表现恶性高血压、快速进展的肾功能损害,中等量蛋白尿及镜下血尿;皮肤损害表现为手指僵硬,双手、前臂、面部皮肤增厚。实验室检查示溶血性贫血,血小板下降,抗核抗体阳性,补体C3水平下降。肾活检病理表现为典型的血栓性微血管病改变。患者最终诊断为硬皮病肾危象。
系统性硬化症 硬皮病 肾活检
病例摘要
病史男性,49岁,因“双手指僵硬、双下肢水肿4月余,发现血清肌酐(SCr)升高1周”于2017-07-07入院。
患者于2017年3月出现双手肿胀、手指僵硬,后出现面部及双下肢水肿,伴腹胀,未就诊。7月1日因心慌入住当地医院,测血压180/99 mmHg,尿检示尿蛋白+,隐血+,SCr 356.3 μmol/L,血红蛋白(Hb) 83 g/L,血小板(PLT) 94×109/L,甲状旁腺激素510.6 pg/ml,抗核抗体(ANA) 1∶ 1 000,抗核抗体谱RO-52+,余正常;抗中性粒细胞胞质抗体(ANCA)正常,予利尿、降压、抗感染、保肾等治疗效果欠佳。7月4日至我院急诊就诊查尿蛋白-、隐血+、血白蛋白38.1 g/L,SCr 526.9 μmol/L,Hb 79 g/L,PLT 76×109/L,予利尿、降压等治疗。患者入院时水肿消退,偶有胸闷,无皮疹、关节痛、雷诺现象。病程中患者纳差,睡眠正常,体重无明显变化,大便正常,排尿正常。
既往史2016年确诊为腰椎间盘突出症,2017年2月因腰痛自服“舒筋健腰丸”1月,间断外用药物治疗;有长期井下工作史,否认传染病史、手术史、外伤史、输血史、药物过敏史,预防接种史不详。个人史:无疫水、疫源、放射物、毒物、毒品接触史,吸烟史20年余,1包/d ,饮酒史20年余,2两/d,近3月来戒烟戒酒。
家族史父亲和二弟有高血压病,否认家族性遗传病史。婚育史无特殊。
体格检查体温36.9℃,脉搏106 次/min,呼吸18次/min,血压161/102 mmHg,体质量指数25.0 kg/m2;神清,双手、前臂皮肤弹性差、僵硬,面部部分皮肤弹性差,咽不红,扁桃体不大,心、肺、腹部未见明显异常,双下肢无水肿。
实验室检查
血常规 Hb 79 g/L,RBC 2.9×1012/L,WBC 13.6×109/L,PLT 72×109/L,网织红细胞百分数5.56%。
尿液 尿蛋白定量1.67 g/24h,尿沉渣红细胞162.9/μl;尿C3、α2-MG均正常,RBP 22.5 mg/L(正常值<0.5 mg/L),Lyso 0.8 mg/L(正常值<0.5 mg/L),NAG 298.5 U/(g·Cr)(正常值≤16.5 U/(g·Cr)]。禁饮13h尿渗量363 mOsm/kg·H2]O。
血生化 白蛋白41.3 g/L,球蛋白19.6 g/L,尿素氮44.6 mmol/L,SCr 634.7 μmol/L,尿酸1 000 μmol/L,谷丙转氨酶9 U/L,谷草转氨酶12 U/L,总胆固醇3.68 mmol/L,三酰甘油2.92 mmol/L,乳酸脱氢酶(LDH)635 U/L,钠137.4 mmol/L,钾3.41 mmol/L,氯93.4 mmol/L,总二氧化碳22 mmol/L,钙1.85 mmol/L,磷2.73 mmol/L,空腹血糖5.72 mmol/L。HbA1c 4.1%。
免疫学 ANA 1∶ 1 024,A-dsDNA<1∶ 10;抗核抗体谱示RO-52 ++、余正常;系统性红斑狼疮抗凝因子、抗心磷脂抗体、抗C1q抗体、抗β2糖蛋白1抗体、ANCA均阴性。IgG 8.55 g/L,IgA 0.997 g/L,IgM 0.787 g/L,IgE<20 IU/ml,ASO、RF正常,补体C3 0.638 gL,C4 0.1 g/L。血游离轻链κ 59.00 mg/L,λ 35.00 mg/L,κ/λ比值 1.69。免疫固定电泳未见单克隆条带。抗磷脂酶A2受体抗体阴性。
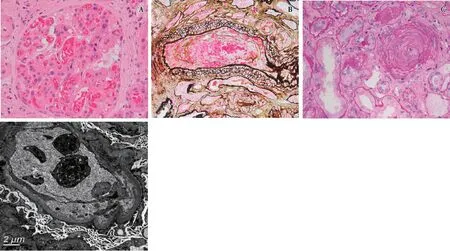
图1 A:肾小球毛细血管袢腔内见红细胞聚集(HE,×400);B:小叶间动脉管腔内见血栓形成及红细胞碎片(PASM-Masson,×400);C:小叶间动脉内膜增厚、管腔接近闭锁,呈“洋葱皮”样改变(PAS,×400);D:肾小球毛细血管袢基膜内皮下区域疏松、增宽,基膜略显扭曲,袢腔内见血小板(EM)
其他 传染病四项阴性。红细胞碎片1%~2%。溶血试验:直接抗人球蛋白试验、血清酸化溶血试验、间接抗人球蛋白试验均阴性,血清结合珠蛋白测定283.0 ng/L、游离血红蛋白测定116.0 mg/L。循环内皮细胞9个/ml(<20),血管内皮细胞粘附分子VACM 2495.6 ng/ml(300~1 000 ng/ml),血栓调节蛋白9.72 ng/ml(3.15~5.8 ng/ml),血清选择素194.55 ng/ml(35~65 ng/ml)。骨髓穿刺细胞学示大致正常骨髓像。
影像学检查 双肾B超:左104 mm×46 mm×52 mm、右96 mm×40 mm×48 mm,肾皮质厚度不清,皮质回声稍增强,左肾下极见一大小约10 mm×11 mm的类圆形无回声区。大便常规+隐血阴性。心脏超声示:(1)左室舒张功能减低;(2)左室壁增厚;(3)少~中等量积液。
皮肤活检 “右手背”皮肤:鳞状上皮轻度增生,伴表皮角化过度,真皮浅层小血管周围少量炎细胞浸润,伴纤维组织增生、胶原化。
肾活检
光镜 皮质、皮髓质肾组织各1条。43个肾小球中9个球性废弃。余正切肾小球体积增大,节段系膜区轻度增宽,系膜细胞和系膜基质略增多,毛细血管袢皱缩、开放欠佳,2个球见系膜溶解、袢腔内见“血栓”及大量红细胞碎片并堵塞袢腔(图1A),节段袢内皮细胞增生,一处球门部袢腔内见纤维素样物质,囊壁节段增厚、分层。PASM-Masson:肾小球未见明确嗜复红物沉积,节段外周袢分层。肾小管间质重度慢性病变,数处灶性肾小管萎缩、基膜增厚,未萎缩肾小管肥大,亦见轻度急性病变,小灶性肾小管上皮细胞刷状缘脱落。管腔内见蛋白管型。间质纤维化+++,较多炎细胞灶性分布,以单个核细胞为主,少量浆细胞、偶见嗜酸性粒细胞。小叶间动脉内膜增厚,内膜水肿、见数处“葱皮”样改变,管腔内见内皮细胞增生、肿胀、血栓形成、红细胞碎片、炎细胞及核碎裂(图1B、C),管腔变窄,个别闭锁,可见球旁器肥大及球旁细胞内嗜银颗粒。
免疫荧光 肾小球14个,其中5个硬化球。冰冻切片荧光染色仅3个球IgA trace,节段分布,呈颗粒状沉积于系膜区。IgG、IgM、C3、C1q阴性。冰冻切片荧光染色κ轻链、λ轻链均阴性。
电镜 观察3个肾小球。肾小球节段系膜区增宽,系膜细胞增生,基质增多,系膜区未见电子致密物分布。肾小球部分毛细血管袢基膜皱缩,节段袢腔内皮细胞增生成对、肿胀,内皮窗结构消失,个别袢腔内见聚集的血小板,较多袢内皮下疏松、增宽(图1D),数处见细胞及基质成分插入,基膜厚约390~560nm。肾小球毛细血管袢基膜内皮下、上皮侧均未见电子致密物分布。肾小球足细胞足突节段融合(30%~40%)。
小结:血栓性微血管病(TMA)。
讨 论
中年男性患者,起病急,肾脏方面表现为恶性高血压伴快速进展性肾功能损害,尿检仅中等量蛋白尿及镜下血尿。实验室检查示正细胞正色素性溶血性贫血,网织红细胞比例升高,血小板下降,直接和间接coomb’s试验阴性,血LDH升高,临床符合TMA。同时该患者尚存在特殊之处,也是临床鉴别诊断的重要提示,包括:(1)皮肤损害:面部、双手、前臂皮肤僵硬、弹性差;(2)免疫学检查示ANA、抗Ro-52抗体阳性,补体C3水平轻度下降。
与临床表现一致,该患者肾脏病理表现为典型的TMA,同时累及肾小球和间质血管,并以间质血管病变更明显,揭示了其临床表现的病理基础。光镜下肾小球表现为部分球外周袢分层,系膜溶解,袢腔内见红细胞大量聚集,并见血栓形成,部分球则表现为毛细血管袢缺血皱缩、开放欠佳;间质动脉表现为内膜水肿、“洋葱皮”样改变,内皮细胞增生、肿胀,管腔见血栓形成、红细胞碎片并伴炎细胞浸润及核碎裂,病变以急性为主,伴慢性化改变,而肾小管间质慢性病变则较明显,提示患者的病理病变已开始趋近于慢性化。免疫荧光仅个别球见微量IgA沉积,电镜下肾小球毛细血管袢内皮细胞肿胀、内皮下区域疏松、增宽,并见系膜插入。综上,该患者临床和病理表现均符合TMA特征。TMA病因多样且复杂,难以仅通过组织学改变来明确病因,必须结合临床。
从临床角度看,TMA的病因分为遗传性和获得性,遗传性病因包括ADAMTS13缺乏、补体相关基因以及其他基因缺陷;获得性病因包括典型/非典型溶血尿毒综合征、特发性血小板减少性紫癜(TTP,存在针对ADAMTS13的抗体)、药物(如奎宁、抗血管内皮细胞生长因子抗体)、补体调节蛋白活性异常(体内产生各种补体调节蛋白相关抗体)、恶性高血压、子痫前期/子痫、HELLP综合征等产科疾病、系统性红斑狼疮(SLE)、抗磷脂综合征、系统性硬化症(硬皮病)等自身免疫性疾病、感染、肿瘤、造血干细胞移植、移植肾排斥反应等。该患者临床无家族遗传病和相关药物服用史,无SLE特异性抗体和抗磷脂抗体阳性,无腹泻、感染、肿瘤及造血干细胞移植、肾移植等特殊情况,因此主要需鉴别非典型溶血尿毒综合征(aHUS)、TTP、恶性高血压、硬皮病肾危象等几种情况。该患者临床表现皮肤僵硬,累及面部、双手、前臂,皮肤活检提示真皮浅层纤维组织增生、胶原化,根据2013年诊断标准符合硬皮病[1]。同时结合突然出现的恶性高血压、迅速进展的肾功能不全,以及肾脏病理表现,高度考虑为硬皮病肾危象。对于其他病因亦存在相应鉴别方法,ADAMTS13缺乏(<5%)被认为是TTP比较特异的检测手段,一些aHUS则认为与补体系统调节异常相关,但由于目前临床检测的局限性并未能获取相应结果,该患者在硬皮病的基础上同时合并这些临床情况的可能性较小,因此仍首先考虑硬皮病肾危象。
系统性硬化症(硬皮病)是一种全身性结缔组织病,其发病机制尚未完全明确,可累及皮肤、消化道、肾脏以及肺,其中皮肤病变表现为增厚和纤维化。根据皮肤受累程度、自身抗体不同以及内脏器官受累的模式分为局限性或弥漫性硬皮病。其中约5%~10%的患者会出现硬皮病肾危象,多数出现在硬皮病发病的一年之内。一项纳入110例硬皮病患者的研究中,发生硬皮病肾危象的中位时间为发病后的第7.5个月[2]。发生硬皮病肾危象的危险因素包括使用糖皮质激素、皮肤弥漫受累、抗RNA聚合酶Ⅲ抗体阳性等[2-5]。与局限性硬皮病相比,弥漫性硬皮病患者消化道受累尤其大小肠运动功能异常更常见、间质性肺部和肺动脉高压、硬皮病肾危象发生率更高。两者均可出现ANA阳性,局限性多为抗着丝点抗体阳性,弥漫性多为抗SCL-70抗体、抗RNA聚合酶抗体阳性。约24%硬皮病患者临床出现补体下降,这些患者抗RNP抗体、抗Ro抗体、抗Smith抗体阳性发生率高,更容易与其他结缔组织病重叠出现[6]。该例患者临床累及皮肤、肾脏,尚无其他系统症状出现,皮肤受累主要分布于面部和肢体远端,属于局限性硬皮病,实验室检查示ANA、抗Ro-52抗体阳性、补体下降,未见硬皮病特异性抗体阳性。
硬皮病肾危象肾脏的主要病变与其他脏器一样,即由于血管内皮细胞损伤进而导致动脉内膜增厚,肾组织最常受累的是小叶间动脉和弓状动脉。肾脏组织学表现可能随着病情阶段不同而有所差异。早期表现为内膜黏液样增厚、血栓形成,伴或不伴纤维素样坏死,随后可出现“洋葱皮”样改变,慢性期可仅仅表现动脉内膜纤维性增厚或急性损伤后的机化,部分病例可出现血管外膜纤维化,并被认为是硬皮病和硬皮病肾危象特征性的病理改变[7]。肾小球病变包括其本身内皮细胞病变和间质血管病变导致两种,其中后者更常见。在急性期,内皮细胞病变所致病理改变表现为内皮细胞肿胀、毛细血管袢内血栓。间质血管病变使得血管管腔狭窄、血流下降,随之肾小球毛细血管袢皱缩呈缺血性改变。在慢性期,肾小球表现为基底膜“双轨”和(或)硬化性病变[8]。由于肾间质血管病变导致流经球旁器的血流灌注下降,部分病例出现球旁器肥大以及球旁细胞分泌大量肾素分泌颗粒[9]。肾小管间质病变主要继发于血管病变,急性期主要表现为缺血性肾小管急性损伤/坏死,慢性期表现为肾小管萎缩、间质纤维化,可伴间质炎症。免疫荧光通常无阳性发现,部分病例可伴免疫球蛋白和补体的沉积。电镜下可见肾小球内皮细胞肿胀,毛细血管袢基膜内皮下区域疏松、增宽。需注意的是,硬皮病肾危象是肾脏受累的急性表现,而在硬皮病未发生肾危象的情况下也可观察到血管病变,主要表现为动脉内膜增厚,提示肾脏血管存在持续慢性损伤[10]。
尽管不同病因导致的TMA通过病理难以区分,但是肾脏病理仍存在细微差别。硬皮病肾危象和恶性高血压患者肾脏病理以间质血管病变更突出,肾小球病变尤其是肾小球内血栓相对少见,Batal等[11]研究发现硬皮病肾危象患者血管血栓的发生率远高于肾小球血栓的发生率,而HUS/TTP则刚好相反,以肾小球病变为主[12]。另外球旁器肥大和血管外膜纤维化也是硬皮病肾危象有别于其他病因相关TMA的病理特征。该例患者肾脏病理表现以血管病变更明显,球旁细胞内见肾素颗粒分泌,更支持为硬皮病肾危象。
硬皮病肾危象目前主要使用ACEI类药物治疗。这类患者外周血中肾素显著升高,肾素-血管紧张素-醛固酮系统明显活化导致高血压。这些肾素主要来源于肾脏,患者在行肾切除后或应用ACEI治疗后高血压可得到有效控制[13]。硬皮病肾危象的总体预后很差,该例患者给予ACEI联合其他药物治疗,但肾功能仍无恢复,1月后转为维持性血液性透析。
小结:TMA是一组由多种病因导致的微血管病变的总称,其病因诊断必须依赖于临床和实验室检查结果的综合考量。该例患者临床诊断硬皮病明确,最终确诊为硬皮病肾危象。
1 van den Hoogen F,Khanna D,Fransen J,et al.2013 classification criteria for systemic sclerosis: an American College of Rheumatology/European League against Rheumatism collaborative initiative.Arthritis Rheum,2013,65(11):2737-2747.
2 Penn H,Howie AJ,Kingdon EJ,et al.Scleroderma renal crisis: patient characteristics and long-term outcomes.QJM,2007,100(8):485-494.
3 Teixeira L,Mouthon L,Mahr A,et al.Mortality and risk factors of scleroderma renal crisis: a French retrospective study of 50 patients.Ann Rheum Dis,2008,67(1):110-116.
4 Kohno K,Katayama T,Majima K,et al.A case of normotensive scleroderma renal crisis after high-dose methylprednisolone treatment.Clin Nephrol,2000,53(6):479-482.
5 Steen VD.Autoantibodies in systemic sclerosis.Semin Arthritis Rheum,2005,35(1):35-42.
6 Esposito J,Brown Z,Stevens W,et al.The association of low complement with disease activity in systemic sclerosis: a prospective cohort study.Arthritis Res Ther,2016,18(1):246.
7 Steen VD.Renal involvement in systemic sclerosis.Clin Dermatol,1994,12(2):253-258.
8 Batal I,Domsic RT,Medsger TA,et al.Scleroderma renal crisis: a pathology perspective.Int J Rheumatol,2010,2010:543704.
9 Stone RA,Tisher CC,Hawkins HK,et al.Juxtaglomerular hyperplasia and hyperreninemia in progressive systemic sclerosis complicated acute renal failure.Am J Med,1974,56(1):119-123.
10 Trostle DC,Bedetti CD,Steen VD,et al.Renal vascular histology and morphometry in systemic sclerosis.A case-control autopsy study.Arthritis Rheum,1988,31(3):393-400.
11 Batal I,Domsic RT,Shafer A,et al.Renal biopsy findings predicting outcome in scleroderma renal crisis.Hum Pathol,2009,40(3):332-340.
12 Tostivint I,Mougenot B,Flahault A,et al.Adult haemolytic and uraemic syndrome: causes and prognostic factors in the last decade.Nephrol Dial Transplant,2002,17(7):1228-1234.
13 Cannon PJ,Hassar M,Case DB,et al.The relationship of hypertension and renal failure in scleroderma (progressive systemic sclerosis) to structural and functional abnormalities of the renal cortical circulation.Medicine (Baltimore),1974,53(1):1-46.
Sclerodermakidneycrisis
LIANGDandan,ZENGCaihong
NationalClinicalResearchCenterofKidneyDiseases,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210016,China
A 49-year-old man presented with leg edema, malignant hypertension and skin thicking restricted to distal upper limbs and face. Urinalysis revealed proteinuria and microscopic hematuria. Blood tests demonstrated elevated serum creatinine, microangiopathic hemolytic anemia, thrombocytopenia, positive antinuclear antibody and hypocomplementaemia. Renal biopsy showed a typical histologic picture of thrombotic microangiopathy. Finally, the patient was diagnosed as scleroderma renal crisis.
systemic sclerosis sclerodema renal biopsy
2017-09-04
(本文编辑 律 舟)
10.3969/j.issn.1006-298X.2017.05.021
南京总医院 国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
