广东地区猪戊型肝炎流行病学调查
2017-11-01佟铁铸李春萍罗卓军朱事康
佟铁铸,刘 星,李春萍,周 宇,丁 宁,罗卓军,朱事康
(1.惠州出入境检验检疫局,惠州 516006;2.河源出入境检验检疫局,河源 517000)
广东地区猪戊型肝炎流行病学调查
佟铁铸1,刘 星1,李春萍1,周 宇1,丁 宁2,罗卓军1,朱事康1
(1.惠州出入境检验检疫局,惠州 516006;2.河源出入境检验检疫局,河源 517000)
为了调查广东地区猪戊型肝炎感染和流行情况,本研究对2014~2016年广东地区猪场抽取的血样进行抗体检测,以及对猪肝和粪便样品进行病毒核酸检测,PCR结果阳性的样品进行序列分析,确定所感染戊型肝炎病毒的基因型。结果显示,戊型肝炎病毒抗体平均阳性率为69.2%,PCR阳性率为46.7%,对PCR结果阳性的30株样品基因序列分析显示,29株为基因型Ⅳ型,1株为基因型Ⅲ型。
猪戊型肝炎病毒;流行病学调查
Abstract:The present study was conducted to investigate the infection situation and prevalence of hepatitis E (HE) in swine herds in Guangdong province. Antibodies of hepatitis E virus from serum samples collected from 2014 to 2016 were tested in ELISA.Furthermore, hepatitis E virus was examined by nucleic acid ampli fi cation from swine liver and fecal samples in order to understand the genetic characteristics and evolution. Total 30 PCR positive samples were sequenced and analyzed for their genotypes. The results showed that the average positive rate of hepatitis E virus antibody was 69.2% and positive rate of PCR was 46.7%. The genotyping analysis showed that 29 strains belonged to genotype IV and one strain to type III.
Key words:Swine hepatitis E virus; epidemiology
戊型肝炎(hepatitis E,HE)是由戊型肝炎病毒(Hepatitis E virus,HEV)引发的一种急性病毒性肝炎,主要通过消化道感染传播[1-3]。HE是一种人畜共患传染病,猪作为主要的动物宿主,成为HEV的巨大病毒储存库,为HE的感染、传播,以及变异进化提供了充分的遗传信息资源[1,3]。HE无论对养殖业还是人类的健康与生命安全都造成极大的威胁。目前,HE已被世界卫生组织(world healthorganization,WHO)认定是发展中国家的一个重要公共卫生问题。HEV只有一种血清型,但是基因型有几种,目前认为其主要有4个基因型(基因1~4型)[4,5],其中基因3型和基因4型可以同时感染人和猪,具有人畜共患的特性。而且基因4型HEV对人的致病性较其他基因型更强,危害也更大[6-9]。本研究对广东地区2014~2016年猪场采取的血样、粪便、猪肝样品,进行了猪戊型肝炎流行病学调查及其猪戊型肝炎病毒(Swine hepatitis E virus,swHEV)基因型分析。
1 材料与方法
1.1 样品来源2014~2016年采自广东省各地区的10个猪场的1127份血清样品、300份猪粪便及猪肝样品,编号后冷冻送回实验室保存备用。用PBS将300份猪粪便、猪肝样品制备成10%的悬浮液,于4℃、5000×g离心15 min,收集上清液,于-70℃保存备用。
1.2 主要试剂戊型肝炎病毒抗体(HEV-Ab)酶联免疫诊断试剂盒(双抗原夹心法)为北京万泰生物药业股份有限公司产品;Trizol LS Reagent为Invetrogent公司产品;AMV逆转录酶,dNTPs,TaKaRa Ex Taq® DNA聚合酶,DNA Marker DL2000等均为宝生物工程(大连)有限公司产品。
1.3 戊型肝炎病毒血清抗体检测将血清样品对应微孔按序编号,每板设阴性对照3孔、阳性对照2孔。用加液器每孔加入50 μL样品稀释液。分别在相应孔中加入待测样品或阴、阳性对照50 μL,轻轻振荡混匀。用封板膜封板后至37℃温育30 min。小心揭掉封板膜,甩干孔内液体,用洗涤液充分洗涤5遍,最后一次尽量扣干。分别在相应孔中加入酶标试剂100 μL重复洗板4~6次,最后1次尽量扣干。每孔加入显色剂A、B液各50 μL,轻轻振荡混匀,用封板膜封板后置37℃避光显色15 min。每孔加终止液50 μL,轻轻振荡混匀,设定酶标仪波长450 nm处(建议用双波长450/630 nm检测),测定各孔OD值。结果判定:临界值(cut off)=阴性对照孔OD均值Nc+0.16;样品OD值≥临界值(cut off)者为HEV抗体阳性;样品OD值<临界值(cut off)者为HEV抗体阴性。
1.4 引物设计与合成从GenBank中选取基因3、4型HEV全基因序列12个(见表1),利用Clustal X软件进行序列分析比对后,于ORF2近5'端的共同保守区6056 nt~6393 nt片段设计一套兼并引物,并由上海英潍捷基生物技术有限公司合成,其理论扩增片段大小为240 bp。EXF∶ 5'- AAY TCT TAC ACT AAT ACA CCT TA -3';EXR:5'- GAG TAG AAC AGC TGA CC-3';INF∶ 5'- CTT GAT TTT GCG CTA GAG CT -3';INR:5'- CCA GCC GAC GAA ATR AAT TC -3';其中,R=A/G;Y=C/T。

表1 用于引物设计的HEV参考毒株Table 1 HEV reference strains used for primer design
1.5 RT-nPCR和序列测定按Invitrogen公司的Trizol说明书操作提取总RNA,AMV反转录酶42℃反转录40 min,制备cDNA。首先使用EXF/EXR进行第一轮PCR扩增,反应体系:EXF/EXR各1 μL,反转录模板2 μL,TaKaRa EX Taq®聚合酶0.5 μL,dNTPs 2μL,灭菌ddH2O补充总体积至20 μL;反应条件:94℃预变性5 min;94℃变性30 s,53℃复性30 s,72℃延伸40 s,35个循环;72℃延伸5 min。使用INF/INR进行第二轮PCR扩增,反应体系:INF/INR各1 μL,第一轮PCR产物2 μL,TaKaRa EX Taq®聚合酶0.5 μL,dNTPs 2 μL,灭菌ddH2O补充至20 μL;反应条件:94℃预变性5 min;94℃变性30 s,53℃复性30 s,72℃延伸40 s,35个循环;72℃延伸5 min。PCR阳性产物回收纯化送往上海生物工程技术有限公司进行测序。
1.6 基因分型将30个PCR阳性产物测序,序列结果提交至NCBI BLAST server进行。从GenBank中选择戊型肝炎病毒4个基因型中具有代表性的毒株(毒株的序列号省略)的相应核苷酸序列,应用软件MEGA5.0进行核苷酸序列同源性分析和遗传进化树分析,根据比对结果进行基因分型。
2 结果
2.1 引物的同源性和特异性分析引物EXF 5'端第9、12碱基是基因3型和基因4型的主要变异位点,引物EXR 5'端6、9碱基也是高变位点。引物INF、INR在基因Ⅲ、Ⅳ型序列中保守,能够与12条基因Ⅲ、Ⅳ序列很好配对。因此,该兼并引物可以适用于检测基因Ⅲ、Ⅳ型HEV。同时,为了检验引物的特异性,将此4条引物于GenBank 数据库中进行BLAST分析,未发现能配对非HEV序列,表明此引物具有较好的特异性。
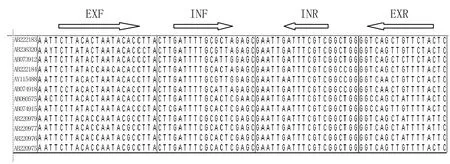
图1 引物与12条HEV全基因序列的同源比较Fig. 1 The homologous comparison of the primer sequences with twelve HEV strains genome sequences
2.2 血清学调查结果对2014~2016年来自广东省各地区的10个猪场的1127份血清样品进行ELISA检测。经分析发现,10个被检测的猪场均存在不同程度的swHEV感染,猪场的swHEV抗体阳性率为100%。2014年各场被检猪群的swHEV抗体阳性率为53.7%~81.8%,平均阳性率为67.4%(262/389);2015年各场被检猪群的swHEV抗体阳性率为63.6%~72.9%,平均阳性率为69.0%(252/365);2016年各场被检猪群的swHEV抗体阳性率为68.4%~80.0%,平均阳性率为71%(265/373)。全部被检查猪的swHEV抗体平均阳性率为69.2%(780/1127)。上述数据表明swHEV在广东地区普遍流行。
2.3 样品的套式PCR检测结果将300份猪粪便、猪肝样品进行套式PCR检测,PCR产物进行琼脂糖凝胶电泳,阳性的样品能扩增出240 bp的特异性条带,如图2。共检测出140份阳性样品,阳性率为46.7%(140/300)。
2.4 HEV ORF2 部分核苷酸序列的同源性和系统进化树分析将测序结果分别与GenBank 中4个基因型HEV毒株的相应核苷酸序列进行相似性比较(BLAST结果略),29株swHEV之间的相似性为85.3%~100%,属于同一基因型,并且与GenBank中基因Ⅳ型的核苷酸序列相似性最高,达82.5%~99.1%。但毒株YF32与其他29株之间相似性只有72.1%~76.3%,而与GenBank中基因Ⅲ型的核苷酸序列相似性很高,达到85.1%~90.2%。将30株swHEV与GenBank中参考序列构建遗传进化树(图3),结果表明29株swHEV为基因Ⅳ型,另外1株YF32为基因Ⅲ型。其中29株swHEV与猪源毒株SWJ13-1亲缘关系较近,均为基因Ⅳ型。而YF32与猪源毒株swKOR-2以及人源毒株JYU-Oki04L、TKKag06C亲缘关系较近,属于基因Ⅲ型。
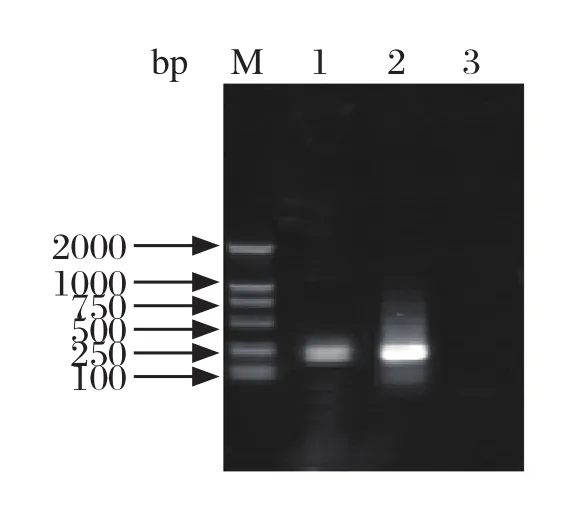
图2 样品的套式PCR检测Fig.2 Detection of clinical samples using RT-nested PCR assay

表2 血清样品HEV抗体检测Table 2 Detection of HEV antibody in serum
3 讨论
HEV感染在国内外的猪群中普遍存在,尤其是在发展中国家感染率非常高,发达国家也有散发疫情报道[10-12]。我国猪场也是戊型肝炎病毒感染的重灾区,猪群普遍存在感染和带毒现象[1,13,14]。猪是HEV的最主要动物宿主和人类戊型肝炎的主要传染源,同时又是HEV的巨大病毒储存库,协同促进HE的感染、传播,以及为HEV的变异进化提供了充分的遗传信息资源。HE无论对养殖业还是人类的健康与生命安全都造成极大的威胁。目前,HE已被世界卫生组织(WHO)认定是发展中国家的一个重要公共卫生问题。因此,了解广东省猪HEV感染情况具有重要的公共卫生学意义。本研究主要针对广东省不同地区的10个猪场2014~2016年间的HEV抗体阳性率及抗体水平变化的跟踪监测,以求初步了解广东省内猪戊型肝炎的流行现状。从血清流行病学统计结果看,1127份血清样品进行ELISA检测发现,10个被检测的猪场均存在swHEV感染,感染率100%。全部被检查猪的swHEV抗体平均阳性率为69.2%(780/1127)。数据显示各猪场HEV抗体平均水平逐年升高,2014年为67.4%,2015年为69.0%,2016年为71.0%,说明广东省猪HEV感染可能有上升的趋势。从分子流行病学统计结果看,共检测出140份阳性样品,阳性率为46.7%(140/300),低于血清学调查结果,可能与戊型肝炎的感染和排毒周期有关。上述数据表明swHEV在广东地区普遍流行。为了进一步了解广东地区swHEV的流行毒株情况,本研究对30份阳性的PCR样品进行swHEV ORF2基因部分序列测定,并进行了相似性分析和基于ORF2部分核苷酸序列的遗传进化树分析。结果表明30株swHEV中29株为基因Ⅳ型,1株为基因Ⅲ型。证实广东地区猪场感染的swHEV以基因Ⅳ型为主导,但检测到1株基因Ⅲ型,说明猪场感染戊型肝炎情况日趋复杂。

图3 HEV ORF2部分核苷酸序列的遗传进化树分析Fig. 3 Phylogenetic tree analysis of HEV ORF2 partial nucleotide sequences
综上所述,作为人畜共患病的猪戊型肝炎,在广东地区的猪场中已经普遍存在,而且除了以往流行的基因Ⅳ型以外还发现了基因Ⅲ型感染的情况,需要引起相关部门的足够重视。尽管目前为止广东地区还没有人感染猪戊型肝炎病毒的报道,但是不应对此掉以轻心,应该加强对猪群感染HEV情况进行持续监测,以便为HE的预防提供依据。
[1] 葛胜祥, 田克恭, 多海刚, 等. 中国不同地区商品猪中戊型肝炎病毒感染情况调查[J]. 中国人兽共患病杂志,2003(2)∶ 108-109.
[2] 李峰, 孟继鸿, 董晨. 戊型肝炎病毒通用性PCR引物的设计及其基因分型的研究[J]. 病毒学报, 2009, 25 (1)∶9-15.
[3] 蓝海云, 王佑春, 张华远.上海部分地区无形肝炎病毒(HEV)基因型的分析[J].中国病毒学, 2002, 17 (2)∶ 106-109.
[4] 夏宁邵, 张军, 李少伟, 等. 戊型病毒性肝炎研究进展[J].厦门大学学报, 2011, 50(2)∶ 431-436.
[5] Renou C, Cadeanel J F, Bourliere M,et al. Possible zoonotic transmission of hepatitis E from pet pig to its owner[J]. Emerg Infect Dis, 2007, 13 (7)∶ 1094-1096.
[6] Ohnishi S, Kang J H, Maekubo H,et al. Comparison of clinical features of acute hepatitis caused by hepatitis E virus (HEV) genotypes 3 and 4 in Sapporo, Japan[J].Hepatol Res, 2006, 36 (4)∶ 301-307.
[7] Balayan M S, Andjaparidze A G, Savinskaya S S,et al. Evidence for a virus in non-A, non-B hepatitis transmitted via the fecal-oral route[J]. Intervirology,1983, 20(1)∶ 23-31.
[8] Meng X J, Halbur P G. Swine hepatitis E virus[C]. Straw B E,et al(eds). Diseases of Swine, 9th Edition Blackwell Publishing Press, 2006∶ 537-545.
[9] Wang Y, Ling R, Erker J C,et al. A divergent genotype of hepatitis E virus in Chinese patients with acute hepatitis[J]. J Gen Virol, 1999, 80 (1)∶ 169-177.
[10] Huang F F, Haqshenas G, Guenette D K,et al. Detection by reverse transcription-PCR and genetic characterization of field isolates of swine hepatitis E virus from pigs in different geographic regions of the United States[J]. J Clinic Microbiol, 2002, 40(4)∶ 1326-1332.
[11] Cooper K, Huang F F, Batista L,et al. Identification of genotype 3 hepatitis E virus(HEV)in serum and fecal samples from pigs in Thailand and Mexico,where genotype 1 and 2 HEV strains are prevalent in the respective human populations[J]. J Clinic Microbiol,2005, 43(4)∶ 1684-1688.
[12] Takahashi M, Nishizawa T, Tanaka T,et al. Correlation between positivity forimmunoglobulin A antibodies and viraemia of swine hepatitis E virus observed among farm pigs in Japan[J]. J Gen Virol, 2005, 86∶ 1807-1813.
[13] Pavio N, Meng X J, Renou C. Zoonotic hepatitis E∶animal reservoirs and emerging risks[J]. Vet Res, 2010,41(6)∶ 46.
[14] Li W, She R, Wei H,et al. Prevalence of hepatitis E virus in swine under different breeding environment and abattoir in Beijing, China[J]. Vet Microbiol, 2009, 133(1-2)∶ 75-83.
EPIDEMIOLOGICAL INVESTIGATION OF SWINE HEPATITIS IN GUANGDONG
TONG Tie-zhu1, LIU Xing1, LI Chun-ping1, ZHOU Yu1, DING Ning2, LUO Zhuo-jun1, ZHU Shi-kang1
(1.Huizhou Entry-Exit Inspection and Quarantine Bureau of P. R.C, Huizhou 516006, China; 2. Heyuan Entry-Exit Inspection and Quarantine Bureau of P. R.C, Heyuan 517000, China)
S852.659.6
A
1674-6422(2017)04-0013-06
2016-12-19
国家质量监督检验检疫总局科技计划项目(2015IK056)
佟铁铸,男,硕士研究生,预防兽医专业
朱事康,E-mail:13829915152@163.com
