蟾酥活性成分协调索拉非尼通过下调Akt/NF-κB信号途径抑制肝癌HepG2细胞生长
2017-11-01王志美徐忠伟王佳宝代二庆徐瑞成
王志美,徐忠伟,王佳宝,代二庆,徐瑞成,4
(1. 锦州医科大学中国人民武装警察部队后勤学院附属医院研究生培养基地,天津 300162;2. 中国人民武装警察部队后勤学院中心实验室,天津 300162;3. 中国人民武装警察部队后勤学院附属医院军人医疗保健中心,天津 300162;4. 天津市职业与环境危害生物标志物重点实验室,天津 300309)
蟾酥活性成分协调索拉非尼通过下调Akt/NF-κB信号途径抑制肝癌HepG2细胞生长
王志美1,徐忠伟2,王佳宝1,代二庆3,徐瑞成2,4
(1. 锦州医科大学中国人民武装警察部队后勤学院附属医院研究生培养基地,天津 300162;2. 中国人民武装警察部队后勤学院中心实验室,天津 300162;3. 中国人民武装警察部队后勤学院附属医院军人医疗保健中心,天津 300162;4. 天津市职业与环境危害生物标志物重点实验室,天津 300309)
目的探讨蟾酥活性成分蟾蜍灵和华蟾毒配基协调索拉非尼抑制肝癌HepG2细胞生长的机制。方法MTT法检测HepG2细胞经药物作用12、24、48 h后的增殖活性;Hoechst 33342荧光染色检测细胞形态学变化;流式细胞仪检测药物对HepG2细胞周期的影响;Western blot检测Akt、p-Akt(Ser473)、IκB、NF-κB、p-NF-κB p65、Bcl-2、Bax、cyclin A、PCNA蛋白表达水平。结果蟾蜍灵、华蟾毒配基和索拉非尼作用组均能抑制HepG2细胞增殖,且药物联合作用组的增殖抑制率明显高于单独药物作用组,呈时间依赖性,用金氏公式得出在24 h具有协同作用(P<0.01);荧光染色结果显示,HepG2细胞经药物处理24 h后,细胞呈现出核染色质凝集的凋亡形态特征;细胞周期检测结果显示,索拉非尼作用组使细胞周期阻滞于G0/G1期(P<0.01),蟾蜍灵、华蟾毒配基作用组使细胞周期阻滞于S期(P<0.01),药物联合作用组使细胞周期阻滞于S期(P<0.01);Western blot结果显示,蟾蜍灵、华蟾毒配基和索拉非尼单独药物作用组和联合作用组Akt、NF-κB总蛋白表达均无明显变化,p-Akt(Ser473)、p-NF-κB p65、Bcl-2、cyclin A、PCNA蛋白表达水平逐渐降低,联合作用组比单独药物作用组降低更为明显(P<0.01)。IκB、Bax蛋白表达水平逐渐升高,联合作用组比单独药物作用组升高更加明显(P<0.01)。结论蟾酥活性成分蟾蜍灵和华蟾毒配基协调索拉非尼通过下调Akt/NF-κB信号通路,抑制肝癌HepG2细胞增殖。
索拉非尼;蟾酥;蟾蜍灵;华蟾毒配基;HepG2;Akt;NF-κB
原发性肝癌(hepatocellular carcinoma, HCC)是常见的恶性肿瘤之一,起病隐匿,进展迅速,预后极差[1],大多数患者在确诊时已进展到HCC晚期。索拉非尼是一种多靶点、多激酶抑制剂,是临床治疗晚期肝癌的一线用药,有效延长HCC患者的生存时间。然而,HCC患者对索拉非尼可产生耐药性,同时伴随胃肠道疾病、手足皮肤病、心血管毒性等多种并发症。这些并发症可能一定程度上影响索拉非尼的治疗效果。因此,筛选临床中索拉非尼的效应增强剂或协同效应剂成为客观需求[2]。蟾蜍灵(bufalin)以及华蟾毒配基(cinobufagin)是蟾酥发挥抗癌作用的主要活性成分,属于外源性强心苷类物质,是天然的钠钾泵(Na+/K+-ATPase)抑制因子[3]。研究表明,蟾蜍灵和华蟾毒配基通过抑制Akt信号通路诱导乳腺癌、非小细胞肺癌细胞凋亡[4-5],通过抑制NF-κB途径诱导胰癌细胞周期阻滞和骨肉瘤细胞凋亡[6-7]。课题组前期研究发现,蟾蜍灵和华蟾毒配基作用HCC细胞可诱发细胞凋亡和细胞周期S期阻滞[8]。因此,本研究对蟾酥活性成分蟾蜍灵和华蟾毒配基联合索拉非尼在抗HCC的药理学作用机制中可能存在的协同和增效机制进行深入研究。
1 材料与方法
1.1材料人肝癌细胞株HepG2购自协和基础医学院细胞库;蟾蜍灵、华蟾毒配基购自美国Sigma公司,无水乙醇溶解成母液,实验终浓度为1 μmol·L-1,-20℃避光保存;H-DMEM 培养基和胎牛血清购自美国Gibco公司;四甲基偶氮唑盐(MTT)、碘化丙啶(PI)、Hoechst 33342、RNaseA、Triton X-100和二甲基亚砜(DMSO) 购自美国Sigma公司;一抗兔抗人Akt、p-Akt(Ser473)、IκB、NF-κB、p-NF-κB p65、Bcl-2、Bax、cyclin A、PCNA和GAPDH单克隆抗体购自美国Abcam公司;HRP标记的二抗和ECL化学发光试剂购自美国KPL公司。
1.2细胞培养及实验分组HepG2细胞按常规方法培养。H-DMEM完全培养基中含有10%胎牛血清、1%青-链霉素、1%谷氨酰胺、1%丙酮酸钠。实验分为对照组、0.1 μmol·L-1索拉非尼组、1 μmol·L-1蟾蜍灵组、1 μmol·L-1华蟾毒配基组、1 μmol·L-1蟾蜍灵联合0.1 μmol·L-1索拉非尼组、1 μmol·L-1华蟾毒配基联合0.1 μmol·L-1索拉非尼组。
1.3MTT检测细胞增殖活性取对数生长期HepG2细胞,以5 000个/孔的密度接种于96孔板,常规培养24 h后,按照预先设计的分组加入相应浓度的药物,分别作用12、24、48 h后,加入20 μL MTT孵育3 h后,水平离心,1 500×g离心5 min,弃上清,加入150 μL DMSO,放入温箱5 min,震荡混匀,酶标仪测定A490nm值。计算细胞生长抑制率。抑制率/% =(A对照-A实验)/(A对照- A空白)×100%。用金氏公式计算蟾酥活性成分联合索拉非尼是否有协同作用:q=E(A+B)/(EA+EB-EA·EB)。式中EA、EB分别为单独药物作用组的抑制率,E(A+B)为药物联合作用的抑制率,q>1.15为协同作用,0.85~1.15为相加作用,<0.85为拮抗作用。实验独立重复3次。
1.4荧光显微镜观察细胞形态实验分组同前,药物作用24 h后,离心,收集细胞,PBS洗4次,悬于200 μL PBS中,加入20 μL Hoechst 33342(终浓度为10 mg·L-1),在37℃孵育箱中染色15 min,1 000×g离心10 min,弃上清,加入适量PBS,吹打混匀,每组细胞取3张玻片,200倍视野,在荧光显微镜下观察细胞形态。实验独立重复3次。
1.5流式细胞术检测细胞周期常规培养细胞,待细胞融合至80%时加药,实验分组同前。24 h后胰酶消化收集细胞,PBS洗净胰酶后,细胞经预冷的75%乙醇固定过夜。上机前离心弃上清,PBS洗3次以充分洗净固定液,加入100 μL染色剂(RNaseA 100 mg·L-1、50 mg·L-1PI、0.2% Triton X-100),避光染色30 min后,加入400 μL预冷PBS,过300目尼龙网,流式细胞仪检测细胞周期变化。实验独立重复3次。
1.6Westernblot法检测蛋白表达常规培养细胞后加药,胰酶消化收集各组细胞,PBS洗3次,在冰上加入RIPA裂解混合液,超声细胞破碎仪破碎各组细胞,12 000×g离心10 min后留上清,BCA定量各组蛋白浓度。上样50 μg,进行半干转转膜,转移至 NC膜上。5%的脱脂奶粉常温封闭 1 h,一抗(1 ∶1 000稀释)Akt、p-Akt(Ser473)、IκB、NF-κB、p-NF-κB p65、Bcl-2、Bax、cyclin A、PCNA和GAPDH 4℃孵育过夜,TBST洗NC膜3次,每次15 min。二抗常温孵育1 h,TBST洗膜4次,每次10 min。将NC膜置于暗盒中,滴加ECL液化学发光(A液 ∶B液=1 ∶1),显影定影,用Scion Image软件进行灰度值分析。实验独立重复3次。
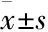
2 结果
2.1蟾酥活性成分与索拉非尼单独以及联合用药对HepG2细胞增殖抑制有协同作用肝癌HepG2细胞经蟾蜍灵、华蟾毒配基和索拉非尼单药处理及联合处理后,在不同时间均能出现细胞增殖抑制作用。与单独药物作用组相比,药物联合作用组对细胞的增殖抑制率明显增高(Tab 1、Fig 1)。1 μmol·L-1蟾蜍灵+0.1 μmol·L-1索拉非尼作用12、24、48 h时,q值分别为1.05、1.32、1.19。1 μmol·L-1华蟾毒配基+0.1 μmol·L-1索拉非尼作用12、24、48 h时,q值分别为 1.10、1.20、1.13,在药物作用24 h时均表现为协同作用(P<0.01)。
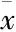
Tab 1 Effects of bufalin, cinobufagin, sorafenib and their combinations on proliferation of HepG2 cells (±s, n=3)
**P<0.01vscontrol group
2.2蟾酥活性成分与索拉非尼单独以及联合用药
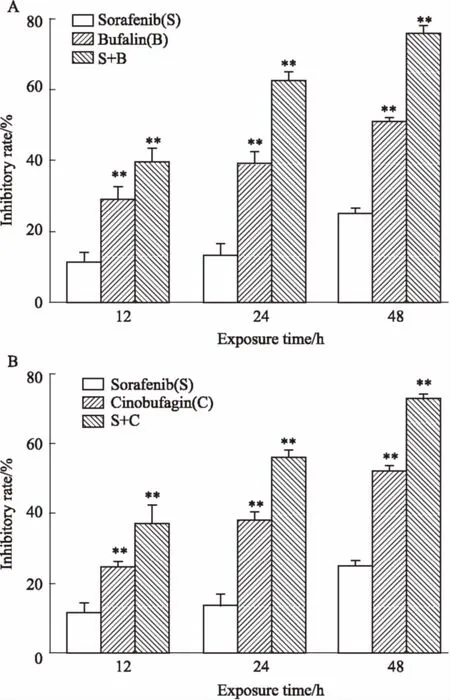
Fig 1 Effects of bufalin, cinobufagin, sorafenib andtheir combinations on proliferation of HepG2 cells (±s, n=3)
A: Effects of bufalin, sorafenib and their combination on proliferation of HepG2 cells; B: Effects of cinobufagin, sorafenib and their combination on proliferation of HepG2 cells.**P<0.01vssorafenib group
诱导HepG2细胞凋亡形态变化经荧光染色后(Fig 2),荧光显微镜下可见对照组HepG2细胞核较大,被Hoechst 33342染成均匀的蓝色荧光。蟾蜍灵、华蟾毒配基和索拉非尼作用组24 h后,可见蓝染、染色质凝集的凋亡细胞形态。药物联合作用组24 h后,蓝染、染色质凝集的凋亡细胞形态大量出现。
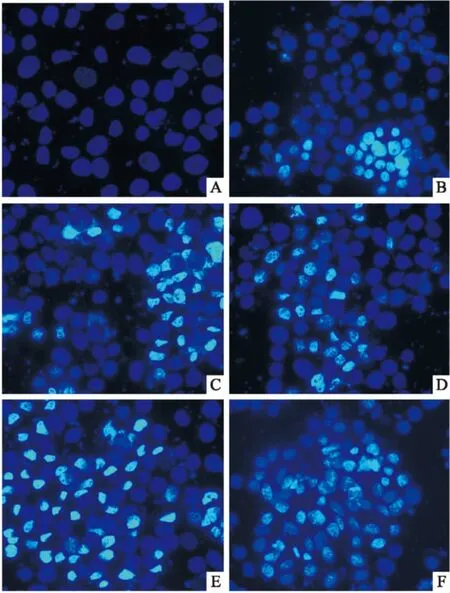
Fig 2 Effects of bufalin, cinobufagin, sorafenib and their combinations on cell morphology of HepG2 cells (× 200)
A: Control group; B: Sorafenib group; C: Bufalin group; D: Cinobufagin group; E: Bufalin combined with sorafenib; F: Cinobufagin combined with sorafenib
2.3蟾酥活性成分与索拉非尼单独以及联合用药对HepG2细胞周期的影响Fig 3流式结果显示,正常对照组细胞G0/G1、S、G2/M期比例分别为69.61%、20.85%、9.54%。索拉非尼作用24 h后,G1期细胞比例为72.88%,与对照组相比,差异有显著性(P<0.01),呈现G0/G1期周期阻滞。蟾蜍灵和华蟾毒配基作用24 h后,处于S期的细胞比例分别为38.17%、34.53%,与对照组的20.85%相比,差异有显著性(P<0.01),呈现S期周期阻滞。联合用药24 h后,索拉非尼联合蟾蜍灵以及索拉非尼联合华蟾毒配基处于S期的细胞分别上升至39.08%和38.23%,与对照组的20.85%相比,差异有显著性(P<0.01),呈现S期周期阻滞。
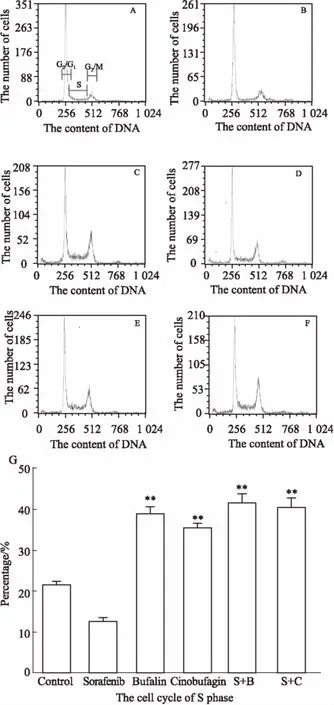
Fig 3 Effects of bufalin, cinobufagin, sorafenib and their combinations on cell cycle of HepG2 cells(±s, n=3)
A: Control group; B: Sorafenib group; C: Bufalin group; D: Cinobufagin group; E: Bufalin combined with sorafenib; F: Cinobufagin combined with sorafenib; G: Changes of HepG2 cells S phases in proportion of bufalin, cinobufagin, sorafenib and their combination treatment.**P<0.01vscontrol group.
2.4蟾酥活性成分与索拉非尼单独以及联合用药对HepG2细胞相关蛋白表达的影响
2.4.1蟾酥活性成分与索拉非尼单独以及联合用药对HepG2细胞周期相关蛋白表达的影响 如Fig 4A所示,1 μmol·L-1蟾蜍灵、1 μmol·L-1华蟾毒配基与0.1 μmol·L-1索拉非尼单独或联合作用HepG2细胞24 h后,cyclin A、PCNA蛋白表达量下调,药物联合作用组明显下调,与正常对照组相比,差异有显著性(P<0.01)。Cyclin A、PCNA蛋白表达量的降低,提示蟾酥活性成分与索拉非尼联合用药可能引起HepG2细胞S期细胞周期阻滞。
2.4.2蟾酥活性成分与索拉非尼单独以及联合用药对HepG2细胞凋亡相关蛋白表达的影响 如Fig 4B所示,1 μmol·L-1蟾蜍灵、1 μmol·L-1华蟾毒配基与0.1 μmol·L-1索拉非尼单独或联合作用HepG2细胞24 h后,Bcl-2蛋白表达量下调,药物联合作用组明显下调,与正常对照组相比,差异有显著性(P<0.01)。Bax蛋白表达量上调,药物联合作用组明显上调,与正常对照组相比,差异有显著性(P<0.01)。Bcl-2/Bax的比值下降,药物联合作用组下降明显,与正常对照组相比,差异有显著性(P<0.01)。Bcl-2/Bax的比值常作为细胞凋亡“分子开关”,其比值的下降使细胞对凋亡抑制作用减弱,细胞出现凋亡。
2.4.3蟾酥活性成分与索拉非尼单独以及联合用药对HepG2细胞信号通路相关蛋白表达的影响 如Fig 4C所示,1 μmol·L-1蟾蜍灵、1 μmol·L-1华蟾毒配基与0.1 μmol·L-1索拉非尼单独作用或联合作用HepG2细胞24 h后,Akt、NF-κB总蛋白表达均无明显变化;p-Akt(Ser473)、p-NF-κB p65蛋白表达量下调,药物联合作用组明显下调,与正常对照组相比,差异有显著性(P<0.01)。IκB蛋白表达量上调,药物联合作用组明显上调,与正常对照组相比,差异有显著性(P<0.01)。
3 讨论
HCC的致死率居世界第2位,其发生发展与信号通路的异常密切相关。Akt信号通路是细胞内重要信号转导通路之一。研究显示,Akt信号通路在人类肿瘤细胞中普遍失调,因此,该通路为肿瘤靶向治疗和预防转移提供新的思路。Akt抑制剂GSK2110183、MK-2206在肺癌、胰腺癌以及血液恶性肿瘤中表现出很好的治疗效果[9]。索拉非尼是一种多靶点的激酶抑制剂,经美国食品药物管理局(FDA)批准用于晚期HCC的标准治疗药物。目前已有研究发现,索拉非尼可以通过下调Akt信号途径,抑制人肝癌细胞株SMMC-7721的生长增殖[10],但发现索拉非尼单独作用于Akt信号通路,对信号途径中的关键酶Akt、mTOR等磷酸化抑制作用却有限[11]。同时,流行病学队列研究显示,索拉非尼仅仅能延长HCC患者生存3个月,并且具有多种不良反应。因此,筛选临床中索拉非尼的效应增强剂或协同效应剂成为客观需求[2]。已有研究表明,索拉非尼联合培美曲塞通过抑制Akt途径有效诱导非小细胞肺癌A549细胞凋亡[12];索拉非尼联合C2-神经酰胺通过抑制PI3K/Akt/mTOR和ERK信号通路,有效诱导肝癌细胞凋亡[13]。蟾酥及其相关制剂为我国传统的抗肿瘤药物,在我国广泛用于肝癌、结肠癌、乳腺癌、胃癌等恶性肿瘤的中晚期治疗,疗效明显。蟾酥注射液联合放化疗有效治疗中晚期肺癌、胃癌、胰腺癌等多种恶性肿瘤[6]。相关研究报道,蟾蜍灵和华蟾毒配基通过抑制Akt信号通路,下调Bcl-2/Bax的比值,诱导结肠癌HCT116细胞和非小细胞肺癌细胞凋亡[6]。
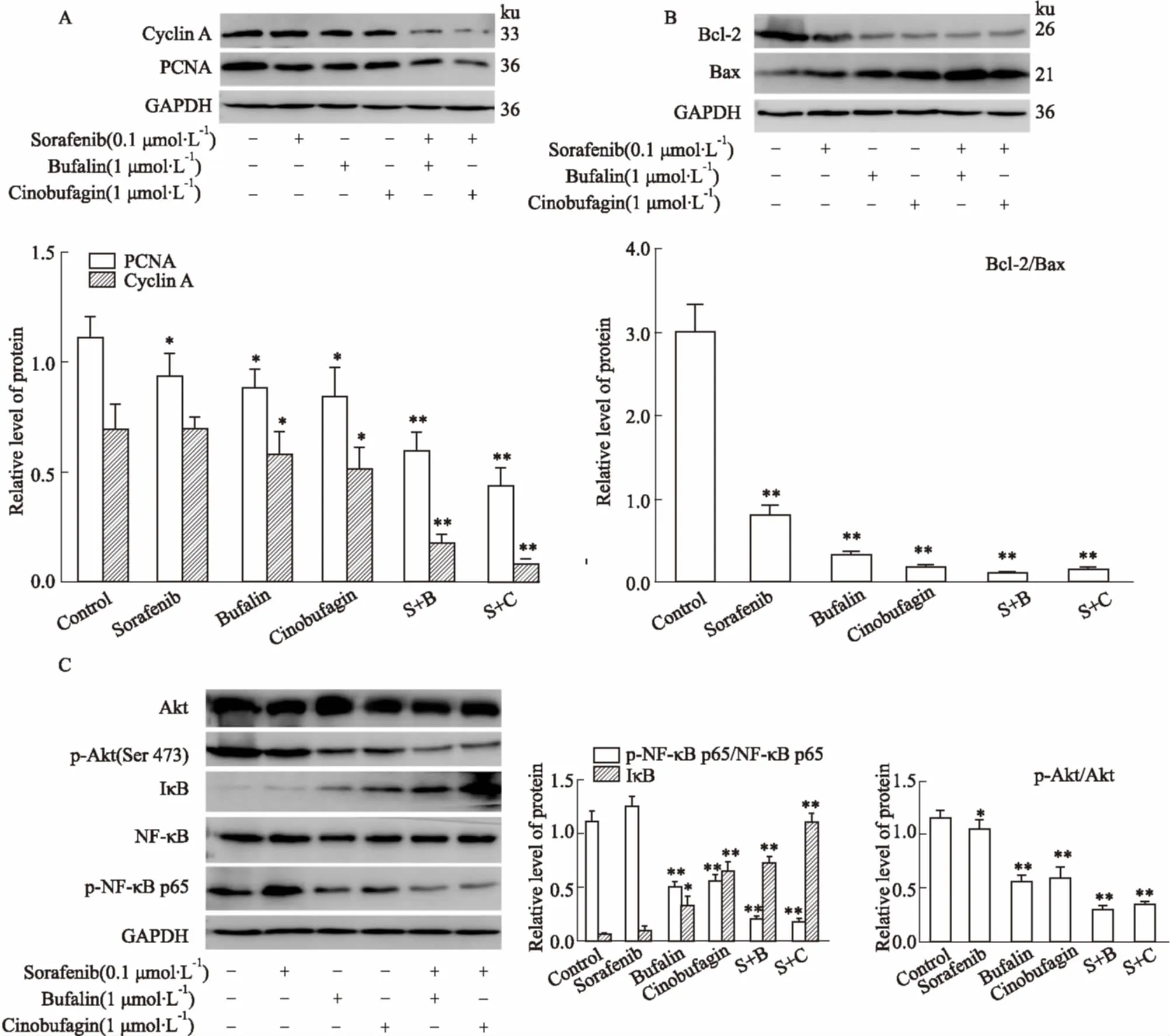
A: The protein levels of cyclin A and PCNA in HepG2 cells treated with bufalin, cinobufagin, sorafenib and their combinations; B: The protein levels of Bcl-2 and Bax in HepG2 cells treated with bufalin, cinobufagin, sorafenib and their combinations; C: The protein levels of Akt/NF-κB signal in HepG2 cells treated with bufalin, cinobufagin, sorafenib and their combinations.*P<0.05,**P<0.01vscontrol group
本研究将蟾蜍灵、华蟾毒配基分别与索拉非尼联合作用于肝癌HepG2细胞,结果显示,蟾蜍灵、华蟾毒配基和索拉非尼对肝癌HepG2细胞均有抑制增殖的作用,且呈时间依赖性。药物联合作用时抑制增殖作用更加明显,并在作用24 h后产生协同抑制效果。同时出现了染色质凝集等细胞凋亡形态,药物联合作用细胞凋亡形态更为明显。流式结果显示,索拉非尼将细胞阻滞在G1期,蟾蜍灵和华蟾毒配基单药以及与索拉非尼联合作用使细胞阻滞在S期。Cyclin A是正向细胞周期调控蛋白,在G1晚期出现合成,S期开始检测到激酶活性,促进DNA的复制合成。PCNA是真核细胞DNA合成所必须的一种核蛋白,是DNA聚合酶的辅助蛋白,直接参与DNA的复制[8], G1期后期开始出现,S期达到高峰,G2/M期明显下降。本研究中发现,药物联合后cyclin A、PCNA的蛋白表达下降更为明显,从而推断药物联合以后可能引起S期细胞周期阻滞,抑制肿瘤细胞的增殖。
Akt信号通路是细胞内重要信号转导通路之一,PI3K激活的Akt可以通过磷酸化作用激活或抑制其下游靶蛋白Bad、caspase-9、NF-κB等,是重要的抗凋亡调节因子[14]。NF-κB是介导细胞内信号传递最重要的核转录因子,在多数细胞中,NF-κB以同源二聚体或异源三聚体的形式与其抑制蛋白IκB直接结合,形成三聚体复合物,以无活性形式存在于多种类型细胞内。当细胞受到刺激时,有信号诱导激活IκB激酶(IKK),引起IκB的降解,使NF-κB快速入核,与DNA接触,从而调控下游基因的表达。通过诱导抗凋亡因子Bcl-2蛋白家族,启动凋亡抑制因子(X-chromosome linked inhibitor of apoptosis protein,XIAP),促进癌基因c-Myc的激活,进而对凋亡信息产生抗性,与肿瘤的发生发展息息相关。相关研究报道,NF-κB的持续活化可作为包括乳腺肿瘤、卵巢肿瘤、直肠癌、胰腺癌、前列腺癌、黑色素瘤等实体瘤和白血病的标志[15]。提示我们,阻断NF-κB的活化,抑制肿瘤细胞的增殖,诱导其凋亡为恶性肿瘤的治疗提供了新的思路。Bcl-2家族蛋白在线粒体内源性凋亡通路中起着重要作用,Bcl-2具有拮抗细胞凋亡作用,Bax具有促进细胞凋亡的作用,Bcl-2与Bax的比值对药物诱导的细胞凋亡起着决定性的作用[16]。本研究发现,药物作用肝癌HepG2细胞后,单独药物作用组与药物联合作用组Akt、NF-κB总蛋白表达水平没有明显变化,但是,p-Akt(Ser473)、p-NF-κB p65蛋白表达明显降低,且药物联合作用组降低程度更加明显;Bcl-2蛋白表达水平逐渐降低,药物联合作用组降低程度更加明显;IκB、Bax蛋白表达水平逐渐升高,药物联合作用组升高更为明显。结果显示,蟾蜍灵、华蟾毒配基联合索拉非尼抑制Akt信号通路,直接或间接抑制IKK活性,减少IκB蛋白的降解,从而抑制NF-κB通路,减少Bcl-2蛋白表达水平,促进Bax的表达,使Bcl-2/Bax的比值下降,从而抑制细胞增殖和诱导凋亡。
综上,蟾酥活性成分蟾蜍灵和华蟾毒配基协调索拉非尼通过下调Akt/NF-κB信号通路,抑制肝癌HepG2细胞增殖。
(致谢:本文实验在天津武警后勤学院中心实验室完成,衷心感谢课题组老师和同学的协助)。
[1] 夏丽洁, 张富春. 肝癌治疗新靶点GPC3研究进展[J]. 中国药理学通报, 2016,32(11):1486-9.
[1] Xia L J,Zhang F C. Advances in GPC3 research on new target of liver cancer [J].ChinPharmacolBull, 2016,32(11):1486-9.
[2] Zhu Y J, Zheng B, Wang H Y, Chen L. New knowledge of the mechanisms of sorafenib resistance in liver cancer[J].ActaPharmacolSin, 2017,38(5):614-22.
[3] Xu Z W, Wang F M, Fan F X, et al. Quantitative proteomics reveals that the inhibition of Na(+) /K(+)-ATPase activity affects S-phase progression leading to a chromosome segregation disorder by attenuating the Aurora A function in hepatocellular carcinoma cells[J].JProteomeRes, 2015,14(11): 4594-602.
[4] Zhen S, Hua L, Liu Y H, et al. Bufalin attenuates the proliferation of breast cancer MCF-7 cellsinvitroandinvivoby inhibiting the PI3K/Akt pathway[J].IntJClinExpMed, 2016,9(6): 10297-303.
[5] Zhang G, Wang C, Sun M, et al. Cinobufagin inhibits tumor growth by inducing intrinsic apoptosis through AKT signaling pathway in human nonsmall cell lung cancer cells[J].Oncotarget, 2016,7(20): 28935-46.
[6] Li M, Yu X, Guo H, et al. Bufalin exerts antitumor effects by inducing cell cycle arrest and triggering apoptosis in pancreatic cancer cells[J].TumourBiol, 2014,35(3):2461-71.
[7] Yin J Q, Wen L, Wu L C, et al. The glycogen synthase kinase-3β/nuclear factor-kappa B pathway is involved in cinobufagin-induced apoptosis in cultured osteosarcoma cells[J].ToxicolLett, 2013,218(2):129-36.
[8] 徐忠伟, 王凤梅, 王聪聪,等.钠钾ATP酶抑制剂通过调节DNA损伤感应复合体Mre11/Rad50/Nbs1的表达诱导肝癌HepG2细胞周期阻滞[J]. 中国药理学通报, 2016,32(3): 323-7.
[8] Xu Z W,Wang F M,Wang C C,et al. Na+,K+-ATPase inhibitor induces cell cycle arrest in liver cancer HepG2 cells by regulating expression of DNA damage Mre11/Rad50/Nbs1 complex[J].ChinPharmacolBull, 2016,32(3):323-7
[9] Sokolowski K M, Koprowski S, Kunnimalaiyaan S, et al. Potential molecular targeted therapeutics: role of PI3K/Akt/mTOR inhibition in cancer[J].AnticancerAgentsMedChem, 2016,16(1):29-37.
[10] Zhang C Z, Wang X D, Wang H W, et al. Sorafenib inhibits liver cancer growth by decreasing mTOR, AKT, and PI3K expression[J].JBUON, 2015,20(1):218-22.
[11] Gedaly R, Angulo P, Chen C, et al. The role of PI3K/mTOR inhibition in combination with sorafenib in hepatocellular carcinoma treatment[J].AnticancerRes, 2012,32(7): 2531-6.
[12] Li J, Wang S, Su Z F, Yuan Y.Synergistic effects of sorafenib in combination with gemcitabine or pemetrexed in lung cancer cell lines with K-ras mutations [J].ContempOncol(Pozn), 2016,20(1):33-8.
[13] Jiang S S, Wang Q, Feng M Q, et al.C2-ceramide enhances sorafenib-induced caspase-dependent apoptosis via PI3K/Akt/mTOR and ERK signaling pathways in HCC cells [J].ApplMicrobiolBiotechnol, 2017,101(4):1535-46.
[14] Huang H, Li L J, Zhang H B, Wei A Y. Papaverine selectively inhibits human prostate cancer cell (PC-3) growth by inducing mitochondrial mediated apoptosis, cell cycle arrest and downregulation of NF-κB/PI3K/Akt signalling pathway [J].JBUON,2017,22(7):112-8.
[15] Wang S, Liu Z, Wang L, Zhang X. NF-κB signaling pathway, inflammation and colorectal cancer[J].CellMolImmunol, 2009,6(5):327-34.
[16] Ke F, Wang Z, Song X, et al. Cryptotanshinone induces cell cycle arrest and apoptosis through the JAK2/STAT3 and PI3K/Akt/NF-κB pathways in cholangiocarcinoma cells. [J].DrugDesDevelTher, 2017,11:1753-66.
SynergywiththeactiveingredientsoftoadvenomandsorafenibsuppresseshepatocellularcarcinomaHepG2cellsproliferationthroughdown-regulatingAkt/NF-κBsignalingpathways
WANG Zhi-mei1, XU Zhong-wei2, WANG Jia-bao1, DAI Er-qing3, XU Rui-cheng2,4
(1.thePostgraduateCultureBaseofJinzhouMedicalUniversity-theAffiliatedHospitalofLogisticsUniversityofChinesePeople’sArmedPoliceForce,Tianjin300162,China; 2.CentralLaboratoryLogisticsUniversityofChinesePeople’sArmedPoliceForce,Tianjin300162,China; 3.theAffiliatedHospitalofLogisticsUniversityofChinesePeople’sArmedPoliceForce,Tianjin300162,China; 4.KeyLabforBiomarkersofOccupationalandEnvironmentalHazard,Tianjin300309,China)
AimTo investigate the effect of the active ingredients of toad venom (bufalin and cinobufagin)combined with sorafenib on the growth of hepatocellular carcinoma HepG2 cells, and to explore the possible mechanism.MethodsThe rates of inhibition after treated with drugs 12, 24, 48 h were detected by MTT assay. The changes of cell morphology were detected by Hoechst 33342 fluorescent staining. The changes of cell cycle were detected by flow cytometry. The expressions of proteins such as Akt, p-Akt(Ser473), IκB, NF-κB, p-NF-κB p65, Bcl-2, Bax, cyclin A, PCNA were detected by Western blot.ResultsBufalin, cinobufagin and sorafenib could inhibit the proliferation of HepG2 cells, presenting a dose- and time-dependent manner. Meanwhile, it could significantly increase the inhibitory rate of cells compared with those of single treatment, and they performed a synergistic activity in sorafenib combined with cinobufagin or bufalin by Jin Formula after 24 h treatment (P<0.01). The results of fluorescence staining showed the observation of the morphological features of nuclear condensation. Sorafenib induced the cell cycle G0/G1phase arrest (P<0.01), and bufalin, cinobufagin and the combination treatment generated the cell cycle S phase arrest (P<0.01). The results of Western blot showed that the expressions of Akt, NF-κB were not obviously changed between control and all other treatment. The expression levels of p-Akt(Ser473), p-NF-κB p65, Bcl-2, PCNA and cyclin A in combination treatment significantly decreased, and the expression levels of IκB and Bax significantly increased compared to those in single treatment (P<0.01).ConclusionThe active ingredients of toad venom (bufalin and cinobufagin) combined with sorafenib performs a synergetic effect on the anti-cancer of HepG2 cells by down-regulating Akt/NF-κB signaling pathway.
sorafenib; toad venom; bufalin; cinobufagin; HepG2; Akt; NF-κB
A
1001-1978(2017)11-1510-07
R282.74;R329.24;R329.28;R735.7;R979.1
时间:2017-10-10 10:05 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20171010.1005.016.html
10.3969/j.issn.1001-1978.2017.11.008
2017-08-19,
2017-09-21
国家自然科学基金资助项目(No 81673651,81273552,81273745);武警后勤学院博士启动金项目(No WHB201501)
王志美(1989-),女,硕士生,研究方向:中西医结合临床,E-mail:1032924476@qq.com; 代二庆(1969-),男,博士,教授,硕士生导师,研究方向:中西医结合临床,通讯作者,E-mail:13502136445@163.com; 徐瑞成(1968-),男,硕士,教授,硕士生导师,研究方向:细胞信号转导,通讯作者,Tel:022-84876451,E-mail:xu_rc@sohu.com
