荧光双向电泳检测雌雄小鼠肝组织蛋白组学的差异
2017-11-01戎卓娜李慧玲董鹏辉樊婷婷王福金王爱国王靖宇
戎卓娜,李慧玲,董鹏辉,樊婷婷,李 娟,赵 毅,王福金,王爱国,王靖宇
(大连医科大学实验动物中心,大连 116044)
研究报告
荧光双向电泳检测雌雄小鼠肝组织蛋白组学的差异
戎卓娜,李慧玲*,董鹏辉,樊婷婷,李 娟,赵 毅,王福金,王爱国,王靖宇*
(大连医科大学实验动物中心,大连 116044)
目的检测雌雄小鼠肝组织蛋白质组表达差异,探讨肝病发生的性别差异机制。方法采用双向荧光差异凝胶电泳(two dimension difference gel electrophoresis, 2D-DIGE)和基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ionization time of flight mass spectrometry, MALDI-TOF-MS)技术检测C57BL/6J雌雄小鼠肝组织的蛋白质组差异表达谱,分离并鉴定差异表达蛋白,应用Western blot进行验证,并对差异表达蛋白进行生物信息学分析,包括蛋白功能注释、分类分析、京都基因与基因组百科全书通路分析。结果经双向荧光差异凝胶电泳-图像分析得到1767个蛋白点,其中差异倍数≥1.5(P< 0.05)的蛋白点325个。从中选择78个差异蛋白点进行MALDI-TOF-MS鉴定,得到48种差异性表达的蛋白质。其中,与雌鼠相比,雄鼠肝组织中高表达的蛋白有14种,低表达的蛋白有34种。选取6个差异蛋白点进行Western blot 验证,证明了2D-DIGE结果的可靠性。GO分析结果显示,涉及雌雄鼠肝组织中的差异蛋白在细胞组分、分子功能、生物学过程中的分布广泛。KEGG通路分析发现差异蛋白涉及6条信号通路。结论C57BL/6J雌雄小鼠肝组织的差异性蛋白表达的检测结果为研究性别差异性肝病发生的分子机制提供了基础生物学信息和有益的线索。
肝;性别差异;蛋白质组学;生物信息学;双向荧光差异凝胶电泳
肝病的雄性倾向性是哺乳动物的显著特征[1-5],说明哺乳动物具有相似的性别差异性肝病发生机制,但其分子机制尚不清楚。近年,蛋白质组学技术和生物信息学分析的飞速发展,为从整体、动态、定量水平研究疾病发生发展的机制提供了关键性技术方法和重要信息[6]。本研究采用双向荧光差异凝胶电泳分析法,首次对C57BL/6J品系雌雄小鼠肝组织进行了差异蛋白质组学检测和相应的生物信息学分析,为以小鼠为动物模型的肝病的性别差异性发生机制研究提供基础生物学信息。
1 材料和方法
1.1实验动物
SPF级C57BL/6J雄性小鼠3只,9月龄,体重24~27 g,雌性小鼠3只,15月龄,体重24~27 g,小鼠的繁育饲养和实验均在大连医科大学实验动物中心SPF区进行[SCXK(辽)2013-0003][SYXK(辽)2013-0006]。实验动物使用与管理委员会(ICUC)批准号:L20130326。
1.2主要试剂与仪器
Cy2,Cy3,和Cy5购自英国GE Healthcare Bio-Sciences公司;二甲基甲酰胺购自美国Aldrich公司;尿素、琼脂糖、甘油、溴酚蓝、CHAPS、SDS、碘乙酰胺、过硫酸铵、TEMED、IPG凝胶(24 cm,pH3~10)购自美国Bio-Rad;蛋白酶抑制剂混合物购自瑞士Roche Applied Science;胰蛋白酶(测序级)购自普洛麦格(北京)生物技术有限公司;GelDocTMEZ成像仪(美国Bio-RAD);质谱仪(AutoFlex,德国Bruker公司);紫外分光光度计(Nanodrop 2000)、xMark酶标仪等。
1.3实验方法
1.3.1 组织样本的采集和蛋白质提取
宏观解剖分别采集C57BL/6J雄性和雌性小鼠的肝组织,剪成约1 cm3大小的组织块,置于冷冻管中液氮冻存。组织块液氮研磨,加入1 mL裂解液(7 mol/L尿素,2 mol/L硫脲,4%CHAPS,30 mmol/L Tris-Cl pH 8.5,磷酸酶抑制剂),超声破碎10 s, 14 000 r/min 离心30 min。用Bradford蛋白浓度测定试剂盒对蛋白浓度进行定量,并用SDS-PAGE确认。
1.3.2 DIGE实验设计和荧光染料标记
在3只雌性或3只雄性小鼠的肝组织蛋白样本中各取50 μg进行等量混合,分别获得雄性(M)和雌性(F)肝组织混合蛋白样本。雌雄肝组织混合样本分别以Cy3和Cy5进行荧光标记,两者再进行等量混合为内标,以Cy2进行荧光标记。
1.3.3 双向电泳
IPG胶条(24 cm,pH 3~10)置于IPGphor水平电泳仪(Bio-Rad)上进行水化和聚焦,取1.3.2中样本的等量混合液进行2D-DIGE,电泳条件280 kVh(30 min内达到250 V,1000 V稳定1 h,5 h内达到10000 V,10000 V维持到60 kVh)。等电聚焦结束后,IPG胶条先后在十二烷基磺酸钠平衡液(0.5%DTT)和平衡液II(4.5%碘乙酰胺)中各平衡15 min;将平衡好的IPG胶条转移至12%的十二烷基磺酸钠聚丙烯酰胺凝胶上端,设置功率,避光条件下进行垂直电泳,直至溴酚蓝达胶底线,然后用Typhoon 9410激光共聚焦扫描仪对电泳结果进行成像,各个荧光染料激发/吸收特异波长设置分别为Cy2(488/520 nm),Cy3(532/580 nm)和Cy5(633/670 nm)。同时取未标记的蛋白内标样品1 mg进行双向电泳,具体操作同荧光染色样本。电泳结束后,先用超敏考马斯亮蓝染色液染色,再扫描成像,用于质谱分析。
1.3.4 图像分析
双向荧光差异凝胶电泳图谱用SameSpots软件分析,观察蛋白的变化趋势。同时,将一张分析过的图像用于切胶图像(SpotPicking),与1 mg内标样品的制备胶的染色点进行匹配。选择倍数≥1.5(P< 0.05)的斑点为差异蛋白点。
1.3.5 差异蛋白的胶内酶切和质谱鉴定
采集差异蛋白点,经过清洗和脱色,脱水干燥,37℃酶解15 h。收集上清,提取蛋白并冻干。将蛋白样本复溶,点靶于MALDI金属盘上,4700 MALDI-TOF-MS串联飞行质谱仪进行鉴定。
1.3.6 数据库检索差异蛋白名称
应用MASCOT软件对上述质谱鉴定数据在NCBI非冗余数据库进行检索。检索参数:种类为Mus musculus;酶为胰蛋白酶,允许1个漏切位点;肽质量容忍差异为0.2;MS/MS容忍差异为0.3。
1.3.7 蛋白质印迹法验证2D-DIGE检测结果
RIPA裂解液提取C57BL/6J雌雄小鼠肝脏组织的总蛋白(4只/组),Bradford试剂盒测定样本蛋白浓度。将30 μg的蛋白样品在12%的SDS-PAGE上进行分离、转膜、封闭后,分别用EPHX2、CA3、FBP1、ARHGDIA(Abcam)和SCP2、Albumin(Bioworld)一抗以及HRP标记山羊抗兔(ABclonal)二抗孵育后,用ECL化学发光试剂盒(Advansta,USA)显影。实验重复3次,Bradford染色作为上样内参。
1.4生物信息学分析
用DAVID软件(https://david.ncifcrf.gov/home.jsp)对鉴定的差异蛋白质进行Gene Ontology(GO)分析,对差异蛋白进行功能注释和分类,包括Cellular component(CC)、Molecular function(MF)和Biological Process(BP)分析;以及对差异蛋白进行Kyoto Encyclopedia of Genes and Genomes(KEGG)的通路富集分析。
2 结果
2.12D-DIGE图谱和分析结果
将雌鼠和雄鼠的肝组织蛋白样本进行荧光标记和电泳后,分别经488、532、633 nm波长的激光进行扫描,即获得内标图谱、雌鼠肝组织蛋白图谱、雄鼠肝组织蛋白图谱共3张,然后用SameSpots分析软件进行分析,并将图谱叠加(图1)。雌雄小鼠肝组织蛋白样本中共检测到蛋白质斑点1767个。

注:A:3个不同荧光标记样品的叠加图像;B:Cy2标记的混合蛋白样本内标;C:Cy3标记的雄鼠肝组织蛋白样本;D:Cy5标记的雌鼠肝组织蛋白样本。图1 C57BL/6J雄鼠和雌鼠肝组织蛋白表达的双向荧光差异凝胶电泳图谱Note.A: The merged images of different fluorescent labeled samples; B: Cy2 labeled mixed protein samples; C: Cy3 labeled liver tissue protein samples of male mice; D: Cy5 labeled liver tissue protein samples of female mice.Fig.1 Images of gender differentially expressed proteins in C57BL/6J mouse liver tissues detected by two dimensional fluorescence difference gel electrophoresis
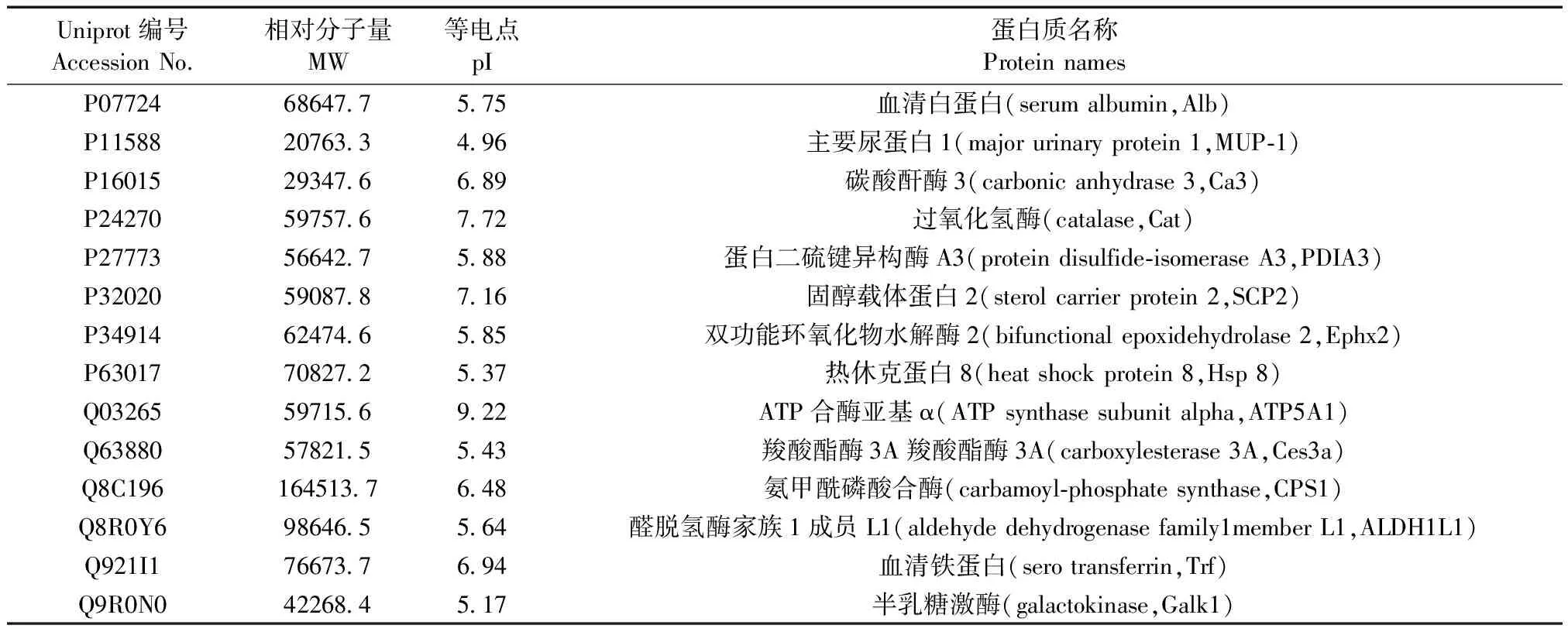
Uniprot编号AccessionNo.相对分子量MW等电点pI蛋白质名称ProteinnamesP07724686477575血清白蛋白(serumalbumin,Alb)P11588207633496主要尿蛋白1(majorurinaryprotein1,MUP⁃1)P16015293476689碳酸酐酶3(carbonicanhydrase3,Ca3)P24270597576772过氧化氢酶(catalase,Cat)P27773566427588蛋白二硫键异构酶A3(proteindisulfide⁃isomeraseA3,PDIA3)P32020590878716固醇载体蛋白2(sterolcarrierprotein2,SCP2)P34914624746585双功能环氧化物水解酶2(bifunctionalepoxidehydrolase2,Ephx2)P63017708272537热休克蛋白8(heatshockprotein8,Hsp8)Q03265597156922ATP合酶亚基α(ATPsynthasesubunitalpha,ATP5A1)Q63880578215543羧酸酯酶3A羧酸酯酶3A(carboxylesterase3A,Ces3a)Q8C1961645137648氨甲酰磷酸合酶(carbamoyl⁃phosphatesynthase,CPS1)Q8R0Y6986465564醛脱氢酶家族1成员L1(aldehydedehydrogenasefamily1memberL1,ALDH1L1)Q921I1766737694血清铁蛋白(serotransferrin,Trf)Q9R0N0422684517半乳糖激酶(galactokinase,Galk1)
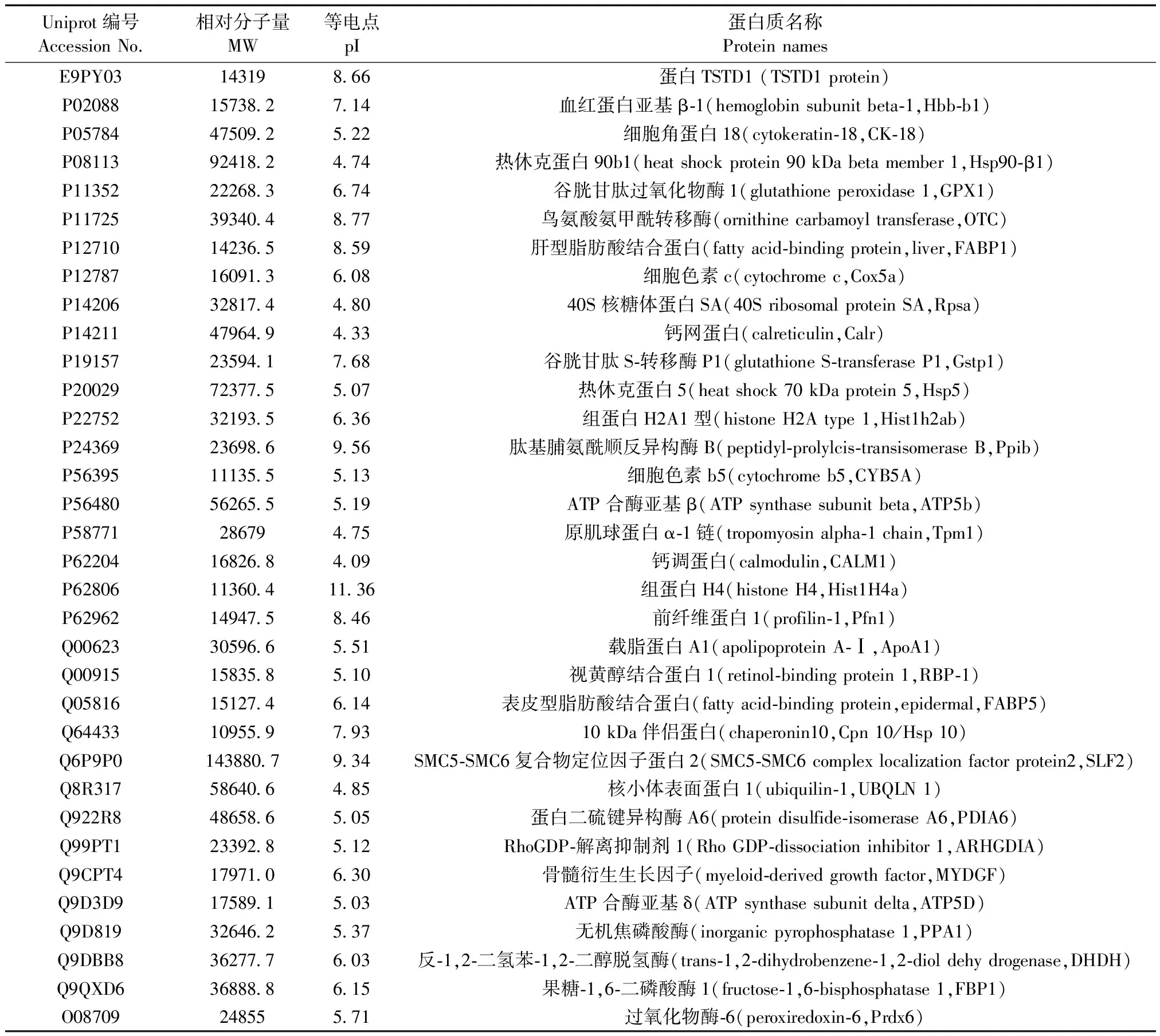
表2 雄鼠肝组织低表达差异蛋白的质谱鉴定结果
2.2雌雄小鼠肝脏组织中差异表达蛋白的筛选和鉴定
采用SameSpots软件对差异蛋白点进行分析和筛选。筛选条件:蛋白质差异在1.5倍以上(P< 0.05)。比较后共分析出325个差异点。其中,与雌鼠相比,雄鼠肝组织中高表达的蛋白点共计155个,低表达的蛋白点共计170个。对筛选出来的差异蛋白点,随机选取78个点进行MALDI-TOF-MS质谱鉴定。结果显示,这些鉴定的所有蛋白点均获得了较好的质谱图。将肽质量指纹图谱和MS/MS数据提交MASCOT进行在线检索,共成功检索出48种蛋白。其中,与雌鼠相比,雄鼠肝组织中高表达的蛋白14种(表1),低表达的蛋白34种(表2)。
2.3鉴定结果的蛋白质印迹验证
在鉴定出的雌雄小鼠肝脏组织差异表达蛋白中选取EPHX2、SCP2、CA3、FBP1、ARHGDIA和Albumin 6个蛋白进行蛋白质印迹验证。结果如图2所示,与雌性小鼠的肝组织相比,EPHX2、SCP2和CA3在雄性小鼠肝组织中的表达明显升高,FBP1和ARHGDIA在雄性小鼠肝组织中的表达明显降低。这些结果与2D-DIGE的鉴定结果一致,说明了2D-DIGE结果的可靠性。但是,Albumin的蛋白表达在雌雄小鼠间未见明显差异,在2D-DIGE鉴定的78个蛋白点中,有9个点鉴定为Albumin。这表明Albumin在雌雄小鼠间可能存在转录剪切或翻译后修饰的显著差异。
2.4差异蛋白的GO分析
将所有差异蛋白进行GO分析(表3),共涉及26条分子功能,其中包含蛋白数量最多的前10种分子功能为:poly(A)RNA结合、酶结合、脂质结合、受体结合、催化活性、解折叠蛋白结合、ATPase活性、钙粘蛋白结合参与细胞间粘附、泛素蛋白连接酶结合和蛋白复合物结合。共涉及28条细胞组分,其中包含蛋白数量最多的前十种细胞组分为:胞外体、细胞质、细胞核、胞质溶胶、线粒体、细胞外空间、内质网、蛋白复合物、胞外区和髓鞘。共涉及40条生物学功能,其中包含蛋白数量最多的前十种生物学功能为:运输、凋亡过程的负调控、代谢过程、蛋白质折叠、脂代谢过程、氧化还原过程、对药物的反应、响应活性氧、ATP代谢过程和受体介导的内吞作用。以上结果表明,雌雄小鼠肝脏差异蛋白在分子功能、细胞组分和生物学功能中都存在广泛而显著的差异。
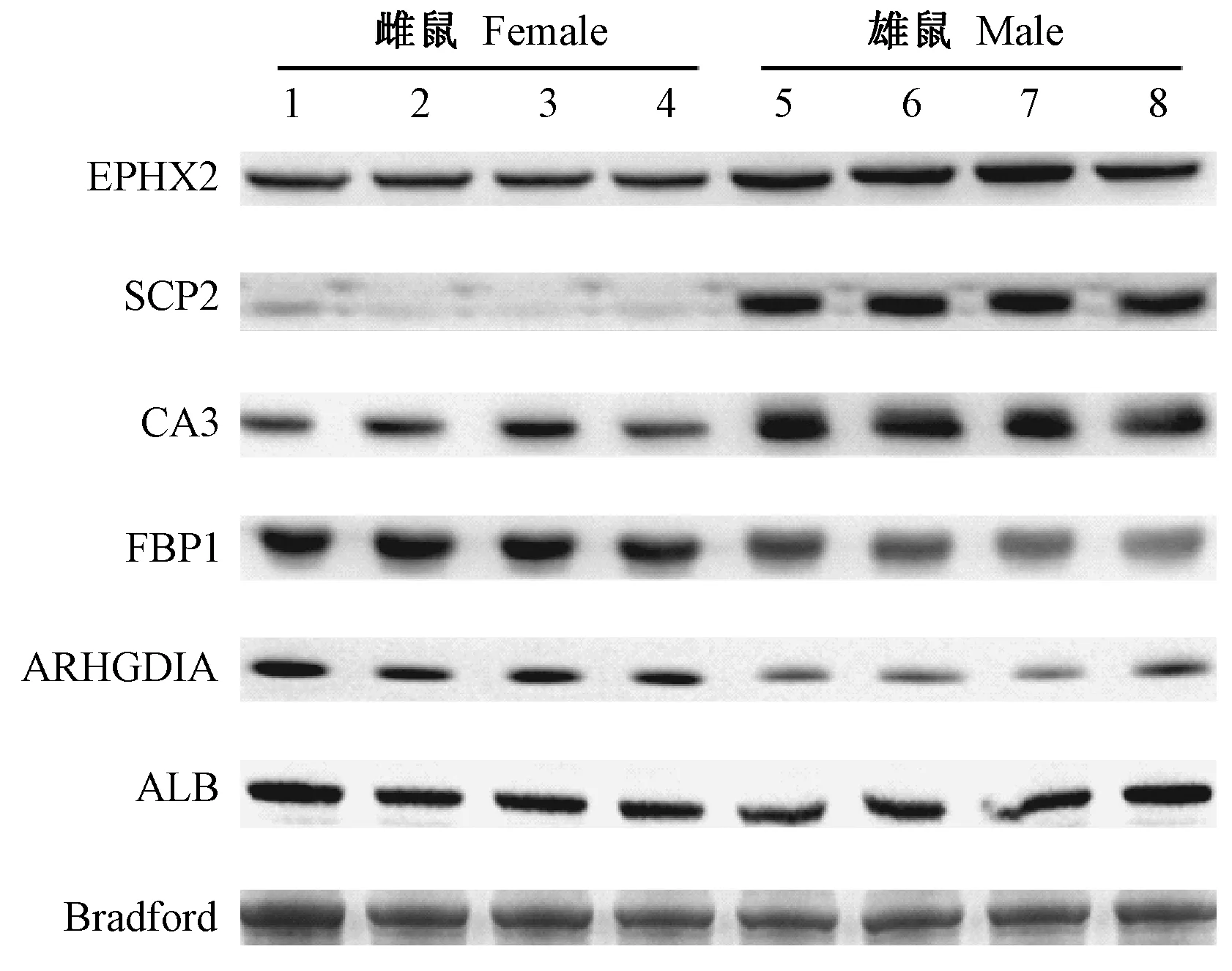
注:1~8数字分别代表不同个体的C57BL/6J小鼠。图2 蛋白质印迹法验证雌雄小鼠肝脏组织差异表达蛋白Note.1~8 numbers indicate the different individuals of C57BL/6J mice.Fig.2 Validation of the differentially expressed proteins between females and males by Western blot assay
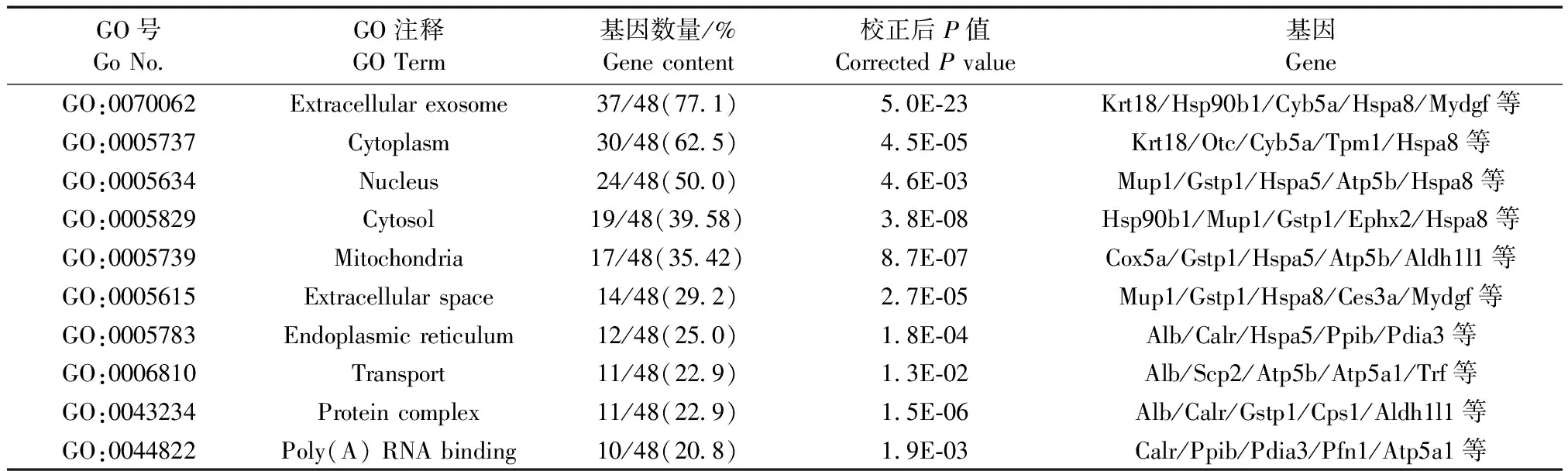
表3 雌雄小鼠肝组织差异蛋白GO富集分析结果
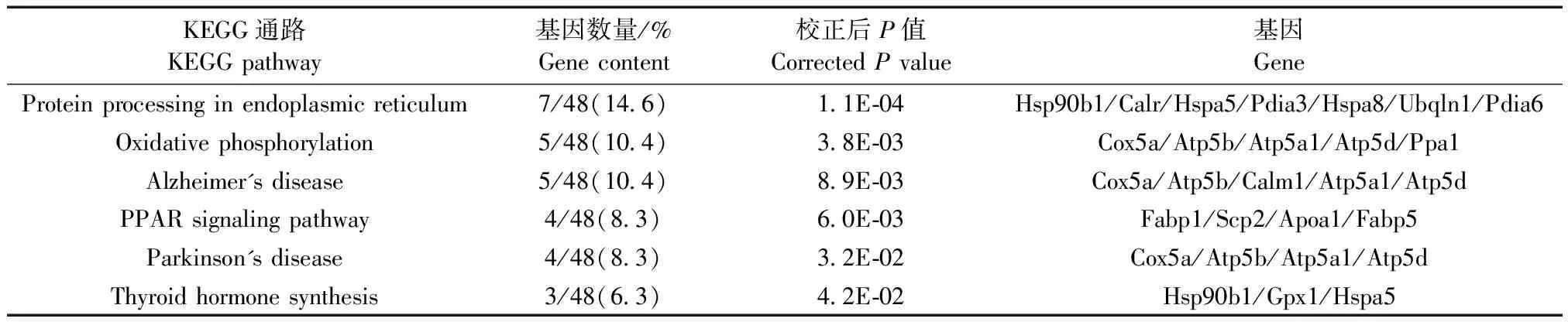
表4 雌雄小鼠肝组织差异蛋白的KEGG通路数据库富集分析结果
2.5差异蛋白的KEGG分析
对所有差异蛋白进行KEGG通路分析,共发现了6个有统计学意义的代谢通路(表4),包括内质网中的蛋白质加工、氧化磷酸化、阿尔茨海默病、PPAR信号通路、帕金森病和甲状腺激素合成。
3 讨论
我们的前期研究结果表明,在Ras癌基因诱导的,以C57BL/6J为遗传背景的肝癌小鼠动物模型中[3],肝肿瘤的发生主要集中在雄鼠的中年阶段和雌鼠的老年阶段,并存在显著的差异(肝肿瘤发生率:9月龄雄鼠为100%,15月龄雌鼠为34.62%)。由此,本研究选择9月龄雄鼠和15月龄雌鼠作为研究对象。通过2D-DIGE分析,与雌鼠相比,雄鼠肝组织中下调的蛋白34个,上调蛋白14个,涉及广泛的细胞生物学功能和代谢通路。
适当的ROS水平对正常细胞的生理过程具有重要的调节作用,但过量的ROS又是参与细胞病变过程的重要因素[7]。本研究发现,三种参与ROS代谢的关键酶(GPX1,Prdx6,CAT)在雌雄小鼠肝组织中的表达具有显著的差异。其中,GPX1和Prdx6在雄性C57BL/6J小鼠肝组织内的表达较雌性小鼠显著降低(GPX1下降5.31倍,Prdx6下降2.7倍)。GPX1是线粒体中重要的抗氧化酶,主要负责消除线粒体内H2O2的水平,从而抵抗或阻止ROS蓄积所导致的细胞损伤[8]。Prdx6是抗氧化蛋白超家族成员之一,是具有GPX和Ca2+非依赖性磷脂酶A2双重酶活性的蛋白。体外研究表明,小鼠表皮细胞过表达Prdx6具有抵抗氧化应激损伤的作用[9]。GPX1和Prdx6的显著降低可能会导致雄性小鼠肝细胞中的ROS水平偏高,肝细胞易受损伤,进而有利于肝病的发生发展。另外,KEGG富集分析结果显示,线粒体中氧化磷酸化通路发生了显著变化,其中的相关蛋白在雄性小鼠肝细胞中普遍降低,这可能会进一步提升雄性小鼠肝细胞中的ROS水平。有趣的是,CAT在雄性C57BL/6J小鼠肝组织内的表达较雌性小鼠显著升高(1.6倍)。CAT主要功能是分解H2O2为H2O和O2,与SOD、POD共同组成抗氧化酶系统,降低细胞内ROS水平[10]。CAT的显著升高可能是低水平GPX1和Prdx6的代偿性补充,以维持雄性肝细胞的正常ROS水平和生理功能,但具体机制尚需进一步研究。
肝脏是生物体脂质代谢的中枢器官,而脂质代谢紊乱又是诱发或影响肝病发生发展的重要因素之一[11]。本研究的KEGG通路富集分析数据表明,调节脂质代谢的PPAR信号通路在雌雄小鼠的肝组织中具有显著的差异,其中检测到的差异蛋白为Scp2、ApoA1、FABP1和FABP5,与雌性小鼠相比,Scp2在雄性小鼠中上调,其他蛋白均下调。Scp2是胆固醇代谢的重要调节因子,不仅参与胆固醇的生物合成和转化,还是胆固醇的重要转运蛋白。Liu等研究表明,中草药当归可显著下调肝组织Scp2的表达进而抑制脂肪肝的发生[12]。因而,Scp2在雄性小鼠肝组织中的显著升高可能会导致胆固醇在雄性肝细胞中的蓄积,进而影响肝病的进展。ApoA1作为卵磷脂胆固醇酰基转移酶的载脂蛋白,主要参与胆固醇由外周组织向肝脏的逆向转运[13]。而FABP1和FABP5均为脂肪酸结合蛋白家族的成员,其中FABP5不仅可以转运脂肪酸为细胞生长提供能量及原材料,而且可以结合和转运各种配体,参与肿瘤生长相关的信号转导[14]。这些脂质代谢相关蛋白在脂肪肝及肝肿瘤中都具有重要的作用,然而,它们的显著下降对雄性倾向性肝病病变过程的影响尚有待进一步探究。
综上所述,本研究应用双向荧光差异凝胶电泳技术首次检测了C57BL/6J雌雄小鼠肝脏组织的差异性蛋白表达,为研究性别差异性肝病发生的分子机制提供了基础生物学信息和有益的线索。
[1] Bianco T, Cillo U, Amodio P, et al. Gender differences in the quality of life of patients with liver cirrhosis related to hepatitis C after liver transplantation[J]. Blood Purif, 2013, 36(3-4): 231-236.
[2] Pan JJ, Fallon MB. Gender and racial differences in nonalcoholic fatty liver disease[J]. World J Hepatol, 2014, 6(5): 274-283.
[3] Wang AG, Moon HB, Lee MR, et al. Gender-dependent hepatic alterations in H-ras12V transgenic mice[J]. J Hepatol, 2005, 43(5): 836-844.
[4] 定明, 何允刚, 张小飞, 等.蛋白质组学技术筛选和鉴定白化黑线仓鼠皮肤白化相关差异蛋白质[J]. 中国实验动物学报,2014,22(1):79-82.
[5] 李顺,陈丽香,彭秀华, 等.小鼠肝癌模型研究进展[J].中国实验动物学报,2016,24(2):213-216.
[6] Boguski MS, McIntosh MW. Biomedical informatics for proteomics[J]. Nature, 2003, 422(6928): 233-237.
[7] Holbrook NJ, Ikeyama S. Age-related decline in cellular response to oxidative stress: links to growth factor signaling pathways with common defects[J]. Biochem Pharmacol, 2002, 64(5-6): 999-1005.
[8] Thu VT, Kim HK, Ha SH, et al. Glutathione peroxidase 1 protects mitochondria against hypoxia/reoxygenation damage in mouse hearts[J]. Pflugers Arch, 2010, 460(1): 55-68.
[9] Shibata S, Shibata N, Shibata T, et al. The role of Prdx6 in the protection of cells of the crystalline lens from oxidative stress induced by UV exposure[J]. Jpn J Ophthalmol, 2016, 60(5): 408-418.
[10] Jadeja RN, Urrunaga NH, Ahmad D, et al. Data regarding M1 muscarinic receptor-mediated modulation of hepatic catalase activity in response to oxidative stress[J]. Data Brief, 2016, 6: 405-409.
[11] Cohen JC, Horton JD, Hobbs HH. Human fatty liver disease: old questions and new insights[J]. Science, 2011, 332(6037): 1519-1523.
[12] Lu X, Yuan ZY, Yan XJ, et al. Effects of Angelica dahurica on obesity and fatty liver in mice[J]. Chin J Nat Med, 2016, 14(9): 641-652.
[13] Fernandez-Miranda C, Perez-Carreras M, Colina F, et al. A pilot trial of fenofibrate for the treatment of non-alcoholic fatty liver disease[J]. Dig Liver Dis, 2008, 40(3): 200-205.
[14] 周玲丽, 曹骥, 李薇, 等.RNA干扰 FABP5基因对人肝癌 HepG2细胞裸鼠移植瘤生长的影响[J]. 中国病理生理杂志, 2015, 31(4): 603-608.
DifferentialproteomicanalysisoflivertissuesbetweenmaleandfemaleC57BL/6Jmiceby2D-DIGE
RONG Zhuo-na, LI Hui-ling*, DONG Peng-hui, FAN Ting-ting, LI Juan, ZHAO Yi, WANG Fu-jin, WANG Ai-guo, WANG Jing-yu*
(Laboratory Animal Center, Dalian Medical University, Dalian 116044, China)
ObjectiveTo identify the differential proteomic expressions between the liver tissues of male and female mice, and investigate the mechanisms underlying gender differences in liver diseases.MethodsTwo-dimensional fluorescence difference gel electrophoresis (2D-DIGE) and matrix-assisted laser desorption/ionization time of flight mass spectrometry (MALDI-TOF-MS) were used to identify the differentially expressed proteins in the liver tissues of male and female C57BL/6J mice. The differentially expressed proteins were validated by Western blot and further analyzed by bioinformatics, including Gene Ontology (GO) analysis and Kyoto Encyclopedia of Genes and Genomes (KEGG).ResultsAmong the auto-detected 1767 protein spots by 2D-DIGE, 325 protein spots were differentially expressed (|ratio|≥1.5,P< 0.05) between the liver tissues of male and female mice, in which 78 spots were randomly selected for MALDI-TOF-MS identification and finally 48 distinct proteins were obtained. Compared with females, 14 and 34 proteins were up- or down-regulated in males, respectively. Among them, 6 differentially expressed proteins were validated by Western blot which confirmed the reliability of 2D-DIGE results.GO analysis showed that the differentially expressed proteins in the liver tissues of male and female mice are associated to various cellular component, molecular function and biological process. 6 pathways were significantly different between the liver tissues of males and females depending on KEGG analysis.ConclusionsThe proteomic data and related analysis of the liver tissues of C57BL/6J mice offer crucial clues for elucidating the underlying mechanisms of different gender effects on liver diseases.
Liver; Gender difference; Proteomic; Bioinformatics; Two dimension difference gel electrophoresis, 2D-DIGE
R-33
A
1671-7856(2017) 10-0016-07
10.3969.j.issn.1671-7856. 2017.10.004
2017-02-19
辽宁省教育厅科学规划课题(L2014341);国家自然科学基金(30872950)。
戎卓娜,女,硕士,研究方向:肝肿瘤发生分子机制的研究。E-mail: rongzhuona@163.com
李慧玲,女,硕士,讲师,研究方向:肝肿瘤发生分子机制的研究。E-mail: 5421992@qq.com。
王靖宇,男,教授,博士生导师,研究方向:动物行为学和分子生物学。E-mail: wangjingyus@163.com。*共同通讯
