脑胶质瘤IDH基因突变与定量多模态MRI研究进展
2017-11-01梅东东龚静山刘永光
梅东东,龚静山,刘永光,冯 霞
(暨南大学第二临床医学院 深圳市人民医院放射科,广东 深圳 518020)
脑胶质瘤IDH基因突变与定量多模态MRI研究进展
梅东东,龚静山*,刘永光,冯 霞
(暨南大学第二临床医学院 深圳市人民医院放射科,广东 深圳 518020)
异柠檬酸脱氢酶(IDH)基因突变与脑胶质瘤的发生、预后及对治疗的反应有密切关系。由于IDH是细胞能量代谢重要的限速酶,IDH基因突变改变了IDH与底物的亲和力和代谢方向,使肿瘤代谢和微观结构发生改变。定量多模态MRI能够获得多种与微观结构、功能和代谢产物相关的影像学生物标记,有望通过检测影像学生物标记在体评价IDH基因突变引起的胶质瘤代谢和微结构改变。本文对近年来有关脑胶质瘤定量多模态MRI特征与IDH基因突变关系的研究进展进行综述。
异柠檬酸脱氢酶;突变;胶质瘤;磁共振成像
胶质瘤是中枢神经系统最常见的原发肿瘤,具有较高的异质性。目前临床主要根据WHO分级决定治疗方案和判断预后。WHO分级依据临床和病理特征将胶质瘤分为Ⅰ~Ⅳ级,级别越高恶性程度越高,预后越差[1]。在目前的临床治疗策略下,Ⅳ级胶质母细胞瘤患者中位生存时间仅12~15个月,但也有一些患者生存时间可达数年,甚至十余年[2-3]。基于组织病理学改变的WHO分级对于一些胶质瘤治疗指导和预后判断存在一定局限性。异柠檬酸脱氢酶(isocitrate dehydrogenase, IDH)基因突变可改变IDH与底物亲和力以及代谢的方向,使肿瘤代谢和微观结构发生改变,从而影响胶质瘤患者的预后和治疗反应,但IDH基因表型检测依赖于组织病理学检查,临床缺乏无创、简便地在体评价IDH基因表型的生物学标记。定量多模态MRI能够获得组织微观结构、代谢功能改变相关的影像学生物标记,通过检测影像学生物标记可获得反映病变异质性的相关参数。本文对近年来定量多模态MRI特征与IDH基因表型相关性研究进行综述。
1 IDH基因突变与胶质瘤的发生的关系
2006年Sjöblom等[4]在转移性结肠癌中首次发现异柠檬酸脱氢酶1(IDHl)家族基因突变。2008年Parsons等[5]利用全组基因测序,在12%的胶质母细胞瘤患者中检出IDHl精氨酸132(R132)突变;且进一步研究[3,6-7]表明,部分胶质瘤可发生IDH基因突变,且与野生型IDH胶质瘤相比,IDH突变的恶性胶质瘤具有较好的预后。Reuss等[2]报道,IDH突变型的弥漫型和间变型星形细胞瘤具有相似的发病年龄和较小的预后差异。IDH突变为影响胶质瘤预后和治疗反应的独立危险因素,存在于50%~80%的胶质瘤患者[8-10]。
IDH为三羧酸循环的关键限速酶,借助氧化型烟酰胺腺嘌呤二核苷酸(NAD+)或氧化型烟酰胺腺嘌呤二核苷酸磷酸(NADP+)作为辅助因子,催化异柠檬酸氧化脱羧生成α-酮戊二酸及CO2,同时分别生成还原型烟酰胺腺嘌呤二核苷酸(NADH)或还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH),见图1。IDH同工酶有依赖NADP的胞质IDHl、线粒体的IDH2和依赖NAD的线粒体IDH3 3种形式。IDHl基因位于染色体2q33.3,定位于细胞质和过氧化物酶体;IDH2基因位于染色体15q26.1,定位于细胞线粒体[11]。
胶质瘤主要存在IDH1/2突变,而IDH3突变较少,以下将IDH1/2突变均简称为IDH突变。突变型IDH与底物结合形成二聚体,进而使IDH的活性降低,最终α-酮戊二酸生成量大幅度下降,并使NADPH依赖性的还原反应被催化,使α-酮戊二酸(α-KG)变成2-羟基戊二酸(2-bydroxyglutarate, 2-HG)[12],见图1。正常细胞中2-HG较少,而IDH突变可使肿瘤细胞内2-HG含量增加。在胶质瘤手术切除标本中,IDH突变型胶质瘤中2-HG水平比野生型高100倍[13]。IDH突变可改变细胞的甲基化谱以并可阻止细胞分化和促进细胞增殖,从而导致肿瘤的发生。此外,2-HG的积累可导致细胞缺氧诱导因子(hypoxia-mducible factor 1α, HIF-1α)水平降低[14]。在正常生理条件下,HIF-1α起着调节线粒体氧消耗和限制活性氧(reactive oxygen species, ROS)的作用[15]。HIF-1α水平下降使细胞暴露于更多的ROS介导的DNA损伤和突变,使肿瘤发生,并促进人类星形细胞的增殖和克隆,但在胶质母细胞瘤中,HIF-1α活性增加可促进肿瘤细胞增殖和血管生成[16]。因此,在胶质瘤中,IDH突变是一部分肿瘤的启动因素,也使这部分肿瘤因细胞增殖程度低和血管生成少(相对野生型的肿瘤)而侵袭性相对较低,具有相对良好的预后。Parsons等[5]研究表明,IDH野生型胶质瘤患者死亡率是突变型的3.7 倍,前者平均存活时间仅1.1 年,后者则为3.8年。
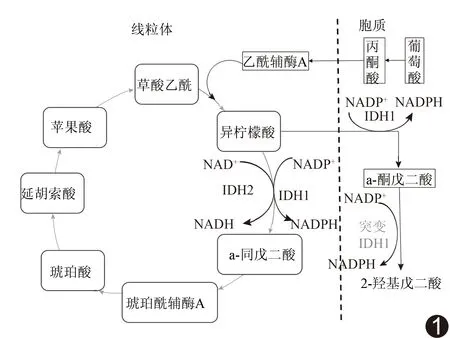
图1 IDH生理状态和突变状态下的代谢途径
2 IDH基因突变检测的临床意义
检测胶质瘤IDH基因突变不仅可指导临床判断预后,而且有助于治疗方案的选择和靶向药物的研发。Rohle等[14]研究显示,可穿过血脑屏障的小分子IDH基因突变特异性抑制剂(AGI-5198)在体内和体外均显示较好的疗效。AGI-5198可反转因IDH基因突变导致的细胞分化改变并降低2-HG含量。由于IDH基因突变改变胶质瘤的甲基化谱,对烷化剂化疗药的疗效产生影响[17-18]。因此,IDH基因突变的检测对胶质瘤预后判断、治疗方案的选择和靶向药物的研发和临床应用有重要意义。由于组织标本获得对胶质瘤患者创伤较大,而且手术治疗严重影响患者的生活质量和预后,因此,临床亟须无创技术手段获得胶质瘤IDH基因表型的途径。
3 胶质瘤定量多模态MRI特征与IDH基因突变相关性研究
MRI是神经系统肿瘤首选的影像学检查方法。传统的结构MRI研究[19-22]表明,一些形态学特征,如边界不清、周围浸润、弥散受限和增强显著强化与WHO分级的高级别胶质瘤相关。近年来,伴随定量和功能MRI的发展,多模态影像学研究已深入到影像基因组学和遗传学方面,研究者们试图建立放射影像学特征和肿瘤基因表型之间的联系。定量多模态MRI可通过多种成像技术获得组织和病变的微结构、代谢和功能改变的多种影像学生物标记。有学者[23-24]采用多模态MRI寻找与脑胶质瘤IDH基因突变相关的影像学生物标记。由于IDH基因突变,改变了IDH与底物的亲和力,影响能量代谢,使肿瘤的代谢产物和微结构发生改变。定量多模态MRI有望通过获得与这些代谢和微结构的改变相关的影像学生物标记在体评价胶质瘤的IDH基因表型,为临床胶质瘤预后判断、治疗方案的选择提供简便无创无辐射的方法。Metellus等[25]报道IDH野生型胶质瘤好发于额颞岛叶,并且肿瘤的体积相对较大,具有单侧生长、信号较均匀,强化相对较弱等特点。张劲松等[26]研究结果也表明,胶质瘤的发生部位与IDH表型相关,IDH突变型低级别胶质瘤常见于右侧额叶,其次为右侧颞叶,但未发现肿瘤强化程度与IDH表型相关。由于张劲松等[26]的研究为回顾性分析,增强扫描为常规单期扫描,不能详尽反映肿瘤血供特征。Stadlbauer等[23]结合定量血氧水平依赖成像和动态磁敏感灌注成像计算胶质瘤氧代谢和新生血管的影像学生物标记,结果表明影像学生物标记可用于IDH基因表型的评价。Biller等[24]对胶质瘤行Na-MR成像,显示Na-MR信号可作为未经治疗的胶质瘤IDH表型影像学标记。
4 展望
通过定量多模态MRI提供的影像学大数据,可获得精准反映组织和病变的代谢和微结构改变的影像学生物标记。IDH基因突变可引起胶质瘤代谢和微结构改变,包括:①IDH突变型胶质瘤2-HG含量为野生型100倍;②IDH基因突变型胶质瘤较野生型细胞增殖程度低、血管生成少;③IDH突变改变肿瘤细胞的代谢途径,如HIF-1a降低,使线粒体对氧的消耗下降和ROS聚集。这些代谢和微结构的改变可通过MRS、多参数DWI、PWI和血氧水平依赖成像获得反映肿瘤2-HG含量、细胞密集度、微血管密度、血管通透性和氧代谢等的影像学生物标记,为在体评价IDH基因表型提供分子病理学基础。因此,有望通过定量多模态MRI解决临床缺乏生物学标记评价胶质瘤IDH基因表型,为胶质瘤的精准医疗和靶向药物的研发提供指导。
[1] Louis DN, Ohgaki H, Wiestler OD, et al. WHO classifcation of tumors of the central nervous system. 4th ed. Lyon: IARC Press, 2007:10.
[2] Reuss DE, Mamatjan Y, Schrimpf D, et al. IDH mutant diffuse and anaplastic astrocytomas have similar age at presentation and little difference in survival: A grading problem for WHO. Acta Neuropathol, 2015,129(6):867-873.
[3] Marijnen CA, van den Berg SM, van Duinen SG, et al. Radiotherapy is effective in patients with glioblastoma multiforme with a limited prognosis and in patients above 70 years of age: A retrospective single institution analysis. Radiother Oncol, 2005,75(2):210-216.
[4] Sjöblom T, Jones S, Wood LD, et al. The consensus coding sequences of human breast and colorectal cancers. Science, 2006,314(5797):268-274.
[5] Parsons DW, Jones S, Zhang X, et al. An integrated genomic analysis of human glioblastoma multiforme. Science, 2008,321(5897):1807-1812.
[6] Watanabe T, Nobusawa S, Kleihues P, et al. IDH1 mutations are early events in the development of astrocytomas and oligodendrogliomas. Am J Pathol, 2009,174(4):1149-1153.
[7] Qi S, Yu L, Li H, et al. Isocitrate dehydrogenase mutation is associated with tumor location and magnetic resonance imaging characteristics in astrocytic neoplasms. Oncol Lett, 2014,7(6):1895-1902.
[8] Hartmann C, Hentschel B, Wick W, et al. Patients with IDH1 wild type anaplastic astrocytomas exhibit worse prognosis than IDH1-mutated glioblastomas, and IDH1 mutation status accounts for the unfavorable prognostic effect of higher age: Implications for classification of gliomas. Acta Neuropathol, 2010,120(6):707-718.
[9] Ducray F, Marie Y, Sanson M. IDH1 and IDH2 mutations in gliomas. N Engl J Med, 2009,360(21):2248-2249.
[10] 罗秀萍,陈茂君,杨前美,等.不同病理类型及分级胶质瘤细胞IDH1基因突变临床研究.陕西医学杂志,2016,45(7):912-914.
[11] Rakheja D, Konoplev S, Medeiros LJ, et al. IDH mutations in acute myeloid leukemia. Hum Pathol, 2012,43(10):1541-1551.
[12] Pietrak B, Zhao H, Qi H, et al. A tale of two subunits: How the neomorphic R132H IDH1 mutation enhances production of αHG. Biochemistry, 2011,50(21):4804-4812.
[13] Dang L, White DW, Gross S, et al. Cancer-associated IDH1 mutations produce 2-hydroxyglutarate. Nature, 2009,462(7274):739-744.
[14] Rohle D, Popovici-Muller J, Palaskas N, et al. An inhibitor of mutant IDH1 delays growth and promotes differentiation of glioma cells. Science, 2013,340(6132):626-630.
[15] Papandreou I, Cairns RA, Fontana L, et al. HIF-1 mediates adaptation to hypoxia by actively downregulating mitochondrial oxygen consumption. Cell Metab, 2006,3(3):187-197.
[16] Kaur B, Khwaja FW, Severson EA, et al. Hypoxia and the hypoxia-inducible-factor pathway in glioma growth and angiogenesis. Neuro Oncol, 2005,7(2):134-153.
[17] Turcan S, Fabius AW, Borodovsky A, et al. Efficient induction of differentiation and growth inhibition in IDH1 mutant glioma cells by the DNMT Inhibitor Decitabine. Oncotarget, 2013,4(10):1729-1736.
[18] Borodovsky A, Salmasi V, Turcan S, et al. 5-azacytidine reduces methylation, promotes differentiation and induces tumor regression in a patient-derived IDH1 mutant glioma xenograft. Oncotarget, 2013,4(10):1737-1747.
[19] Guzmán-De-Villoria JA, Mateos-Pérez JM, Fernández-García P, et al. Added value of advanced over conventional magnetic resonance imaging in grading gliomas and other primary brain tumors. Cancer Imaging, 2014,14:35.
[20] Skogen K, Schulz A,Dormagen JB, et al. Diagnostic performance of texture analysis on MRI in grading cerebral gliomas. Eur J Radiol, 2016,85(4):824-829.
[21] Ideguchi M, Kajiwara K, Goto H, et al. MRI findings and pathological features in early-stage glioblastoma. J Neurooncol, 2015,123(2):289-297.
[22] Brynolfsson P, Nilsson D, Henriksson R, et al. ADC texture—an imaging biomarker for high-grade glioma? Med Phys, 2014,41(10):101903.
[23] Stadlbauer A, Zimmermann M, Kitzwogerer M, et al. MR imaging-derived oxygen metabolism and neovascularization characterization for grading and IDH gene mutation detection of gliomas. Radiology, 2017,283(3):799-809.
[24] Biller A, Badde S, Nagel A, et al. Improved brain tumor classification by sodium MR imaging: Prediction of IDH mutation status and tumor progression. AJNR Am J Neuroradiol, 2016,37(1):66-73.
[25] Metellus P, Coulibaly B, Colin C, et al. Absence of IDH mutation identifies a novel radiologic and molecular subtype of WHO grade Ⅱ gliomas with dismal prognosis. Acta Neuropathol, 2010,120(6):719-729.
[26] 张劲松,尚磊,叶菁,等.幕上IDH突变型低级别胶质瘤MRI特征与病理相关研究.中华神经外科疾病研究杂志,2016,15(2):140-143.
2017中国介入医学材料与工程学术论坛暨第四届中国糖尿病足细胞与介入治疗学术会议
由中国生物医学工程学会、上海市中国工程院院士咨询与学术活动中心、中国糖尿病足细胞与介入治疗技术联盟等主办,同济大学介入血管研究所、同济大学附属第十人民医院、《中国介入影像与治疗学》杂志等承办的“2017中国介入医学材料与工程学术论坛暨第四届中国糖尿病足细胞与介入治疗学术会议”,将于2017年11月17—19日在同济大学隆重举行。
大会邀请国内著名专家葛均波院士、孟安明院士及魏于全院士等,以及国内介入材料与工程、糖尿病血管病等相关专家进行主题报告,并围绕以下主题展开研讨:
①中国介入医学材料及工程技术的科学创新,新产品、新方法推广与临床应用;
②糖尿病足细胞与介入技术的临床转化及应用;
③介入医学材料与工程大数据研究及互联网应用;
④中国介入医学相关临床学科的合作、整合及创新。
本次会议为国家继续医学教育项目,授予国家级继续教育Ⅰ类学分10分,参会代表可登录大会官方网站(www.cimechina.com)进行信息注册(注册费400元)。欢迎广大医务工作者、专家学者积极参加!
联系方式:
联 系 人:刘芳
联系电话:17710452286 15330242286
电子邮箱:lhy_hyhz2014@126.com
传 真:010-59122368
《中国医学影像技术》期刊社
《中国介入影像与治疗学》编辑部
2017年9月6日
CurrentstatusofquantitativemultimodalityMRIfeaturesandIDHgenemutationingliomas
MEIDongdong,GONGJingshan*,LIUYongguang,FENGXia
(DepartmentofRadiology,ShenzhenPeople'sHospital,theSecondClinicalMedicalCollegeofJinanUniversity,Shenzhen518020,China)
The mutation of isocitrate dehydrogenase (IDH) gene is associated with gliomagenesis. It has also significant positive effects on survival and chemosensitivity in comparison with IDH wild-type glioma. Being an important energetic metabolism enzyme, mutation of IDH results in changes of microstructures and metabolism. Quantitative multimodality MR imaging has ability to obtain imaging biomarkers about microstructural, physiologic and functional information, which demonstrates the promises to assess IDH gene status in vivo. The progresses of association between quantitative multimodality MRI features and IDH genesmutations in glioma were reviewed in this paper.
Isocitrate dehydrogenase; Mutation; Gliomas; Magnetic resonance imaging
10.13929/j.1003-3289.201703090
R739.41; R445.2
A
1003-3289(2017)10-1550-04
梅东东(1990—),女,河南濮阳人,在读硕士。研究方向:神经系统影像诊断。E-mail: 704304956@qq.com
龚静山,暨南大学第二临床医学院 深圳市人民医院放射科,518020。E-mail: jshgong@sina.com
2017-03-17
2017-05-28
