丹顶鹤体内曲领棘缘吸虫的鉴定
2017-10-31王丽坤张莹崔宇超高俊峰侯美如杨淑萍
王丽坤 ,张莹 ,崔宇超 ,高俊峰 ,2,侯美如 ,杨淑萍
丹顶鹤体内曲领棘缘吸虫的鉴定
王丽坤1,张莹1,崔宇超1,高俊峰1,2,侯美如1,杨淑萍1
(1.黑龙江省兽医科学研究所,齐齐哈尔 161000;2.黑龙江八一农垦大学动物科技学院)
为了鉴定经吡喹酮治疗有拉稀症状的丹顶鹤排出的吸虫种类,应用形态学结合分子生物学方法对该吸虫进行虫种鉴定。结果显示:该虫体形态与文献中报道的曲领棘缘吸虫的形态一致;所分离的吸虫ITS rDNA序列全长为1 083 bp,通过与NCBI上其他棘口科吸虫的ITS序列进行比对,表明该虫体与Echinostoma trivolvis的同源性可高达93%,属于棘口属吸虫,得出虫体鉴定结果为曲领棘缘吸虫,为鱼媒介寄生虫的防治提供参考依据。
丹顶鹤;形态学;ITS序列;曲领棘缘吸虫
以淡水鱼为媒介的禽类寄生虫疾病多见于吸虫类寄生虫病。禽类因食入感染吸虫囊蚴的淡水鱼虾而感染,特别是以采食淡水鱼为食的水禽,感染更为普遍。扎龙自然保护区内存在大量的野生水禽,其中丹顶鹤是国家一级保护动物,丹顶鹤的生命健康关系到珍惜物种的延续和生态平衡,因此需要重点保护。在我国陈浩等曾经报道在江苏省盐城市国家级珍禽自然保护区的丹顶鹤感染东方次睾吸虫[1],梁金华等曾经报道在广东省肇庆市星湖湿地公园的丹顶鹤感染卷棘口吸虫[2],虽然有关于黑龙江淡水鱼感染多种吸虫的报道[3],但黑龙江省扎龙自然保护区丹顶鹤还没有吸虫感染的相关报道。因此,研究将对黑龙江省扎龙自然保护区的丹顶鹤感染吸虫疾病进行检测分析,为该自然保护区寄生虫疾病防控提供参考依据,也为保护珍禽丹顶鹤的健康生长和有序繁殖提供保障。
目前,鱼媒介寄生虫对水禽危害严重,然而禽类的鱼源性吸虫疾病还未引起足够的重视。鉴于此,试验以丹顶鹤体内排出的寄生虫为研究对象,观察其主要形态学特征,并采取PCR进行虫体分子生物学鉴定,为鱼媒介寄生虫的防治提供参考依据,也为鱼媒介感染禽类寄生虫虫种鉴别奠定基础。
1 材料与方法
1.1 虫体
虫体是在黑龙江省齐齐哈尔市扎龙自然保护区丹顶鹤粪样中所采集(图1)。用生理盐水将虫体冲洗干净,再将虫体放入盛有70%酒精溶液的容器中保存备用。

图1 曲领棘缘吸虫成虫Fig.1 The adults of Echinoparyphium recurvatum
1.2 主要试剂
德氏苏木素染液,酒精,酸酒精,二甲苯,加拿大树胶。PMD18-T载体。Ex Taq DNA聚合酶、DL2000 DNA Marker、dNTPs、限制性内切酶;组织 DNA 提取试剂盒(OMEGA公司);凝胶回收试剂盒、质粒小量制备试剂盒(康宁生命科学吴江有限公司)。
1.3 形态学鉴定
研究利用苏木素染色法[3]对该虫体进行染色制作吸虫压片,显微镜下观察其形态特征进行虫种鉴定。具体操作方法如下:
(1)将保存于乙醇溶液中的虫体取出后用流水冲洗。
(2)将蒸馏水加入德氏苏木素染液稀释10~15倍,使苏木素稀释液呈浓葡萄酒色。将保存于乙醇溶液中的虫体取出放在苏木素稀释液内,染色过夜。
(3)将染液后的虫体取出,放入蒸馏水中洗掉多余的染液,然后依次通过30%、50%和70%酒精各0.5~1 h。
(4)将虫体移入酸酒精中褪色,待虫体变成淡红色。
(5)将虫体置于80%酒精中,再依次通过90%和95%、100%酒精中各0.5~1 h。
(6)再将虫体由100%酒精中移入二甲苯中,透明 0.5~1 h。
(7)再将透明的虫体置于载玻片上,滴加加拿大树胶一滴,加载盖玻片封固,待干燥,即成,显微镜下观察。
1.4 分子生物学鉴定
1.4.1 DNA的提取
从采集的成虫中选取5条虫体样品,用蒸馏水冲洗干净后用研钵碾碎分别置于无菌离心管中。参照OMEGA公司提供的E.Z.N.A.TM Stool DNA Kit试剂盒说明书操作提取虫体DNA。
1.4.2 ITS序列的扩增及序列分析
棘口吸虫基因组DNA ITS序列的PCR扩增[4],扩增引物NC5/NC2: 上游引物 NC5:5’-GTA GGT GAA CCT GCG GAA GGA TCA TT-3’, 下游引物NC2:5’-TTA GTT TCT TTT CCT CCG CT-3’。反应采取25 μL体系,反应条件为94℃预变性10 min;进入循环:94℃变性1 min,50℃退火1 min,72℃延伸1.5 min,共30个循环;最后72℃延伸10 min。PCR产物用1%琼脂糖凝胶电泳进行检测。用DNA凝胶回收试剂盒(DNA Gel Extraction Kit)回收和纯化DNA。将样品送往上海生工生物工程技术服务有限公司,分别从正反链双向进行测序。测序拼接结果与NCBI数据库报道的其他吸虫ITS序列进行同源性进行比对分析。
2 结果
经过苏木素染色法染色的成虫虫体小而软薄,呈长叶形。头领发达,其上有45枚头棘,头棘前后两排相互排列,前排较小,后排较大。背棘前后排成两排,左右腹角棘各5枚,上列3枚,下列2枚(图2)。口吸盘位于体前端的亚腹面(图3),腹吸盘发达,位于虫体前部1/4处。睾丸2个,位于虫体后1/2处,呈长叶形或边缘有缺刻,前后排列,卵巢发达,近似圆形,卵黄腺自腹吸盘与卵巢之间开始分布,至虫体中央汇合伸至体末端。子宫不发达,内含少数虫卵。根据此虫体的形态特征,其与文献中报道的曲领棘缘吸虫的形态极为相似,因此在形态学上鉴定此虫体为曲领棘缘吸虫。
研究利用通用引物扩增5条成虫的rDNA ITS序列,产物经1%琼脂糖凝胶电泳,扩增的条带均出现在约1 000 bp的位置,与预期目的片段一致(图4),且无非特异性条带。经测序5条虫体的ITS序列完全一致,序列全长为1 083 bp。将扩增的ITS序列与NCBI上其他吸虫的ITS序列进行比对,结果表明该虫体与曲领棘缘吸虫(Echinoparyphium recurvatum)的同源性可高达99.3%,因此在分子水平上也确定研究的吸虫为曲领棘缘吸虫。
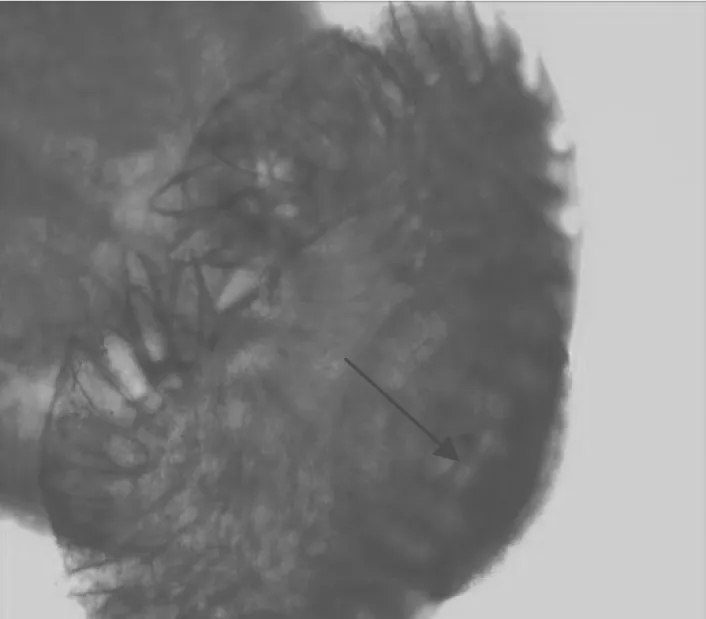
图2 曲领棘缘吸虫45枚头棘如箭头所示Fig.2 The spines of Echinoparyphium recurvatum
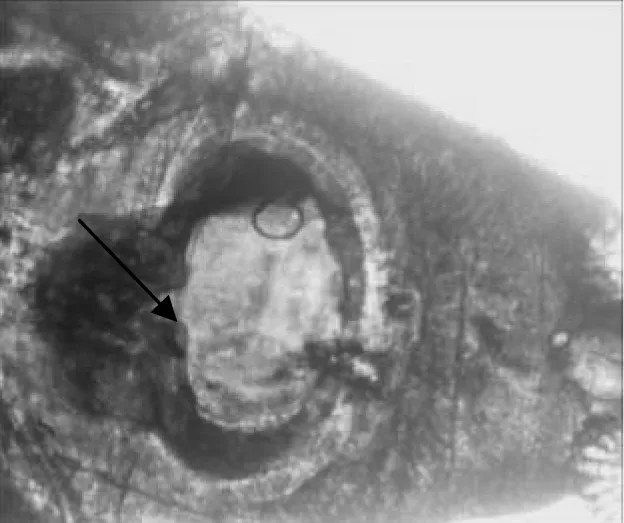
图3 曲领棘缘吸虫腹吸盘Fig.3 The ventral sucker of Echinoparyphium recurvatum
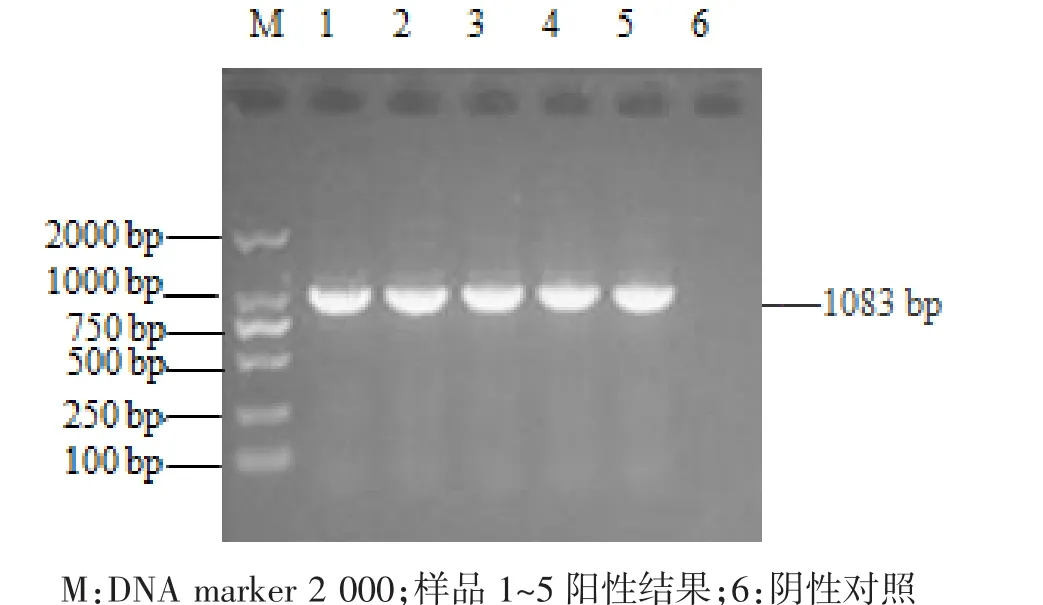
图4 ITS序列PCR扩增结果Fig.4 ITS sequence PCR amplification
3 讨论
形态学鉴定是传统的鉴定吸虫分类的方法,吸虫成虫的鉴定主要通过观察吸虫的大小形态、口腹吸盘的大小以及相对位置,口吸盘是否有棘,卵巢、子宫以及睾丸等形状和相对位置大小等。吸虫虫体形态特征不易直接观察,通过制作装片可以很清晰的观察虫体内部形态结构,可以有效的区别鉴定吸虫的种类。形态学鉴定是吸虫鉴定最直接常用的方法,但是由于虫体的形态特征易受环境、宿主等因素影响,使得形态学分类的准确性和可靠性受到一定的限制[5-7],例如一些同名异物的吸虫[9]。相比传统的形态学鉴定方法,分子生物学鉴定技术具有效率高、样品用量少、鉴定结果准确性高等优点。因此,分子生物学鉴定避免了应用形态学进行分类而引起的纷争,完善了传统分类学上的一些不足。目前,遗传标记基因rDNA ITS因其在种内变异很小,并且在种间差异很明显,已被广泛应用于物种的分类学研究。ITS序列在吸虫鉴定工作中占有重要作用,ITS序列在研究属内和关系较近的属间关系时是十分有价值的,尤其在近似种的区别中。近年来,ITS序列分析已广泛应用于吸虫科、亚科、族、属和种间系统学研究[8-9]。因此,研究采用了分子生物学鉴定和形态学鉴定结合的方法确保鉴定结果的准确性。
研究通过对驱虫所得的棘口科吸虫成虫进行形态学鉴定结合分子生物学鉴定,确定了本区域鱼媒介感染丹顶鹤的寄生虫种类为曲领棘缘吸虫。曲领棘缘吸虫的第二中间宿主为淡水鱼类,禽类因啄食第二中间宿主而感染其囊蚴,囊蚴在小肠内脱囊,逸出的幼虫在小肠内约7~9 d即可发育成熟、产卵。其成虫多在小肠上段寄生,虫体头部插入肠粘膜,引发肠道局部炎症病变,导致丹顶鹤食欲降低,生长迟缓等症状,给丹顶鹤的健康生长带来严重的影响,感染率高时还可造成鹤只全身衰竭甚至死亡。所以,研究的确切诊断,是有效治愈丹顶鹤吸虫疾病的关键所在,是保证丹顶鹤健康生长和有序繁殖的重要因素,并为有针对性的防控鱼媒介感染禽类寄生虫提供了有效的参考依据。研究的虫种鉴定更为棘口科吸虫基因库增添了新的数据,为今后寄生虫领域更深入的研究奠定了有利基础。
[1] 高志东,蔡中涛,陈浩,等.丹顶鹤东方次睾吸虫病的发现及治疗[M].北京:中国家禽,2004.
[2] 梁金华,冼永杰,兰伟强.丹顶鹤全群驱虫效果分析[J].广东畜牧兽医科技,2014,39(173):21-22.
[3] 段红,高俊峰,刘泽轩,等.四种三齿线虫核糖体ITS序列的比较分析及亲缘关系探讨[J].黑龙江八一农垦大学学报,2015,27(4):54-57.
[4] 王运宏,薄新文,孙延鸣,等.绦虫成虫制片方法的改进[J].中国兽医寄生虫病,2007,15(6):17-20.
[5] 牛庆丽,罗建勋,殷宏.转录间隔区(ITS)在寄生虫分子生物学分类中的应用及其进展[J].中国兽医寄生虫病,2008(1):41-47.
[6] 刘娟,李雍龙.DNA序列分析在吸虫种株基因差异研究方面的应用[J].国外医学寄生虫病分册,2004,31(3):108-111.
[7] Kinsella J M.Growth,development,and intraspecific variation of Quinqueserialis quinqueserialis(Trematoda:Notocotylidae)in rodent hosts[J].J Parasitol,1971,57(1):62-70.
[8] 杨健美,苑纯秀,冯新港,等.日本血吸虫感染不同相容性动物宿主的比较研究[J].中国人兽共患病学报,2012,28(12):1207-1211.
[9] 梁思婷,董辉,朱顺海,等.喜鹊和山斑鸠体内棘口科吸虫的种类鉴定[J].中国动物传染病学报,2015(4):44-52.
[10] 罗洪林,黄维义,许翠翠,等.分子分类结合形态学观察鉴定重庆地区片形吸虫种类[J].中国兽医寄生虫病,2007,15(4):7-11.
Identification of Echinoparyphium recurvatum in Grus japonensis
Wang Likun1,Zhang Ying1,Cui Yuchao1,Gao Junfeng1,2,Hou Meiru1,Yang Shuping1
(1.Dapartment of Parasitology,Heilongjiang Institute of Veterinary Science,Qiqihar 161000;2.College of Animal Science and Technology,Heilongjiang Bayi Agricultural University)
In order to identification the trematode species,which were collected from Grus japonensis with diarrhea,morphology and molecular biology method were carried out.Morphological identification results showed that the morphological characteristscs were consistent with Echinoparyphium recurvatum.Molecular identification showed,the length of ITS rDNA sequence was 1 083 bp long,Comparison ITS sequence of NCBI morphological,it displayed that the highest similarity rate was 93%with Echinoparyphium recurvatum,which belongs to Echinostoma members.Therefore,the trematode isolated from Grus japonensis was identified as Echinoparyphium recurvatum.The results provided a reference for the prevention of fish-born trematode.
Grus japonensis;Morphological;ITS sequences;Echinoparyphium recurvatumi
S852.7
A
1002-2090(2017)05-0037-03
10.3969/j.issn.1002-2090.2017.05.010
2017-04-05
王丽坤(1981-),女,高级兽医师,吉林农业大学毕业,现主要从事动物寄生虫病学方面的研究。
