酶处理豆粕替代鱼粉对断奶仔猪生长性能及肠道发育的影响
2017-10-23朱智超曹山川刘静波
欧 洋,朱智超,曹山川,谢 强,刘静波,4*
(1.西南科技大学生命科学与工程学院,四川绵阳621010;2.四川恒力通农牧科技股份有限公司,四川绵阳621010;3.四川省金核辐照技术有限公司;四川眉山620866;4. 四川省奉献农业有限公司,四川德阳618000)
酶处理豆粕替代鱼粉对断奶仔猪生长性能及肠道发育的影响
欧 洋1,2,朱智超3,曹山川1,谢 强2,刘静波1,4*
(1.西南科技大学生命科学与工程学院,四川绵阳621010;2.四川恒力通农牧科技股份有限公司,四川绵阳621010;3.四川省金核辐照技术有限公司;四川眉山620866;4. 四川省奉献农业有限公司,四川德阳618000)
本试验旨在研究酶处理豆粕(ESBM)替代不同比例鱼粉对断奶仔猪生长性能、肠道发育及后肠短链脂肪酸(SCFAs)产生的影响。选用21日龄杜×长×大断奶仔猪144头,分为4个处理,每个处理6个重复,每个重复6头猪。在4个处理组日粮中,分别用ESBM替代0(对照组)、33.3%、66.7%、100%的鱼粉。结果表明:ESBM替代不同比例鱼粉对断奶仔猪的养分表观消化率影响差异不显著(P>0.05);与对照组相比,33.3%、66.7%替代组断奶仔猪日采食量、日增重、空肠绒毛高度、隐窝深度无显著差异(P>0.05),但100%替代组断奶仔猪的日采食量及日增重显著降低(P<0.05),导致35日龄(-4.85%;)和42日龄(-6.62%)体重显著降低(P<0.05),空肠绒毛高度及隐窝深度显著下降(P<0.05);ESBM替代100%鱼粉显著降低断奶仔猪后肠食糜中乳酸杆菌数量(P<0.05),改变后肠微生物体外发酵回肠食靡产生SCFAs的能力及丙酸、丁酸比例。因此,ESBM可部分替代断奶仔猪日粮中鱼粉用量,全部替代鱼粉会引起肠道微生物的改变及SCFAs的产生,并影响断奶仔猪的生长性能。
酶处理豆粕;鱼粉;断奶仔猪;肠道发育
营养性腹泻导致断奶仔猪采食量下降、生长停滞、甚至死亡,原因主要在于饲粮中大豆抗原等抗营养因子会引起肠道损伤及肠道发育受阻[1]。在实际生产中,通过降低断奶仔猪饲粮中豆粕用量、增加鱼粉等抗营养因子含量较低的动物蛋白饲料以提高断奶仔猪的肠道健康[2]。但随着海洋资源紧张,寻求替代鱼粉的蛋白质饲料原料是当前畜牧生产者的重要工作之一。
通过豆粕深加工提高其营养价值逐渐成为替代鱼粉的关键手段[2]。目前通过膨化、发酵、热处理、醇溶浸提等方式可部分降低豆粕中胰蛋白酶抑制剂等抗营养因子的含量[3],但由于部分抗营养因子(如大豆抗原)分子量大,对热处理稳定,一般的加工方式不能完全将其去除[4]。通过酶处理豆粕(ESBM)不仅可以彻底消除豆粕中的抗原分子,而且可以降解大豆蛋白生成小肽,对仔猪的肠道健康具有积极意义,可替代饲粮中鱼粉甚至降低抗生素的用量[5]。尽管如此,鱼粉中含有促进动物生长及肠道健康的未知生长因子,ESBM能否完全替代断奶仔猪饲粮中的鱼粉尚不清楚,同时ESBM替代鱼粉后对肠道发育、肠道微生物组成及其代谢活动(如短链脂肪酸产生)的影响有待证实。因此,本研究重点考察ESBM替代不同比例的鱼粉对断奶仔猪生长性能、肠道发育及肠道微生物产生短链脂肪酸(SCFAs)能力的影响。
1 材料与方法
1.1 试验材料 ESBM由四川省奉献农业有限公司提供,其关键生产工艺如下:复合酶添加量为豆粕质量的1.0%,每克复合酶含果胶酶(10 000 IU/g)、纤维素酶(600 IU/g)、甘露聚糖酶(10 000 IU/g)、木聚糖酶(50 000 IU/g)、葡聚糖酶(50 000IU/g)、半乳聚糖酶(1 000 IU/g)、碱性蛋白酶(50 000IU/g)、中性蛋白酶(50 000 IU/g)、木瓜蛋白酶(100 000 IU/g),在温度为50℃、pH为7.0条件下处理8 h,低温烘干。为防止微生物在酶处理过程中发酵营养物质,因此对水源及豆粕实施10kGy钴60辐照处理。试验用豆粕与ESBM的营养组成见表1,其中干物质、粗蛋白、粗脂肪、粗纤维、钙、磷、脲酶活性检测参照国家标准,葡萄糖、蔗糖、水苏糖、棉子糖、氨基酸的检测采用高效液相色谱法(数据由四川省奉献农业有限公司提供),大豆球蛋白、β-伴球蛋白、胰蛋白酶抑制因子检测采用酶联免疫吸附法(试剂盒购于北京龙科方舟生物工程技术有限公司)。
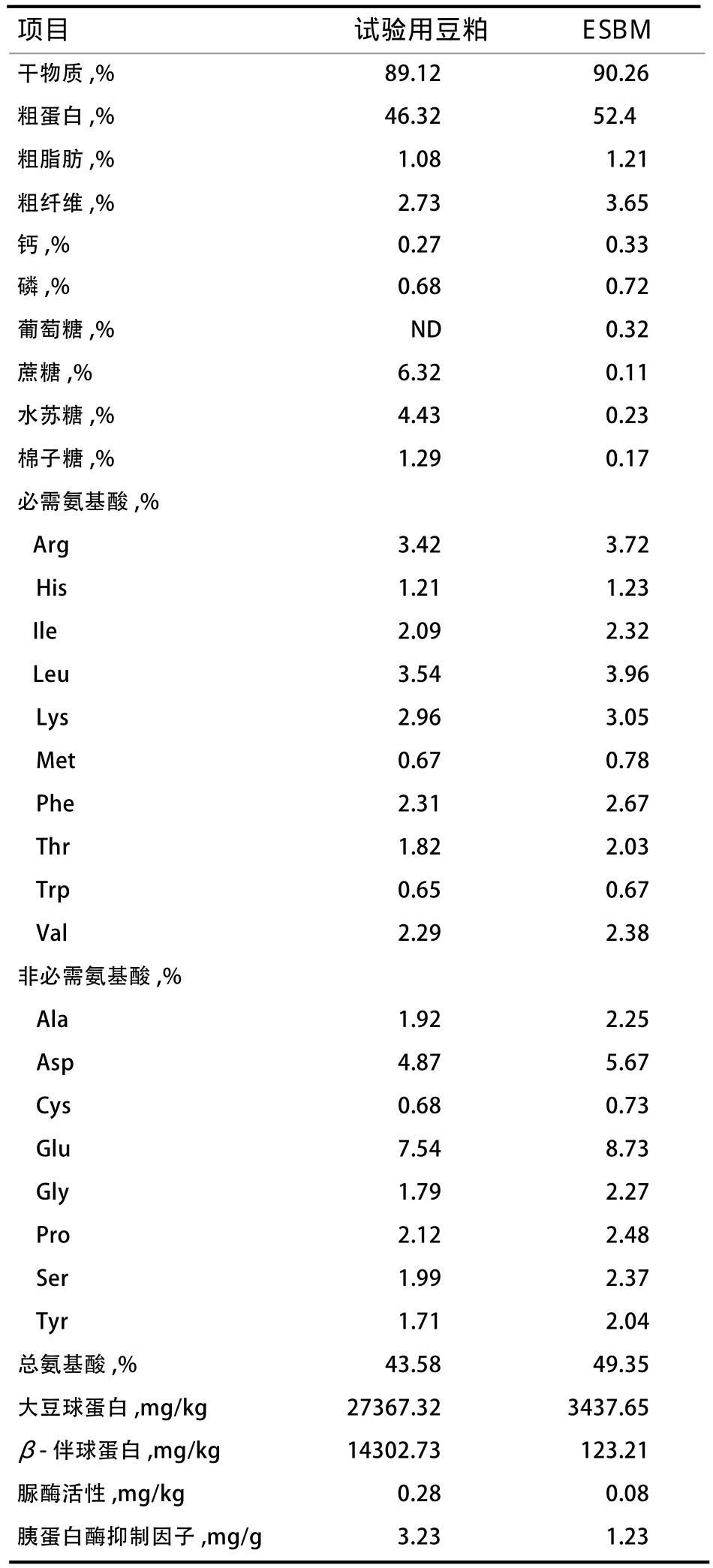
表1 试验用豆粕与ESBM的化学组分比例
1.2 试验动物及日粮 选用21日龄、体重相近的杜洛克×长白×大白(DLY)断奶仔猪144头,随机分为4个处理,每个处理6个重复,每个重复6头仔猪(公、母各半)。对照组日粮中含有7.5%鱼粉,使用ESBM等氮替代对照日粮中33.3%、66.7%、100%鱼粉。试验饲粮参考NRC(2012)7~11 kg仔猪营养需要进行配制,饲粮组成及营养成分见表1。为了防止抗生素干扰ESBM替代鱼粉效果,本次试验所使用配方均不添加抗生素。
1.3 饲养管理 试验在西南科技大学动物试验基地完成,试验期21 d,饲养管理方案按《西南科技大学试验基地饲养管理规程》进行。仔猪自由饮水及采食,断奶后0~7、7~14、14~21 d温度控制在26~28、24~26、22~24℃,湿度控制在50%~60%。
1.4 样品采集及指标测定
1.4.1 样品的收集 试验结束前3 d(40~42日龄),每个重复选择1头平均体重的仔猪,然后收集粪样(150 g/d)检测养分表观消化率。试验至42日龄时屠宰仔猪,收集空肠组织用于形态学检测,收集结肠食靡检测微生物活菌数量,收集空肠和结肠中段组织进行基因检测。
1.4.2 养分表观消化率测定 收集的粪样混匀后,加入10%盐酸进行固氮,低温烘干。以酸不溶灰分为内源指示剂,测定饲料粗蛋白、粗脂肪、粗灰分、钙、磷的表观消化率。
1.4.3 生长性能的测定 根据每周体重及采食量计算平均日增重(ADG)、每栏平均日采食量(ADFI)、耗料增重比(F/G)。
1.4.4 腹泻评分 每日07:30、12:30、17:00观察仔猪粪便情况并评分。以圈为单位,腹泻评分=受试仔猪粪便评分之和/3次/7d。评定标准见表3。
1.4.5 肠道形态学指标 选择2 cm空肠中部组织经4%多聚甲醛固定48 h,梯度酒精脱水,二甲苯透明,浸蜡包埋,切片(4 μm)处理后,再经过苏木精和伊红染色制成切片。组织切片利用Nikon倒置显微镜观察,并应用爱普图像处理分析软件测量小肠绒毛高度和隐窝深度,计算绒毛高度/隐窝深度。
1.4.6 肠道微生物活菌计数 取0.5 g 结肠食糜于无菌试管内,加4.5 mL无菌生理盐水,振荡5 min,4℃、800 r/min离心 15 min,取 100 μL上清液用加900 μL无菌生理盐水按10倍稀释,分别取10-3、10-4、10-5稀释梯度菌液20 μL接种到大肠杆菌选择培养基;同时抽取10-5、10-6、10-7稀释菌液20μL接种到双歧杆菌选择性培养基和乳酸杆菌选择性培养基上,每个梯度接种3个平板做重复。大肠杆菌37℃需氧培养48 h,双歧杆菌和乳酸杆菌37℃厌氧培养72 h后菌落计数,计算每克食糜中所含大肠杆菌、乳酸杆菌和双歧杆菌的活菌数量(CFU/g),结果以log(CFU/g)表示。
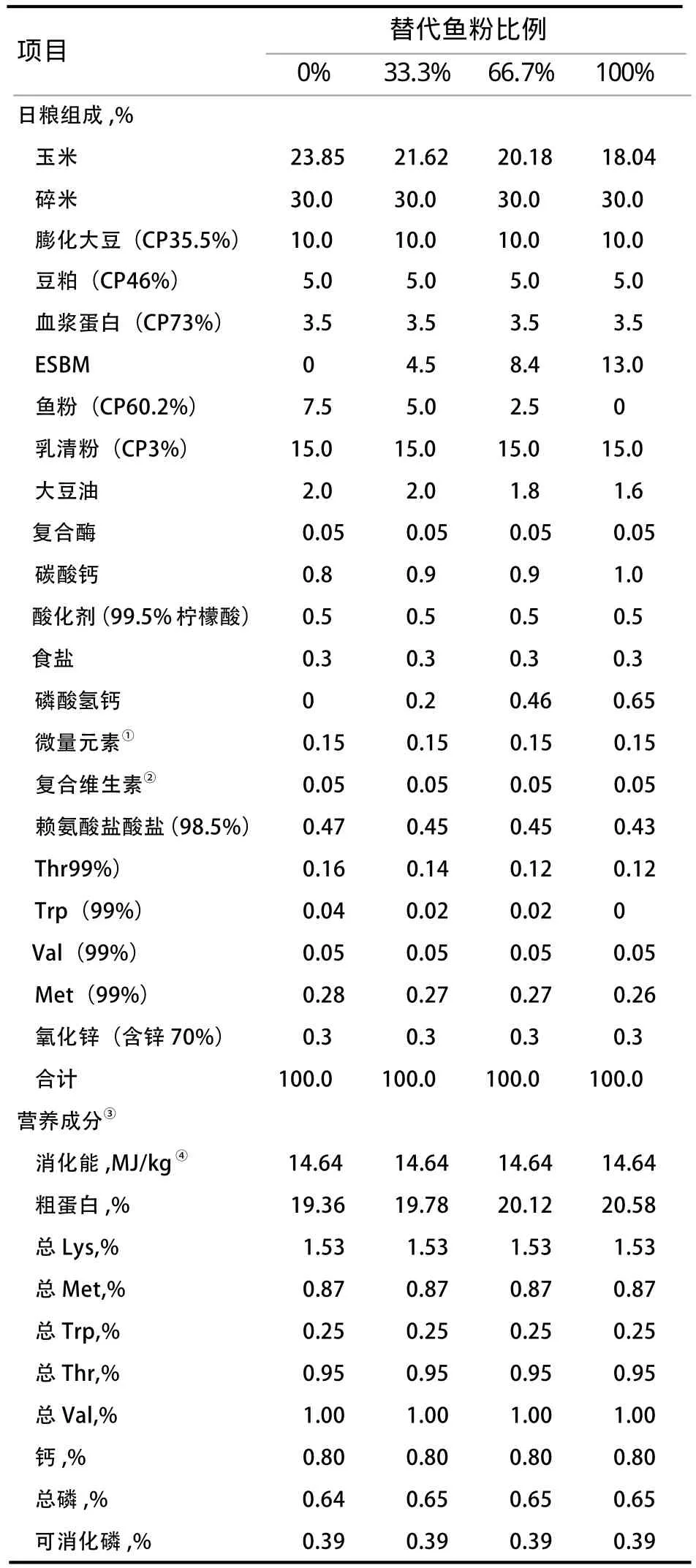
表2 试验饲粮配方

表3仔猪腹泻评分标准
1.4.7 后肠微生物 参考Iyayi等[6]的方法检测后肠(盲肠、结肠、直肠)微生物体外发酵产生SCFAs的能力:试验至42日龄时,每个重复选择1只平均体重的仔猪收集粪样,然后安装T-型瘘管,恢复2 d后连续3 d收集回肠末端食靡;粪样收集后加入0.1 mol/L磷酸盐缓冲液(1:5 wt:vol)匀浆,过滤后收集滤液;然后按1%比例发酵从受试猪只回肠末端收集的食靡,发酵结束后SCFAs产量根据气相色谱法检测。
1.4.8 基因表达选择 空肠组织和结肠组织检测基因p53、B 细胞淋巴瘤基因-2(BCL-2)、BAX(Bcl相关 X 蛋白)、SGLT1(钠葡萄糖共转运载体1)、GLUT2(葡萄糖转运载体2)、GPR41(G蛋白偶联受体41)、GPR43的转录表达。p53、BCL-2、BAX、SGLT1、GLUT2、18S RNA的 引物序列参考前期研究[7]。GPR41上游引物序列为ACTACTTCTCATCCTCGGGGTT,下游序列为CTCCACTTCGCTCTTCTTCAGT;GPR43上 游序列为TCATGGGTTTCGGCTTCTACAG,下游序列为GTACTGAACGATGAACACGACG。利用Trizol法提取RNA,使用1.0%琼脂糖凝胶电泳检测 RNA 的完整性,核酸蛋白仪上测定 260 nm和280 nm处的吸光度( OD 值)鉴定RNA纯度,在PCR仪(Bio-Rad,美国)上进行反转录,反应程序为37℃,15 min;85℃,5 s。反转录后得到的cDNA样品置于-20℃保存。Real-Time PCR体系的配制按照试剂盒(TaKaRa)说明书进行,在ABI 7900HT(Applied Biosystems,美国)上运行RT-PCR程序。结果通过2-ΔΔCT法计算,以18S RNA作为内参计算待测基因的相对表达量。
1.5 统计分析 数据采用SAS9.3 统计软件分析均符合正态分布并进行单因素方差分析,并用 Duncan's法进行多重比较,数据结果以P<0.05 为差异显著,P<0.10 为有趋势,结果用平均值±标准误表示。
2 结 果
2.1 ESBM替代鱼粉对断奶仔猪生长性能影响 由表4可见,与对照组相比,33.3%、66.7%替代组对断奶仔猪35、42日龄体重影响差异不显著(P> 0.05),但100%替代组仔猪在35、42日龄的体重显著降低(P< 0.05)。100%替代组仔猪在21~28、28~35日龄的ADG和ADFI均显著低于对照组(P<0.05),但其在21~42日龄的ADG、ADFI与其他3组无显著差异(P>0.05)。ESBM替代不同比例的鱼粉对整个饲喂阶段仔猪F/G影响差异不显著(P>0.05)。
2.2 ESBM替代鱼粉对断奶仔猪表观消化率影响 由表5可见,ESBM替代不同比例的鱼粉对断奶仔猪粗蛋白、粗脂肪、粗灰分、钙、磷的表观消化率均无显著影响(P>0.05)。
2.3 ESBM替代鱼粉对断奶仔猪粪便评分的影响 从表6可以看出,ESBM替代不同比例的鱼粉对断奶仔猪各阶段的粪便评分无显著影响(P> 0.05)。

表4 ESBM替代鱼粉对断奶仔猪生长性能的影响

表5 ESBM替代鱼粉对断奶仔猪养分表观消化率的影响 %
2.4 ESBM替代鱼粉对断奶仔猪空肠组织形态学的影响 从表7可以看出,与对照组相比,33.3%、66.7%替代组断奶仔猪的空肠组织绒毛高度和隐窝深度无显著差异(P>0.05),100%替代组绒毛高度及隐窝深度显著降低(P<0.05)。ESBM替代不同比例的鱼粉对断奶仔猪绒毛高度/隐窝深度影响差异不显著(P>0.05)。
2.5 ESBM替代鱼粉对断奶仔猪肠道微生物的影响从表8可以看出,与对照组相比,100%替代组仔猪乳酸杆菌的数量显著降低(P<0.05),但双歧杆菌、大肠杆菌的数量与其他3组差异不显著(P>0.05)。
2.6 ESBM替代鱼粉对断奶仔猪后肠微生物体外发酵产生SCFAs能力的影响 从表9可以看出,ESBM替代鱼粉显著影响断奶仔猪后肠微生物体外发酵产生SCFAs能力。100%替代组仔猪SCFAs的产量显著下降(P<0.05)。ESBM全部替代鱼粉提高了断奶仔猪后肠微生物体外发酵产生丙酸的比例(P<0.05),同时降低断奶仔猪后肠微生物体外发酵产生丁酸的比例(P<0.05),各处理组间乙酸产生的比例差异不显著(P>0.05)。
2.7 ESBM替代不同比例鱼粉对断奶仔猪空肠和结肠组织基因表达的影响 通过图1(A)可以看出,ESBM替代33.3%和66.7%鱼粉对断奶仔猪空肠组 织GLUT2、SGLT1、p53、BAX、BCL-2基 因mRNA表达影响差异不显著(P>0.05),但100%替代组仔猪GLUT2、SGLT1、BCL-1基因mRNA表达显著下调(P<0.05),p53基因mRNA表达显著上调(P<0.05)。通过图1(B)可以看出,ESBM替代不同水平的鱼粉对断奶仔猪结肠组织GPR41基因mRNA表达影响差异不显著(P>0.05),但100%替代组断奶仔猪结肠组织GPR43基因表达显著下调(P<0.05)。

表6 ESBM替代鱼粉对断奶仔猪粪便评分的影响
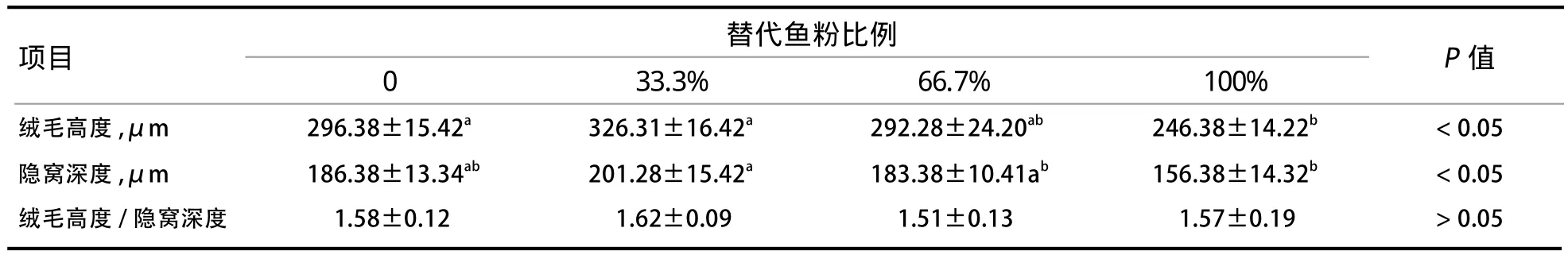
表7 ESBM替代鱼粉对断奶仔猪空肠组织形态学的影响

表8 ESBM替代鱼粉对断奶仔猪肠道微生物的影响 log10CFU/g
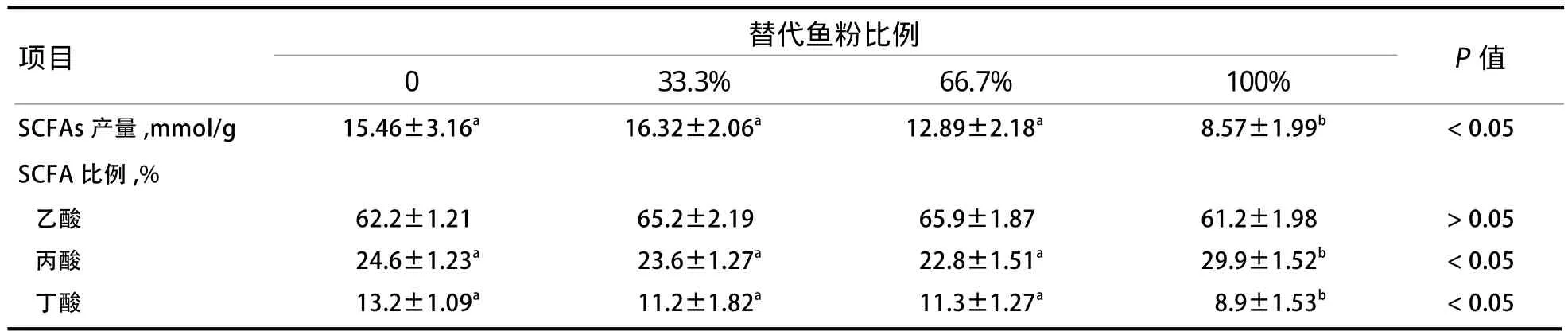
表9 ESBM替代鱼粉对断奶仔猪后肠微生物体外发酵产生SCFAs能力的影响

图1 ESBM替代不同比例鱼粉对断奶仔猪空肠和结肠组织基因表达的影响
3 讨 论
3.1 ESBM对豆粕营养组成及消化率的影响 通过深加工豆制品提高其营养价值是断奶仔猪饲料资源开发的研究热点[2-3]。大豆存在的多种抗营养因子干扰动物对养分的消化和吸收,通过浸提和热处理大豆粕的方式可部分降低豆制品中的抗营养因子[8-9]。大豆抗原主要包括大豆球蛋白(Glycinin)和β-伴球蛋白(β-conglycinin),是影响仔猪利用豆制品的主要抗营养因子,且对热处理十分稳定,可引起仔猪肠道组织过敏反应并诱导营养性腹泻[10]。在本试验中,通过复合ESBM之后,大豆球蛋白和β-伴球蛋白含量显著下降,可能是外源酶处理降解了豆粕中的大豆球蛋白和β-伴球蛋白。同时,ESBM导致非淀粉多糖、胰蛋白酶抑制因子等抗营养因子含量下降,说明其营养价值提高。通过分析ESBM替代鱼粉后的养分表观消化率,发现各处理组粗蛋白、粗脂肪、粗灰分、钙、磷的表观消化率差异不显著,该结果与前人研究相似[5],说明ESBM可提高豆粕消化率。由于消化率是影响断奶仔猪采食量和生长性能的主要限制性因素,因此ESBM具有替代断奶仔猪饲粮中鱼粉的基础。
3.2 ESBM替代不同比例鱼粉对断奶仔猪生长性能及肠道发育的影响 通过粪便评分看出,各处理组仔猪均未发生腹泻,说明本试验条件下ESBM不会引起仔猪营养性腹泻,与前人研究结果相似[2]。尽管如此,由于基础日粮中含有酸化剂、氧化锌等添加物有利于抑制肠道病原微生物增殖,因此ESBM在不同营养结构条件下替代鱼粉对断奶仔猪生长性能及腹泻指数的影响值得深入探讨。ESBM分别替代33.3%和66.7%的鱼粉时,对断奶仔猪生长性能的影响差异不显著;而全部替代鱼粉时,仔猪的ADG显著下降,其原因主要在于ESBM降低断奶仔猪的采食量。对ESBM与鱼粉对仔猪采食偏好影响的研究发现,仔猪采食鱼粉的频率显著高于ESBM,可能原因在于鱼粉中含有促进采食的未知因子[11],这可能是ESBM完全替代鱼粉之后断奶仔猪采食量下降的原因。由于断奶仔猪的采食量与肠道发育密切相关[7],因此本研究进一步检测了空肠组织的形态学。本研究结果发现,ESBM全部替代鱼粉时,空肠组织绒毛高度和隐窝深度都显著下降,与肠道吸收功能的关键基因如SGLT1、GLUT2、p53、BAX、BCL-2表达量显著下调,说明ESBM全部替代鱼粉后引起了肠道组织发育受阻。
3.3 ESBM替代不同比例鱼粉对断奶仔猪肠道微生物及SCFAs产生的影响 本研究进一步分析了肠道微生物及SCFAs产生的变化。通过细菌体外增殖试验发现,100%替代组仔猪乳酸杆菌的数量显著降低,但双歧杆菌、大肠杆菌无显著变化,与Jeong等[2]的研究结果不一致。Jeong等[2]的研究发现ESBM替代鱼粉会显著增加后肠乳酸杆菌的含量。由于豆粕中含有较高的非淀粉多糖含量,在后肠发酵可能有利于有益菌定植,因此酶处理工艺不同引起的非淀粉多糖含量差异可能是试验结果存在不一致的缘故。后肠微生物发酵产生SCFAs在断奶仔猪肠道发育中扮演重要角色[1],因此本研究进一步探究肠道微生物的改变是否会影响断奶仔猪后肠SCFAs的产生。本研究结果表明,ESBM全部替代鱼粉后显著降低了后肠微生物发酵回肠末端食靡产生SCFAs的能力。各处理间SCFAs产生总量不仅发生变化,乙酸、丙酸、丁酸的产生比例也发生明显改变。ESBM完全替代鱼粉后,丙酸的比例增加,而丁酸的比例下降。本研究中ESBM完全替代鱼粉后生长性能下降可能与后肠微生物发酵产生丁酸的能力下降有关[12-13]。同时,小鼠上的研究报道已经发现,丙酸能够通过结肠组织GPR41或GPR43调控机体的能量代谢及采食量,而丙酸是影响采食量最明显的SCFA[14]。通过RT-PCR的方法也发现GPR43表达量显著下降,说明ESBM替代鱼粉后采食量及生长性能下降的原因可能与断奶仔猪后肠SCFAs组成及GPR43表达有关。
4 结 论
综上研究表明,ESBM能够部分替代断奶仔猪饲粮中鱼粉;全部替代鱼粉会引起肠道微生物的改变及SCFAs的产生,进而抑制采食量并降低生长性能。
[1] Pluske J R. Invited review: Aspects of gastrointestinal tract growth and maturation in the pre- and postweaning period of pigs[J]. J Anim Sci, 2016, 94(Suppl3):399-411.
[2] Jeong J S, Kim I H. Comparative efficacy of up to 50%partial fish meal replacement with fermented soybean meal or enzymatically prepared soybean meal on growth performance, nutrient digestibility and fecal microflora in weaned pigs[J]. Anim Sci J, 2014, 86(6):624-633.
[3] Pangeni D, Jendza J A, Menon D R, et al. Effect of replacing conventional soybean meal with low oligosaccharide soybean meal fed to weanling piglets[J]. J Anim Sci, 2017, 95(1):320-326.
[4] Taliercio E, Kim S W. Epitopes from two soybean glycinin subunits are antigenic in pigs[J]. J Sci Food Agrc, 2013,93(12):2927-2932.
[5] Cervantes-Pahm S K, Stein H H. Ileal digestibility of amino acids in conventional, fermented, and enzymetreated soybean meal and in soy protein isolate, fish meal,and casein fed to weanling pigs[J]. J Anim Sci, 2010,88(8):2674-2683.
[6] Iyayi E A, Adeola O. Quantification of short-chain fatty acids and energy production from hindgut fermentation in cannulated pigs fed graded levels of wheat bran[J]. J Anim Sci, 2015, 93(10):4781-4787.
[7] Liu J, Liu Z, Gao L, et al. Nutrient-intake-leveldependent regulation of intestinal development in newborn intrauterine growth-restricted piglets via glucagon-like peptide-2[J]. Animal, 2016, 10(10):1645-1654.
[8] Qin G, Elstter E R, Bosch M W, et al. Thermal processing of whole soya beans: Studies on the inactivation of antinutritional factors and effects on ileal digestibility in piglets[J]. Anim Feed Sci Tech, 1996, 57(4):313-324.
[9] White C E, Campbell D R, McDowell L R. Effects of dry matter content on trypsin inhibitors and urease activity in heat treated soya beans fed to weaned piglets[J]. Anim Feed Sci Tech, 2000, 87(1-2):105-115.
[10] Sun P, Li D, Dong B, et al. Effects of soybean glycinin on performance and immune function in early weaned pigs[J].Arch Anim Nutr, 2008, 62(4):313-321.
[11] Solà-Oriol D, Roura E, Torrallardona D. Feed preference in pigs: effect of selected protein, fat, and fiber sources at different inclusion rates[J]. J Anim Sci, 2011, 89(10):3219-3227.
[12] Huang C, Song P, Fan P, et al. Dietary sodium butyrate decreases postweaning diarrhea by modulating intestinal permeability and changing the bacterial communities in weaned piglets[J]. J Nutr, 2015, 145(12):2774-2780.
[13] Zhou X L, Kong X F, Lian G Q, et al. Dietary supplementation with soybean oligosaccharides increases short-chain fatty acids but decreases protein-derived catabolites in the intestinal luminal content of weaned Huanjiang mini-piglets[J]. Nutr Res, 2014, 34(9):780-788.
[14] Ulven T. Short-chain free fatty acid receptors FFA2/GPR43 and FFA3/GPR41 as new potential therapeutic targets[J].Front Endocrinol, 2012, 3:111.
[15] Goebel K P, Stein H H. Phosphorus digestibility and energy concentration of enzyme-treated and conventional soybean meal fed to weanling pigs[J]. J Anim Sci, 2011, 89(3):764-772.
Effects of Replacing Fishmeal with Enzyme-treated Soybean Meal on Growth Performance and Intestinal Development in Weanling Piglets
OU Yang1,2, ZHU Zhi-chao3, CAO Shan-chuan1, XIE Qiang2, LIU Jing-bo1,4*
(1.School of Life Science and Engineering, Southwest University of Science and Technology, Sichuan Mianyang 621010,China; 2. Sichuan Henglitong Agricultural and Animal Husbandry Science and Technology Co., Ltd., Sichuan Mianyang 621010, China; 3.Sichuan Hinge Radiation Technical Co. Ltd., Sichuan Meishan 620866 ,China; 4.Sichuan Fengxian Agricultural Co., Ltd., Sichuan Deyang 618000, China)
The present study was conducted to investigate the effects of replacing fishmeal with enzyme-treated soybean meal (ESBM) on the growth performance, nutrient digestibility, intestinal development and production of short-chain fatty acid in weanling piglets. A total of 144 21-d-old Landrace×Yorkshire×Duroc weanling piglets were allocated into four treatment groups with 6 replicates of 6 piglets. Fish meal was replaced by ESBM at percentages of 0 (the control diet),33.3%, 66.7% and 100%, respectively, in 4 treatment groups. The apparent nutrient digestibility was not affected by replacing fishmeal with ESBM (P>0.05). Compared with control, replacing 33.3% or 66.7% did not affect the ADFI, ADG and intestinal development of piglets (P<0.05). But the ADFI, ADG, BW on d 35 and d 42, and the intestinal development were lower in piglets fed diet with replacing 100%(P<0.05). Moreover, the number of lactobacillus, the in vitro production of SCFAs and the composition of SCFAs were altered in piglets fed diets replacing 100% fishmeal with ESBM.Collectively, ESBM could partially replace the usage of fishmeal in weanling piglets, but total replacement of fishmeal with EBSM would negatively affect the growth performance of piglets possibly though the alternations of microbiota composition and SCFAs production.
Enzyme-treated soybean meal; Fishmeal; Weanling piglets; Intestinal development
S828.5
A
10.19556/j.0258-7033.2017-10-055
2017-04-09;
2017-05-04
德阳市科技支撑计划(2016NZ008);四川省教育厅资助科研项目(17ZA0413)
欧洋(1980-),男,重庆人,硕士研究生,主要从事猪的健康养殖研究,E-mail:29759889@qq.com
* 通讯作者:刘静波,博士,副研究员,E-mail:liuswust@163.com
