鲤IL-10锦鲤疱疹病毒核酸疫苗联合免疫效果的研究
2017-10-23祖岫杰康学会杨炳坤刘艳辉周井祥
于 慧, 王 好, 祖岫杰, 康学会, 杨炳坤, 刘艳辉, 周井祥
(1.吉林农业大学动物科学技术学院 , 吉林 长春 130118 ; 2.吉林省水产科学研究院 , 吉林 长春 130033)
鲤IL-10锦鲤疱疹病毒核酸疫苗联合免疫效果的研究
于 慧1, 王 好1, 祖岫杰2, 康学会2, 杨炳坤2, 刘艳辉2, 周井祥1
(1.吉林农业大学动物科学技术学院 , 吉林 长春 130118 ; 2.吉林省水产科学研究院 , 吉林 长春 130033)
本研究选用鲤IL-10,构建pEGFP-N1-IL-10真核表达质粒,分别进行体外细胞转染试验和免疫鱼的试验,证明了重组质粒在细胞中能成功表达,体内免疫试验ELISA结果显示,抗体水平会随着免疫次数、剂量的增加逐渐升高,三免后第1周的抗体水平最高,随后抗体水平逐渐下降。相比单一核酸疫苗pIRES-ORF81,pEGFP-N1-IL-10与核酸疫苗pIRES-ORF81联合免疫所产生抗体水平明显升高,但差异不显著(P>0.05)。
锦鲤疱疹病毒 ; 鲤白细胞介素10 ; 核酸疫苗pIRES-ORF81
锦鲤疱疹病毒病(Koi herpesvirus disease, KHVD)是能够使鲤(Cyprinuscarpio)、锦鲤(Cyprinuscarpiokoi)及其变种大量死亡的疾病,大面积暴发该病时,死亡率为80%~100%[1]。随着全球水产品贸易迅猛发展,该病在世界范围内肆意传播,难以控制,对鲤鱼养殖业构成严重威胁。目前国内外已经有一些预防锦鲤疱疹病毒病疫苗的相关报道,且具有一定效果。
1989年 Fiorentino 等[2]首次发现白细胞介素 10 (Interleukin-10,IL-10)。IL-10可以在很多细胞中产生, 如T 细胞亚群,单核细胞,巨噬细胞等。已获得多种哺乳动物的 IL-10 序列,以及非哺乳动物,禽类、鳗鱼、鳟鱼、河豚鱼等的IL-10 序列。目前认为 IL-10 具有多种免疫活性,它可以诱导外周耐受和免疫抑制,还在免疫调节中起关键作用。
本研究在核酸疫苗pIRES-ORF81作用的基础上,将构建的pEGFP-N1-IL-10真核表达质粒与该核酸疫苗联合,进行同时免疫,来探究鲤IL-10对于锦鲤疱疹病毒病发挥哪种免疫功能。
1 材料与方法
1.1 试验动物 150条250~300 g的健康鲤鱼数尾(购自长春双阳某渔场),平均体长18 cm,试验前在吉林农业大学动物科学技术学院养鱼室充氧的20 ℃水中饲养2周,研究中使用自然光周期。
1.2 主要试剂 多聚肌苷酸胞苷酸(PolyI:C),购自南京生利德生物技术有限公司; TRIZol®Reagent,购至Invitrogen;反转录试剂、T4 DNA连接酶等,购自TaKaRa公司;DNA凝胶回收试剂盒,购自AxyGen公司;L-15液体培养基、新生牛血清/胎牛血清,购自HyClone公司。
1.3 细胞、病毒与质粒 锦鲤疱疹病毒中国吉林株(KHV-CJ)由本实验室分离保存[3];框镜鲤尾鳍原代细胞由本实验室繁殖保存;核酸疫苗PpIRES-ORF81质粒由本实验室保存[4]。
1.4 引物的设计与合成 根据鲤IL-10 mRNA基因序列(GenBank上登录的),引物设计使用Primer Premiers 5.0软件,上游引物P1序列:5′-AAGCTTATGGTTTTCAGTGGAGTCATCCTTT-3′;下游引物P2序列:5′-GAATTCAATCACGAACGGAGAGAAACTAC-3′。划线部分依次为限制性酶切位点HindⅢ和EcoRⅠ,送上海生物工程技术服务有限公司合成引物。
1.5 IL-10基因的扩增、克隆及鉴定 试验前18 h对试验鱼进行胞苷酸(500 mg/鱼)注射,取新鲜鲤鱼头肾样品及脾脏使用液氮对进行其充分研磨使之成粉末状,利用TRIZol法提取RNA,并进行反转录反应,以上述反转录产物为模板,进行PCR反应,采用25 μL反应体系,反应条件如下: 94 ℃ 预变性5 min,94 ℃ 变性 30 s,58.1 ℃退火30 s, 72 ℃ 延伸 1 min,35 个循环,72 ℃ 10 min,反应结束 4 ℃ 保存。将回收的IL-10目的基因与pMD-18T克隆载体16 ℃连接过夜,将连接产物转入大肠杆菌感受态细胞DH5α中,经筛选鉴定后,将阳性质粒送上海生工生物工程技术服务有限公司测序。
1.6 IL-10基因的真核表达载体的构建及鉴定 对测序正确的质粒和pEGFP-N1质粒分别用HindⅢ和EcoRⅠ进行双酶切鉴定和回收, T4连接酶16 ℃连接过夜,将产物转化至感受态细胞DH5α中,筛选克隆菌落接种至含卡那霉素的培养基中,提取质粒进行PCR和酶切鉴定双重鉴定,选取阳性质粒命名为pEGFP-N1-IL-10。
1.7 重组质粒pEGFP-N1- IL-10在锦鲤鳍条细胞中的表达
1.7.1 重组质粒pEGFP-N1-IL-10的大量提取与纯化 将含有pEGFP-N1-IL-10质粒的菌液扩摇至对数生长期,进行质粒大提,方法参照AxyGen质粒大量提取与纯化说明书,使用分光光度计测定重组表达质粒在260 nm波长时的吸光值,根据重组表达质粒的浓度计算公式:质粒浓度(μg/μL)=OD260×稀释倍数×50 μg/mL。
1.7.2 重组质粒pEGFP-N1- IL-10的转染 用500 μL无血清培养基,分别稀释3 μg重组质粒pEGFP-N1-IL-10和9 μg EndoFectionTMMax转染试剂,充分混匀,室温孵育5 min。在六孔板中,加入混匀的DNA-EndoFectionTM复合物,8字混匀后放入26 ℃培养箱孵育。转染24 h后在荧光倒置显微镜下观察转染情况并采集图片。分别提取细胞(转染后)总RNA,方法与提组织RNA相似,再进行RT-PCR及PCR。
1.8 重组质粒pEGFP-N1- IL-10与核酸疫苗联合免疫鱼试验 免疫试验前,将鱼分6组,每组10尾,组1 灭菌的PBS;组2 空白对照组;组3 pIRES-ORF81;组4~6组pIRES-ORF81+pEGFP-N1-IL-10(剂量分别为1 μg、5 μg、15 μg);注射剂量为200 μL/尾,三次免疫间隔14 d。尾静脉采血于免疫前、一免及二免后第一、二周,三免后一到三周。收集血清,间接ELISA检测抗体水平
2 结果与分析
2.1 IL-10目的基因的扩增及鉴定 分别以提取的鲤鱼头肾RNA及脾脏RNA为模板,反转录为cDNA后,再分别以IL-10的P1,P2序列为引物,通过PCR扩增得到与预期大小一致的540 bp的目的片段,如图1。用限制性内切酶HindⅢ和EcoRⅠ对pMD18-T-IL-10阳性质粒(PCR鉴定)分别进行双酶切鉴定。结果显示,在540 bp位置均有条带,同时有一条2 000 bp以上条带。与预期相符,说明成功构建pMD18-T-IL-10,如图2。
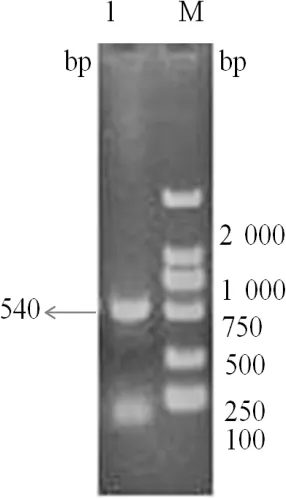
图1 IL-10 PCR扩增产物
M: DNA分子量标准; 1:PCR产物(IL-10)
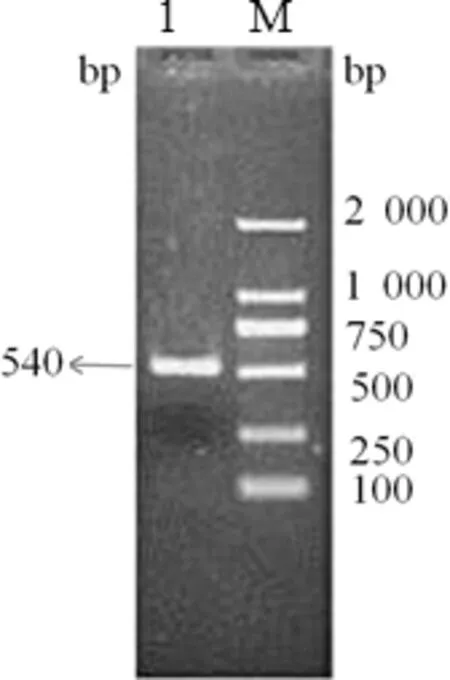
图2 双酶切鉴定pMD18-T-IL-10
M:DNA分子质量标准; 1:双酶切产物(pMD18-T-IL-10)
2.2 重组质粒pEGFP-N1-IL-10鉴定 分别用限制性内切酶HindⅢ和EcoRⅠ对PCR鉴定为阳性的重组质粒pEGFP-N1-IL-10进行双酶切。结果显示的目的片段大小与预期结果相符,在540 bp位置有条带,同时有1条片段大小为4 645 bp的载体条带。说明已经成功将IL-10基因克隆到pEGFP-N1真核表达载体上,如图3。
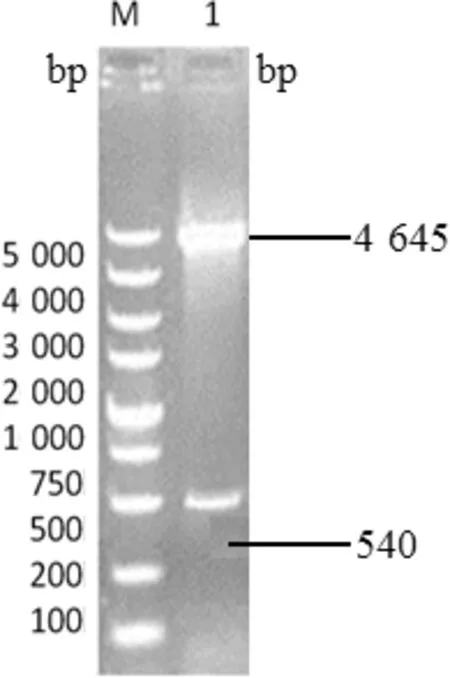
图3 酶切鉴定重组质粒pEGFP-N1-IL-10
M:DNA分子质量标准; 1:pEGFP-N1-IL-10酶切结果
2.3 重组表达质粒的转染 将重组质粒pEGFP-N1-IL-10转染至锦鲤鳍条细胞中,在倒置荧光显微镜下可观察到有质粒成功转入细胞(如中插彩版图4)。
2.4 RT-PCR检测真核表达质粒的转染情况 转染成功后的细胞用TRIZol裂解,提取细胞总RNA,RT-PCR,以cDNA作为模板,用P1,P2作为引物进行PCR检测。电泳后分别在位置540 bp处观察到目的条带,说明pEGFP-N1-IL-10已转染成功,如图5。
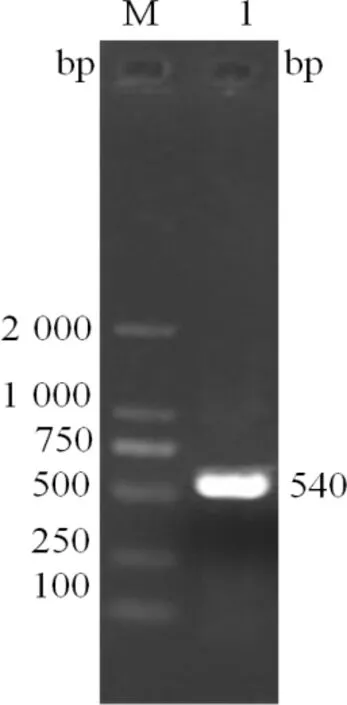
图5 IL-10基因的PCR扩增结果
M:DNA 分子质量标准; 1:IL-10PCR产物
2.5 鲤鱼血清中抗体水平ELISA检测结果 注射前要进行一次采血,再向不同试验组鲤鱼分别注射对应的免疫剂,一免及二免后第1周和第2周,三免后第1~3周,尾静脉采血。采用间接ELISA法检测注射免疫剂后鲤鱼血清中的抗体水平。通过平均数和标准差的计算,最终得出图中数据。图6为结果,依图所见,除了PBS组和空白组,其他各组鲤鱼血清中均能检测出KHV特异性抗体,免疫次数增多抗体水平随之增加。三免后1周,抗体水平达到峰值,之后趋于下降。增加质粒浓度抗体水平稍有增加,但不明显。PBS组和空白组这两组与注射重组质粒组的抗体水平差异显著(P<0.05)。混合制剂pEGFP-N1-IL-10+pIRES-ORF81,相比单一核酸疫苗pIRES-ORF81抗体水平有所升高,但差异不显著(P>0.05);

图6 不同剂量各组的血清抗体水平曲线
3 讨论
IL-10是多效细胞因子,具有免疫刺激、免疫抑制双重免疫调节活性。IL-10能够促进B细胞及天然杀伤性细胞的分化和增殖,促进单核细胞和巨噬细胞及肥大细胞集落[5]。在免疫反应中,IL-10能够平衡组织损伤及阻止病原入侵,在对抗病原体的过程中能够减轻炎症反应,保护组织免受过分的炎症反应损伤。因此该细胞因子具有一定的特殊性,目前,在许多哺乳动物上已经有过对 IL-10 的研究,但是对于低等脊椎动物 ,IL-10 的研究还很少。特别是关于鲤IL-10的报道十分有限[6]。冯祥汝等[7]通过研究IL-10 在鲤鱼不同组织部位中的表达情况证明了IL-10 参与鲤鱼的早期免疫反应。
Segal B等[8],证明了在某些情况下,IL-10通过先天性免疫和适应性免疫,也能够对恶性细胞的免疫反应产生积极作用。在接种抗癌疫苗之前给予 IL-10 能导致免疫抑制及肿瘤的形成,这与 IL-10 对 DC 的抑制作用一致。但是,在免疫接种之后注射 IL-10 能明显增强其抗肿瘤免疫效果。
并且,同时注射疫苗和 IL-10的动物体内经受过抗原刺激的 CTL水平明显高于只注射了疫苗的动物,表明IL-10 可以作为免疫佐剂维持 CTL 的水平。
本试验通过体外转染试验证明了构建的真核质粒pEGFP-N1-IL-10可在鲤鱼鳍条细胞中表达,采用pEGFP-N1-IL-10+pIRES-ORF81、联合免疫制剂对试验鱼进行免疫,结果表明,抗体水平随着免疫次数增多而有所增加,在三免后1周抗体水平趋于下降。3种剂量均获得很好的免疫效果,且低剂量的核酸疫苗就可获得较好的抗体水平。重组质粒浓度增加,抗体水平随之增加,结果是具有显著差异的,由此可见,针对锦鲤疱疹病毒病,相比单一核酸疫苗pIRES-ORF81,联合免疫制剂所产生的抗体水平更高,免疫效果更好,鲤IL-10可作为免疫佐剂以提高所接种疫苗的效果。
未来希望可以通过调控 IL-10 水平来调节免疫反应,但是由于该因子的特殊性,我们很难掌握免疫刺激和免疫抑制之间的平衡状态,因此调节该细胞因子也具有较高的风险,我们必须掌握好最佳IL-10 的剂量以达到预期的免疫效果。
[1] Taylor N G H, Dixon P F, Jeffery K R,etal. Koi herpesvirus: distribution and prospects for control in England and Wales[J]. Journal of Fish Diseases, 2010, 33(3):221-230.
[2] Fiorentino D F, Bond M W, Mosmann T R. Two types of mouse T helper cell. IV. Th2 clones secrete a factor that inhibits cytokine production by Th1 clones[J]. The Journal of experimental medicine, 1989, 170(6): 2081-2095.
[3] 朱霞, 李新伟, 王好,等. 一株锦鲤疱疹病毒的分离与鉴定[J]. 中国预防兽医学报, 2011, 33(5):340-343.
[4] 李新伟.锦鲤疱疹病毒ORF25、ORF81基因核酸疫苗的构建及免疫原性的研究[D].长春:吉林农业大学, 2012.
[5] Sabat R, Grutz G, Warszawska K,etal. Biology of interleukin-10[J]. Cytokine Growth Factor Rev, 2010, 21: 331-344.
[6] Wenjun, Ouyang, Sascha Rutz, Natasha K. Crellin,etal. Regulation and functions of the IL-10 family of cytokines in inflammation and disease[J]. Annual Review of Immunology, 2011, 29: 71-109.
[7] 冯祥汝,陈义龙,卢强.白细胞介素-10 的生物学功能及其在疾病中的作用研究进展[J].中国畜牧兽医, 2012,39(3):74-77.
[8] Segal B,Glass D,Shevach E.Cutting edge:IL-10-producing CD4+-T cells mediate tumor rejection[J].Immunol,2002,168:1-4.
征订启事
2017年本刊征订工作已结束,未在当地邮局(所)订到2017年本刊的读者,可直接从邮局汇款至本刊编辑部订阅。全年共12期,每期定价:16.00元,全年192.00元,不收邮费。欢迎订阅!编辑部地址:北京市海淀区圆明园西路2号、中国农业大学动物医学院,电话:010-62733040,邮编:100193。
《中国兽医杂志》编辑部
ImmuneeffectofcarpInterleukin-10andKoiHerpesvirusnucleicacidvaccinecombinedimmunization
YU Hui1, WANG Hao1, ZU Xiu-jie2, KANG Xue-hui2, YANG Bing-kun2, LIU Yan-hui2, ZHOU Jing-xiang1
(1.Institute of Animal Science and Technology of Jilin Agricultural University, Changchun 130118, China;2.Jilin Academy of Fishery Sciences, Changchun 130033, China)
The eukaryotic recombinant plasmid pEGFP-N1-IL-10 were constructed based on IL-10 mRNA. In vitro cell transfection experiment , proved that the recombinant plasmid was successfully expressed in cells .ELISA results showed that antibody levels increased gradually with the increase of number and dose of immunization, The highest antibody level was on the first week after three immune. Then the antibody levels gradually declined. Compared with the single nucleic acid vaccine pIRES-ORF81, antibody levels in fish immunized with the combination of pEGFP-N1-IL-10 and nucleic acid vaccine pIRES-ORF81 increased , but it was not significant (P> 0.05).
Koi herpes virus ; Carp interleukin 10 ; Nucleic acid vaccine pIRES- ORF81
s:ZHOU Jing-xiang ; LIU Yan-hui
S942.5
A
0529-6005(2017)08-0083-04
2016-08-01
国家现代农业产业技术体系建设项目(CARS-46-29);吉林省自然科学基金项目(20140101035JC)
于慧(1990-),女,硕士生,从事动物病毒分子学研究,E-mail:1150520227@qq.com
周井祥,E-mail:zhjxnd@126.com;刘艳辉,E-mail:liuyanhui9@163.com
