温度对鲤CYP2E1同工酶活性的影响
2017-10-20李在建操继跃
李在建, 操继跃
(1.聊城大学农学院,山东 聊城 252000;2. 华中农业大学动物医学院,湖北 武汉 430070)
温度对鲤CYP2E1同工酶活性的影响
李在建1, 操继跃2
(1.聊城大学农学院,山东 聊城 252000;2. 华中农业大学动物医学院,湖北 武汉 430070)
为了探究温度对鲤CYP2E1同工酶活性的影响,本试验以氯唑沙宗(CZX)为探针药物探究不同水温(5、10、15、20、25、30 ℃)对鲤CYP2E1同工酶活性的影响。结果表明,CYP2E1同工酶的Km值(以CZX作为探针)在反应温度为25 ℃时相对较低,其Vmax(以CZX作为探针)在该温度时相对较高;反应温度对CYP450酶活性的影响能够间接反映水温对鱼类体内药物代谢的影响;可以推断鱼类在不同水温条件下药物动力学参数的差异主要是由于其CYP450酶在不同温度下的活性差异所造成的。
温度;CYP450;鲤;CYP2E1同工酶
CYP450的体外研究方法排除了动物内部因素的干扰,探究CYP450对某种特异性底物的代谢,为动物机体内的代谢提供了重要的理论依据。大部分药物的代谢都是由CYP450酶介导的,CYP450酶含量相对较多的器官是肝脏,目前CYP450酶体外研究方法主要围绕肝脏展开。常用的方法有肝组织切片法、肝微粒体体外孵育法、肝脏亚细胞成分研究法、肝脏离体灌流法和重组代谢酶研究系统等。其中最常用的是肝微粒体体外孵育法[1]。外孵育法主要是让肝微粒体在体外条件下模拟动物机体生理反应, NADPH启动反应,三氯乙酸终止反应,测定孵育液中原型药物和代谢产物的浓度,并对代谢产物的特征进行鉴定。目前医药工作者主要采用此方法研究药物代谢产物的结构和药物的代谢途径,以及测定药物的酶促动力学参数(Km和Vmax),进而来预测药物之间的代谢差异。有研究者利用此方法来研究海洋药物971和911对CYP2E1的影响[2]。余露山等采用此法来研究依普黄酮的体外代谢情况[3]。此方法具有制备简便、重现性好等优点,因此,此法是研究药物代谢最常用的方法。然而此法仅用于体内代谢的预测,因为体内和体外代谢存在一定的差异。本试验以CZX作为探针探究不同水温(5、10、15、20、25、30 ℃)对鲤CYP2E1同工酶活性的影响。本试验目的在于为水产动物CYP450酶系的进一步研究以及指导水产动物合理用药提供理论基础。
1 材料与方法
1.1 实验动物
采用体重为(250±30) g的健康鲤,饲喂不添加抗菌药物的鲤鱼全价配合饲料并采用循环水养殖,适应性饲养1周。
1.2 主要试剂
NADPH, Roche公司产;CZX(含量98 %,批号:2289502500), Acros organics公司产;CZX 标准品(批号:100364-200301),中国药品监察所产;一氧化碳(CO),购于京华工业气体有限公司;其余试剂为国产化学试剂,分析纯AR。
1.3 主要仪器和设备
美国Agilent1100型高效液相色谱仪,美国Agilent公司;低温高速离心机、低温超速离心机,Beckman公司;紫外可见分光光度计,尤尼柯(上海)仪器有限公司;ALC-21002型电子天平,上海市精密科学仪器有限公司。
1.4 探针药物HPLC检测方法的建立
1.4.1 色谱条件 色谱柱:Agilent TC-C18柱 (150 mm×4.6 mm,5 μm);流动相:甲醇-乙腈-草酸铵(20 mmol/L)(35∶25∶40,v/v/v);紫外检测波长:280 nm; 流速:1.0 mL/min; 柱温:30 ℃;进样量:20 μl。
1.4.2 肝微粒体样品的处理 吸取200 μl肝微粒体孵育于15 mL离心管中,加入4 mL提取液涡旋振荡1 min,以5000 r/min离心5 min,取上层3 mL于另一15 mL离心管,在60 ℃水浴锅中氮气吹干。吹干后的残渣用120 μl甲醇溶解,6000 r/min离心,上清液过带注射器的微孔滤膜,取滤液20 μl进样。
1.4.3 孵育液中CZX标准工作曲线 向8支离心管中分别加入200 μl的空白体孵育液,然后依次加入适量的CZX,使CZX的浓度分别为0.5、1、2、5、10、50、100 和 200 μM。参照肝微粒体样品处理方法处理后,进样。以肝微粒体中CZX的峰面积(A)为横坐标,CZX在肝微粒体中的浓度(C)为纵坐标,制标准曲线。
1.5 肝微粒体体外孵育系统的建立
1.5.1 蛋白浓度的优化 50 μl肝微粒体、50 μl NADPH、50 μl Tris-HCl缓冲液,固定反应温度,加入50 μl CZX溶液(20 μM), 反应15 min加入冰冷的三氯乙酸(15 %)终止反应,取200 μl上清液处理样品。本次反应中鲤肝微粒体蛋白的浓度依次为0.025、0.05、0.1、0.3、0.4、0.5和1 mg/L,将CZX峰面积带入所建立的标准曲线,算出对应浓度,将蛋白浓度为横坐标,产物浓度为纵坐标绘图,确定出最佳反应浓度。
1.5.2 反应时间的优化 50 μl肝微粒体、50 μl NADPH、50 μl Tris-HCl孵育缓冲液,固定反应温度,加入50 μl CZX溶液(20 μM)并启动反应,分别在5、10、15、 20、30、40、60和 90 min加入冰冷的三氯乙酸(15 %),终止反应。将CZX峰面积带入标准曲线,计算出浓度,确定最佳反应时间。
1.5.3 利用酶促动力学原理求Vmax和Km值 在50 μl肝微粒体、50 μl NADPH、50 μl Tris-HCl孵育缓冲液分别加入0.625、1.25、2.5、5、10、20、30、40、60、80、100、120、150和200 μM的CZX分别在5、10、15、20、25、30 ℃启动反应,15 min后加入冰冷的三氯乙酸,终止反应,取200 μl上清液处理样品,每组3个重复。计算出不同底物浓度下CZX的反应速度并带入下面的方程。

绘制出此反应的Michaelies-Meten图与Eadie-Hosfetee图并计算Vmax和Km。酶动力学参数均采用Sigma Plot Enzyme Kinetics 1.10分析软件计算,统计学分析采用SPSS 11.5软件。
2 结果与分析
2.1 肝微粒体代谢体系的建立
由图1可知,在0.05~0.500 mg/mL肝微粒体浓度范围内,CZX的减少浓度与蛋白浓度具有良好的线性关系(Y=-13.865x+7.394,r=0.9979),在此范围内CZX的反应速度基本恒定,参照CYP450体外研究的指导原则[4-5],选定蛋白浓度为0.2 mg/mL。
由图2可知,在5~30 min反应时间范围内,CZX的减少浓度与反应时间具有良好的线性关系(Y=-0.2481x+8.372,r=0.9991),在此范围内CZX的反应速度基本恒定,参照CYP450体外研究的指导原则[4-5],选定体外反应时间为15 min。
2.2 反应温度对CYP2E1活性的影响
表1反映了不同底物浓度在不同温度条件下的反应速度,通过拟合可以看出CYP2E1同工酶在25 ℃条件下具较小的Km值和较大的Vmax(表2,图3),该酶在不同温度下的差异见图4~5。

图1 不同蛋白浓度对CZX代谢的影响Fig.1 The influence of different carp liver microsomes protein concentration on the metabolism of CZX.

图2 不同反应时间对CZX代谢的影响Fig.2 The influence of different reaction time on the metabolism of CZX
3 讨 论
鲤CYP2E1的Km值在温度为25 ℃时相对较低,其Vmax在25 ℃时相对较高。有学者曾经报道鱼类的消化酶受外界环境温度的影响差异显著[6]。丁方科(2006)在两种水温条件下研究二氟沙星在鲫鱼体内的代谢,其结果表明该药在鲫体内的CLb在冬季和夏季分别为0.015和0.056 L/(h·kg)[7];祝艳蕾(2009)报道了2种水温条件下麻保沙星在鲫鱼体内的药物动力学及残留,研究结果表明麻保沙星在鲫体内的CLb在冬季和夏季条件下分别为0.03和0.05 L/(h·kg)[8]。这些研究结果都表明鱼类在夏季体内药物代谢速率较冬季快,这与本结果相一致。

图3 CYP2E1同工酶在不同温度下的双倒数曲线Fig.3 The CYP2E1-like isoform Lineweaver-Burk maps at different temperature

表1 CZX 在不同浓度下的反应速度 (Mean±S.D., n=3)
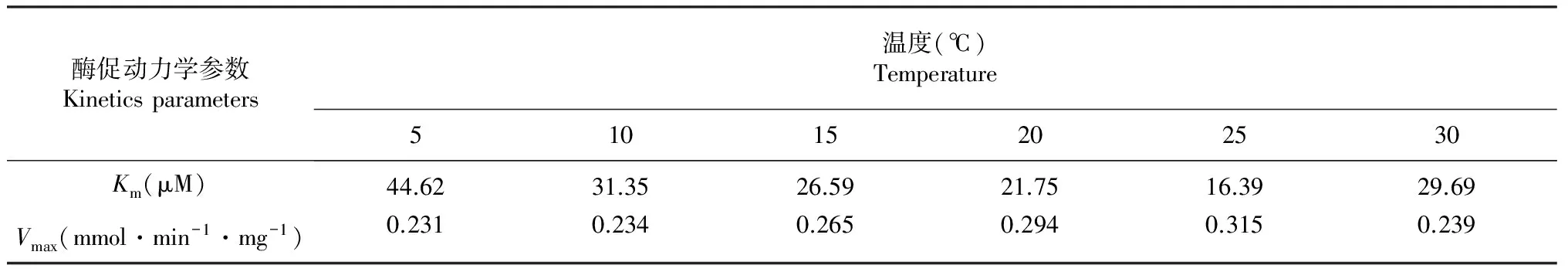
表2 CYP2E1同工酶在不同反应温度下的酶促动力学参数
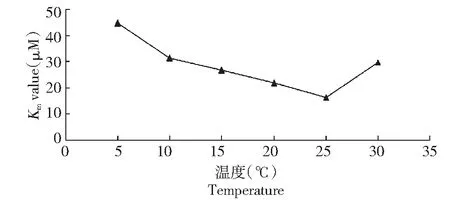
图4 Km 在不同反应温度下的比较Fig.4 The comparison of the Km value at different temperature
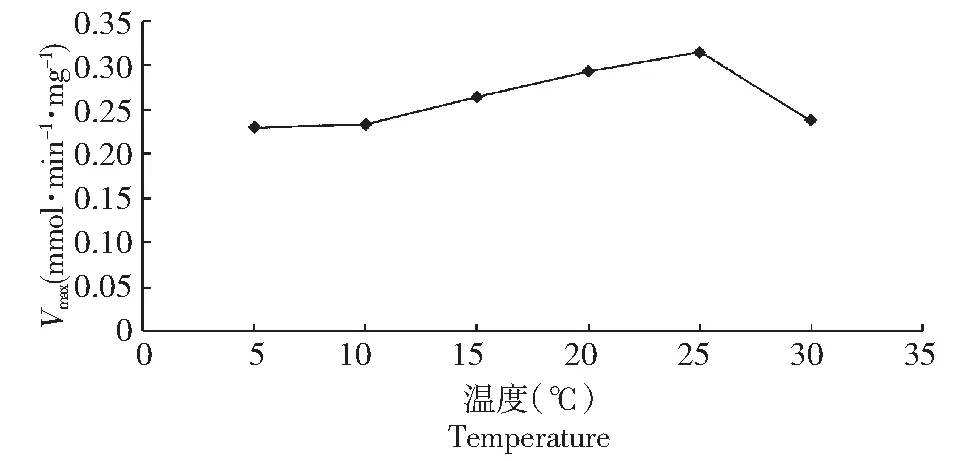
图5 Vmax 在不同反应温度下的比较Fig.5 The comparison of the Vmax at different temperature
4 结 论
体外反应温度对CYP450酶活性的影响能够间接反映不同季节水温对鱼类体内药物代谢的影响。由此可推断出鱼类在不同水温条件下药物代谢的差异主要是由于其肝脏内CYP450酶在不同反应温度下活性的差异所造成的。大量的研究表明酶分子骨架对酶的活性起着重要的作用[9-12]。反应温度有可能改变了鱼类肝脏CYP450酶的空间结构,进而导致不同反应水温条件下CYP450酶活性的差异。
[1]Breimer D D. Interindividual variations in drug disposition: Clinical implications and methods of investigation[J]. Clinical Pharmacokinetics, 1983, 8(5): 371-377.
[2]石 杰,庄安士,张雪玲.体外方法研究海洋药物911和971对大鼠CYP2E1的影响[J].中国海洋大学学报,2005, 35(3): 478-482.
[3]余露山,胡晓渝,姚彤炜.反相高效液相色谱法测定鼠肝微粒体中依普黄酮及其在代谢研究中的应用[J].中国现代应用药学杂志,2003, 20(6): 447-449.
[4]Yuan R, Madani S, Wei X X, et al. Evaluation of cytochrome P450 probe substrates commonly used by the pharmaceutical industry to study in vitro drug interactions[J]. Drug Metabolism and Disposition, 2002, 30(12): 1311-1319.
[5]Thorir D B, John T C, Heidi J E, et al. The conduct of in vitro and in vivo drug-drug interaction studies: A Pharmaceutical research and manufacturers of America (PhRMA) perspective[J]. Drug Metabolism and Disposition, 2003, 31(7): 819-825.
[6]Eustratio S P, Alastair R L. Effect of incubation temperature on carbohydrate digestion in important teleosts for aquaculture[J]. Aquac Res, 2005, 36: 1252-1264.
[7]Ding F K, Cao J Y, Ma L B, et al. Pharmacokinetics and tissue residues of difoxacin in crucian carp (Carassiusauratus) after oral administration[J]. Aquaculture, 2006, 256: 121-128.
[8]Yanlei Z H, Yeping T, Chunmei W, et al. Pharmacokinetics and tissue residues of marbofloxacin in crucian carp (Carassiusauratus) after oral administration[J]. Aquaculture Research, 2009, 40: 696-709.
[9]Fuhr U, Strobl G, Manaut F, et al. Quinolone antibacterial agents: relationship between structures and in vitro inhibition of the human cytochrome P450 isoform CYP1A2[J]. Mol Pharmacol, 1993, 43: 191-199.
[10]Fuhr U, Wolff T, Harder S, et al. Quinolone inhibition of cytochrome P450-dependent caffeine metabolism in human liver microsomes[J]. Drug Metb Dispos, 1990, 18: 1005-1010.
[11]Sarkar M, Polk R E, Guzelian P S, et al. In vitro effect of fluoroquinolones on theophylline metabolism in human liver microsomes[J]. Antimicrob Agents Chemother, 1990, 34: 594-599.
[12]Pollenz R S. The aryl-hydrocarbon receptor, but not the aryl-hydrocarbon receptor nuclear translocator protein, is rapidly depleted in hepatic and nonhepatic culture cells exposed to 2, 3, 7, 8-tetrachlorodibenzo-p-dioxin[J]. Mol Pharmacol, 1996, 49: 391-398.
(责任编辑 李 洁)
EffectofTemperatureonCarpCYP2E1-likeIsoformActivity
LI Zai-jian1, CAO Ji-yue2
(1.College of Agriculture, Liaocheng University, Shandong Liaocheng 252000, China; 2. College of Veterinary Medicine, Huazhong Agricultural University, Hubei Wuhan 430070, China)
To study the effect of temperature on carp CYP2E1, the influence of reaction temperature(5, 10, 15, 20, 25, 30 ℃) on the CYP2E1-like isoform activity was determined with Chorzoxazone (CZX) as substrate; The results revealed that the Michaelis constant (Km) value of CYP2E1-like isoform(with CZX as probe) was minimal and the maximum reaction velocity (Vmax) was maximal at 25 ℃ compared with those at other temperatures. The influence of reaction temperature on CYP450 activity could reflect the influence of water temperature on drug metabolism in fish indirectly; So the variations of fish pharmacokinetic parameters at different water temperatures could be due to the variation of CYP450 activity at different temperatures.
Temperature; CYP450; Carp; CYP2E1-like isoform
1001-4829(2017)3-0707-04
10.16213/j.cnki.scjas.2017.3.040
S859.7
A
2016-04-26
山东省自然科学基金(2016ZRB019RS);聊城大学博士启动基金(318051314)
李在建(1986-),男,山东青州人,博士,讲师,研究方向为兽医药理与毒理学,E-mail:lizj8603@163.com。
