靶向PIK3CA和AKT3基因RNA干扰对家兔SCs增殖的影响
2017-10-20王利娜贾先波陈仕毅赖松家
王利娜,贾先波,陈仕毅,王 杰,赖松家
(四川农业大学动物遗传育种研究所,四川 成都 611130)
靶向PIK3CA和AKT3基因RNA干扰对家兔SCs增殖的影响
王利娜,贾先波,陈仕毅,王 杰,赖松家*
(四川农业大学动物遗传育种研究所,四川 成都 611130)
PI3K与AKT组成的PI3K-AKT信号通路在细胞的增殖以及凋亡具有重要意义,本试验旨在研究该信号通路在家兔SCs增殖过程中发挥的作用。采用siRNA介导的PIK3CA和AKT3基因进行基因的沉默表达。结果发现对处于对数生长期的细胞转染si-PIK3CA-03或si-AKT3-01后48 h,分别对靶基因和上下游基因PTEN和FoxO1进行qRT-PCR反应,并采用CCK-8试剂盒通过酶标仪检测其在转染si-PIK3CA-03或si-AKT3-01后对细胞增殖能力的影响。结果表明:在转染si-PIK3CA-03后,PIK3CA和AKT3基因的相对表达量均显著下调,PTEN和FoxO1基因的表达量均显著上调;当转染了si-AKT3-01后,PTEN和FoxO1基因表达量均显著上调。表明PTEN、FoxO1基因与PIK3CA、AKT3基因的相对表达量呈负相关。转染实验组OD值显著低于空白对照组(P<0.05),说明通过转染实验下调PIK3CA和AKT3基因表达后,细胞增殖能力均有显著的下降。由此说明,分别抑制表达PIK3CA、AKT3基因后,靶基因的表达量显著下降,家兔SCs的增殖能力也显著下降,说明PIK3CA、AKT3基因能够正向调控肌细胞的增殖。
PIK3CA基因;AKT3基因;siRNA;SCs
作为原癌基因,3-磷酸肌醇激酶(phosphoinositide3-kinase, PI3K)家族成员参与多种信号通路[1],在细胞的生长、分化和细胞凋亡途径中起重要作用[2],从而影响细胞的数量和体积大小。然而目前有关探究该通路相关基因对骨骼肌生长发育作用的研究仍罕有报道。PI3K激活后在质膜上产生第二信使PIP3,PIP3与细胞内信号蛋白AKT的PH结构域结合,磷酸化AKT蛋白的308位苏氨酸,活化AKT蛋白。活化后的AKT通过磷酸化作用激活或抑制其下游靶蛋白[3],如Bad、Caspase-9、NF-κB、GSK-3、FKHR、p21Cip1,和p27Kip1等,进而起到调节细胞的增殖、分化、凋亡以及迁移等作用。PI3K-AKT信号通路对癌症细胞以及干细胞的存活和增殖具有显著的影响,例如采用LY294002特异性阻断PI3K信号通路后,会显著抑制人肝癌细胞(SMMC-7721)的增殖[4]。本试验首先分离家兔骨骼肌卫星细胞,再针对PI3K-AKT信号通路上的PIK3CA和AKT3基因,采用介导的靶基因沉默表达的方式研究其对家兔骨骼肌卫星细胞(skeletal muscle satellite cells,SCs)增殖的影响。家兔骨骼肌卫星细胞的分离和siRNA介导的靶基因沉默。
1 材料与方法
1.1 主要材料s
试验于2015 年3月至2016年2 月在四川农业大学动物遗传育种研究所进行。
实验动物:1日龄新生仔兔。
主要试剂:RNA提取试剂RNAiso plus(TaKaRa),实时荧光定量试剂盒SYBR Premix ExTaqTMⅡ(TaKaRa),HG-DMEM培养基(Gibco),胎牛血清(Gbico),马血清(Gbico), Percoll(Sigma)等。Desmin一抗和SABC试剂盒均购自武汉博士德生物技术有限公司。
引物:定量引物由北京六合华大基因科技有限公司合成,si-PIK3CA和si-AKT3序列由广州市锐博生物科技有限公司设计和合成。
1.2 兔SCs的培养
参照郑素月[5]的研究采用组织块培养法分离兔SCs细胞。取仔兔后腿肌肉组织,将其剪成1 mm3左右的碎块,以一定的密度接种在25 cm2培养瓶中,放于37 ℃,5 % CO2的培养箱中,直到SCs从组织块中游离出来并增殖到70 %~80 %后,进行消化,重悬细胞并采用Percoll密度梯度离心[6]对细胞进行纯化。
将配好的60 %和20 %密度梯度的Percoll液按从下到上的顺序依次缓慢轻盈的转入15 mL的离心管内,每层3 mL,已重悬好的细胞悬液轻轻注入最上层,500 r/min 离心25 min。收集60 %和20 % Percoll液之间的液体,离心重悬后培养。
1.3 免疫化学鉴定SCs
将细胞接种于10 mm×35 mm的细胞培养皿内,待密度占据培养皿面积的80 %左右时,倒掉培养液,PBS洗2次;按照武汉博士德公司SABC试剂盒的操作说明进行SCs细胞Desmin抗体的免疫组化染色。阴性对照用PBS代替一抗。DAB显色2~10 min,自来水冲洗;显微镜下观察照相。
1.4 诱导分化和HE染色
将细胞悬液接种在3.5 cm的培养皿中,加入生长培养基培养,增殖至铺满皿底70 %~80 %时,换用分化培养基。对不同分化阶段细胞采用HE染色。
倒掉培养基,PBS清洗两次;4 %多聚甲醛固定细胞30 min, PBS冲洗2次;0.5 %的盐酸乙醇分化液分化30 s;苏木精染液染色5 min,自来水清洗30 s;伊红染色20 s;增色液冲洗1~2次;用自来水冲洗,停止染色并去掉多余染料,显微镜下拍照。
1.5 siRNA合成及转染细胞
根据GeneBank中兔PIK3CA和AKT3基因全长cDNA序列,由广州市锐博生物科技有限公司设计并合成特异性siRNA,引物序列:si-PIK3CA上游引物-5’ GCUAUUGCGUUGCAACUUU dTdT 3’,下游引物-3’ dTdT CGAUAACGCAACGUUGAAA 5’;si-AKT3上游引物-5’ GGCAAGAUGUAUAUGAUAA dTdT 3’,下游引物-3’ dTdT CCGUUCUACAUAUACUAUU 5’。
选择对数期细胞进行转染实验,选取合适密度后接种在12孔板里,按照广州锐博公司的siRNA产品使用说明利用LipofectamineTM2000将浓度为50 nM的siRNA分别转染到SCs中。每个处理设3个对照,另外设置空白对照和siRNA阴性对照。
1.6 CCK-8试剂盒检测细胞的增殖
按照刘爱旗[7]的方法,采用CCK-8试剂盒在450 nm波长下,检测经过特异siRNA转染处理后SCs的增殖能力变化。将细胞接种96孔板,每个处理48孔。第2小时起每隔24 h计数细胞1次,每次计数6个复孔取平均值,连续8 d。根据结果绘制生长曲线。
1.7 荧光定量检测相关靶基因的相对表达量
应用实时定量PCR 技术,以GAPDH为内参,检测siRNA处理后靶基因和上下游相关基因的表达情况。数值采用2-ΔΔCt法定量分析,每个处理设3个对照,计算平均值。引物参数详见表1。
1.8 统计学分析
2 结果与分析
2.1 兔SCs免疫化学鉴定
利用Desmin抗体对收集并培养2 d的细胞进行免疫组化染色,结果显示Desmin呈阳性表达(图1),且阳性率高达90 %以上。细胞质呈棕褐色排列,细胞核被苏木素复染成淡蓝色;阴性对照组细胞,细胞质没被染色,而仅有细胞核被染成蓝色。
2.2 兔SCs分化过程中的形态学变化
经显微镜观察,发现刚分离获得的SCs的折光性强(图2),未贴壁时为圆形的亮点(图2A),随着培养时间的增加,细胞逐渐贴壁, SCs贴壁呈长梭形或纺锤形(图2B)。更换为含2 % HS的分化培养基后,细胞平行方向生长的趋势明显,分化第2天细胞开始出现融合(图2C)。分化第4天可观察到圆柱状的肌管。经HE染色后,胞质被染成红色,细胞核被染成淡蓝色(图2D)。

表1 荧光定量PCR引物信息

图1 SCs细胞Desmin抗体免疫鉴定(400×)Fig.1 Identification of SCs by Desmin antibody

图2 SCs的分化过程变化Fig.2 The differentiation process of SCs
2.3 转染si-PIK3CA和si-AKT3对靶基因的影响
分别转染浓度为50 nM的PIK3CA和AKT3基因siRNA进入SCs。与对照组相比,si-PIK3CA下调了细胞内PIK3CA基因的mRNA表达水平的85.16 %。si-AKT3下调了细胞内AKT3基因的mRNA表达水平的83.93 %。因此,合成的siRNA均可用于后续试验。
2.4 SCs生长曲线绘制
接种纯化兔SCs对数生长期细胞,进行为期8 d的CCK-8生长曲线测定试验(图3)。SCs纯化细胞在接种24 h后就开始进入对数生长期,之后细胞生长逐渐进入停滞期,群体倍增时间约为48 h。

图3 新生仔兔原代纯化SCs生长曲线Fig.3 The growth diagram of purified SCs
2.5 转染siRNA后SCs的增殖能力检测结果
对处于对数期的细胞转染siRNA后48 h,对SCs细胞进行增殖能力检测。与空白对照组相比,转染试剂组对细胞的OD值无显著影响;转染组OD值显著低于空白对照组(P<0.05)(图4),说明转染si-PIK3CA和 si-AKT3后,细胞增殖能力均显著下降。表明PIK3CA和AKT3被抑制表达后,骨骼肌卫星细胞的增殖能力会受到显著的抑制。
2.6 转染siRNA后上下游相关基因的相对表达量
在转染si-PIK3CA-03后(图5A),PIK3CA和AKT3基因的相对表达量均显著下调,PTEN和FoxO1基因的表达量均表现出显著上调;而当转染了si-AKT3-01后(图5B), 除了PTEN和FoxO1基因表达量显著提高外,为了激活更多AKT3的表达,PIK3CA基因的相对表达量也显著上调。
3 讨 论
Desmin是SCs细胞的一种特异性标记蛋白,可以用于骨骼肌卫星细胞的鉴别[8]。本试验采用免疫组化鉴定的方法鉴定经纯化的家兔SCs细胞中的Desmin蛋白。在显微镜下观察到细胞质呈棕褐色排列,细胞核被苏木素复染成淡蓝色,Desmin呈阳性表达。阴性对照组细胞,细胞质没被染色,而仅有细胞核被染成蓝色,表明试验所获得的细胞是纯度较高的SCs。
PTEN和FoxO1分别是PI3K-AKT信号通路最重要的上下游调控因子。PTEN是重要的肿瘤抑制基因,可调控PI3K-AKT信号通路及其下游靶标[9]。FoxO1是PTEN/AKT信号通路下游最重要的靶基因[10],参与了大量的生理进程,包括细胞分化、增殖、凋亡、迁徙及抗应激等。周诗琼和熊兵红[11-12]均发现PI3K与AKT蛋白阳性表达之间呈正相关(r=0.645,P<0.05),PTEN与PI3K蛋白阳性表达之间呈负相关(r=-0.354,P<0.05),PTEN与AKT蛋白阳性表达之间呈负相关(r=-0.365,P<0.05)。本试验中也发现在转染si-PIK3CA-03后,随着PIK3CA和AKT3基因的相对表达量的均显著下调,PTEN基因的表达量表现出显著上调,而当转染了si-AKT3-01后,PTEN基因的表达量也表现出显著的提高,说明PTEN的表达与PI3K-AKT信号通路的激活负相关,FoxO1基因的相对表达量均表现出上调,与PTEN基因的表达量趋势相一致。吕艳蓉[13]的研究也证明了细胞内PTEN蛋白水平下降会导致PI3K-AKT被过度激活,进而促进了下游FoxO家族分子的磷酸化,使其降解增加。说明FoxO1的表达可以受到PIK3CA、AKT3基因的负向调控[14],而与PTEN的表达量呈正相关[15]。
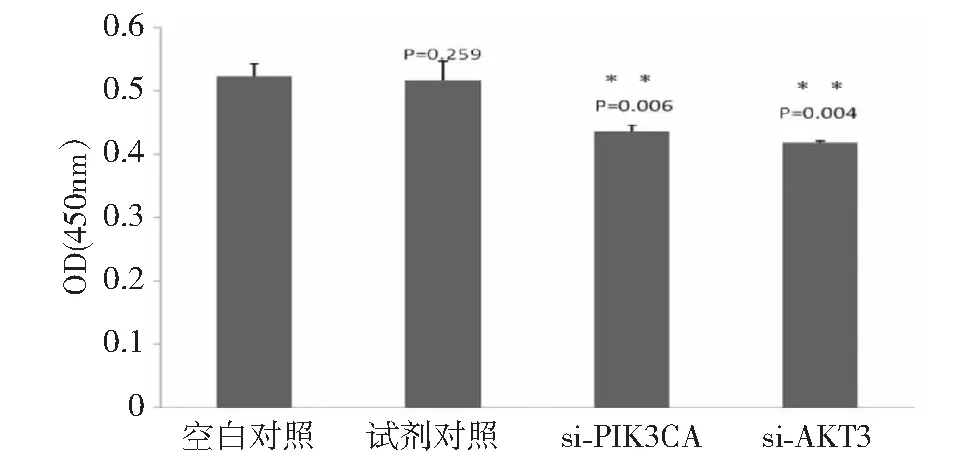
图4 不同处理组细胞OD值Fig.4 The OD values in black control and transfections
近年来,越来越多的研究表明了PI3K-AKT信号通路在细胞增殖、分化中的重要作用[16-18]。PI3K-AKT信号通路可以参与hMSCs增殖和分化过程[19],以WM(PI3K-AKT通路特异性抑制剂)阻断PI3K信号通路能延迟猪骨骼肌卫星细胞肌管的形成,并降低成肌分化标志基因MyoD、MyoG和MyHC的表达[20]。刘苏健[21]成功构建了2条兔AKT1 shRNA真核表达载体,研究靶向AKT1基因RNA干扰对胸主动脉平滑肌细胞增殖的影响,有效地抑制了平滑肌细胞增殖。笔者对处于对数期的家兔SCs转染相应PIK3CA、AKT3基因特异性siRNA后,发现与空白对照组相比,阴性对照组对细胞的OD值无显著影响;转染组OD值显著低于空白对照组(P<0.05)。说明通过转染si-PIK3CA-03和 si-AKT3-01,下调PIK3CA和AKT3基因表达后,细胞增殖能力均有显著的下降。说明PIK3CA和AKT3在SCs的增殖过程中起到重要的作用,能够正向调控肌细胞的发育。

图5 转染siRNA后基因相对表达量Fig.5 The relative mRNA expression after transfection of siRNA
4 结 论
分别抑制表达PIK3CA、AKT3基因后,靶基因的表达量显著下降,家兔SCs的增殖能力也显著下降,说明PIK3CA、AKT3基因会促进家兔SCs的增殖过程。从分子水平上阐释了PIK3CA和AKT3基因影响家兔生长过程的作用机理。
[1]Picard B, Lefaucheur LC, Duclos MJ. Muscle fibre ontogenesis in farm animal species[J]. Reproduction Nutrition Development, 2002,42:415-431.
[2]Osaki M, Oshimura M, Ito H. PI3K-Akt pathway: its functions and alterations in human cancer[J]. Apoptosis An International Journal on Programmed Cell Death, 2004(9):667-676.
[3]Gao N, Zhang Z, Jiang B H, et al. Role of PI3K/AKT/mTOR signaling in the cell cycle progression of human prostate cancer[J]. Biochemical & Biophysical Research Communications, 2003,310:1124-1132.
[4]傅 奕, 方征宇, 王丽影, 等. PI3K信号通路通过Skp2、p27调节肝癌细胞的增殖[J]. 生物化学与生物物理进展, 2008,35:1263-1269.
[5]郑素月, 樊宝良, 张庆桥. 蛋鸡骨骼肌卫星细胞分离培养及鉴定[J]. 中国畜牧兽医, 2011,38:80-83.
[6]Pertoft H. Fractionation of cells and subcellular particles with Percoll[J]. Journal of Biochemical & Biophysical Methods, 2000,44:1-30.
[7]刘爱旗, 夏 璐. CCK-8法与MTT法检测兔成纤维细胞活性的比较研究[J]. 中国医学创新, 2013:12-13.
[8]Goldfarb L G, Dalakas M C. Tragedy in a heartbeat: malfunctioning desmin causes skeletal and cardiac muscle disease[J]. Journal of Clinical Investigation, 2009,119:1806-1813.
[9]Stambolic V, Suzuki A, Pompa J L, et al. Negative regulation of PKB/Akt-dependent cell survival by the tumor suppressor PTEN[J]. Cell, 1998,95:29-39.
[10]Yong S, Li-Qing W, Quan-Yi G, et al. MicroRNA-196a overexpression promotes cell proliferation and inhibits cell apoptosis through PTEN/Akt/FOXO1 pathway[J]. International Journal of Clinical & Experimental Pathology, 2015(8):2461-2472.
[11]熊兵红. MiR-21通过PTEN/PI3K/AKT信号通路调控结直肠癌侵袭转移的机制研究[D]: 重庆医科大学, 2014.
[12]周诗琼, 陈洪雷, 姚 峰,等. PTEN、PI3K和Akt蛋白在胃癌组织中的表达及其临床意义[J]. 武汉大学学报:医学版, 2006,27:433-436.
[13]吕艳蓉. 抑癌蛋白PTEN的去泛素化酶鉴定及PTEN泛素化调控乳腺癌细胞凋亡的研究[D]: 山东大学, 2014.
[14]Sykes S, Lane S, Bullinger L, et al. AKT/FOXO Signaling Enforces Reversible Differentiation Blockade in Myeloid Leukemias[J]. Cell, 2011,146:697-708.
[15]Ryan C, Luis T U, Azad B, et al. A conserved PTEN/FOXO pathway regulates neuronal morphology during elegans development[J]. Development, 2011,138:5257-5267.
[16]Payne S N, Maher M E, Tran N H, et al. PIK3CA mutations can initiate pancreatic tumorigenesis and are targetable with PI3K inhibitors[J]. Oncogenesis, 2015:4.
[17]Song G, Ouyang G, Bao S. The activation of Akt/PKB signaling pathway and cell survival[J]. Journal of Cellular & Molecular Medicine, 2005(9):59-71.
[18]Steelman L S, Chappell W H, Abrams S L, et al. Roles of the Raf/MEK/ERK and PI3K/PTEN/Akt/mTOR pathways in controlling growth and sensitivity to therapy-implications for cancer and aging[J]. Aging, 2011(3):192-222.
[19]王雪鹏, 李茂强, 边振宇, 等. PI3K/Akt信号通路在骨髓间充质干细胞增殖及成骨分化调控中的作用[J]. 中华骨质疏松和骨矿盐疾病杂志, 2014(1):250-257.
[20]史新娥, 吴国芳, 宋子仪, 等. 阻断PI3K/AKT通路通过激活FoxO1抑制猪骨骼肌卫星细胞分化[J]. 中国农业科学, 2014,47:154-160.
[21]刘苏健, 范 波, 丁明超,等. 靶向Akt1基因RNA干扰对胸主动脉平滑肌细胞增殖的影响[J]. 河北医药, 2014(3):2725-2727.
(责任编辑 李 洁)
EffectofsiRNA-mediatedSilencingofPIK3CAandAKT3GenesonProliferationofRabbitSCs
WANG Li-na, JIA Xian-bo, CHEN Shi-yi, WANG Jie, LAI Song-jia*
(Institute of Animal Genetics and Breeding, Sichuan Agricultural University, Sichuan Chengdu 611130, China)
PI3K-AKT signaling pathway plays an important role in cell growth and survival in a variety of tissues. In the present study,the effect of siRNA-mediated silencing ofPIK3CAandAKT3 genes on cell proliferation in rabbit SCs were detected. Transfecting the SCs with either si-PIK3CA-03 or si-AKT3-01, then did the qRT-PCR reaction 48 h later to detect the relative expression level ofPIK3CA,AKT3, PTENandFoxO1. Then detect the OD level of SCs in microplate reader with CCK-8 knit after transfection. The results showed that the expression level ofPIK3CAandAKT3 were significantly lower after transfection while the expression level of PTEN and FoxO1 were significantly higher compared with the black group. It indicated that there were negative correlation between the expression level ofPIK3CA/AKT3 andPTEN/FoxO1. The OD of the experimental group was significantly lower than the black group (P<0.05). It explained that,with the reduction ofPIK3CAandAKT3, the proliferation rate of SCs declined as well. SoPIK3CAandAKT3 genes could play an key role in proliferation of SCs.
PIK3CA;AKT3; siRNA; SCs
1001-4829(2017)3-0702-05
10.16213/j.cnki.scjas.2017.3.039
S829.1
A
2016-04-20
国家兔产业技术体系建设( CARS-44-A-2)
王利娜,女,河南济源人,硕士研究生,E-mail:lenasmiling@hotmail.com, *为通讯作者:赖松家,教授,生物技术与兔遗传育种,E-mail: laisj5794@gmail.com。
