不同初加工滇龙胆HPLC指纹图谱及其有效成分含量测定
2017-10-20左智天王元忠赵艳丽王家金
左智天,王元忠,张 霁,赵艳丽,王家金 *
(1. 云南省农业科学院药用植物研究所,云南 昆明 650205;2. 云南省省级中药原料质量监测技术服务中心,云南 昆明 650200)
不同初加工滇龙胆HPLC指纹图谱及其有效成分含量测定
左智天1,2,王元忠1,2,张 霁1,2,赵艳丽1,2,王家金1,2 *
(1. 云南省农业科学院药用植物研究所,云南 昆明 650205;2. 云南省省级中药原料质量监测技术服务中心,云南 昆明 650200)
建立不同初加工方法滇龙胆(Gentianarigescens)样品的高效液相色谱(HPLC)指纹图谱,并测定其中马钱苷酸、獐芽菜苦苷、龙胆苦苷和当药苷4种有效成分含量,结合化学计量学方法对4种有效成分含量测定结果进行主成分分析(Principal Component Analysis, PCA),对9种初加工方法进行评价。结果显示,样品间相似度高于0.960。经水洗净后室内通风干燥处理的滇龙胆中獐牙菜苦苷、龙胆苦苷、当药苷含量最高,分别为(5.89±0.23)、(15.62±0.84)和(3.79±0.16)mg/g,微波带皮处理的滇龙胆中马钱苷酸含量最高,为(8.58±1.48)mg/g,4种有效成分总含量达到(27.67±6.09)mg/g。主成分分析结果显示,前2个主成分累积贡献率为86.822 %,与4种有效成分的线性关系为F(PC1)=-0.003X1+0.409X2+0.31X3+0.398X4,F(PC2)=0.875X1-0.168X2+0.329X3-0.078X4;计算不同初加工滇龙胆的主成分综合得分排名,带皮水洗后室内通风干燥滇龙胆综合得分最高。不同初加工处理对滇龙胆有效成分的含量会产生影响,其中带皮水洗后通风干燥的传统初加工方法对滇龙胆品质影响最小,是理想的初加工方法。
初加工;中药指纹图谱;主成分分析;滇龙胆
传统中药的加工炮制技术在不同程度上影响原材料中有效成分含量及相关生物代谢产物的转化[1],关系到临床用药的安全性及中成药质量的稳定性[2-3]。对中药材进行初加工有利于后续干燥,方便其储存与运输,从而达到防腐、防霉、防虫蛀等目的,在整个炮制过程中具有重要作用[4]。近年来国内用药需求不断增大,药材的内在品质受到普遍关注,由于人为因素造成的药材质量不稳定,尤其加工炮制的粗放导致药品市场鱼龙混杂,故对药材加工炮制技术的规范和评价显得尤为重要[5]。目前,国内对不同加工炮制的传统中药一般多采用光谱法、色谱法测定其有效成分含量,或结合指纹图谱法进行综合评价[6]。
中药指纹图谱技术(Traditional chinese medicine fingerprints,TCMF)出现于20世纪70年代,该技术可针对中药成分的复杂性从整体上表征中药的内在品质,满足国际社会对于药品“安全、有效、可控、稳定”的基本要求,是国际公认的中成药质量控制方法[7]。美国食品药品管理局(FDA)、德国药用植物学会、英国草药典、印度草药典、加拿大药用及芳香植物学会等接受指纹图谱技术并将其纳入质量标准的一部分,该技术的国际地位得到显著提高[8]。作为一种综合的、可量化的中药质量控制手段,中药指纹图谱的唯一性、全息性能够对中药材的真伪、优劣、产地、药用部位进行有效鉴别,中药指纹图谱技术已成为中国传统中药走向现代化、国际化不可或缺的重要因素[9-10]。化学计量学(Chemometrics)是在化学测量过程中所使用的某种特定数学方法或统计学方法与数据交互关系的科学,常用的分析方法有主成分分析(Principal component analysis, PCA)、平行因子分析(Parallel factor analysis, PARAFAC)、秩消因子分析(Rank annihilation factor analysis, RAFA)、渐进因子分析(Evolving factor analysis, EFA)、偏最小二乘判别分析(Partial least squares discriminant analysis, PLS-DA)等[11]。相较于单一指标含量的测定,化学计量学可对量化和整合后的色谱或光谱数据做出多元统计分析,评价药物质量更具代表性[12-13]。以化学计量学为“纽带”,用中药指纹图谱技术与含量测定相结合的方法对药物进行评价可更加全面阐释其品质好坏[14-15]。
滇龙胆(Gentianarigescens)为龙胆科(Gentianaceae)龙胆属(Gentiana)多年生草本植物,性寒,味苦,归肝、胆经,清热燥湿,泻肝胆火[16-17],其主要有效成分为龙胆苦苷、獐牙菜苦苷、当药苷等[18]。滇龙胆作为云南地区的道地药材,其内在品质受到关注,但药典或有关论著对其具体炮制加工方法的描述或记载报道较少[19]。本研究旨在建立不同初加工滇龙胆样品的高效液相色谱(HPLC)指纹图谱,测定马钱苷酸、龙胆苦苷、獐牙菜苦苷和当药苷4种主要有效成分含量,采用主成分分析处理含量测定结果,对滇龙胆的初加工技术进行评价。
1 材料与方法
1.1 药材
供试样品采收自云南省云县,经云南省农业科学院药用植物研究所金航研究员鉴定为龙胆科(Gentianaceae)植物滇龙胆草(GentianarigescensFranch.),凭证标本保存在云南省农业科学院药用植物研究所标本室。样品经不同方式初加工后粉碎过60目筛,置自封袋内备用。
1.2 仪器
HPLC-10高效液相色谱仪(日本岛津公司,含HPLC-10ATVP泵,7725i手动进样器, SPD-M10A VP二级管阵列检测器,190~800 nm),SY3200-T型超声波清洗仪(上海声源超声波仪器设备有限公司),万分之一电子分析天平(美国奥豪斯公司),FW-100型高速万能粉碎机(天津市华鑫仪器厂),CS101型电热鼓风干燥箱(浙江余姚温度仪表四厂)。
1.3 试剂
对照品马钱苷酸、龙胆苦苷、獐牙菜苦苷、当药苷均购自中国食品药品检定研究院(批号分别为111865-201403,110770-201313,10785-201203,1117 42-201101)。实验使用乙腈、甲醇为色谱纯(美国Fisher试剂公司),甲酸为分析纯(天津市风船化学试剂三厂),水为自制超纯水。
1.4 方法
1.4.1 初加工方法及干燥条件 对每批样品采用9种不同初加工方法,见表1。
1.4.2 有效成分含量的测定 (1) 色谱条件。C18岛津液相色谱柱(Shim-pack VP-ODS,150 mm×4.6 mm,5 μm),流动相A为0.1 %甲酸水溶液,流动相B为乙腈,梯度洗脱(0~2.5 min,7 %~10 % B;2.5~20 min,10 %~26 % B;20~29 min,26 %~58.3 % B;29~30 min,58.3 %~90 % B),流速1.00 mL/min,检测波长241 nm,柱温35 ℃,进样量5 μl,理论板数按欧前胡素峰计算不低于3000。
(2) 供试品溶液制备。取样品粉末50.0 mg于35 mL试管中,加入80 %甲醇溶液2.5 mL,超声处理30 min,冷却到室温,用80 %甲醇溶液补足减失提取试剂,静置3 min,提取溶液过0.45 μm微孔滤膜得供试品溶液。
(3)对照品溶液制备。精密称取马钱苷酸、獐牙菜苦苷、龙胆苦苷、当药苷对照品各10.0 mg,用适量甲醇将其溶解,用100 mL容量瓶定容,摇匀,避光4 ℃保存备用。
(4)标准曲线绘制。精密吸取(3)项下的备用对照溶液4 mL,用甲醇定容到10 mL容量瓶中,连续等梯度稀释0.5倍7次,得不同浓度对照溶液。注入5 μl不同浓度对照品溶液于高效液相色谱仪,依据(1)色谱条件测定其峰面积,分别以对照溶液为横坐标,峰面积为纵坐标,绘制标准曲线,计算得回归方程,见表2。

表1 9种不同初加工方法
(5)精密度试验。取1份供试品溶液,按(1)项下色谱条件连续进样6次,测得马钱苷酸、獐牙菜苦苷、龙胆苦苷和当药苷相对峰面积的RSD分别为0.91 %,0.97 %,1.31 %和0.87 %,结果显示方法精密度良好。
(6)重复性试验。精密称取同一份样品6份,按(2)项下方法制备样品溶液,按(1)项下色谱条件测得马钱苷酸、獐牙菜苦苷、龙胆苦苷和当药苷相对峰面积的RSD分别为1.85 %,2.54 %,2.09 %和1.36 %,结果显示方法重现性良好。
(7)稳定性试验。精密吸取同一供试品溶液,按上述色谱条件,依次在0,2,6,12,18,24 h 进样,测得马钱苷酸、獐牙菜苦苷、龙胆苦苷和当药苷相对峰面积的RSD分别为2.63 %,1.34 %,2.86 %和1.49 %,结果显示方法稳定性良好。
1.4.3 数据分析 采用《中药色谱指纹图谱相似度评价系统》2004A版对不同初加工滇龙胆HPLC指纹图谱进行相似度分析。采用IBM SPSS Statistics 20软件对4种有效成分含量测定结果进行主成分分析和方差分析,4种有效成分含量测定结果的三维主成分得分图用SIMCA-P+11.5软件绘制。
2 结果与分析
2.1 滇龙胆环烯醚萜苷类成分指纹图谱建立及相似度分析
依照(1)色谱条件对9种初加工方法处理过的样品进行测定,将9批样品HPLC图谱信号数据导入《中药色谱指纹图谱相似度评价系统》软件(2004A 版),设定S1为参照图谱,选取“时间窗宽度”为0.1 min,对照图谱的生成方法为“平均数”,选定9个特征峰(8、9、13、15、17、18、25、40、41)进行多点校正,自动匹配生成对照指纹图谱(图1B),确定42个共有峰。通过与混合对照品色谱峰进行对照,指认共有峰:9号为马钱苷酸、15号为獐牙菜苦苷、17号为龙胆苦苷、18号为当药苷。通过《中药色谱指纹图谱相似度评价系统》计算不同初加工方法处理的滇龙胆HPLC指纹图谱与对照图谱的相似度(表3),结果显示各样品图谱与对照图谱的相似度大部分高于0.960,其中仅S20、S25相似度相对较低,分别为0.948、0.955。
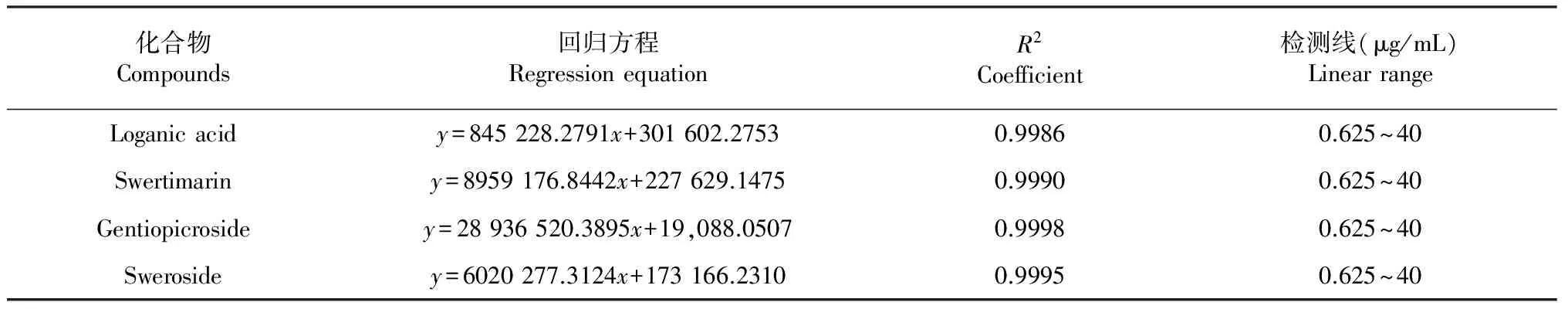
表2 马钱苷酸、獐牙菜苦苷、龙胆苦苷和当药苷标准曲线

A:4种有效成分混合对照品溶液色谱图;B:滇龙胆样品对照指纹图谱;C:9种初加工方法处理的滇龙胆指纹图谱A: HPLC Chromatograms of mixed standards of 4 effective constituents; B: Fingerprint of reference sample of Gentiana rigescens; C: Fingerprints of different samples processed by 9 preliminary processing methods图1 滇龙胆有效成分指纹图谱建立Fig.1 The HPLC fingerprints of index components of Gentiana rigescens
2.2 不同初加工方法对滇龙胆中有效成分含量的影响
按(1)项色谱条件测定27批样品中4种有效成分含量。从表4可知,滇龙胆中龙胆苦苷含量在4种有效成分中含量最高,占总含量的49.17 %~70.91 %。通过(4)建立的滇龙胆中4种有效成分标准曲线,计算得出不同初加工方法处理的滇龙胆样品中马钱苷酸、獐牙菜苦苷、龙胆苦苷、当药苷含量的差异显著(P<0.05)。经微波处理(WBDP)的滇龙胆样品中马钱苷酸含量最高,为(8.58±1.48)mg/g;经沸水烫皮处理(FSDP)含量最低,为(1.45±0.20)mg/g;经水洗处理(SXDP)的滇龙胆样品中獐牙菜苦苷含量最高,为(5.89±0.23)mg/g;经微波处理(WBDP)含量最低,为(1.79±0.78)mg/g;经水洗处理(SXDP)的滇龙胆样品中龙胆苦苷含量最高,为(15.62±0.84)mg/g;经烘箱处理(HXDP)含量最低,为(8.91±0.88)mg/g;经水洗处理(SXDP)的滇龙胆样品中当药苷含量最高,为(3.79±0.16)mg/g;未经水洗处理(BXDP)含量最低,为(0.72±0.51)mg/g。
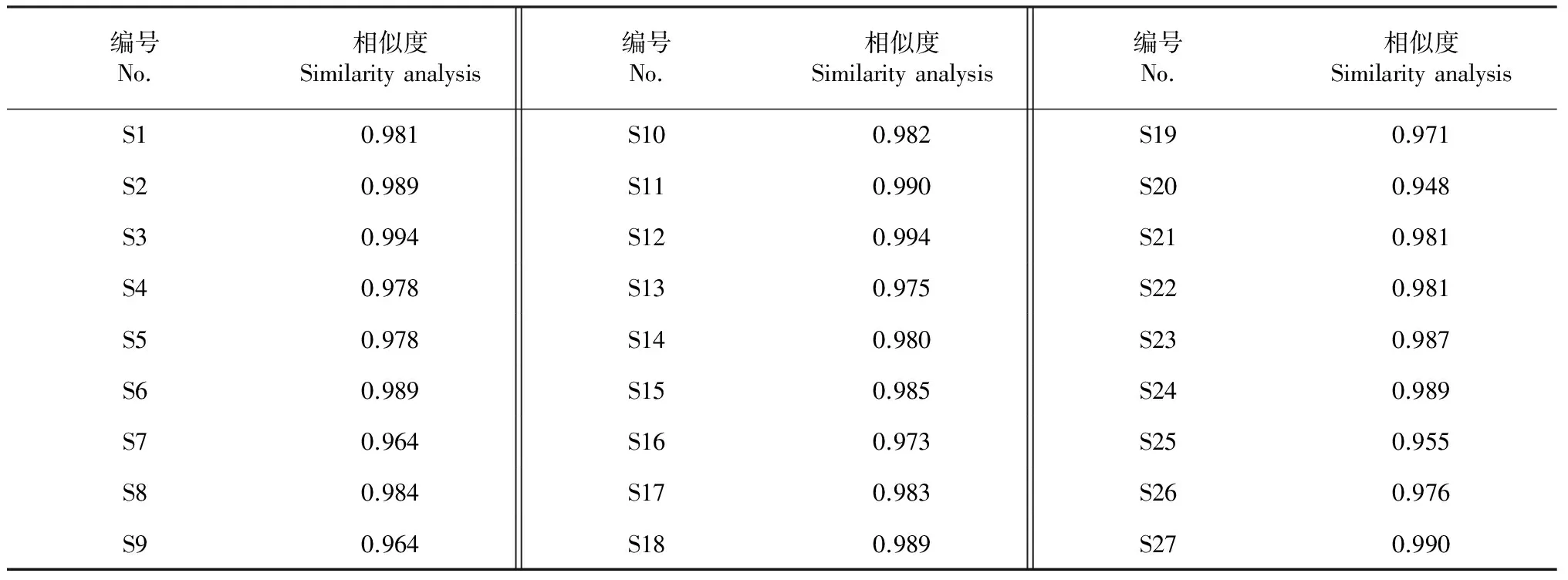
表3 不同初加工方法处理的滇龙胆HPLC指纹图谱相似度评价
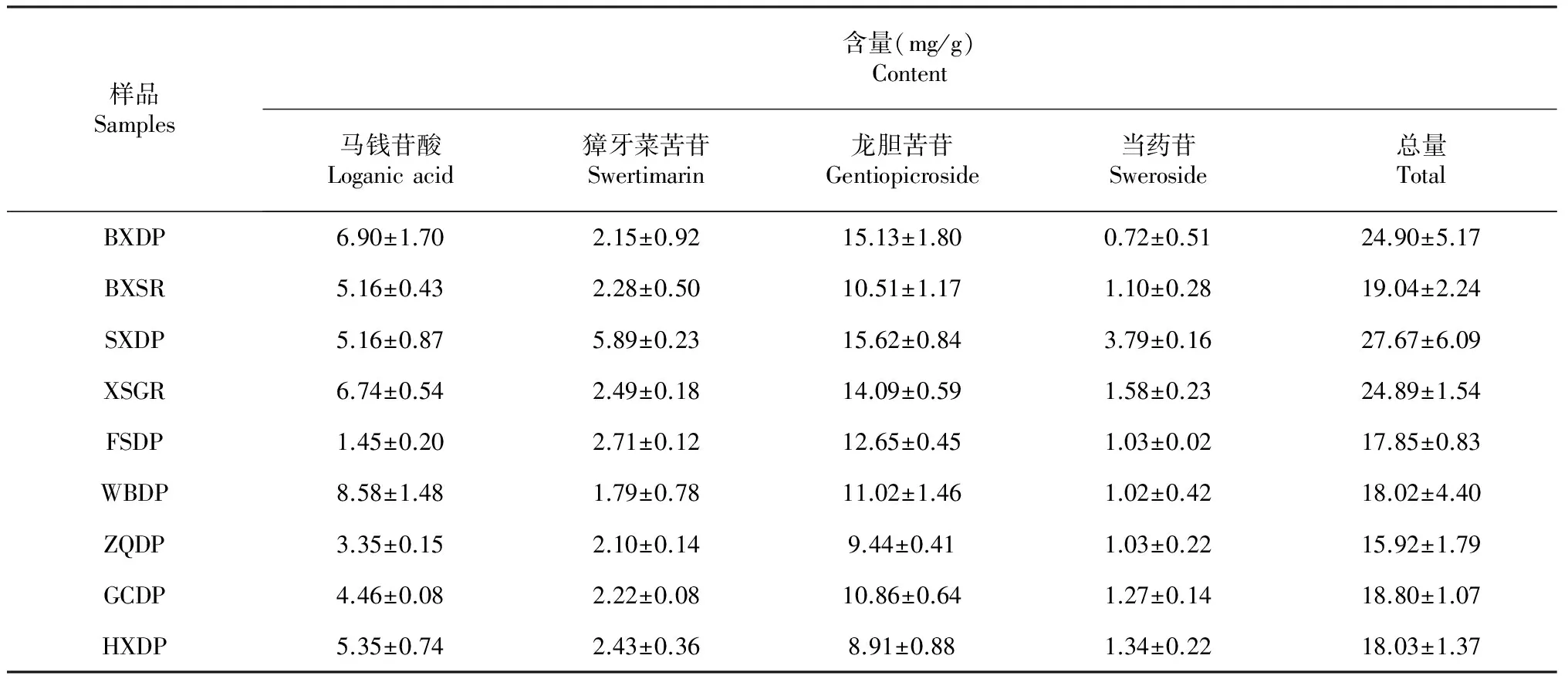
表4 采用9种初加工方法处理的滇龙胆中4种有效成分含量
2.3 主成分分析
对9种初加工方式处理的27批(n=3)滇龙胆样品中马钱苷酸、獐牙菜苦苷、龙胆苦苷、当药苷含量数据标准化后,用SPSS 19.0统计分析软件对其进行主成分分析。由表5可知,以特征值大于1为提取标准,得到2个主成分。主成分1(PC1)的特征值为2.372,其贡献率最大,占总方差贡献率59.301 %,包含信息最多,由成分的载荷矩阵(表6)可知,獐牙菜苦苷在主成分1上的载荷值最高,对主成分1贡献较大。主成分2(PC2)的特征值为1.101,其贡献率占总方差贡献率的27.521 %,马钱苷酸在这一主成分中载荷值较大。前2个主成分的累积贡献率达到86.822 %(≥85 %),表达全部信息的86.822 %。通过SPSS软件处理后得出主成分得分系数(表7),第一主成分贡献最大,而第一主成分中系数最大的为獐牙菜苦苷,说明獐牙菜苦苷在滇龙胆的质量控制中起着重要作用[33]。根据主成分计算公式和主成分得分相关系数可以得到前2个主成分与4种有效成分的线性组合为:
F1=-0.003X1+0.409X2+0.31X3+0.398X4
F2=0.875X1-0.168X2+0.329X3-0.078X4
根据F=0.59301F1+0.27521F2计算主成分综合得分及排序(表8)。对含量测定结果做主成分分析,计算主成分综合得分可评价样品质量[33-34]。滇龙胆经冲洗沥干后于通风处晾干的处理方法(SXDP)综合得分最高,为17.11299;蒸锅处理后于室内通风处晾干的处理方法(ZQDP)综合得分最低,为9.78906。
用SIMAC-P 11.5软件对9种初加工的27批滇龙胆样品绘制主成分分析的三维得分图(图2)。依图可见,带皮水洗处理(DPSX)、沸水带皮处理(FSDP)、微波带皮处理(WBDP)的滇龙胆明显区别于其它初加工处理的滇龙胆,这3种加工方式中带皮水洗(DPSX)滇龙胆的獐牙菜苦苷、龙胆苦苷和当药苷含量及4种有效成分总含量最高,微波处理(WBDP)滇龙胆中马钱苷酸含量最高。其它初加工滇龙胆也存在一定差别,但无法明显区分。

表5 主成分的特征根及贡献率

表6 成分载荷矩阵

表7 成分得分系数矩阵

表8 主成分综合得分

图2 27批滇龙胆样品主成分分析3D得分Fig.2 PCA analysis 3D score of 27 different batch samples
3 讨 论
HPLC指纹图谱是中草药鉴别及评价的有效、简便和可靠的方法,从整体上显示出研究对象之间的相似性。本实验建立了不同初加工方法处理的滇龙胆HPLC指纹图谱,相似度结果显示,样品间整体相似度比较接近,而主成分分析三维得分图显示不同初加工滇龙胆样品存在一定差别。不同初加工滇龙胆中化学成分种类相似,成分含量和构成比例存在差异。
本试验选用的9种初加工方式按加工性质可分为两大类:其中XSGR、SXDP、BXSR、BXDP属于传统加工方法,即不借用加工设备(如蒸锅、微波炉、炒锅、烘箱等),仅用清水进行清洗或不清洗后直接对其进行干燥。FSDP、WBDP、ZQDP、GCDP、HXDP属于辅助加工方法,即借用加工设备进行相关处理后再对其进行干燥。传统加工滇龙胆中4种有效成分含量与主成分分析综合得分均高于辅助加工滇龙胆,表明传统加工方法更有利于滇龙胆品质的保护。而传统加工方法的缺点是操作耗时长、成本高、效率低,故部分药材加工厂为提高生产效率和利润而选择后者。
4种传统加工方式按是否去皮可分为两大类:其中BXDP、SXDP为不去皮处理,BXSR、XSGR为去皮处理。不去皮处理的滇龙胆中4种有效成分总含量高于去皮处理,主成分分析结果不去皮处理的综合得分排名也高于去皮处理,表明滇龙胆表皮的存在对滇龙胆质量有一定影响。经不同初加工处理后马钱苷酸、獐牙菜苦苷、龙胆苦苷、当药苷含量变化存在差异,滇龙胆最佳初加工方式为带皮水洗后于室内通风干燥。
[1]Cai H, Cao G, Zhang H. Qualitative analysis of a sulfur-fumigated Chinese herbal medicine by comprehensive two-dimensional gas chromatography and high-resolution time of flight mass spectrometry using colorized fuzzy difference data processing[J]. Chin J Integr Med, 2015: 1-9.
[2]Korus A. Effect of preliminary and technological treatments on the content of chlorophylls and carotenoids in kale (BrassicaoleraceaL. var. Acephala)[J]. J Food Process Pres, 2013, 37(4): 335-344.
[3]Geng L, Ma C, Zhang L, et al. Metabonomic Study of Genkwa Flos-induced Hepatotoxicity and Effect of Herb-Processing Procedure on Toxicity[J]. Phytother Res, 2013, 27(4): 521-529.
[4]陆兔林,单 鑫,李 林,等.中药材硫磺熏蒸及其现代加工技术研究进展[J].中国中药杂志, 2014, 39(15): 2791-2795.
[5]谭铭铭,黄 勇,徐小飞,等.干燥方法对板蓝根药材中表告依春和尿苷含量的影响[J].中药材, 2014(4): 578-580.
[6]刘 培,陈 京,周 冰,等.不同干燥加工方法及其条件对杭白芷中香豆素及挥发油类化学成分的影响[J].中国中药杂志, 2014, 39(14): 2653-2659.
[7]Cai Y, Li X, Li M, et al. Traceability and quality control in traditional Chinese medicine: from chemical fingerprint to two-dimensional barcode[J]. Evid-Based Compl Alt, 2015, DOI: http://dx.doi.org/10.1155/2015/251304.
[8]Jing J, Parekh H S, Wei M, et al. Advances in analytical technologies to evaluate the quality of traditional Chinese medicines[J]. Trac-Trend Anal Chem, 2013, 44: 39-45.
[9]Zhu Y, Zheng Q, Sun Z, et al. Fingerprint-efficacy study of Radix Aconiti Lateralis Preparata (Fuzi) in quality control of Chinese herbal medicine[J]. J Therm Anal Calorim, 2014, 118(3): 1763-1772.
[10]Zhang R, Chen J, Shi Q, et al. Quality control method for commercially available wild Jujube leaf tea based on HPLC characteristic fingerprint analysis of flavonoid compounds[J]. J Sep Sci, 2014, 37(1-2): 45-52.
[11]Kumar N, Bansal A, Sarma G S, et al. Chemometrics tools used in analytical chemistry: An overview[J]. Talanta, 2014, 123: 186-199.
[12]Guo L, Duan L, Liu K, et al. Chemical comparison ofTripterygiumwilfordiiandTripterygiumhypoglaucumbased on quantitative analysis and chemometrics methods[J]. J Pharmaceut Biomed, 2014, 95: 220-228.
[13]Zhou J, Yao L, Li Y, et al. Floral classification of honey using liquid chromatography-diode array detection-tandem mass spectrometry and chemometric analysis[J]. Food Chem, 2014, 145: 941-949.
[14]Qin K, Wang B, Li W, et al. Quality assessment of raw and processedArctiumlappaL. through multicomponent quantification, chromatographic fingerprint, and related chemometric analysis[J]. J Sep Sci, 2015, 38(9): 1491-1498.
[15]Azemin A, Dharmaraj S, Hamdan M R, et al. DiscriminatingFicusdeltoideavar.bornensisfrom Different Localities by HPTLC and FTIR Fingerprinting[J]. J Appl Pharm Sci, 2014, 4(11): 069-075.
[16]国家药典委员会.中国药典2010年版.一部[S].北京: 中国医药科技出版社, 2010.
[17]杨 雁,金 航,王家金,等.大理苍山不同海拔梯度和土壤对野生滇龙胆生长及其成分的影响[J].西南农业学报,2014,27(4):1601-1606.
[18]Wang Y Z, Xu M, Wang D, et al. Review on ‘Long-Dan’, one of the traditional Chinese medicinal herbs recorded in Chinese Pharmacopoeia[J]. Nat. Prod. Bioprospect, 2012(2): 1-10.
[19]Zhao Y, Zhang J, Jin H, et al. Discrimination ofGentianarigescensfrom Different Origins by Fourier Transform Infrared Spectroscopy Combined with Chemometric Methods[J]. J Aoac. Int., 2015, 98(1): 22-26.
(责任编辑 王家银)
StudyonHPLCFingerprintsofGentianaRigescenswithDifferentPreliminaryProcessingandDeterminationofIndexComponents
ZUO Zhi-tian1,2, WANG Yuan-zhong1,2, ZHANG Ji1,2, ZHAO Yan-li1,2, WANG Jia-jin1,2 *
(1.Institute of Medicinal Plants, Yunnan Academy of Agricultural Sciences, Yunnan Kunming 650205, China; 2.Yunnan Technical Center for Quality of Chinese Material Medica, Yunnan Kunming 650200, China)
HPLC fingerprints of different preliminary processingGentianarigescenswere established, and 4 index contents as loganic acid, swertimarin, gentiopicroside and swerosidefour were determined. Principal component analysis (PCA) was employed to evaluate nine preliminary processing methods. The results showed relatively high similarity among samples. The contents of swertimarin, gentiopicroside and sweroside were the highest inGentianarigescenssamples which were cleaned by rinsing and indoor seasoning, and reached(5.89±0.23),(15.62±0.84),(3.79±0.16)mg/g, respectively. While the sample which was treated by microwave had the highest content of loganic acid, was(8.58±1.48)mg/g. The total content of the 4 effective components was(27.67±6.09)mg/g. The results of principal component analysis revealed that cumulativerate of contribution of PCA1 and PCA2 reached 86.822 %, and formed linearrelation with four effective constituents:F(PC1)=-0.003X1+0.409X2+0.31X3+0.398X4,F(PC2)=0.875X1-0.168X2+0.329X3-0.078X4; The results showed that the samples with the skin dried indoor after washing got the highest score in PCA. Analysis results revealed cleaning by rinsing and indoor seasoning was more optimizing processing method than others.
Preliminary processing; Traditional Chinese medicine fingerprints; Principal component analysis;Gentianarigescens
1001-4829(2017)3-0535-07
10.16213/j.cnki.scjas.2017.3.009
S567
A
2015-10-08
国家自然科学基金资助项目(81260608);云南省自然科学基金资助项目(2014FD068,2013FZ150,2013FD066)
左智天(1984-),女,助理研究员,主要从事天然药物化学与活性方面研究,E-mail:yaaszztian@126.com,*为通讯作者,E-mail:2354665275@qq.com。
