泛素E3连接酶TRIM10在心肌细胞肥大中的作用*
2017-10-20周春宇李南南王红霞李汇华
周春宇, 李南南, 王红霞, 田 翠, 李汇华
(首都医科大学基础医学院生理学与病理生理学系, 北京 100069)
泛素E3连接酶TRIM10在心肌细胞肥大中的作用*
周春宇, 李南南, 王红霞, 田 翠, 李汇华△
(首都医科大学基础医学院生理学与病理生理学系, 北京 100069)
目的探讨泛素E3连接酶TRIM10在心肌细胞肥大中的作用及分子机制。方法培养原代的大鼠乳鼠心肌细胞,siRNA-TRIM10与siRNA对照(siRNA-control)或过表达腺病毒Ad-TRIM10与空载对照Ad-GFP转染细胞24 h,然后用苯肾上腺素(phenylephrine, PE)处理细胞24 h。Western blot检测TRIM10、AKT和ERK1/2的蛋白水平;免疫荧光染色观察心肌细胞的大小;实时荧光定量PCR检测心房钠尿肽(ANP) 和脑钠尿肽(BNP)的mRNA 的表达水平。结果与对照组相比,PE处理明显上调心肌细胞中TRIM10蛋白的表达水平。siRNA-TRIM10敲低内源性TRIM10表达后明显减小PE诱导的心肌细胞体积,抑制ANP和BNP的mRNA的表达以及降低AKT和ERK1/2的磷酸化水平;而过表达TRIM10则呈现出与siRNA-TRIM10完全相反的结果。结论TRIM10可调节心肌细胞肥大,其作用可能与AKT和ERK信号相关。
泛素E3连接酶; TRIM10; 心肌细胞肥大
心肌肥厚是高血压、瓣膜病和心肌梗塞等临床常见疾病的一种并发症,是心脏应对血液动力学负荷增加、体液激素改变、内分泌激活及能量代谢障碍等发生的一种病理生理适应过程,最终导致心力衰竭[1]。心肌肥厚的主要病理改变包括心肌细胞体积增大、间质纤维化、肌小节排列紊乱、蛋白质合成增多和胚胎基因表达增高[2]。目前发现有多条信号通路参与心肌肥厚的发生,如丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)通路、磷酯酰肌醇3激酶(phosphatidylinositol 3-kinase, PI3K)-AKT通路、蛋白激酶C(protein kinase C, PKC) 通路和钙调磷酸酶通路等[3-6]。
心肌肥厚发生时表现为心肌蛋白质的合成增加或降解减少,其中泛素-蛋白酶体系统(ubiquitin-proteasome system, UPS)是生物体内调控蛋白质降解的主要途径,其主要由泛素激活酶E1、泛素转运酶E2、泛素连接酶E3和26S蛋白酶体组成。近年,许多研究及我们前期研究均证实E3连接酶如 atrogin-1、MuRF1、Nrdp1 等在心肌肥厚的发生中具有重要的调节作用[7-9]。TRIM家族是E3连接酶中的新成员,具有泛素连接酶的结构和功能,参与多种细胞的生物学进程,如细胞凋亡、细胞周期调控和病毒应答等[10],目前发现该家族中多个成员与心血管疾病的发生密切相关。TRIM10是TRIM家族的成员之一,具有E3连接酶的功能,主要参与红系细胞的终末分化,对造血功能、细胞凋亡均具有重要的调节作用[11-12]。但是,TRIM10在心肌肥厚中的作用不清楚。
本研究在培养的大鼠乳鼠心肌细胞中,转染siRNA-TRIM10以及过表达腺病毒Ad-TRIM10敲低或过表达TRIM10,观察其对心肌细胞的大小、肥大标志物心房钠尿肽(atrial natriuretic peptide,ANP) 和脑钠尿肽(brain natriuretic peptide,BNP)的mRNA水平以及相关信号通路的影响,探讨TRIM10在心肌肥厚发生中的作用及机制。
材 料 和 方 法
1动物
SD大鼠的新生乳鼠(出生后3 d内)购自北京华阜康实验动物技术有限公司。
2主要试剂及仪器
苯肾上腺素(phenylephrine,PE)和TRIM10兔源抗体购自Sigma;siRNA-TRIM10 和siRNA-control购自GE Healthcare;过表达腺病毒Ad-TRIM10 和Ad-GFP购自汉恒生物公司;Lipofectamine 2000购自Invitrogen;DMEM/F12培养基和胎牛血清购自Gibco;兔抗ERK1/2、 p-ERK1/2、AKT、p-AKT、GAPDH抗体及兔源II抗购自Cell Signaling Technology。
Nikon Labophot 2 显微镜购自Nikon;电泳仪、电转仪购自Bio-Rad;Western blot显影仪购自北京赛智创业科技有限公司;实时荧光定量PCR仪购自Life Technologies;酶标仪购自BioTek。
3主要方法
3.1细胞转染 原代心肌细胞贴壁20 h后,用Lipofectamine 2000转染siRNA-TRIM10(50 nmol/L,1∶100)敲低TRIMIO表达或用腺病毒Ad-TRIM10(50 nmol/L,1∶100)感染过表达内源性TRIM10;相应的对照组分别转染siRNA-control和Ad-GFP。同时换无血清培养基饥饿处理24 h,然后给予PE(30 μmol/L)处理24 h。收集细胞提取总RNA和蛋白等用于后续实验。
3.2细胞α-actinin荧光染色 用4%多聚甲醛固定心肌细胞15 min,然后用PBS清洗3 min、3次,洗完后再用10 g/L的血清白蛋白溶液室温封闭30 min。PBS 清洗3 min、3次, I 抗4 ℃孵育过夜(α-actinin, 1∶2 000稀释)后用PBS洗去(5 min、3次)。加入II抗室温避光孵育1 h,然后用含有DAPI的防荧光淬灭剂封片,避光放置数分钟之后即可在荧光显微镜下采集图像。
3.3Western blot实验 用蛋白RIPA裂解液(80~100 μL)冰上裂解细胞15 min,然后用细胞刮子收集至1.5 mL EP管中。用细胞破碎仪裂解细胞后离心(4 ℃、12 000 r/min)10 min,吸取上清。按照BCA法测蛋白浓度。取40~50 μg总蛋白进行SDS-PAGE,然后将蛋白电转至PVDF 膜。用5% 脱脂牛奶室温封闭膜1 h, I 抗4 ℃孵育过夜,次日洗涤10 min、3 次。用 II 抗孵育膜1 h后,ECL显影。
3.4实时荧光定量PCR实验 用Trizol 裂解法提取心肌细胞总RNA。取1~2 μg逆转录合成cDNA第一链,然后取2 μL cDNA模板、上下游引物各1 μL、SYBR 10 μL,添加dd H2O 6 μL至总体积20 μL,进行反应。用实时荧光定量PCR仪测定心肌肥厚标志物ANP和BNP的mRNA水平。引物购自上海生工生物技术有限公司,序列如表1所示。

表1 用于实时荧光定量PCR实验的引物序列
4统计学处理
统计分析使用SPSS 19.0软件进行。每个指标进行3次以上独立重复实验,所得数据均以均数±标准误(mean±SEM)表示,均数组间比较采用单因素方差分析方法,以P<0.05为差异有统计学意义。
结 果
1PE处理上调心肌细胞中TRIM10蛋白的表达
PE处理原代心肌细胞24 h后, Western blot检测显示TRIM10的蛋白水平比对照组明显增高,见图1。
2敲低TRIM10抑制PE诱导的心肌细胞肥大
Western blot 检测发现siRNA-TRIM10组的TRIM10蛋白水平比siRNA-control组明显降低,DE可明显增加TRIM10的蛋白水平,siRNA-TRIM10可显著降低PE诱导的TRIM10表达;免疫荧光染色结果显示,与siRNA-control组相比,siRNA-TRIM10转染后可明显抑制PE诱导的心肌细胞体积增大;RT-qPCR测定显示,与siRNA-control组相比,siRNA-TRIM10转染后可明显抑制PE诱导的肥大标志物ANP和BNP mRNA的表达,见图2。
3过表达TRIM10促进PE诱导的心肌细胞肥大
Western blot 结果表明Ad-TRIM10感染后的TRIM10蛋白水平比Ad-GFP组明显升高,PE处理的Ad-TRIM10感染细胞中TRIM10水平较PE处理空载组进一步升高;免疫荧光染色显示,与Ad-GFP组相比Ad-TRIM10转染后可明显增大PE诱导的心肌细胞直径;RT-qPCR分析发现与Ad-GFP组相比,Ad-TRIM10感染后可明显促进PE诱导的肥大标志物ANP和BNP mRNA的表达,见图3。
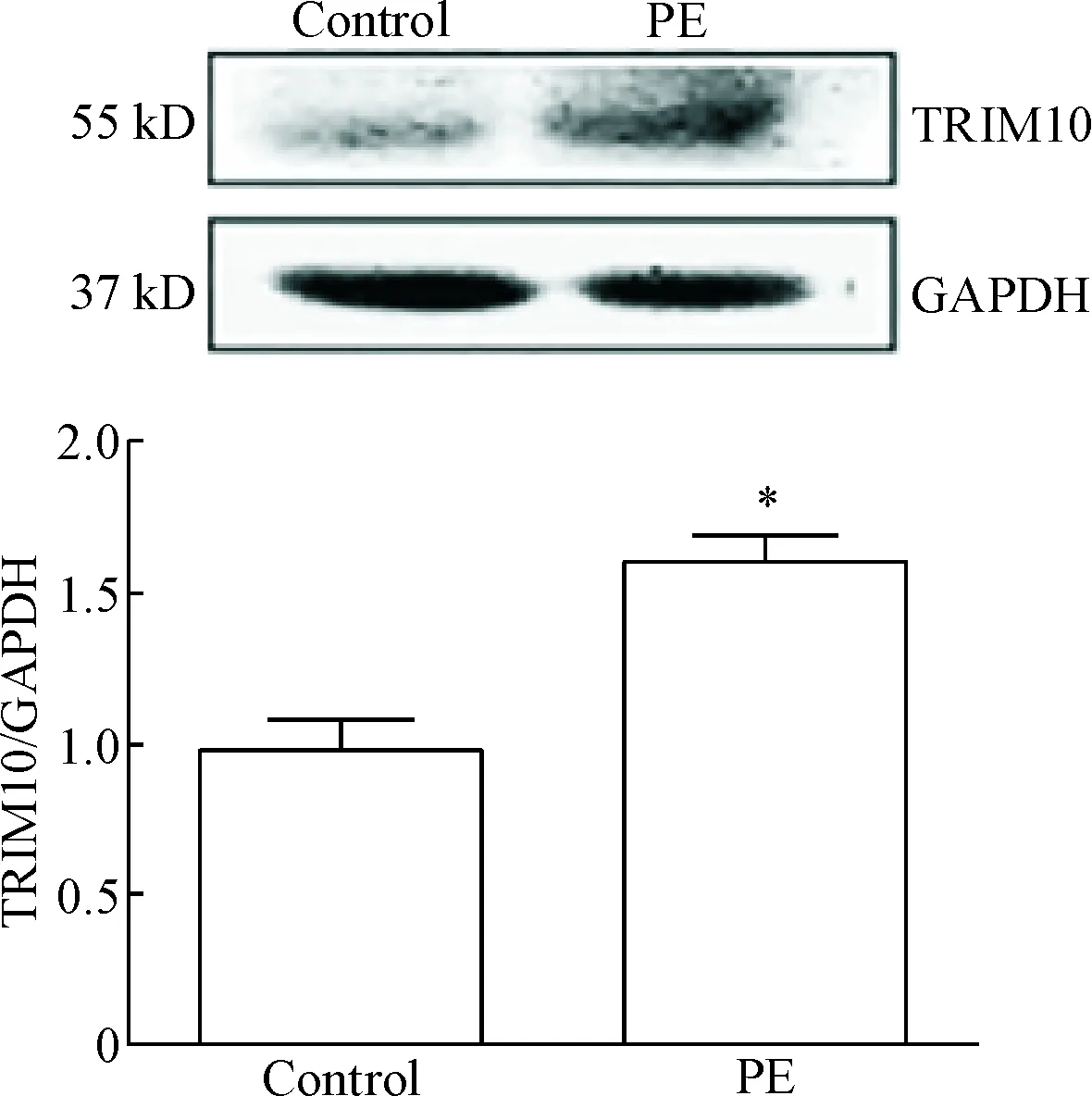
Figure 1. PE treatment up-regulated TRIM10 protein expression in the cardiomyocytes. The protein level of TRIM10 was determined by Western blot. Mean±SEM.n=3.*P<0.05vscontrol group.
图1PE处理上调心肌细胞中TRIM10的蛋白表达
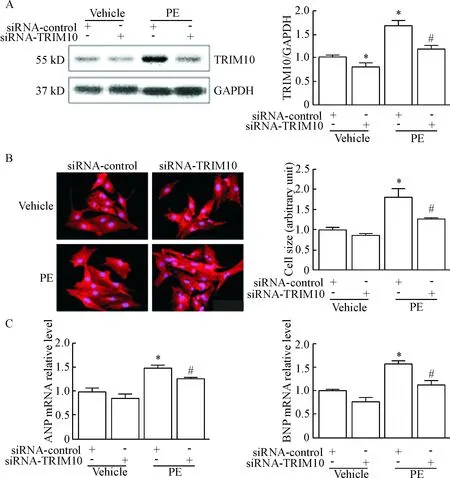
Figure 2. siRNA-TRIM10 inhibited the cardiomyocyte size, the ANP and BNP mRNA expression induced by PE-treatment. The cardiomyocytes were transfected with siRNA-TRIM10 or siRNA-control for 24 h, and then treated with PE for 24 h. A: the protein level of TRIM10 was determined by Western blot; B: the cardiomyocyte size was measured by α-actinin staining (×200); C: the mRNA levels of cardiac hypertrophy markers ANP and BNP were detected by RT-qPCR. Mean±SEM.n=3.*P<0.05vssiRNA-control (vehicle);#P<0.05vssiRNA-control (PE).
图2敲低TRIM10抑制PE诱导的心肌细胞体积增大和肥大标志物ANP和BNP的mRNA的表达
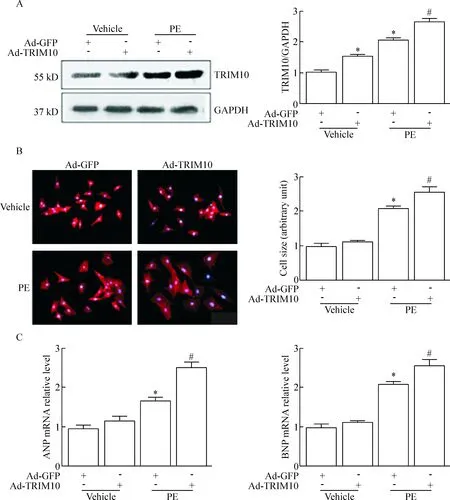
Figure 3. Ad-TRIM10 increased cardiomyocyte size, ANP and BNP mRNA expression induced by PE-treatment. The cardiomyocytes were infected with Ad-TRIM10 or Ad-GFP for 24 h, and then treated with PE for 24 h. A: the protein level of TRIM10 was determined by Western blot; B: the cardiomyocyte size was measured by α-actinin staining (×200); C: the mRNA levels of cardiac hypertrophy markers ANP and BNP were detected by RT-qPCR. Mean±SEM.n=3.*P<0.05vsAd-GFP (vehicle);#P<0.05vsAd-GFP (PE).
图3过表达TRIM10促进PE诱导的心肌细胞体积增大和肥大标志物ANP和BNPmRNA的表达
4TRIM10参与调控AKT和ERK1/2信号通路
Western blot 结果显示,PE可显著升高心肌细胞中AKT和ERK1/2的磷酸化水平(P<0.05),敲低TRIM10后,可明显抑制PE诱导的AKT和ERK1/2的磷酸化水平。相反,过表达TRIM10后则进一步升高PE诱导的AKT和ERK1/2的磷酸化水平,见图4。
讨 论
TRIM家族在调节细胞增殖、分化、个体发育、肿瘤及细胞凋亡等多种生物学过程发挥重要的作用。比如TRIM45可与膜转运家族蛋白SLC25A3以及热休克家族蛋白DNAJB6发生相互作用,共同阻断钙调磷酸酶介导的心肌肥厚[13];TRIM7可通过调节c-Jun/AP-1 复合物,激活Ras系统进而调节细胞增殖和凋亡,促进肺癌的发生[14]。TRIM10具有TRIM家族所共有的结构域,包括锌指结构域(RING finger)、1个B-box以及1个coiled-coil结构域。研究表明TRIM10可调节胚胎发育、红系细胞生成以及成年小鼠的红细胞分化与增殖[12]。

Figure 4. The effect of siRNA-TRIM10 and Ad-TRIM10 on the expression of p-ERK1/2 and p-AKT. A: the levels of p-ERK1/2 and p-AKT were determined by Western blot after transfected with siRNA-TRIM10 or siRNA-control; B: the levels of p-ERK1/2 and p-AKT were determined by Western blot after transfected with Ad-TRIM10 or Ad-GFP. Mean±SEM.n=3.*P<0.05vssiRNA-control (vehicle);#P<0.05vssiRNA-control (PE);△P<0.05vsAd-GFP (vehicle);$P<0.05vsAd-GFP (PE).
图4siRNA-TRIM10和Ad-TRIM10对PE诱导的ERK1/2和AKT的磷酸化水平的影响
本研究结果显示敲低TRIM10后可抑制PE诱导的细胞体积增大、降低肥大标志物的表达,而过表达TRIM10则具有相反的效应,说明TRIM10具有促进心肌肥大的作用。AKT和ERK信号激活是导致心肌细胞蛋白质合成增加、细胞肥大的一个重要机制[15],因此本研究进一步探讨了TRIM10对以上信号的影响。结果发现敲低TRIM10 后可明显降低AKT和ERK1/2 的磷酸化水平,过表达TRIM10则相反,提示TRIM10可能是通过激活AKT和ERK1/2信号转导通路来诱导心肌细胞肥大的。
本研究为深入了解TRIM10的生物学功能提供了新的依据,但是仍需要在基因敲除和过表达小鼠模型中进一步验证TRIM10的作用及其分子机制。
[1] Balakumar P, Jagadeesh G. Multifarious molecular signaling cascades of cardiac hypertrophy: can the muddy waters be cleared?[J]. Pharmacol Res, 2010, 62(5): 365-383.
[2] Mancini DM, Beniaminovitz A, Levin H, et al. Low incidence of myocardial recovery after left ventricular assist device implantation in patients with chronic heart failure[J]. Circulation, 1998, 98(22):2383-2389.
[3] Frey N, Katus HA, Olson EN, et al. Hypertrophy of the heart: a new therapeutic target? [J]. Circulation, 2004, 109(13):1580-1589.
[4] Gupta S, Das B, Sen S. Cardiac hypertrophy: mechanisms and therapeutic opportunities[J]. Antioxid Redox Signal, 2007, 9(6):623-652.
[5] Choudhary R, Sastry BK, Subramanyam C. Positive correlations between serum calcineurin activity and left ventricular hypertrophy[J]. Int J Cardiol, 2005, 105(3): 327-331.
[6] 张 鑫, 杨永健, 黄 燕, 等. 钙蛋白酶调节致心肌细胞肥大的信号转导[J]. 中国病理生理杂志, 2007, 23(5):858-861.
[7] Li HH, Kedar V, Zhang C, et al. Atrogin-1/muscle atrophy F-box inhibits calcineurin-dependent cardiac hypertrophy by participating in an SCF ubiquitin ligase complex[J]. J Clin Invest, 2004, 114(8):1058-1071.
[8] Maejima Y, Usui S, Zhai P, et al. Muscle-specific RING finger 1 negatively regulates pathological cardiac hypertrophy through downregulation of calcineurin A[J]. Circ Heart Fail, 2014, 7(3):479-490.
[9] Zhang Y, Zeng Y, Wang M, et al. Cardiac-specific overexpression of E3 ligase Nrdp1 increases ischemia and reperfusion-induced cardiac injury[J]. Basic Res Cardiol, 2011, 106(3):371-383.
[10] Meroni G, Diez-Roux G. TRIM/RBCC, a novel class of single protein RING finger E3 ubiquitin ligases[J]. Bioessays, 2005, 27(11):1147-1157.
[11] Blaybel R, Théoleyre O, Douablin A, et al. Downregulation of the Spi-1/PU.1 oncogene induces the expression of TRIM10/HERF1, a key factor required for terminal erythroid cell differentiation and survival[J]. Cell Res, 2008, 18(8):834-845.
[12] Harada H, Harada Y, O′Brien DP, et al. HERF1, a novel hematopoiesis-specific RING finger protein, is required for terminal differentiation of erythroid cells[J]. Mol Cell Biol, 1999, 19(5):3808-3815.
[13] 姚力群. 人类心脏发育候选基因TRIM45及BZW2的蛋白相互作用研究及初步功能鉴定[D]. 长沙:湖南师范大学, 2011.
[14] Chakraborty A, Diefenbacher ME, Mylona A, et al. The E3 ubiquitin ligase Trim7 mediates c-Jun/AP-1 activation by Ras signalling[J]. Nat Commun, 2015, 8(6):6782.
[15] Matsui T, Nagoshi T, Rosenzweig A. Akt and PI 3-kinase signaling in cardiomyocyte hypertrophy and survival[J]. Cell Cycle, 2003, 2(3):220-223.
(责任编辑: 林白霜, 余小慧)
DUSP9调控雌性小鼠多能干细胞的DNA低甲基化
囊胚来源的胚胎干细胞(embryonic stem cells, ESCs)和性腺来源的胚胎生殖细胞(embryonic germ cells, EGCs)代表了多能干细胞系的两个经典类型,但它们的分子等价性仍未被完全了解。Choi等对遗传背景相同的ESCs和EGCs细胞系之间的全基因组甲基化模式进行比较,从而确定它们表观遗传的相似性和差异性。令人惊讶的是,他们发现真正驱动ESCs和EGCs甲基化模式的是性别而非细胞类型。细胞融合实验进一步表明,X染色体与常染色体的比值决定了甲基化水平,雌性杂交细胞表现为低甲基化,而雄性杂交细胞表现为高甲基化。他们还发现,与雄性ESCs 相比,雌性ESCs中X连锁的MAPK磷酸酶DUSP9上调,同时雌性ESCs中DUSP9的杂合性缺失导致了雄性样甲基化水平。然而,雄性和雌性囊胚均有相似的低甲基化水平,表明在培养过程中出现了性别特异性甲基化差异。总的来说,该研究表明,相同性别的ESCs和EGCs具有表观遗传相似性,同时确认了DUSP9是雌性特异性低甲基化的一个调控因子。
Cell Stem Cell, 2017, 20(5):706-719.e7(范冲竹)
RoleofubiquitinE3ligaseTRIM10inregulatingcardiomyocytehypertrophy
ZHOU Chun-yu, LI Nan-nan, WANG Hong-xia, TIAN Cui, LI Hui-hua
(DepartmentofPhysiologyandPathophysiology,SchoolofBasicMedicalSciences,CapitalMedicalUniversity,Beijing100069,China.E-mail:hhli1935@aliyun.com)
AIM: To explore the role of ubiquitin E3 ligase tripartite motif 10 (TRIM10) in the development of cardiomyocyte hypertrophy.METHODSPrimary cultured neonatal rat cardiomyocytes (NRCMs) were infected with siRNA-TRIM10, siRNA-control, Ad-TRIM10 or Ad-GFP for 24 h respectively, and then stimulated with phenylephrine (PE) for additional 24 h. The protein levels of TRIM10, AKT and ERK1/2 were determined by Western blot. The size of the NRCMs was measured by immunofluorescence staining. The mRNA expression of atrial natriuretic peptide (ANP) and brain natriuretic peptide (BNP) was detected by RT-qPCR.RESULTSCompared with the control, PE treatment significantly increased the protein expression of TRIM10. Moreover, transfection of NRCMs with siRNA-TRIM10 markedly inhibited cardiomyocyte size, the mRNA expression of ANP and BNP, and the phosphorylation levels of AKT and ERK as compared with siRNA-control after PE treatment. In contrast, overexpression of TRIM10 significantly enhanced PE-induced hypertrophic effect on NRCMs above.CONCLUSIONTRIM10 regulates cardiomyocyte hypertrophy partially through AKT and ERK signaling pathways.
Ubiquitin E3 ligase; TRIM10; Cardiomyocyte hypertrophy
R54; R363
A
10.3969/j.issn.1000- 4718.2017.10.009
1000- 4718(2017)10- 1788- 06
2017- 01- 20
2017- 05- 19
国家自然科学基金重点项目(No. 81330003)
△通讯作者 Tel: 010-83950092; E-mail: hhli1935@aliyun.com
杂志网址: http://www.cjpp.net
