额颞叶变性的临床及生物学标记物特点
2017-10-20豆玉超张惠红王艳张淼田志岩王盼周玉颖
豆玉超 张惠红 王艳 张淼 田志岩 王盼 周玉颖
额颞叶变性的临床及生物学标记物特点
豆玉超 张惠红 王艳 张淼 田志岩 王盼 周玉颖
目的探讨额颞叶变性(FTLD)患者的临床、影像以及生物学标记物的特点。方法回顾性分析入组的43例FTLD患者的临床资料,包括一般资料、临床特点、行为-认知量表评分〔如蒙特利尔认知评估量表(MoCA)、简易精神状态检查量表(MMSE)、日常活动能力量表(ADL)、额叶行为量表(FBI)、神经精神量表(NPI)和汉密尔顿抑郁量表(HAMD)评分〕、头MRI、血APOEε4、尿液Alzheimer相关神经丝蛋白(AD7c-NTP)以及FDG-PET检查结果。结果FTLD患者早期主要表现为执行功能障碍、行为去抑制;头颅MRI检查结果表现为单/双侧对称(或)不对称性额颞叶萎缩,可伴或不伴海马萎缩;FDG-PET检查结果显示大脑半球前部对称/不对称性葡萄糖低代谢改变;FTLD患者APOEε4等位基因的表达频率为15.12%,尿液AD7c-NTP平均值(3.23±1.78)ng/mL,高于正常值范围(0~1.5 ng/mL);P300波的潜伏期不同程度延长,波幅均降低。结论FTLD患者早期临床表现以行为、执行功能障碍多见,也可出现记忆障碍。行为-认知量表和FDG-PET检查可能有助于FTLD诊断。FTLD患者P300波的潜伏期和波幅也可出现变化,可能有助于发现患者记忆、推理功能障碍。FTLD患者也可以出现APOEε4等位基因表达以及尿AD7c-NTP表达的变化。
额颞痴呆;额颞叶退化;AD7c-NTP;载脂蛋白E类;事件相关电位,P300
额颞叶变性(frontotemporal lobar degeneration,FTLD)是一组以社会行为、人格改变和语言功能障碍为临床特征,主要表现为额叶和(或)颞叶萎缩的临床综合征,是目前仅次于阿尔茨海默病(AD)和路易体痴呆的第3位导致痴呆的疾病,约占所有痴呆类型的20%[1]。目前国际上将FTLD主要分为行为变异型、语义型以及进行性非流利性失语型,其中行为变异型最为常见[2]。有学者提出精神行为症状为FTLD患者的特征性表现,以行为异常、沟通能力及执行能力下降为主要临床症状的FTLD患者与其他类型痴呆的症状有重叠,易漏诊、误诊。越来越多的研究显示FTLD亦存在记忆障碍[3]。目前FTLD确切的病理生理机制还不清楚。本文回顾性分析43例FTLD患者的临床及影像学等特点,以期为FTLD的早期诊断及鉴别诊断提供依据。
1 对象和方法
1.1观察对象收集2011-04—2015-11天津市环湖医院痴呆诊疗中心就诊的FTLD患者43例,其中男13例,女30例,年龄47~72岁,平均(64.72±6.44)岁。发病年龄45~72岁,平均(63.02±6.28)岁,就诊时病程0.5~5年,中位数为2.0年,四分位数间距为2.0年。受教育年限2~15年,中位数为9.0年,四分位数间距为7.0年,体重指数(BMI)15~30 kg/m2,平均(23.42±3.13)kg/m2。有痴呆家族史8例(18.60%),合并高血压6例(13.95%)、糖尿病4例(9.30%)、冠心病5例(11.63%)、甲状腺疾病和脑梗死各1例(2.33%),有吸烟史者5例(11.63%),饮酒史 3例(6.98%)。所有患者由至少2名有经验的神经内科专科医师诊断为很可能的FTLD患者,诊断符合1998年Neary等标准[4]、2011年修订的FTLD诊断指南[5]。排除标准:(1)对各类神经精神量表评估不配合者;(2)不符合上述诊断标准者;(3)肿瘤史、脑外伤史、中毒史、癫痫病史等;(4)心、肝、肺、肾功能不全者;(5)精神病患者。
1.2方法
1.2.1一般资料收集:收集患者的年龄、性别、身高、体重、受教育程度、痴呆家族史、高血压、糖尿病、心脑血管病、甲状腺功能低下、吸烟及饮酒史等。
1.2.2神经精神量表评估:由经过正规培训的医师进行量表评估。(1)应用简易精神状态量表(MMSE)和蒙特利尔认知评估量表(MoCA)评价认知功能。(2)采用神经精神量表(NPI)和额叶行为评估量表〔FBI,包括负项(阴性)行为分量表(FBI-A)和正项(阳性)行为分量表(FBI-B)〕评价神经精神行为。(3)采用日常活动能力量表(ADL) 评价日常生活活动能力。(4)采用汉密尔顿抑郁量表 (HAMD-21)评价情绪状态。
1.2.3影像学检查:对患者进行头颅MRI(Phi-lips Achieva 3.0 T超导型核磁共振仪)和PET(西门子CTI EXACT HR)检查。FDG-PET影像结果使用NeuroQ软件进行处理,筛选出患者代谢减低明显的脑区。
1.2.4ApoE基因型测定:于清晨空腹时取外周静脉血5 mL,用常规酚-氯仿法提取基因组DNA,采用聚合酶链反应-限制性片段长度多态性方法(PCR-RFLP)分析ApoE基因型。
1.2.5尿Alzheimer相关神经丝蛋白(AD7c-NTP)含量测定:留清晨中段合格尿标本,以1700g离心5 min,保存于-20℃待用。采用酶联免疫吸附法(试剂盒购自广州汉光公司),利用酶标仪(德国Analytik Jena AG)测定450 nm处吸光度值,计算尿AD7c-NTP浓度。每组标本重复测定3次取均值。
1.2.6事件相关电位P300检测:采用Keypoint型肌电诱发电位仪,按国际10/20系统方法安放电极,受试者接受双耳短音刺激,记录P300波潜伏期与波幅。
1.3统计学处理数据输入SPSS 18.0统计学软件建立数据库,计数资料以构成比(%)或率(%)表示,呈正态分布计量资料以均数±标准差表示,非正态分布计量资料以中位数和四分位数间距表示。
2 结果
2.1临床特点主要临床表现为执行功能障碍(32例,74.42%)、行为去抑制(29例,67.44%)、淡漠或惰性(22例,51.16%)、同情心/同理心丧失(20例,46.51%)、记忆力下降(14例,32.56%)、口欲亢进(9例,20.93%)、刻板或仪式化行为(3例,6.98%)、语言障碍(1例2.33%)。24例(55.81%)患者随病情进展出现一系列非特异性症状,包括失眠(23例)、焦虑(5例)、幻觉(3例)、妄想(2例)等。
2.2神经心理量表评定
2.2.1认知功能:43例FTLD患者MMSE评分6~28分,中位数为18.00分,四分位数间距为14.00分;MoCA评分1~27分,中位数为12.00分,四分位数间距为11.00分,亚项分析表明FTLD患者在执行功能、语言、注意力、抽象能力和延迟回忆等方面分值明显降低,定向力分值降低则不明显(表1)。
2.2.2神经精神行为:43例FTLD患者NPI评分0~79分,中位数为23.00分,四分位数间距为33.00分,患者出现精神行为异常最多者为情感淡漠(62.79%),其次为易激惹(58.14%)、激越(55.81%),而情绪高涨/欣快感最少(16.28%)(表2)。患者FBI评分为0~46分,中位数为17.00分,四分位数间距为15.00分,其中FBI-A评分0~21分,中位数为9.00分,四分位数间距为9.00分,FBI-B评分0~19分,中位数为8.00分,四分位数间距为6.00分。HAMD评分为0~19分,中位数为5.00分,四分位数间距为7.00分。ADL评分为20~45分,中位数为27.00分,四分位数间距为12.00分。
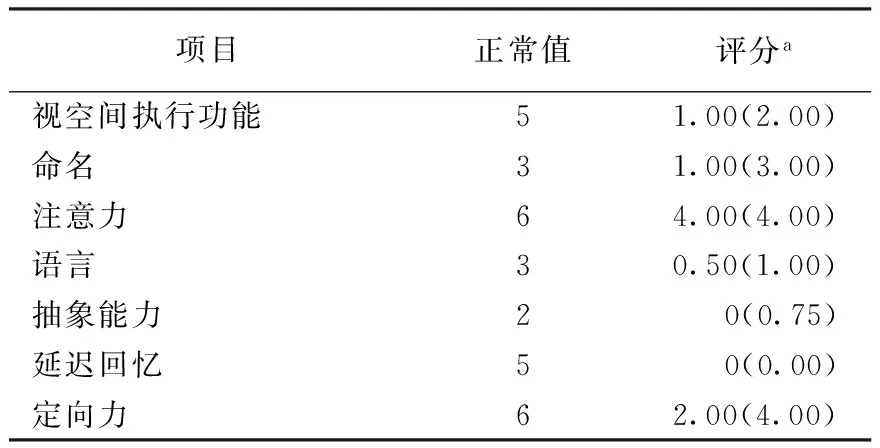
表1 FTLD患者MoCA各亚项评分结果(n=43)
注:FTLD:额颞叶变性,表2~3、图1~2同;MoCA:蒙特利尔认知评估量表;a数据以中位数(四分位数间距)表示

表2 FTLD患者NPI各亚项评分及阳性患者例数(n=43)
注:NPI:神经精神量表;a数据以中位数(四分位数间距)表示
2.3影像学检查MRI表现为单/双侧额叶和/或颞叶萎缩(图1),其中对称性萎缩20例(46.51%),
不对称性萎缩23例(53.49%,其中左侧大脑半球萎缩15例,右侧大脑半球萎缩8例)。8例(18.60%)患者伴有不同程度海马萎缩(图1)。6例患者行FDG-PET检查,表现为对称/非对称性额叶和(或)颞叶为主的低代谢,4例为不对称性(均为左侧显著),并伴有皮质下核团(杏仁核、海马、尾状核、纹状体、豆状核及下丘脑等)低代谢,行Neuro Q软件分析后筛选出5个最低代谢区(表3,图2)。
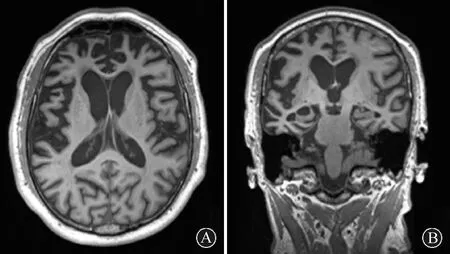
图1 某例FTLD患者头颅MRI轴位T1WI相显示双侧额颞叶对称性萎缩(A),冠状位显示双侧颞叶、海马萎缩(B)
2.4尿液AD7c-NTP水平及APOE基因型分析43例FTLD患者尿液AD7c-NTP水平为0.51~4.71 ng/mL,平均(3.23±1.78)ng/mL,21例(48.84%)患者尿液AD7c-NTP水平高于正常值(0~1.5 ng/mL)。43例患者APOE基因型分布,ε3/3基因型24例(55.81%),ε3/4基因型11例(25.58%),ε2/3基因型7例(16.28%),ε4/4基因型1例(2.33%),APOEε4等位基因的表达频率15.12%。
2.5神经电生理检查22例FTLD患者行事件相关电位P300检查,结果显示Pz引导点的潜伏期为(397.09±45.6)ms ,波幅为(-3.90±12.3)μV,Cz引导点的潜伏期为(395.87±47.18)ms,波幅为(-4.78±16.09)μV,潜伏期均有不同程度延长,波幅降低。

表3 FTLD患者FDG-PET检查显示前5个代谢减低区
3 讨论
额颞叶痴呆是以额叶和(或)颞叶进行性萎缩为病理学特征,以进行性精神行为异常和语言功能障碍为主要表现的临床症候群,是早发性痴呆的首要病因[1-2]。国外报道FTLD好发于45~65岁的中老年人[6]。该研究43例患者发病平均年龄为(63.02±6.28)岁,起病隐袭,就诊时平均病程为(2.32±1.21)年。通过对43例FTLD患者进行行为-认知量表评价发现,患者出现情感淡漠、激越、异常运动行为、幻觉、易激惹和脱抑制等精神行为障碍,在执行功能、语言、注意力、延迟回忆及计算力等方面能力也有所降低,但定向力降低则不明显。国外学者通过对FTLD 和AD的对比研究提出,FTLD患者主要表现为额叶的执行功能障碍,而记忆力和定向力好于AD患者[7-8]。
AD7c-NTP属于神经丝蛋白(NTP)家族,当神经元退行性变时AD7c-NTP表达增加,并可通过血-脑脊液屏障进入外周血,随病情发展,外周血中其水平升高后经尿液排出,研究认为尿AD7c-NTP水平升高与病情严重程度呈正相关[9]。王艳等[10]报道AD患者尿液AD7c-NTP表达水平与MoCA评分呈负相关,且FTLD患者亦存在尿液AD7c-NTP表达升高。该研究结果显示,21例FTLD患者尿AD7c-NTP水平有不同程度升高,提示尿液AD7c-NTP表达变化可能有助于FTLD的诊断。
既往研究结果显示ApoEε4等位基因和FTLD的发病有相关性。Fabre等[11]研究表明,与对照组相比,在FTLD患者中ApoEε4基因型频率升高。ApoE基因型不仅影响FTLD 发病风险而且携带 ApoEε4等位基因与较差的临床预后有关,建议将ApoE基因视为 FTLD 发病的一个疾病修饰因子[12]。本研究结果显示FTLD患者APOEε4等位基因表达频率为15.12%,提示ApoE基因变异可能是 FTLD 发病的潜在危险因素。
FTLD典型MRI表现为前脑(额颞叶)萎缩明显,晚期可累及基底节[13],但头颅MRI表现正常不能排除FTLD诊断,因疾病早期MRI变化可不明显。本组患者MRI表现为单侧或双侧额叶和/或颞叶对称性或非对称性萎缩为主,8例(16.3%)患者尚伴有不同程度海马萎缩,提示存在海马萎缩不能简单诊断为AD。18F-FDG-PET显示额叶、颞叶低灌注或低代谢是FTLD特征性改变[14]。本组6例患者行FDG-PET检查,表现为对称或非对称性的额叶、前颞叶和前扣带回葡萄糖低代谢改变,符合FTLD的影像学特点。
事件相关电位P300来源于顶叶深部边缘系统的海马结构的认知电位,是检测感知、印象、记忆、推理等心理活动的电生理指标。Chen等[15]对AD及FTLD患者事件相关电位研究发现,AD患者与对照组相比P300波潜伏期明显延长,而FTLD患者P300潜伏期较对照组亦明显延长,且波幅较对照组降低,表明P300对AD和FTLD的诊断具有重要价值。本研究检测了22例FTLD患者的P300,结果显示各引导点的P300波潜伏期不同程度延长,波幅降低,提示FTLD患者的记忆、理解、推理等方面存在功能障碍。P300不但可以为AD提供客观的指标, 对于FTLD认知损害的早期诊断、鉴别、疗效观察可能亦具有重要的实用价值。
综上所述,该研究结果显示FTLD患者早期临床表现以行为、执行功能障碍为多见,行为-认知量表结合FDG-PET检查可能有助于FTLD诊断; FTLD患者P300波的潜伏期和波幅也可出现变化,可能有助于发现患者记忆、推理功能障碍。FTLD患者也可以出现APOEε4等位基因的表达以及尿AD7c-NTP的水平变化。由于本研究所选FTLD患者的诊断是基于临床表现、成套量表及影像学检查,仅能诊断为“很可能”的FTLD,暂无病理学依据,因此,有关尿AD7c-NTP水平、血ApoEε4等位基因等生物标志物与FTLD的确切关系尚不清楚,需要进一步研究。
[1]Pelicano PJ, Massano J. Clinical, genetic and neuropathological features of frontotemporal dementia: an update and guide[J]. Acta Med Port, 2013,26(4):392-401.
[2]周玉颖, 李攀. 额颞叶变性临床诊断标准研究进展[J].中国神经免疫学和神经病学杂志, 2014,21(05):308-313.
[3]Karageorgiou E, Miller BL. Frontotemporal lobar degeneration: a clinical approach[J]. Semin Neurol, 2014,34(2):189-201.
[4]Neary D, Snowden JS, Gustafson L, et al. Frontotemporal lobar degeneration: a consensus on clinical diagnostic criteria[J]. Neurology, 1998,51(6):1546-1554.
[5]Rascovsky K, Hodges JR, Knopman D, et al. Sensitivity of revised diagnostic criteria for the behavioural variant of frontotemporal dementia[J]. Brain, 2011,134(Pt 9): 2456-2477.
[6]Roberson ED, Hesse JH, Rose KD, et al. Frontotemporal dementia progresses to death faster than Alzheimer disease[J]. Neurology, 2005,65(5):719-725.
[7]Yew B, Alladi S, Shailaja M, et al. Lost and forgotten? Orientation versus memory in Alzheimer’s disease and frontotemporal dementia[J]. J Alzheimers Dis, 2013, 33(2): 473-481.
[8]Stopford CL, Thompson JC, Neary D, et al. Working memory, attention, and executive function in Alzheimer’s disease and frontotemporal dementia[J]. Cortex, 2012, 48(4): 429-446.
[9]陈英道, 石胜良, 张健, 等. AD7 C-NTP 对阿尔茨海默病源性轻度认知功能损害患者诊断的临床价值[J]. 中华医学杂志, 2014(21):1613-1617.
[10]王艳, 李攀, 陈嫄, 等. 尿液 AD7c-NTP表达变化对痴呆诊断价值的探讨[J]. 中国现代神经疾病杂志, 2015,8(15):649-654.
[11]Fabre SF, Forsell C, Viitanen M, et al. Clinic-based cases with frontotemporal dementia show increased cerebrospinal fluid tau and high apolipoprotein E epsilon4 frequency, but no tau gene mutations[J]. Exp Neurol, 2001,168(2):413-418.
[12]Borroni B, Grassi M, Agosti C, et al. Establishing short-term prognosis in Frontotemporal Lobar Degeneration spectrum: role of genetic background and clinical phenotype[J]. Neurobiol Aging, 2010,31(2):270-279.
[13]Whitwell JL, Przybelski SA, Weigand SD, et al. Distinct anatomical subtypes of the behavioural variant of frontotemporal dementia: a cluster analysis study[J]. Brain, 2009,132(Pt 11):2932-2946.
[14]牛娜, 崔瑞雪, 张振馨. 语义性痴呆与进行性非流利失语患者18F-FDGPET/CT脑显像特征分析[J]. 中国神经免疫学和神经病学杂志, 2014(05):314-318.
[15]Chen L, Zhou Y, Liu L, et al. Cortical event-related potentials in Alzheimer’s disease and frontotemporal lobar degeneration[J]. J Neurol Sci, 2015,359(1-2):88-93.
Clinicalandbiologicalmarkers’profilesoffrontotemporallobardegeneration
DOUYuchao,ZHANGHuihong,WANGYan,ZHANGMiao,TIANZhiyan,WANGPan,ZHOUYuying*.
*DepartmentofNeurology,TianjinHuanhuHospital,Tianjin300053,China
ZHOU Yuying,Email:qiying789@sina.cn
ObjectiveTo describe the clinical, neuroimaging and biological markers’ profiles of frontotemporal lobar degeneration (FTLD).MethodsForty-three patients with FTLD were retrospectively evaluated by the clinical data, including general data, clinical features, neuropsychological scale scores, APOEε4, AD7c-NTP, MRI and PET-CT.ResultsThe main manifestations of early stage were executive function deficits and behavioral disinhibition. MRI revealed symmetrical or asymmetrical atrophy of the frontal and/or temporal lobes, and the atrophy of hippocampus was also demonstrated. FDG-PET showed symmetrical or asymmetrical glucose metabolism decrease in the anterior hemisphere. The APOEε4 frequency was 15.12%, the urine AD7c-NTP level was (3.23±1.78) ng/ml, which was higher than the normal range. P300period in FTLD patients showed different degrees of latency extension and amplitude decrease.ConclusionsThe early symptoms of FTLD patients are mostly behavioral disinhibition and executive function deficits, memory disorders can also appear. Cognitive behavioral scales and FDG-PET examination maybe helpful for FTLD diagnosis. The incubation and amplitude of P300wave can also change in FTLD patients, which may help to identify patients with memory dysfunction. Patients with FTLD can express APOEε4 allele and also had higher AD7c-NTP in urine.
frontotemporal dementia; frontotemporal lobar degeneration; AD7c-NTP; apolipoproteins E; event-related potentials, P300
10.3969/j.issn.1006-2963.2017.05.007
天津市科技计划项目(13ZCZDSY01600);天津市卫生局科技攻关项目(13KG121)
300053天津市环湖医院神经内科
周玉颖,Email:qiyin9789@sina.cn
R 742.8+9
A
1006-2963(2017)05-0339-05
2017-03-31)
(本文编辑:时秋宽)
