QuEChERS-气相色谱/串联质谱法同时测定杨桃中37种农药残留
2017-10-19李萍萍吴学进
李萍萍, 程 景, 吴学进, 万 瑶
(1.中国热带农业科学院分析测试中心,海南海口 571101;2.黑龙江省农产品质量检验检测中心,黑龙江哈尔滨 150090)
杨桃属酢浆草科五敛子属(AverrhoacarambolaL.)植物的果实,主要种植在热带和亚热带地区,是典型的热带水果。其成熟果实甜而多汁、略酸,果肉富含类胡萝卜素、维生素C、多酚等,营养丰富,深受消费者喜爱[1]。由于热带农业环境高温高湿、病虫害较多[2],为提高产量,目前普遍采用农药进行防治。虽然农药对于防治农作物的病虫害起着积极的作用,但是农药的不合理使用会危害人们的身体健康甚至生命。欧盟规定了杨桃中406种农药的最大残留限量值(MRL)。同时国际食品法典(CAC)、美国、日本等国家或组织均对杨桃中的农药残留设定了严格的最大残留限量值。
农药残留的测定方法主要有高效液相色谱法(HPLC)[3]、气相色谱法(GC)[4]、气相色谱-质谱法(GC-MS)[5]、气相色谱-串联质谱法(GC-MS/MS)[6]及高效液相色谱-串联质谱法(HPLC-MS/MS)[7 - 8]。其中,GC-MS/MS法不仅能够同时检测多种农药,且定性效果好,不易出现假阳性。传统的农药残留样品前处理技术普遍采用有机溶剂提取,再经过固相萃取小柱净化,实验步骤繁琐,且使用大量有毒试剂。QuEChERS(Quick,Easy,Cheap,Effective,Rugged and Safe)技术具有简单、快速、便宜、试剂用量少、适应范围广等特点,已被广泛用于果蔬中的农药残留检测[9 - 10]。本研究采用1%乙酸乙腈提取和QuEChERS净化,建立了QuEChERS-气相色谱/串联质谱检测杨桃中37种农药残留的方法。该方法涵盖了有机磷类、有机氯类和拟除虫菊酯类等农药,并且采用基质匹配标准曲线进行定量,降低了基质效应,提高了分析的灵敏度,可用于杨桃中农药残留的检测。
1 实验部分
1.1 主要仪器、试剂与材料
Agilent 7890A型气相色谱仪-Agilent 7000A 型三重四极杆串联质谱仪(美国,Agilent 公司);Trace TR-5毛细管色谱柱(美国,Thermo公司);高速离心机(美国,Scientific Industries);旋转蒸发仪(日本,东京理化器械独资工厂);旋涡混合器(德国,IKA公司)。
标准物质:敌敌畏、乙酰甲胺磷、氧乐果、灭线磷、治螟磷、α-666、β-666、γ-666、五氯硝基苯、特丁硫磷、地虫硫磷、百菌清、δ-666、乙烯菌核利、甲基对硫磷、毒死蜱、倍硫磷、对硫磷、三唑酮、腐霉利、硫环磷、苯线磷、三唑磷、联苯菊酯、甲氰菊酯、三氯杀螨醇、伏杀硫磷、氯氟氰菊酯、哒螨灵、蝇毒磷、氟氯氰菊酯、氯氰菊酯、氟氰戊菊酯、氟胺氰菊酯、氰戊菊酯、苯醚甲环唑、溴氰菊酯(1 000 μg/mL,天津农业部环境质量监督检验测试中心)。乙腈、正己烷(色谱纯,美国Fisher Scientific公司);氯化钠、乙酸、乙酸钠、无水硫酸镁(分析纯,国药集团化学试剂有限公司);柠檬酸钠(分析纯,西陇化工股份有限公司);柠檬酸氢钠(分析纯,阿拉丁公司);N-丙基乙二胺粉(PSA)、C18粉均购自美国Agilent公司。实验用超纯水由美国Millipore公司Milli-Q超纯水净化系统制备。
实验所用杨桃样品均来自海口市场,随机采样。
1.2 标准溶液配制
农药单标准储备溶液:各取1 mL(1 000 μg/mL)农药标准溶液分别置于10 mL容量瓶中,用正己烷溶解并定容至刻度,配制成质量浓度为100 mg/L的单标准储备液,储存于-18 ℃冰箱中备用。混合标准工作溶液:各取1.0 mL 上述单个农药标准储备液于50 mL容量瓶中,用正己烷定容至刻度,配制成质量浓度为2 mg/L的混合标准工作溶液。基质校准工作溶液:精确称取5.00 g空白杨桃样品各5份,按1.3节方法进行样品处理(蒸干未定容)后,分别加入0.01、0.02、0.05、0.10和0.50 mL混合标准工作溶液,用正己烷定容到2 mL,分别配制成质量浓度为0.01、0.02、0.05、0.1和0.5 mg/L的基质校准系列工作溶液。按照1.4节所述GC-MS/MS进样条件,以待测物定量离子的峰面积y对质量浓度x(mg/L)作标准曲线,得到37种农药的线性方程及相关系数。
1.3 样品前处理
称取代表性样品500 g于食品料理机中搅碎、混匀,密封,作为试样,标明标记,于-20 ℃冰箱中保存,备用。将杨桃样品置于室温解冻后,立刻准确称取5 g试样(精确至0.01 g)于50 mL离心管中,依次加入5 mL 1%乙酸乙腈、4 g无水硫酸镁、1 g柠檬酸钠、1 g氯化钠和0.5 g柠檬酸氢钠,加盖迅速摇匀,水平震荡提取2 min后,6 000 r/min离心3 min。取3 mL上清夜转移至含有150 mg PSA、150 mg C18、900 mg无水硫酸镁的15 mL具塞离心管中,水平震荡2 min,6 000 r/min离心3 min,取1 mL上清液于50 mL鸡心瓶中,40 ℃水浴中旋转蒸发浓缩至干,用正己烷定容至2 mL,经过0.22 μm尼龙滤膜过滤后,供GC-MS/MS检测。
1.4 气相色谱与质谱条件
色谱条件:Trace TR-5色谱柱(30 m×0.25 mm×0.25 μm),进样口温度240 ℃;进样方式:不分流进样;恒流模式:流速1.0 mL/min;载气:He(≥99.999%);柱温采用程序升温,初始温度:70 ℃,保持2 min,以25 ℃/min的速度上升到150 ℃,以3 ℃/min的速度上升到200 ℃,再以8 ℃/min的速度上升到280 ℃,保持10 min,共运行41.8 min,进样体积为1 μL。
质谱条件:离子源温度:230 ℃;电离能量:70 eV;四极杆温度:150 ℃;质谱接口温度:280 ℃;碰撞气流速:氮气1.5 mL/min,氦气2.25 mL/min;质谱分析模式:多反应监测(MRM);37种农药的监测离子对、碰撞能量(CE)、保留时间参数、检出限、线性相关系数见表1。
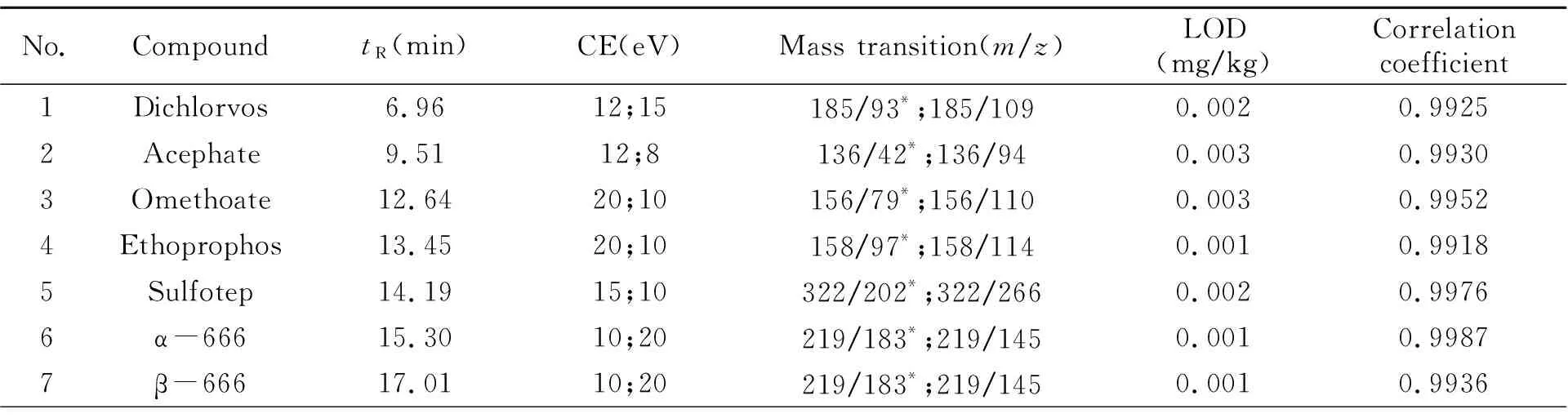
表1 37种农药残留量的气相色谱-串联质谱测定参数
(续表1)
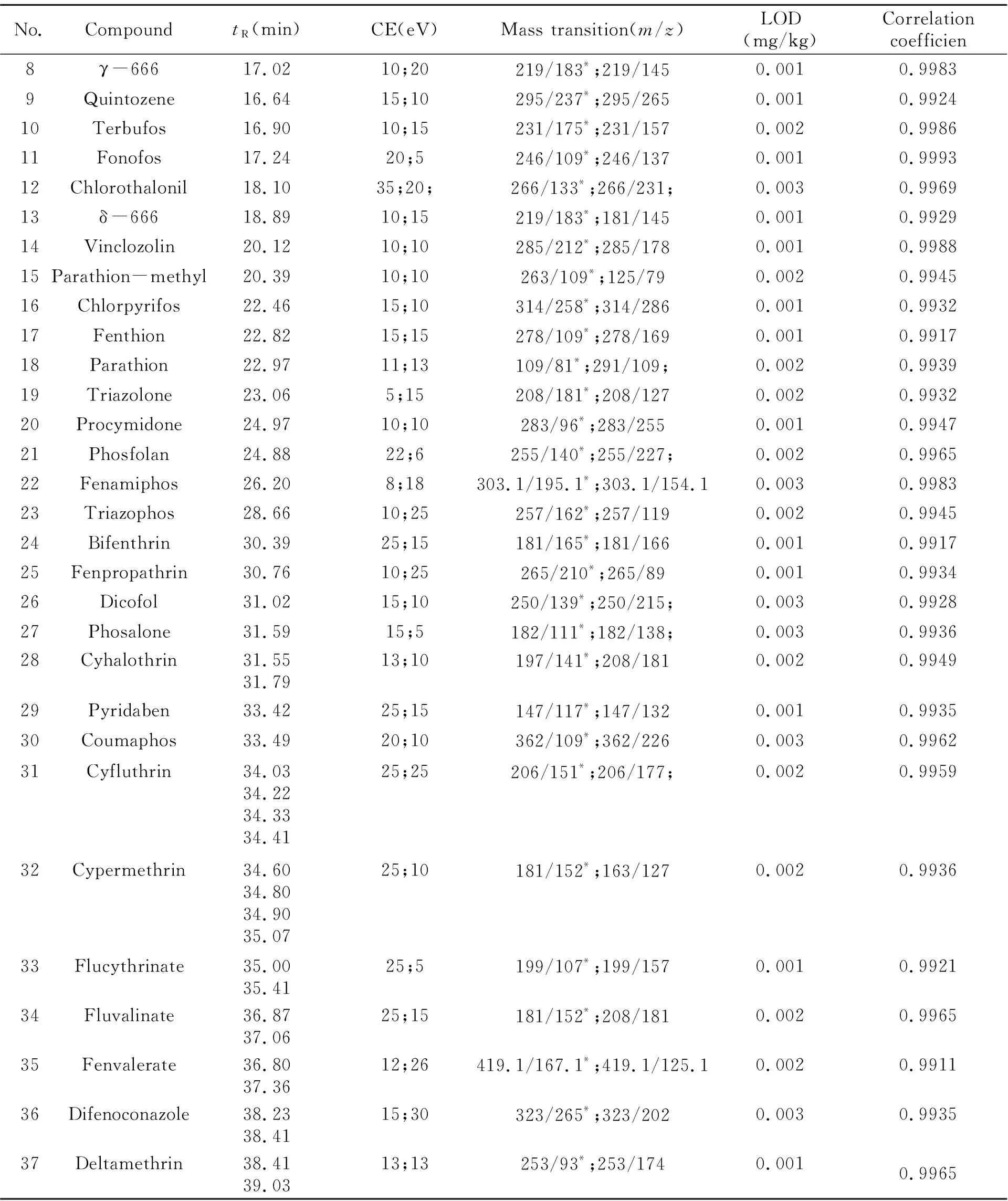
No.CompoundtR(min)CE(eV)Mass transition(m/z)LOD(mg/kg)Correlationcoefficien8γ-66617.0210;20219/183*;219/1450.0010.99839Quintozene16.6415;10295/237*;295/2650.0010.992410Terbufos16.9010;15231/175*;231/1570.0020.998611Fonofos17.2420;5246/109*;246/1370.0010.999312Chlorothalonil18.1035;20;266/133*;266/231;0.0030.996913δ-66618.8910;15219/183*;181/1450.0010.992914Vinclozolin20.1210;10285/212*;285/1780.0010.998815Parathion-methyl20.3910;10263/109*;125/790.0020.994516Chlorpyrifos22.4615;10314/258*;314/2860.0010.993217Fenthion22.8215;15278/109*;278/1690.0010.991718Parathion22.9711;13109/81*;291/109;0.0020.993919Triazolone23.065;15208/181*;208/1270.0020.993220Procymidone24.9710;10283/96*;283/2550.0010.994721Phosfolan24.8822;6255/140*;255/227;0.0020.996522Fenamiphos26.208;18303.1/195.1*;303.1/154.10.0030.998323Triazophos28.6610;25257/162*;257/1190.0020.994524Bifenthrin30.3925;15181/165*;181/1660.0010.991725Fenpropathrin30.7610;25265/210*;265/890.0010.993426Dicofol31.0215;10250/139*;250/215;0.0030.992827Phosalone31.5915;5182/111*;182/138;0.0030.993628Cyhalothrin31.5531.7913;10197/141*;208/1810.0020.994929Pyridaben33.4225;15147/117*;147/1320.0010.993530Coumaphos33.4920;10362/109*;362/2260.0030.996231Cyfluthrin34.0334.2234.3334.4125;25206/151*;206/177;0.0020.995932Cypermethrin34.6034.8034.9035.0725;10181/152*;163/1270.0020.993633Flucythrinate35.0035.4125;5199/107*;199/1570.0010.992134Fluvalinate36.8737.0625;15181/152*;208/1810.0020.996535Fenvalerate36.8037.3612;26419.1/167.1*;419.1/125.10.0020.991136Difenoconazole38.2338.4115;30323/265*;323/2020.0030.993537Deltamethrin38.4139.0313;13253/93*;253/1740.0010.9965
*quantitative transition;CE:collision energy.
2 结果与讨论
2.1 质谱条件的优化
将2 mg/L农药单标溶液在m/z50~550范围内进行全扫描,通过NIST谱库检索确定每种农药的保留时间,然后根据农药的标准质谱图选择响应值高、特征性强的离子作为母离子,然后对其进行产物离子扫描以获得二次碎裂产生的子离子。通过优化碰撞能量,选择丰度值大、特征性强、灵敏度高的离子作为子离子。最后将两对选定的母离子和子离子在MRM模式下进行检测。优化后各农药的母离子、子离子以及碰撞能量等质谱条件见表1。
2.2 提取溶剂的选择
乙腈、丙酮和乙酸乙酯是农药残留分析最常用的提取溶剂。在空白杨桃样品中添加0.5 mg/kg 37种农药混标,考察三种溶剂的提取效率。结果表明,丙酮极性较强,当其作为提取溶剂时,37农药的回收率较高,但丙酮在提取农药的同时许多杂质如叶绿素等也提取出来,增加了基质干扰效应及仪器的维护成本。乙酸乙酯作为提取溶剂时37种农药的回收率在60%~120%之间。与乙酸乙酯和丙酮相比,乙腈提取的色素、脂肪等非极性成分少,而且更容易通过盐析作用去除样品中的水分,减小了后续净化的困难及仪器的维护成本。乙腈作为提取溶剂时农药的回收率优于乙酸乙酯,在75%~120%之间。同时在溶剂中加入1%乙酸,提高了对碱性敏感农药如乙酰甲胺磷、百菌清等的回收率。故本实验选用1%乙酸乙腈作为提取溶剂。
2.3 提取盐缓冲体系的优化
本实验考察了柠檬酸盐缓冲体系(4 g无水硫酸镁、1 g柠檬酸钠、1 g氯化钠和0.5 g柠檬酸氢钠)和乙酸盐缓冲体系(6 g无水硫酸镁和1.5 g乙酸钠)对37种目标农药的加标回收率。结果表明柠檬酸盐缓冲体系有较高的回收率和较好的重现性,故后续实验选择柠檬酸盐缓冲体系萃取目标农药。
2.4 净化条件的优化
考察了不同添加量PSA和C18的净化效果,以空白杨桃样品为实验样品,37种农药的添加浓度均为0.5 mg/kg,PSA和C18的添加量分别为:(1)200 mg PSA;(2)150 mg PSA、150 mg C18;(3)200 mg C18;(4)400 mg PSA、400 mg C18;对目标农药进行加标回收率测定。实验发现采用150 mg PSA、150 mg C18处理后溶液虽含有微量色素,但37种农药的平均回收率均在75%以上,表明采用该方法处理后净化效果较为理想。这种现象是由于方法(4)净化材料中含有较多的C18,吸附了样品中更多的色素的同时也吸附了部分农药,因此为了提高实验的准确度以及降低实验成本,故本实验采用150 mg PSA、150 mg C18对样品进行净化。
2.5 萃取溶剂体积的优化
实验比较了不同体积(5.0、10.0、25.0 mL)的1%乙酸乙腈为萃取体系进行萃取,分别按照1.3样品前处理方法、1.4节仪器条件上机检测发现,随着萃取溶剂体积的增加,各农药的萃取效果基本一致。因此本实验选择5 mL乙腈作为萃取溶剂。
2.6 样品基质效应
利用不含农药的空白杨桃样品提取液配制37种农药的混合基质标准溶液,进行测定,与同浓度的混合溶剂标准溶液质谱响应值进行比较,考察杨桃基质对37种农药的基质效应。基质效应以基质标准溶液的目标农药定量离子质谱峰面积与溶剂标准的质谱峰面积相比增加或者减少的百分比来表示,以峰面积偏差15%来判定,偏差超过15%认为存在显著的基质效应[10]。对37种农药在杨桃样品中的基质效应进行考察,结果表明37种农药存在显著的基质增强效应。因此,为了降低基质效应对定量结果的影响,需要配制基质标准溶液对定量结果进行校正,基质标准现配现用。
2.7 方法的线性范围及检出限
按1.2节方法配制质量浓度为0.01、0.02、0.05、0.1和0.5 mg/L的基质校准工作溶液,按1.4节方法规定的色谱条件进样检测,以目标农药定量离子的峰面积y对质量浓度x(mg/L)作标准曲线,同时用最小二乘法进行线性回归,得到37种农药的线性方程及相关系数。结果表明:在0.01~0.5 mg/L范围内,37种农药的线性相关系数均大于0.99(表1),满足残留测定要求。
在空白样品中添加质量浓度为0.001、0.002、0.003、0.004、0.005、0.01 mg/kg的混合标准溶液,按照1.3节方法前处理后上机测定做添加回收实验,选择目标农药的响应值达到3倍信噪比(S/N=3)的添加浓度为方法的检出限。添加回收率在70%~120%之间,且响应值达到10倍信噪比(S/N=10)的添加浓度为方法的定量限。实验结果表明:该方法37种农药的检出限均低于0.003 mg/kg(表1),定量限均低于0.01 mg/kg,满足国内外残留限量要求,结果见表1。
2.8 方法的回收率及精密度
在空白杨桃样品中按0.01,0.05,0.5 mg/kg 3个水平进行添加回收实验,每个水平重复5次,结果显示,在0.01~0.5 mg/kg添加水平下,37种农药的平均回收率在72.9%~117%之间,相对标准偏差(RSD)≤9.6%,说明本方法得到的数据稳定、可靠,满足农药残留测定要求。
3 结论
本研究运用分散固相萃取净化-气相色谱-三重四极杆串联质谱分析(QuEChERS-GC-MS/MS),建立了同时测定杨桃中37种药残留量的方法。该方法在0.01~0.5 mg/kg添加水平下,37种农药的平均回收率在72.9%~117%之间,RSD≤9.6%,定量限低于0.01 mg/kg,可实现杨桃中敌敌畏等37种农药残留的定性与定量检测。
