表面等离子体共振-质谱联用技术研究进展
2017-10-19张一丁徐姝婷刘虎威
张一丁, 徐姝婷, 白 玉, 刘虎威
(北京大学化学与分子工程学院分析化学研究所,北京 100871)
1 前言
1902年,Wood等报道金属光栅在受到连续波长光照时产生的反常衍射现象[1]之后,Stern等在后续工作里研究了金属价电子受光照而产生共振的条件[2],并将其命名为表面等离子体共振(Surface Plasmon Resonance,SPR)。SPR是一种在分子间相互作用研究中广泛应用的分析技术,它利用金属表面的表面等离子体波(Surface Plasmon Wave,SPW)与检测光路间相互作用实现金属表面状态的监测,进而实现表面反应状态的监测。当其他条件相同时,SPR信号的改变直接源于芯片表面附近折射率的变化。若应用于分子间相互作用的研究,SPR可认为是一种质量敏感型检测方式,即其信号变化主要受到芯片表面所结合物质的质量变化影响。这个特点带来了SPR的最大优势,即可以进行非破坏性、无标记实际分析。1983年,Liedberg等[3]首次将SPR传感器应用于IgG抗原抗体相互作用体系的研究,此后SPR技术在生物传感领域得到了广泛的应用,研究目标包括相互作用反应的分析、特定目标化合物的检测以及药物高通量筛选等[4 - 9],可以进行生物大分子间的相互作用和涉及小分子相互作用体系的检测。特别地,由于相互作用的反应往往具备一定的特异性,因此SPR法也可用于从较为复杂的样品基质中快速分析特定目标化合物,如与疾病相关的标志物[10 - 12]等。但是SPR的质量敏感特点又会带来问题,即样品定性分析能力欠缺。在典型的SPR仪器和分析方法中,结果中观测到的是出射光性质的变化,对应的是相互作用过程导致的传感芯片表面附近的物质质量变化及折射率变化,难以获得关于被分析物分子结构的相关信息。此时,若分析目标体系中存在着未知化合物,则传统SPR法只能通过使用特异性相互作用过程来识别出特定目标化合物,除此之外难以对未知样品进行结构鉴定,这为SPR法研究领域的拓展带来了困难。因此,作为典型的具备强大定性分析能力的分析技术,质谱法(Mass Spectrometry,MS)与SPR的联用获得了重视。
质谱法可以提供有关样品分子结构重要信息,能够很好与SPR技术形成互补。SPR-MS联用,可以有效地在一次实验中同时或者先后获得相互作用反应的有关物理化学数据,以及参与相互作用反应的物质结构信息,进而用于确定样品结构。这样的应用前景大大促进了SPR-MS联用的有关研究,在最早的SPR与MS联用的尝试[13]后,科研工作者不断努力开发了多种联用手段,取得了一定成就。
在仪器联用有关研究中,两种或多种分析仪器之间的接口问题是主要难点。对于SPR-MS联用而言,接口问题主要表现为MS离子化方法的选择和发展。由于SPR-MS联用的目的在于鉴定参与相互作用的反应物,这意味着需要选择或者开发合适的离子化方法,有效地对经过SPR分析后的样品进行MS分析,其离子化对象既包括SPR分析过程中传感芯片表面结合的物质、流通溶液中未结合到芯片表面的物质、结合后被洗脱的物质,也包括芯片表面修饰的物质。这些目标物及其所处的状态为SPR-MS联用接口的开发指明了方向。目前报道的SPR-MS联用方法中,所使用的离子化方法主要有三类,分别是基质辅助激光解吸离子化(Matrix Assisted Laser Desorption Ionization,MALDI)、电喷雾离子化(Electrospray Ionization,ESI)以及敞开式离子化(Ambient Ionization)方法。以下即以离子化方法为分类依据,概述SPR-MS联用的有关研究进展。
2 基于MALDI的SPR-MS联用方法
使用MALDI法是较为简单的SPR-MS联用方式。通过MALDI联用SPR与MS是SPR-MS研究中最早发展的方法,至今也占据着重要的地位,也有一些综述文章涉及了对SPR-MALDI-MS联用方法的总结[14 - 16]。在它们的基础上,本文总结现有的SPR-MALDI-MS典型应用,列于表1中。
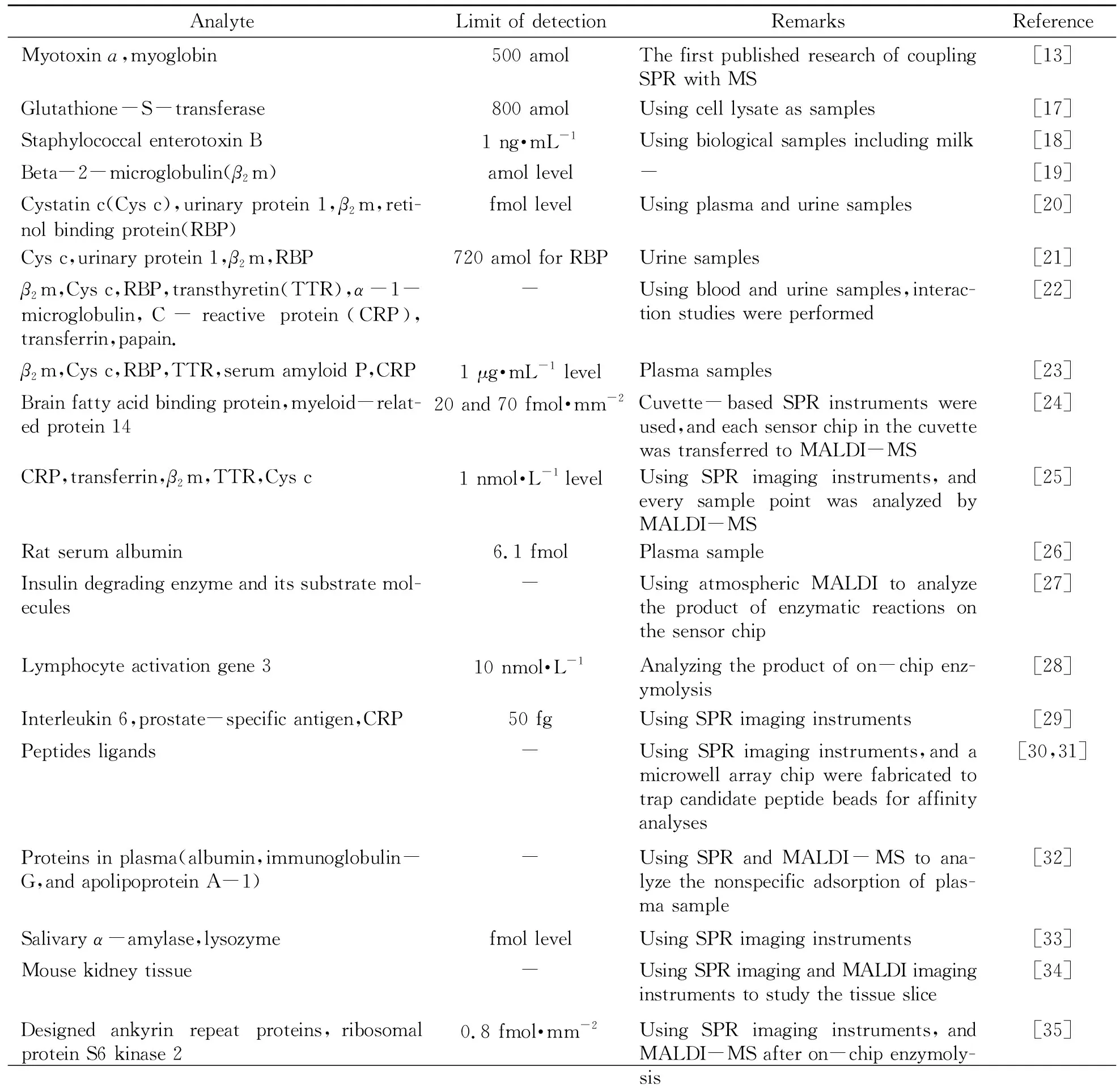
表1 目前报道的典型SPR-MALDI-MS联用应用
(续表1)
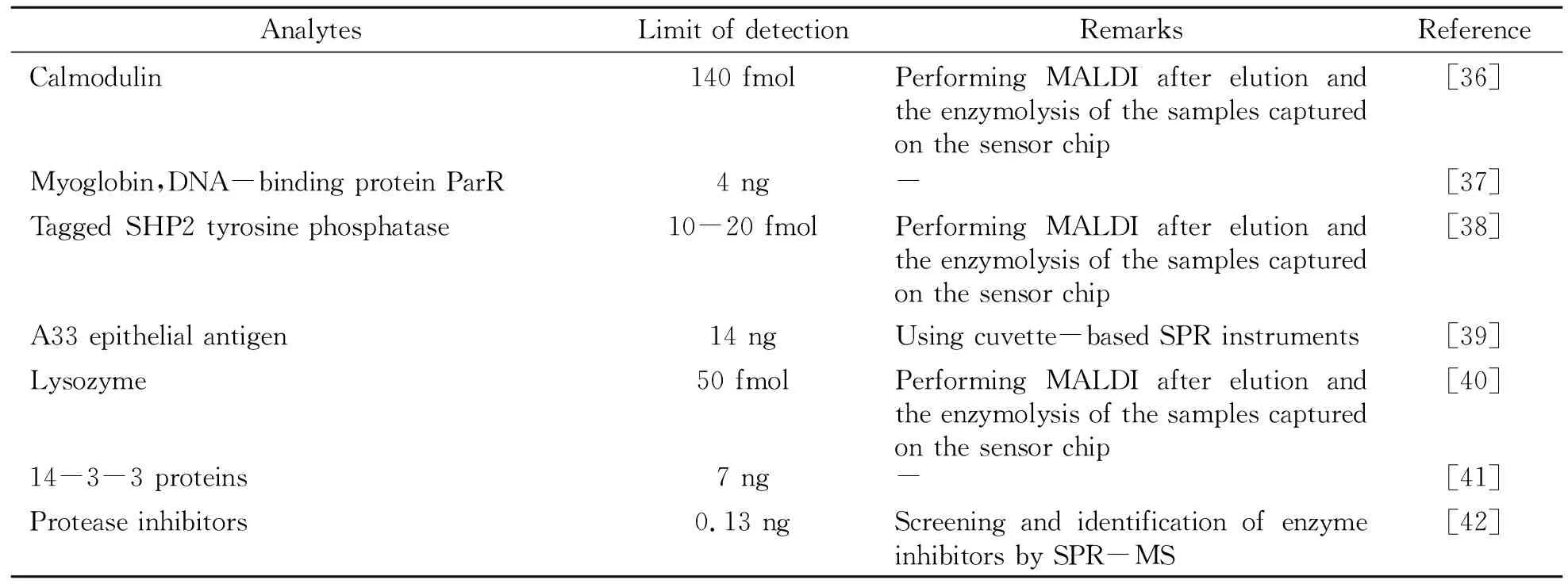
AnalytesLimit of detectionRemarksReferenceCalmodulin140 fmolPerforming MALDI after elution and the enzymolysis of the samples captured on the sensor chip[36]Myoglobin,DNA-binding protein ParR4 ng-[37]Tagged SHP2 tyrosine phosphatase10-20 fmolPerforming MALDI after elution and the enzymolysis of the samples captured on the sensor chip[38]A33 epithelial antigen14 ngUsing cuvette-based SPR instruments[39]Lysozyme50 fmolPerforming MALDI after elution and the enzymolysis of the samples captured on the sensor chip[40]14-3-3 proteins7 ng-[41]Protease inhibitors0.13 ngScreening and identification of enzyme inhibitors by SPR-MS[42]
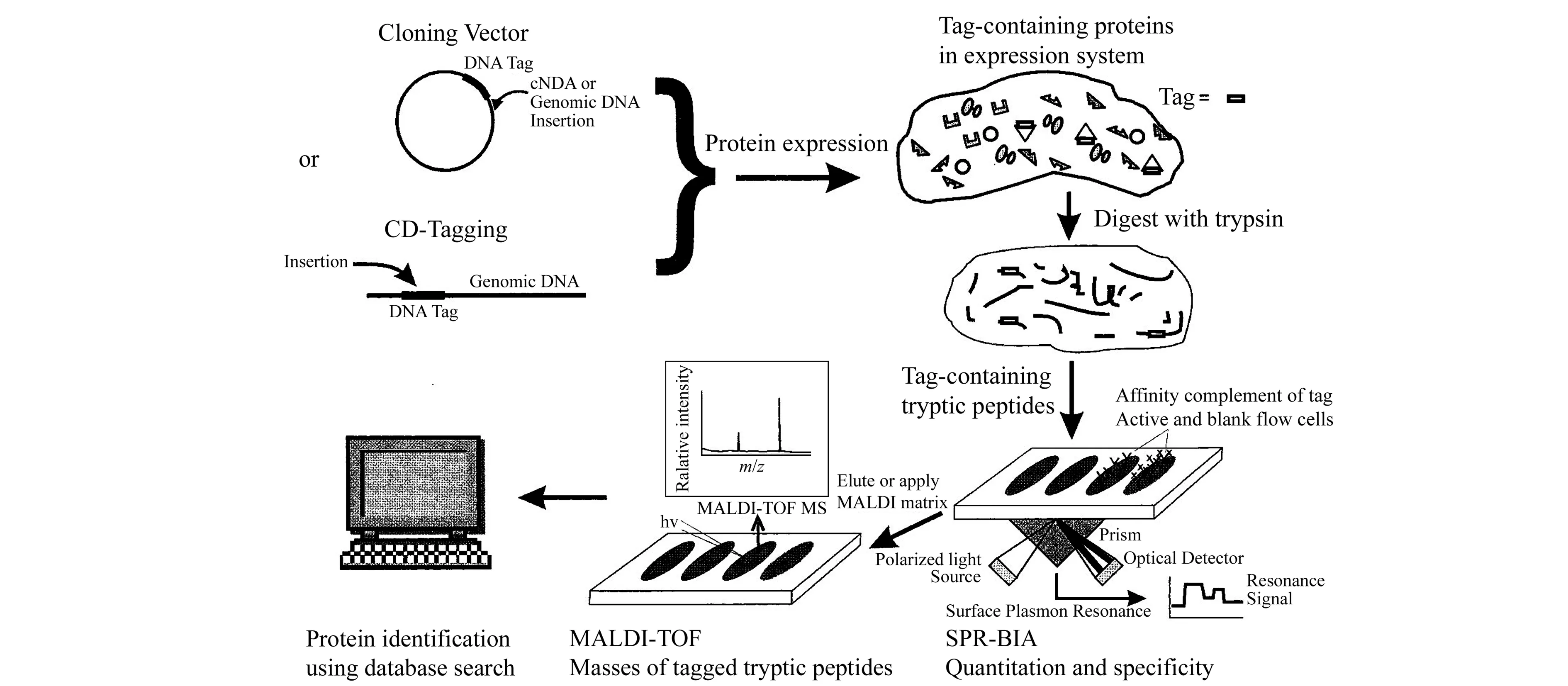
图1 首个报道的SPR-MS联用工作原理示意图(经许可后引用自[17],版权所有 1999 American Chemical Society)Fig.1 Illustration of the first published work of coupling SPR with MS(adapted with permission from [17],Copyright 1999 American Chemical Society)
由表中可以看到,SPR-MALDI-MS联用有两种思路,其一是使用MALDI直接分析处于传感芯片表面的样品;其二是使用MALDI分析从传感芯片表面洗脱、处理后的样品。而第一种思路又包括直接分析SPR传感芯片表面结合的物质,或在芯片表面进行原位酶解反应后再分析酶解产物两种方法。其中,使用MALDI直接分析芯片表面结合的物质,最初报道的SPR-MALDI-MS联用即采用这种方案[17],其原理示意图如图1所示。在此类SPR与MALDI-MS直接联用的方法中,SPR传感芯片本身即可以用作MALDI的样品基板。实验中可在SPR分析完成以后取出其传感芯片,在其表面涂布MALDI所需基质,干燥后即可装入MALDI仪器进行分析。如前所述,SPR的分析过程在芯片表面完成,其中样品可以几乎无损地固定于芯片表面。同时,对于MALDI过程而言,SPR传感芯片可视作惰性的刚性材料,这使得SPR分析后的样品状态特别适合于后续MALDI分析。在仪器方面,SPR-MALDI-MS联用的接口问题表现为将传感芯片送入MALDI样品室的过程中对仪器的要求,主要为对MALDI靶板进行一些改动以固定SPR芯片,或者将SPR芯片进行改动以使之便于送入MALDI样品室。这使得此类联用可以较为简便地实现,若使用大气压MALDI,则联用更为简易。在常见的SPR芯片形式之外,也有一些研究使用了其他种类的SPR传感芯片(及仪器),例如图2中通过SPR流通池侧壁的可拆卸式螺栓实现样品从SPR检测池到MALDI靶板的转移。部分情况下,SPR传感芯片表面所结合的样品难以通过直接MALDI分析实现离子化(比如基质涂布后共结晶状态不佳、样品在芯片表面结合能力过强、样品离子化效率低等),此时可以在芯片表面进行原位酶解反应,再涂布基质对酶解产物进行MALDI分析。一个典型的SPR-芯片表面酶解-直接MALDI分析的联用过程可见文献报道[28]。相对于SPR-MALDI直接联用,此类方法提高了MS离子化效率,并使得结果更易解析。除此之外,为了进一步改善MS分析效果,有时需要对样品进行更多的处理,例如酶解、反应、除盐、浓缩等,此时可以将芯片表面所结合物质洗脱、收集、处理后再进行MALDI分析。采用这种方式进行SPR-MALDI-MS联用的典型示意图如图3所示。在以图3为代表的SPR-MALDI联用方式中,在SPR分析完成后,均将芯片表面所结合的样品洗脱收集,进行一定的处理后再进行MALDI点样与分析。这使得SPR分析步骤与MALDI分析步骤相对独立,很大程度上避免了两者之间的相互干扰,例如芯片表面样品状态不适合MALDI分析,以及直接联用所需的仪器改动等。但是,这也带来了SPR-MALDI-MS联用中的最大问题,即两者的联用处于离线模式。事实上,无论是直接联用、芯片表面酶解后联用还是样品洗脱后联用,SPR-MALDI-MS联用均处于离线模式,SPR分析步骤与MALDI-MS步骤本质上是两个独立的实验。离线联用会导致分析步骤复杂化,并且MALDI分析时样品所处状态与SPR分析时容易出现较大差异,使得分析结果的可靠性降低。这也是至今仍然限制SPR-MALDI-MS发展的主要问题之一。
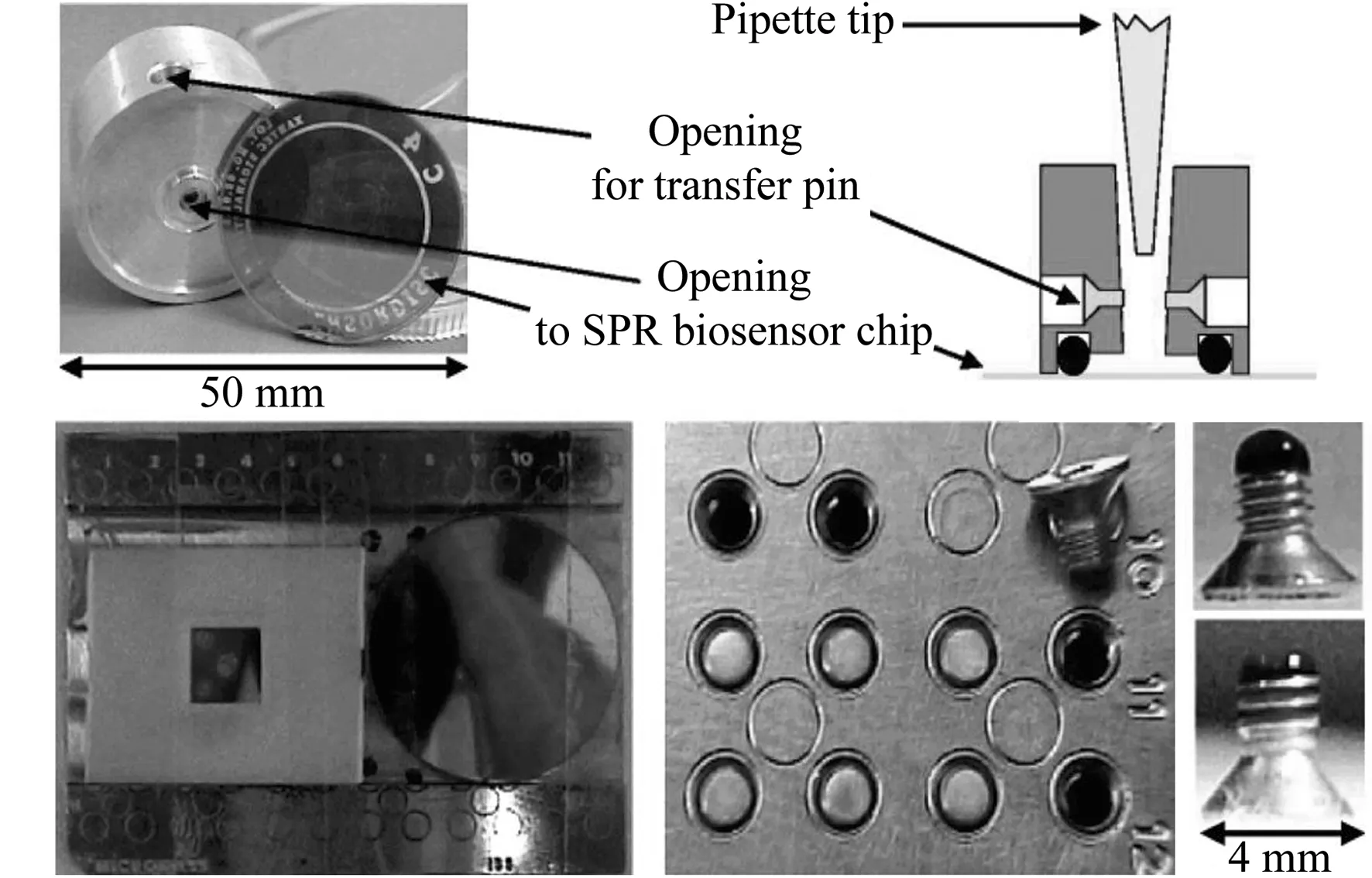
图2 通过螺栓转移样品的SPR-MALDI-MS联用工作原理示意图(经许可后引用自[24],版权所有2005 American Chemical Society)Fig.2 Illustration of coupling SPR with MALDI-MS using a transfer pin(adapted with permission from [24],Copyright 2005 American Chemical Society)
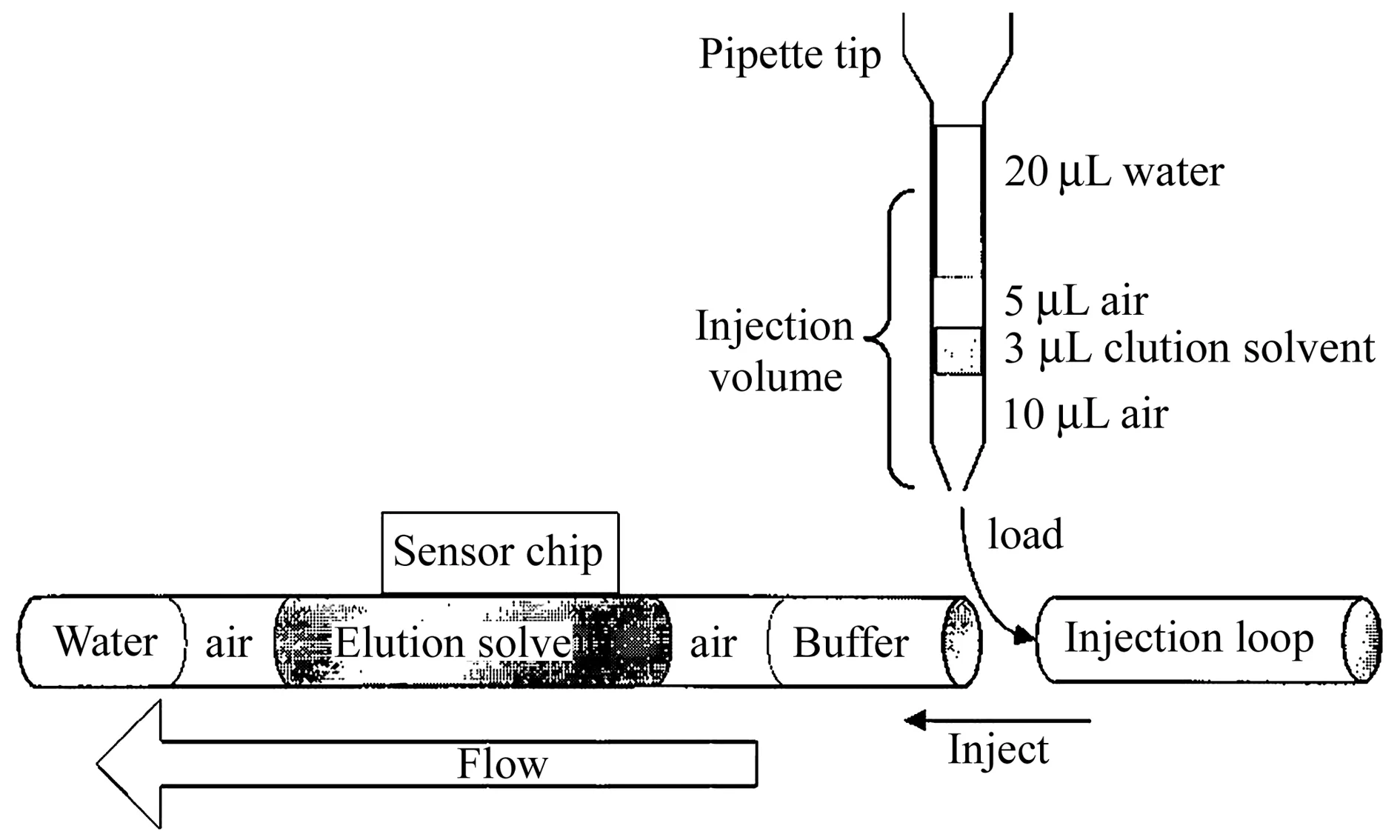
图3 将SPR芯片表面样品洗脱收集后进行MALDI分析的原理示意图(经许可后引用自[37],版权所有1998 American Chemical Society)Fig.3 Schematic diagram of coupling SPR with MALDI-MS after sample elution(adapted with permission from [37],Copyright 1998 American Chemical Society)
3 基于ESI的SPR-MS联用方法
SPR法是一种连续输送样品溶液的分析方法,其样品性质与高效液相色谱(HPLC)、毛细管电泳(CE)等存在着相近之处,这意味着HPLC-MS与CE-MS等发展过程中所使用的离子化方法可以借鉴到SPR-MS中。当代HPLC-MS与CE-MS中,ESI类离子化方法占据着主导地位,多数商品化接口装置均依据ESI原理而开发。同样,ESI也是实现SPR-MS联用的重要方法。SPR-ESI-MS联用的研究进展在前述综述[14 - 16]之中已有所总结,本文在其基础上,补充总结如表2所示。
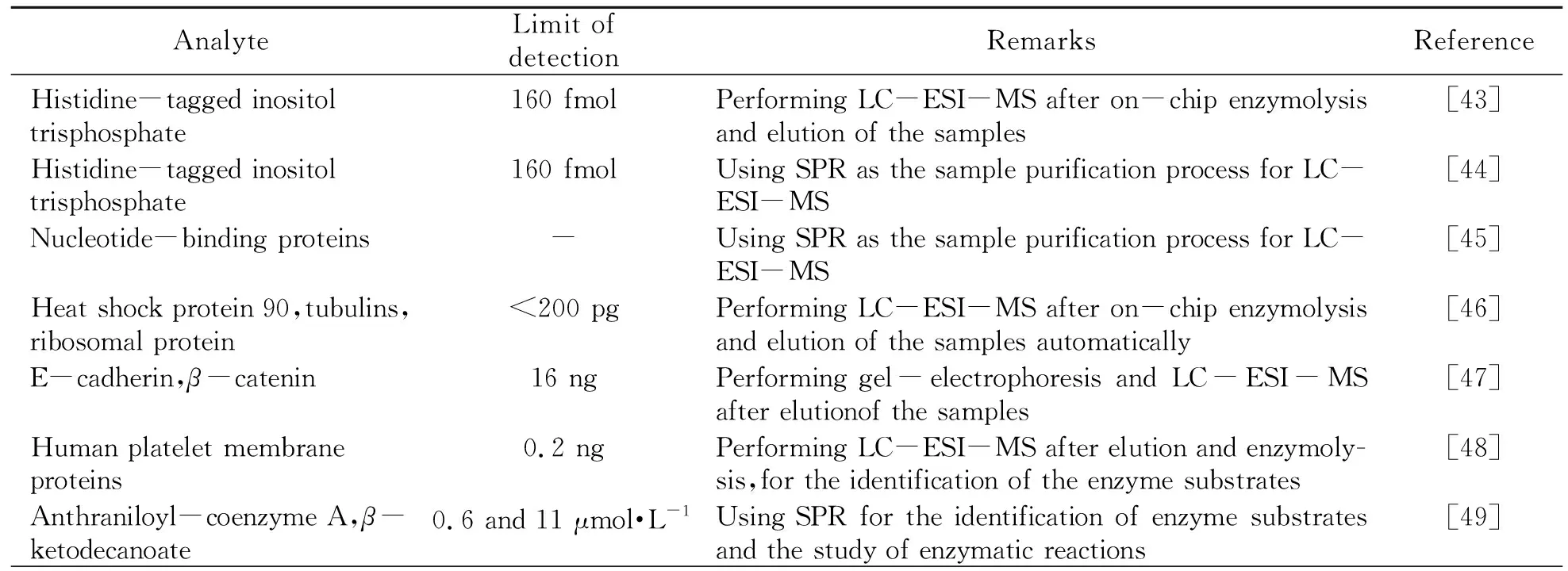
表2 目前报道的典型SPR-ESI-MS联用应用
(续表2)
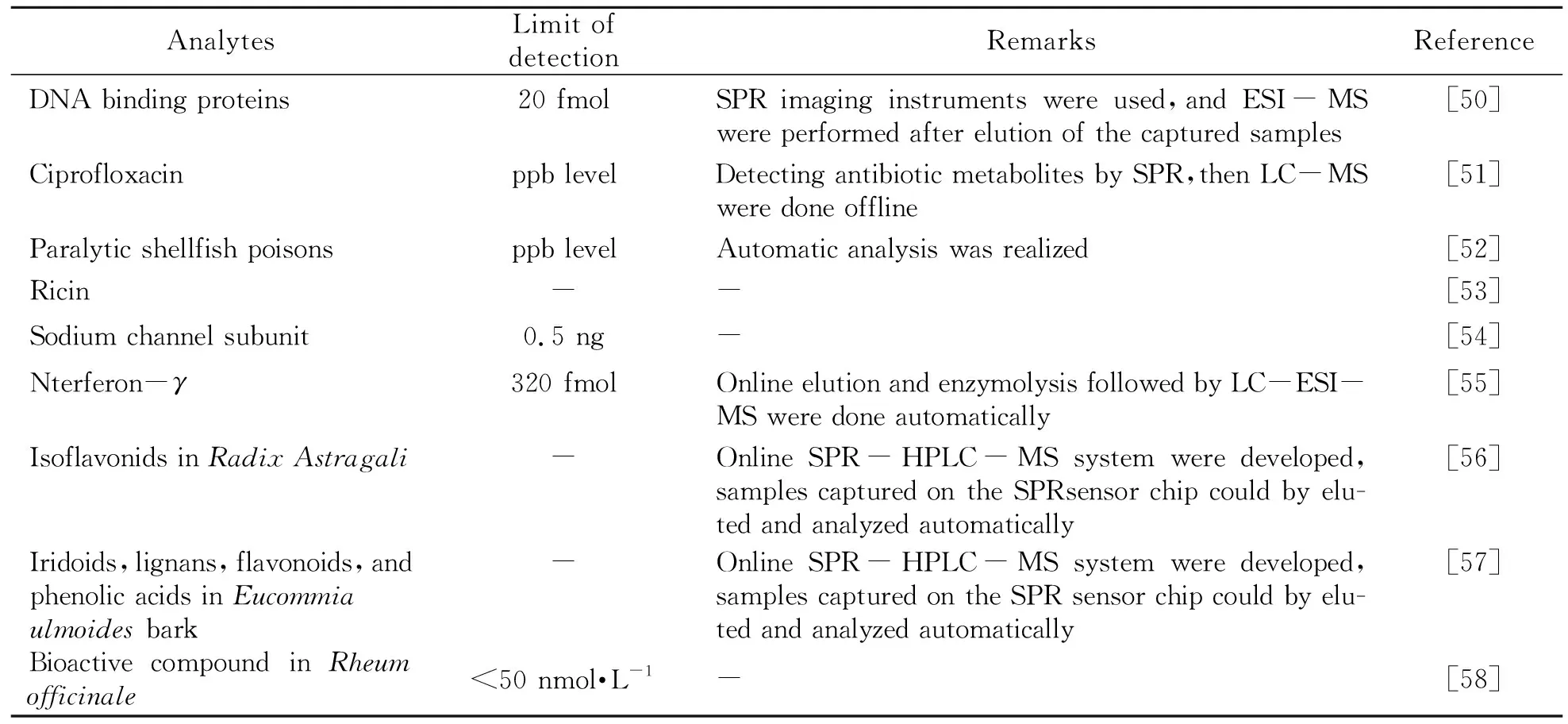
AnalytesLimit ofdetectionRemarksReferenceDNA binding proteins20 fmolSPR imaging instruments were used,and ESI-MS were performed after elution of the captured samples[50]Ciprofloxacinppb levelDetecting antibiotic metabolites by SPR,then LC-MS were done offline[51]Paralytic shellfish poisonsppb levelAutomatic analysis was realized[52]Ricin--[53]Sodium channel subunit0.5 ng-[54]Nterferon-γ320 fmolOnline elution and enzymolysis followed by LC-ESI-MS were done automatically[55]Isoflavonids in Radix Astragali-Online SPR-HPLC-MS system were developed,samples captured on the SPRsensor chip could by elu-ted and analyzed automatically[56]Iridoids,lignans,flavonoids,and phenolic acids in Eucommia ulmoides bark-Online SPR-HPLC-MS system were developed,samples captured on the SPR sensor chip could by elu-ted and analyzed automatically[57]Bioactive compound in Rheum officinale<50 nmol·L-1-[58]
与MALDI法不同,ESI针对的是溶液相的样品,因此它不能直接用于分析SPR传感芯片表面的样品。使用ESI法联用SPR与MS多数需要进行芯片表面样品的洗脱,然后进行ESI-MS的分析。一个典型的SPR-ESI-MS联用方法示意图如图4所示。图4所示的研究工作中,先通过Biacore X仪器完成样品的SPR分析,将活性物质捕集在芯片表面,此后进行芯片表面的酶解。完成后,将酶解产物洗脱并用一个HPLC预柱再次捕集,再将它连入HPLC-ESI-MS系统进行ESI分析。可见,该方法使用了芯片表面酶解后洗脱,再进行ESI分析的方式,SPR与MS的联用处于离线模式。此后,有研究人员在此思路上继续发展,通过使用阀系统连接SPR与LC-MS的液路,部分实现了二者的在线联用,其方法示意图如图5所示。
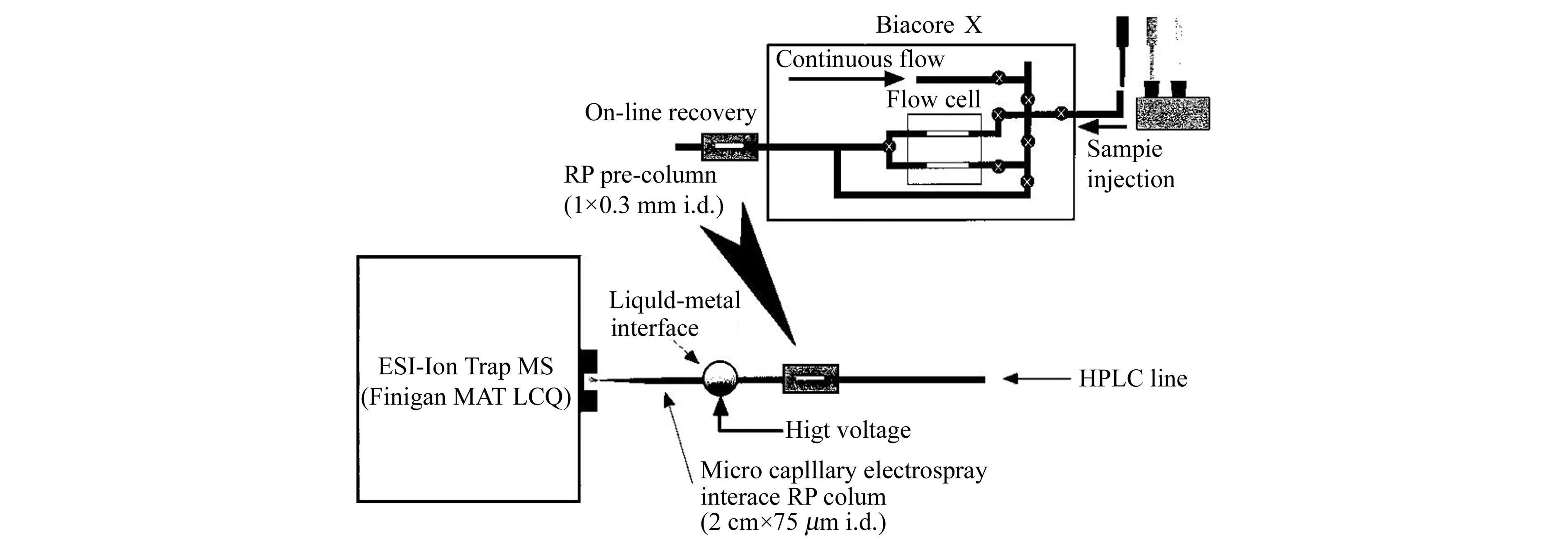
图4 典型的SPR-ESI-MS联用原理示意图(经许可后引用自[43],版权所有2000 American Chemical Society)Fig.4 Schematic diagram of coupling SPR with ESI-MS(adapted with permission from [43],Copyright 2000 American Chemical Society)
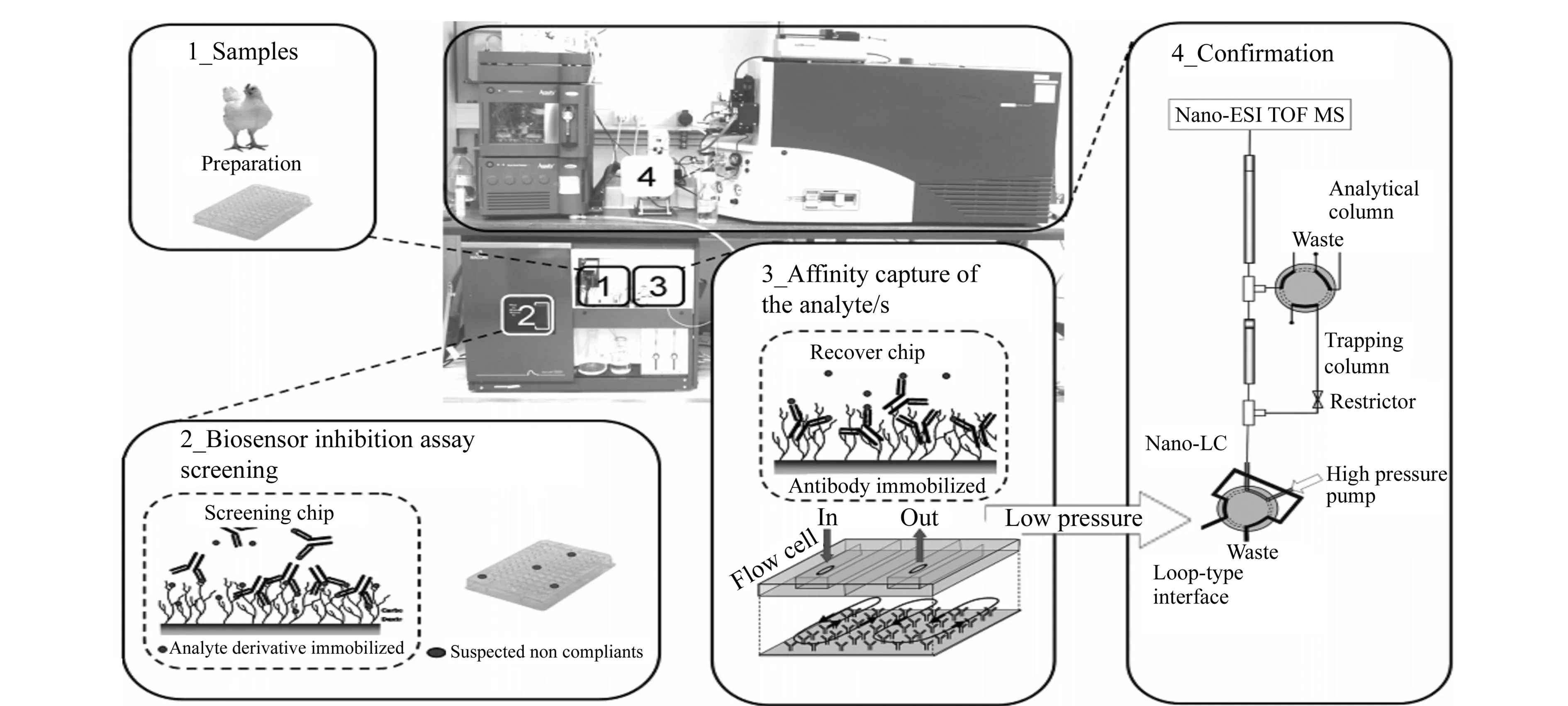
图5 SPR-nanoLC-ESI-MS在线联用原理示意图(经许可后引用自[51],版权所有2008 American Chemical Society)Fig.5 Schematic diagram of online coupling SPR with nanoLC-ESI-MS(adapted with permission from[51],Copyright 2008 American Chemical Society)
图5所示中使用了阀系统,将SPR分析液路、捕集环和捕集柱、LC-MS的液路连接为一个整体,可通过阀实现样品的SPR分析与捕集、MS分析的切换,不再需要手工将捕集柱从SPR系统拆下并转移至LC-MS系统,实现了SPR与ESI-MS的在线联用。在此基础上,进一步在系统中引入了在线酶解等装置,实现了SPR样品的洗脱、收集、酶解与ESI-MS分析,具体可见文献方法[55]。
SPR-ESI-MS是除了MALDI法之外重要的SPR-MS联用方法。可以看到,由于ESI源本身针对连续输送的液态样品设计,因此它可以较好地适配SPR的分析液路。但由于ESI不适合针对芯片表面开展分析,SPR-ESI-MS联用多通过洗脱后再进样的方式实现,经过多年发展已经在一定程度上实现了SPR与ESI-MS的在线联用。但SPR分析中往往需要模拟生理环境,因此经常使用较高浓度的非挥发性盐来构成缓冲溶液,此类样品会造成ESI过程的离子化抑制和离子源污染等问题,因此应尽量避免直接将含有非挥发性盐的样品溶液引入ESI-MS系统。这也是SPR-ESI-MS多采用洗脱-捕集后重新进样分析的重要原因。尽管实现了在线SPR与MS联用,但洗脱-捕集后重新进样分析的策略使得HPLC等额外的仪器系统成为必要,这使得SPR-ESI-MS有关方法和仪器系统均较为复杂,实验步骤和耗时也相对较长。
4 基于敞开式离子化方法的SPR-MS联用方法
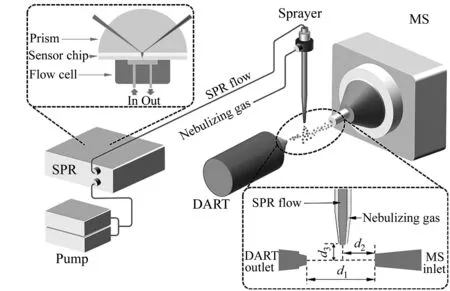
图6 SPR-DART-MS联用接口装置示意图(经许可后引用自[59],版权所有2015 American Chemical Society)Fig.6 Schematic diagram of the SPR-DART-MS interface(adapted with permission from [59],Copyright 2015 American Chemical Society)
在上述基于MALDI和ESI的SPR-MS联用方法之外,近年来还有一些其他的SPR-MS联用方式,主要使用敞开式离子化方法。其中,有利用低温等离子体类敞开式离子化方法中的实时直接分析离子化(Direct Analysis in Real Time,DART)和介质阻挡放电离子化(Dielectric Barrier Discharge Ionization,DBDI)实现SPR-DART-MS和SPR-DBDI-MS联用的方法,也有通过在SPR芯片表面直接实现电喷雾的SPR-MS联用方法。2015年,Zhang等报道了基于DART源的SPR-MS联用方法[59]。DART是一种典型的基于低温等离子体的敞开式离子源,作者发展了一种主要基于喷雾针和DART源的SPR-MS联用接口装置,其示意图如图6所示。该接口的设计中,作者在DART源和质谱仪入口之间放置了用于ESI的喷雾针,并将该喷雾针连接到SPR的分析液路以及雾化气管路。如此,样品溶液在经过SPR仪器分析后,将进入喷雾针形成雾化的液滴,继而在飞行过程中受到DART源作用发生离子化,最终进行MS分析。该装置在敞开式环境下操作,较好地利用了DART源能够耐受复杂样品基质的特点,成功地实现了SPR与MS的实时、在线、持续、直接联用,既能够用于分析SPR液路中由溶液输送的样品,也可以分析芯片表面捕集后洗脱下来的样品,并且能够较好地耐受样品溶液中的非挥发性物质。该接口装置在MALDI与ESI之外提出了新的SPR与MS联用的思路,解决了MALDI法难以实现在线联用、ESI法对非挥发性物质耐受性差的问题,操作直观、简便。在应用DART源以后的后续研究中,同一课题组继续发展了基于DBDI源的SPR-DBDI-MS联用接口装置[60],利用另一种重要的低温等离子体类敞开式离子源DBDI,同样成功实现了SPR与MS的实时在线直接联用,具有与使用DART源时相近的分析性能与更好的盐耐受性。
在DART源与DBDI源之外,Joshi等报道了另一种基于敞开式离子化的SPR-MS联用方法[61]。该方法并未使用独立的离子源装置,而是利用SPR传感芯片直接形成电喷雾。其方法原理示意图如图7所示。在该方法中,作者利用SPR芯片具有导电性金属薄层表面的特点,直接形成电喷雾。在SPR分析完成后,取出传感芯片,与高压电源连通。此后,在芯片表面滴加喷雾溶剂,以芯片的一个角对准质谱仪入口并略微倾斜芯片。此时,喷雾溶剂可以起到对芯片表面结合物质进行洗脱、富集的作用,并集中到芯片正对质谱仪入口的角落。当接通高压电源时,喷雾溶剂即可在芯片角落处形成电喷雾,实现SPR与MS的联用。尽管仍然处于离线模式,但该方法成功实现了SPR与MS的直接联用,不需要额外仪器装置,方法有效、简便,为SPR-MS有关研究提供了新的思路,是MALDI、ESI、DART和DBDI之外的重要补充。
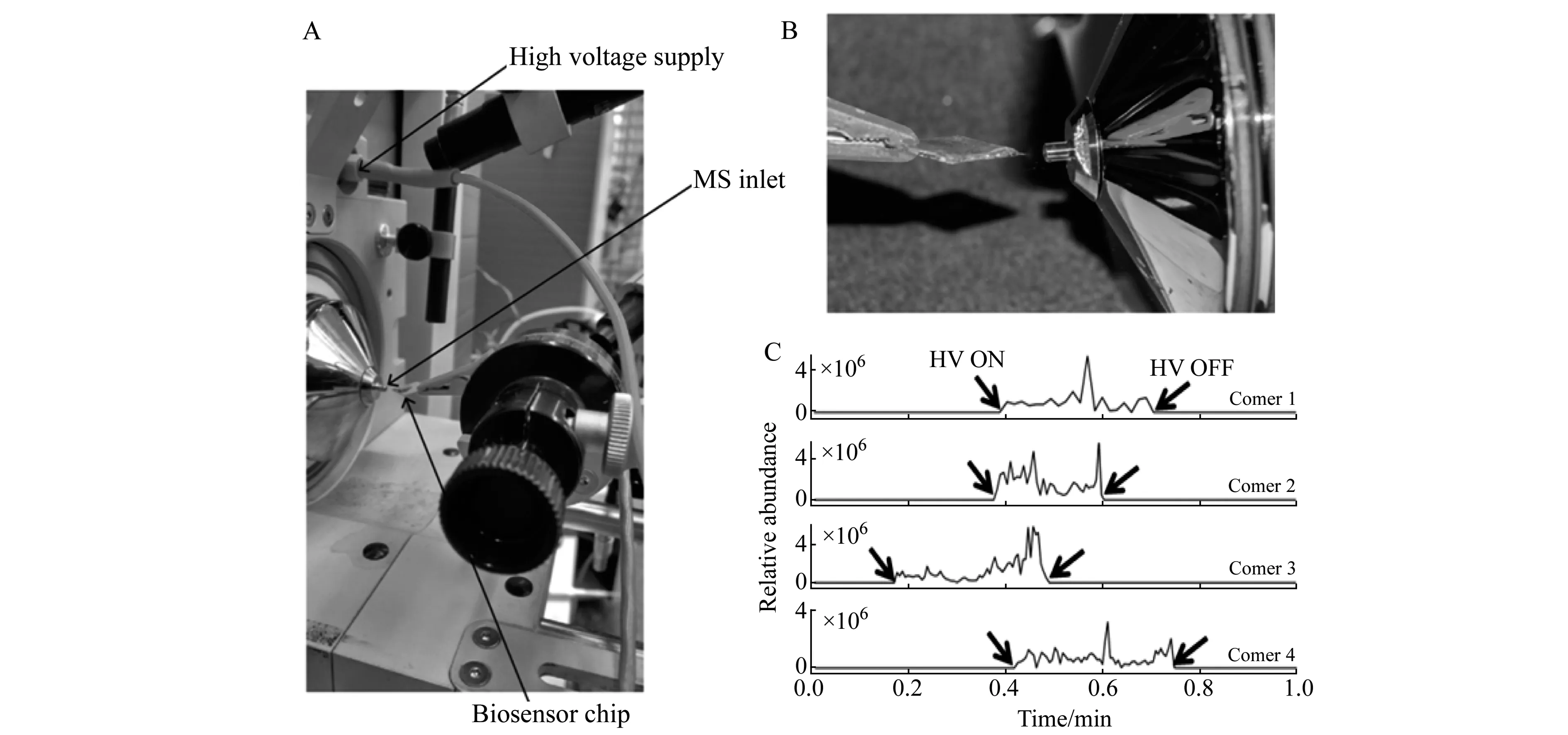
图7 基于芯片表面直接电喷雾的SPR-MS联用装置示意图(经许可后引用自[61],版权所有 2017 American Chemical Society)Fig.7 Schematic diagram of coupling SPR with MS by direct electrospray formed on the sensor chip(adapted with permission from [61],Copyright 2017 American Chemical Society)
5 结论
SPR法可以提供相互作用反应的重要物理化学参数,MS法可以提供样品结构的重要信息,二者联用可以互相补充。本文总结了SPR与MS联用的主要研究进展,根据离子化方式的不同,概述了基于MALDI、ESI和敞开式离子化方法的重要SPR-MS联用接口装置设计原理。总体而言,基于MALDI的方法是SPR-MS联用的主要方法,较易实现且效果良好,但受限于MALDI原理,联用多处于离线模式,难以实现在线联用。基于ESI的方法是另一种重要的SPR与MS联用方法,能够实现在线联用,但往往需要额外的输液泵、切换阀、色谱柱等仪器系统,以解决ESI难以针对表面展开分析、难以耐受非挥发性盐等问题。近年来,基于敞开式离子化方法的SPR-MS联用方法也得到发展,包括DART源、DBDI源、芯片表面直接电喷雾等方法均得到了应用,取得了较好的效果。在应用中,基于MALDI和ESI的联用方法因相关仪器的成熟性可能继续占据主要地位,但新型离子化方法的发展已经证明其有效性,并且具有优于MALDI和ESI方法的特点,将获得更多关注,并逐步占据重要地位。
