适配体功能化多壁碳纳米管整体柱分离富集细胞色素c
2017-10-19周婵媛杜苑琪李攻科肖小华
周婵媛, 杜苑琪, 杜 卓, 李攻科, 肖小华
(中山大学化学学院,广东广州 510275)
蛋白质是动植物生命活动中一类重要的生物大分子,其含量、组成和结构等与许多重要疾病及其形成机制密切相关。然而,蛋白质结构复杂、含量水平差异大,且常以复杂混合物的形式存在于细胞或组织中,给蛋白质尤其是低丰度蛋白质的分离分析提出了很高的挑战[1]。因此,发展高效、高选择性的蛋白质分离富集技术,对复杂基体(如生物、医药、环境等)中蛋白质的深入研究具有重要意义。
多孔聚合物整体介质因易于制备、渗透性好、对流传质快而被广泛地用作萃取材料,整体柱在蛋白质、核酸等大分子的快速分离上已显示出明显优势[2 - 5]。特别是碳纳米管等大比表面积材料修饰形成的聚合物整体柱复合材料,可提高整体柱的吸附容量,快速高效地从复杂生物基体中分离富集碱性蛋白[6]。核酸适配体(Aptamer)是具有特异性识别性的短单链寡核苷酸序列[7 - 9],它性质稳定、易化学修饰,体积虽小但与蛋白质的作用位点多,且可嵌入到蛋白质表面的特定区域,在空间上形成互补结构,从而对蛋白质有很强的特异性识别能力[10 - 12]。因此,核酸适配体在生物传感器、蛋白质分离富集等领域得到了广泛应用[13 - 14]。Zhang等[15]研制的适配体功能化亲水性金纳米粒子改性聚合物整体柱,可对人血浆的凝血酶进行选择性富集;以金纳米粒子为介质的适配体功能化有机无机杂化整体柱,也对人血清的痕量凝血酶具有良好的富集效果[16]。
本文结合核酸适配体技术良好的选择性,以及碳纳米管聚合物整体柱高效分离的优势,开展靶向细胞色素c(Cyt c)核酸适配体-碳纳米管聚合物整体柱(AMMC)研究,结合顺序注射系统(SI)用于人血清、猪心等生物样品中Cyt c的选择性分离富集。
1 实验部分
1.1 仪器与试剂
756PC紫外-可见分光光度计(上海光谱);FIAlab-3000顺序注射系统(美国,FIAlab);Orion 868型酸度计(美国,ThermoElectron);DYCZ-28A垂直式电泳槽及DYY-III2电源(北京六一);LC-10Avp高压泵(日本,Shimadzu);IR-prespige-21 型傅里叶变换红外光谱仪(日本,Shimadzu);Hitachi S-4300场发射扫描电子显微镜(日本,Hitachi);VHX-1000型光学显微镜(日本,KEYENCE)。
细胞色素c(Cyt c,美国Sigma);牛血红蛋白(Hb,美国Sigma);牛血清白蛋白(BSA,上海卓康),溶菌酶(Lyz,上海卓康);多壁碳纳米管(MWNT,深圳市纳米港有限公司);靶向Cyt c DNA适配体(61-mer DNA aptamer targeting Cyt c:5′-NH2-AGT GTG AAA TAT CTA AAC TAA ATG TGG AGG GTG GGA CGG GAA GAA GTT TAT TTT TCA CAC T-3′,上海卓康);二甲基丙烯酸乙二醇酯(EGDMA)、PEG 6000、三(羟甲基)氨基甲烷(Tris)购自阿拉丁试剂(上海)有限公司;偶氮二异丁腈(AIBN)(分析纯,天津福晨)。实验用水均为超纯水(Millipore纯水仪纯化)。
1.2 核酸适配体-碳纳米管聚合物整体柱(AMMC)的制备
首先采用酸化法制备羧基化多壁碳纳米管(MWNT-COOH)[17]。将一定量的MWNT-COOH在冰浴中超声20 min使其均匀分散于超纯水,置于50 mmol/L EDC和25 mmol/L NHS溶液中孵育20 min;将氨基修饰的核酸适配体加入到上述溶液中处理1 h,得到MWNT-APT复合物;在复合物中加入200 μL 100 mmol/L磷酸盐缓冲溶液(PBS,pH=7.5),封闭未与适配体结合的羧基位点。然后以8 000 r/min离心10 min,沉淀用200 μL Tris-HCl缓冲溶液重悬,4 ℃保存备用。
AMMC聚合物整体柱制备方法如下:(a)将一定量的MAA(20 wt%)和EGDMA(40 wt%)溶于甲醇(40 wt%)和PEG 6000(20 wt%)混合溶剂中;加入 AIBN(0.1%,m/m)并超声 20 min 使其充分溶解,氮吹 10 min除氧。将上述混合溶液注入密闭试管中,于60 ℃下反应20 min,得到含有低聚体的混合溶液。(b)将MWNT-APT加入上述低聚体混合溶液中,超声分散后将混合溶液注入不锈钢管(100×2.0 mm i.d.,)中,封口后于60 ℃下反应24 h,得到AMMC;将反应后的AMMC连接液相泵,再用甲醇溶剂冲洗除去致孔剂和未反应的溶剂。(c)按同样合成方法,制备poly-MWNT-COOH整体柱和聚合物整体柱(PMC)。
1.3 整体柱机械稳定性和通透性的研究
机械稳定性和渗透性是整体柱的重要参数。其中柱压降的表达式可描述为[5]:
(1)
式中,ΔP为柱压(psi);l为柱长(cm);η为流动相粘度(cp);dp为填料颗粒直径(cm);f为常数。当其它条件不变时,柱压降ΔP与流速成线性关系。
整体柱的渗透性通过Darcy定律进行计算:
B0=FηL/πγ2ΔP)
(2)
式中,F为流速(mL/min);L为柱长(cm);η为流动相粘度(cp);ΔP为柱压(psi);γ为柱半径(cm)。在既定条件下,F和η不变,渗透性系数B0与ΔP/L成反比,其中B0与整体柱孔隙率有关,在纯水的条件下测定渗透系数B0,可以反映合成的整体柱的性能优劣。
1.4 AMMC-SI-UV在线分离装置[6]
结合AMMC及顺序注射系统(SI)构建AMMC-SI-UV在线萃取装置。该装置包括:一台紫外-可见分光光度计,一个6位选择阀,一个5.0 mL的注射泵,一个容量为5.0 mL的储液环和一个三通组成。顺序注射系统的外部流路由PTFE管(0.8 mm i.d.)和PEEK接头连接。
1.5 实际样品制备
全血样品采自健康志愿者,用10%柠檬酸钠抗凝,然后保存在5 ℃的冰箱中备用。取100 μL抗凝血,加1 mL水稀释,通过稀释后全血溶液中的红血球破裂,以1 000 r/min离心3 min,收集上清液备用。
新鲜猪心购自当地市场,除去脂肪、血管和韧带,洗尽积血,切成小块,放入绞肉机中绞碎。称取猪心肌碎肉0.2 g,放入10 mL离心管中,加水3 mL并超声萃取10 min;用再 2 mol/L HCl调节pH 至4.0,继续超声萃取2 h,然后用1.0 mol/L 氨水调pH至6.0。离心处理后,固体再分别超声萃取2次,合并上层清液,用1.0 mol/L氨水调节pH至7.4,以8 000 r/min离心10 min,收集上清液即得粗提液。将粗提液置于50 mL鸡心瓶中旋干,加10.0 mL 0.05 mol/L Tris-HCl+0.02 mol/L KCl+0.15 mol/L NaCl (pH=7.4)的萃取溶剂重溶,过0.45 μm水相滤膜备用。
2 结果与讨论
2.1 AMMC整体柱的结构性能表征
2.1.1X-射线光电子能谱MWNT-COOH和MWNT-APT材料表面的元素组成和官能团变化的X-射线光电子能谱(XPS)结果如图1所示。结果表明,MWNT-COOH经适配体修饰后,N元素含量明显增加,从原来的0变为3.79%。从C图可以看出,MWNT-APT所含 N 1s 部分是由-NH-CO-和-NH2两组官能团组成,其中-NH-CO-的存在表明适配体已成功修饰于MWNT-COOH表面上。D图结果表明,MWNT-APT所含O1s是由 C-O-C、C-OH和-CO-NH-三组官能团组成,其中C-O-C和C-OH为MWNT-COOH表面所带含氧官能团,而-CO-NH-则为适配体引入所产生,这说明适配体已成功修饰于MWNT-COOH表面。

图1 MWNT-COOH(A)、MWNT-APT(B)、MWNT-APT N1s(C)及MWNT-APT O1s(D)的X-射线光电子能谱(XPS)图Fig.1 XPS spectra of MWNT-COOH(A),MWNT-APT(B),N1s of MWNT-APT(C) and O1s of MWNT-APT MWNT-APT(D)
2.1.2扫描电镜MWNT-COOH、MWNT-APT和AMMC的扫描电镜(SEM)结果如图2所示。结果表明,干燥的MWNT-COOH粉末团聚严重(2A),而MWNT-APT团聚效应明显减弱,粉末分散度答复增加。说明适配体修饰后,碳纳米管疏松分散,可以增大材料的比表面积,有利于MWNT-APT与目标物分子充分接触,从而提高其分离性能。图2C表明制备的AMMC具有聚合均一的微球簇,呈现多孔疏松的结构,该结构特征可以保证AMMC具有良好的通透性。相比较于空白聚合物整体柱(2.1 mm i.d.),经适配体-碳纳米管修饰后的AMMC呈现均匀的黑色(2D),说明适配体碳纳米管分散均匀。

图2 MWNT-COOH(A)、MWNT-APT(B)、AMMC(C)的扫描电镜(SEM)图和AMMC柱及材料照片(D)Fig.2 SEM images of MWNT-COOH(A),MWNT-APT(B),AMMC(C) and photographs of pure polymer monolith AMMC(D)
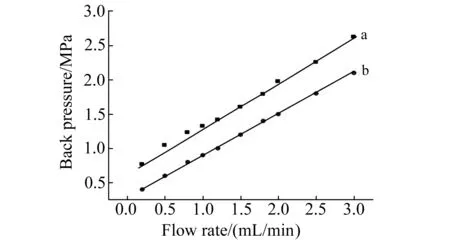
图3 整体柱流速-压力曲线Fig.3 Linear velocity and back-pressure drop on AMMC(a) and PMC(b)(column size:100×2.1 mm i.d.)
2.1.3AMMC机械稳定性和渗透性研究整体柱的机械稳定性和渗透性是关系到其后续应用效果的关键性能。我们对比了AMMC整体柱与普通的聚合物整体柱(PMC)的机械稳定性,结果如图3所示。结果表明,当流动相流速在0.4~2.8 mL/min的范围内变化时,AMMC的柱压随流速的增加呈线性增加,且当流速降低时,其柱压也同样会降低到原来的水平。这表明AMMC具有良好的机械稳定性,MWNT-APT掺杂未破坏聚合物整体柱的物理结构。
另一方面,AMMC与PMC的渗透性分别为2.5×10-13m2和4.2×10-13m2,说明采用低聚体辅助分散方法制备AMMC,可以使MWNT-APT均匀分散并固定在聚合物整体柱中,MWNT-APT掺杂未破坏聚合物整体柱的通透性。
2.2 AMMC分离条件研究
以Cyt c为分析对象,采用单因素变量原则,通过萃取溶液的离子强度、萃取流速、洗脱溶液的离子浓度、洗脱体积等因素,考察了AMMC对Cyt c的分离条件,结果如图4所示。Cyt c的富集效果在萃取溶剂的离子强度小于0.15 mol/L时无明显改变,而当离子强度大于0.15 mol/L时,其富集效果随溶液离子强度增加而降低(图4A),为了尽量避免静电作用造成的非特异性吸附,实验选择较高离子浓度的萃取溶剂。另一方面,当萃取流速大于0.2 mL/min时,AMMC整体柱对Cyt c的富集效果显著下降;但萃取流速小于0.2 mL/min,整个过程耗时过长;综合柱压力和萃取时间考虑,选择0.2 mL/min作为萃取流速(图4B)。洗脱液离子强度对蛋白质的分离有一定影响,随着盐浓度的增加,Cyt c的洗脱效率增加(图4C)。当选择NaCl溶液作为柱洗脱剂时,随洗脱液体积增加,Cyt c的洗脱效率不断提高,用0.5 mL洗脱液即可实现完全洗脱(图4D)。
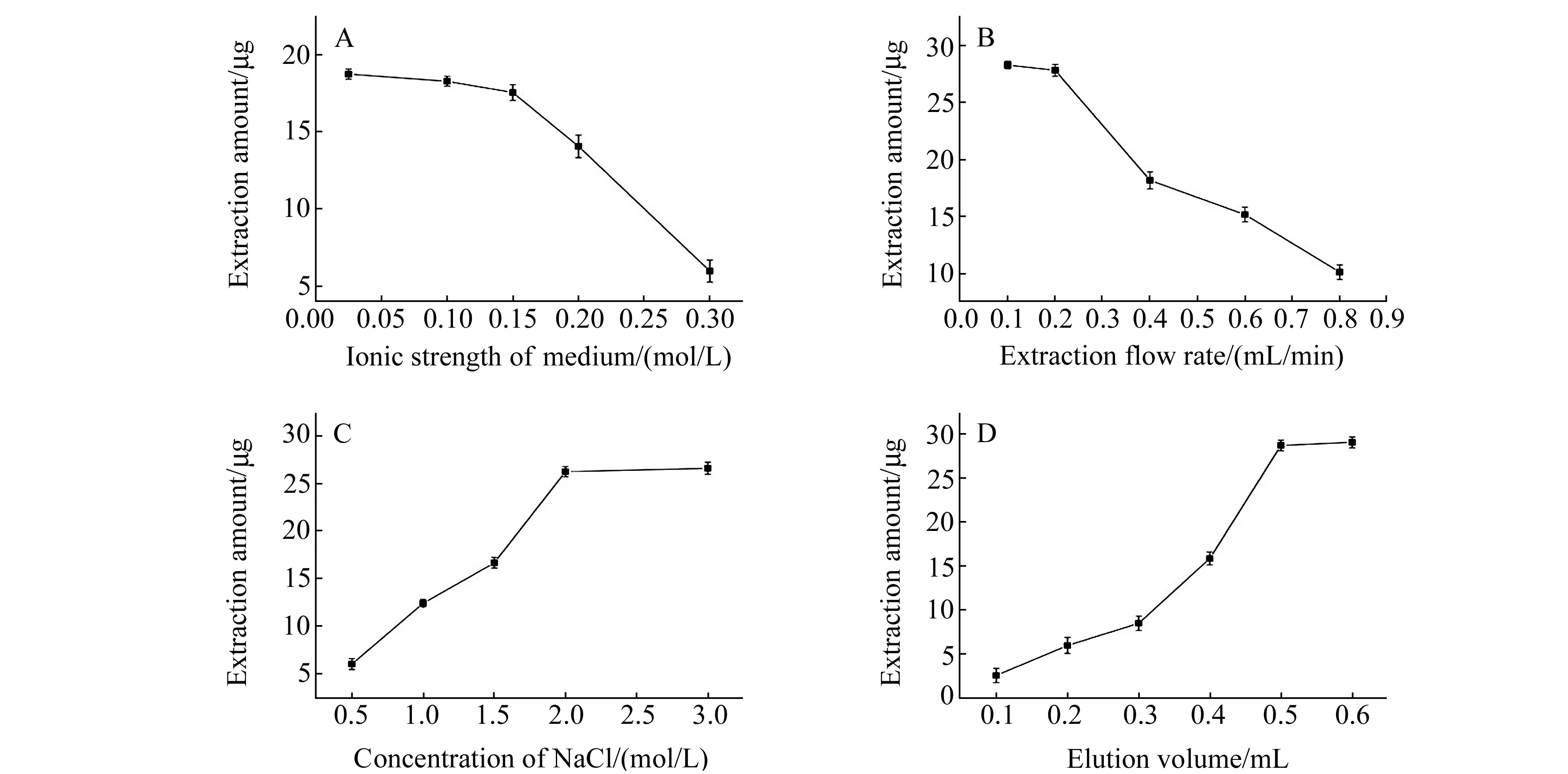
图4 萃取溶剂离子强度(A)、萃取流速(B)、洗脱溶剂(C)、洗脱体积(D)对AMMC萃取效率的影响Fig.4 Effects of extraction solvents(A),flow rate(B),elution solvent(C) and elution volume(D) on the extraction efficiency of AMMC for Cyt c
实验最终优化后得到的AMMC分离条件为:萃取溶剂为Tris-HCl 缓冲溶液(0.05 mol/L Tris-HCl+0.02 mol/L KCl+0.15 mol/L NaCl,pH=7.4),萃取流速为 0.2 mL/min;洗脱溶剂为2.0 mol/L NaCl,洗脱体积为0.5 mL。
2.3 AMMC的选择性
核酸适体与配体结合时会形成稳定的二级结构,这些结构一般通过范德华力、氢键作用或形状匹配等相互作用力,对特定物质表现出高特异性识别。但由于适配体具有高负电荷密度的特性,很可能会通过静电作用发生非特异性吸附。本文研究了AMMC对不同性质的蛋白质如Cyt c、Hb、Lyz和BSA的分离选择性,结果如图5所示。结果表明,当Hb、Lyz和BSA样品通过AMMC整体柱时,流出液的蛋白质浓度与样品溶液基本相同,AMMC无法富集Hb、Lyz和BSA。而在相同条件下,Cyt c在AMMC能得到较好的保留,且吸附在整体柱上的Cyt c可以方便地洗脱下来,这说明AMMC对Cyt c表现出良好的选择性吸附能力。计算整体柱萃取后的Cyt c浓度与富集前样品溶液中的浓度比值,可知Cyt c在AMMC上的富集倍率约为28倍。
2.4 不同整体柱材料的分离效果对比研究
本文以Cyt c、Hb、Lyz、和BSA为模型蛋白质,比较了整体柱poly-c-MWNT、PMC与AMMC的分离效果,结果如图6所示。其中,PMC对四种蛋白质的分离富集能力均较弱,四种蛋白质的富集量均小于0.10 mg;而poly-c-MWNT除了对BSA的富集能力较弱以外,对其他三种蛋白质均有较好的富集能力,四种蛋白质的富集量分别为1.41、1.51、1.38和0.01 mg。这可能是因为poly-c-MWNT蛋白质之间存在的静电作用可以非特异性吸附碱性蛋白质。AMMC对Cyt c显示出明显的特异性吸附,富集量高达1.47 mg;而对其他蛋白质富集量较小,其富集量均小于0.04 mg。这是由于加入的碳纳米管不仅增大了整体柱的比表面积,还提供了更多的适配体作用位点,使其能与Cyt c充分接触,从而提高了AMMC的富集能力和选择性。因此,AMMC可用来选择性分离富集Cyt c。

图5 不同蛋白质在AMMC上的分离富集结果Fig.5 Chromatographic retention of different proteins on AMMC

图6 不同材料整体柱对Cyt c的富集性能对比Fig.6 Enrichment performance of Cyt c on different monolithic columns
2.5 AMMC的实际应用研究
参照文献方法[6]构建AMMC-SI-UV在线分离装置,并用于人血清和猪心中Cyt c的分离。实验以0.6 mL/min的流速将3 mL样品溶液吸入储液环,然后以0.2 mL/min的流速使其通过整体柱;再用1.0 mL的Tris-HCl缓冲溶液清洗整体柱,然后再吸入0.5 mL 洗脱剂进入储液环并以0.2 mL/min的流速流过整体柱,洗脱溶液由载流驱动进入检测器进行检测;并采用SDS-PAGE凝胶电泳对所得到的Cyt c蛋白质纯度进行检测。其中积层胶和分离胶的质量分数分别为5%和15%,电泳后的凝胶经考马斯亮蓝染色、脱色后的凝胶照片如图7所示。结果表明,通过AMMC分离后,从洗脱液中可以得到纯度较高的Cyt c条带,且其出峰位置与标准Cyt c一致(14.3 kDa);样品Cyt c电泳分析图谱中无杂条带,说明分离得到的Cyt c的纯度与标准Cyt c相当。

图7 人血清(左图)和猪心(右图)样品分离后的SDS-聚丙烯酰胺凝胶电泳谱图Fig.7 Gel electrophoresis chromatograms of human plasma(left) and pork heart(right)Lane M,the molecular weight standards(Mr in kDa);lane 1,Cyt c standard;lane 2,samples without treatment;lane 3,effluent from the washing procedure of AMMC;and lane 4,elution of AMMC.
3 结论
采用低聚体辅助分散方法,将适配体和碳纳米管掺杂于聚合物整体柱中,得到的适配体功能化碳纳米管整体柱既具有良好的通透性和稳定性,兼具有适配体良好的蛋白质选择性和碳纳米管的高效富集特性,可选择性地分离富集Cyt c,其富集量为1.47 mg。与流动注射系统联用,可直接从猪心样品中选择性分离富集Cyt c。实验结果表明,此类复合整体柱材料在生物样品中碱性蛋白质选择性分离纯化方面具有良好的应用潜力。
