黑果腺肋花楸原花青素的纯化及表儿茶素和原花青素B2含量测定
2017-10-19,,,,,,,
,,,,,, ,
(北京林业大学生物科学与技术学院,食品加工与安全北京市重点实验室,北京 100083)
黑果腺肋花楸原花青素的纯化及表儿茶素和原花青素B2含量测定
朱月,张海平+,侯亚男,安建辉,封晓茹,温馨亚,李腾,孙爱东*
(北京林业大学生物科学与技术学院,食品加工与安全北京市重点实验室,北京 100083)
本文研究AB-8型大孔树脂对黑果腺肋花楸原花青素粗提物的吸附和解吸特性,并利用高效液相色谱法测定原花青素纯化物中表儿茶素和原花青素B2含量。结果表明,上样溶液浓度4 mg/mL,吸附流速2 BV/h,解吸液乙醇浓度为50%,得到纯化物中原花青素含量为14.29%;高效液相色谱法采用Aglient Eclipse XDB-C18色谱柱(4.6 mm×250 mm,5 μm),以甲醇(A)-水(B)为流动相梯度洗脱(0~10 min,10% A-30% A;10~20 min,30% A-70% A;20~30 min,70% A-100% A),流速1 mL/min,检测波长280 nm,表儿茶素和原花青素B2质量浓度在0.025~0.2 mg/mL内呈现良好的线性关系,两种成分的加样回收率分别为105.5%和99.8%;经测定黑果腺肋花楸纯化物中表儿茶素和原花青素B2含量分别为14.26 mg/g和22.45 mg/g。
黑果腺肋花楸,AB-8大孔树脂,原花青素,高效液相色谱(HPLC),表儿茶素,原花青素B2
黑果腺肋花楸(Aorniamealnocarpa Elliot)为蔷薇科(Roseeeae)腺肋花楸属多年生落叶灌木,原产于美国东北部,我国对黑果腺肋花楸的相关研究起步较晚。自20世纪90年代初,辽宁省干旱地区造林研究所最先开始了我国腺肋花楸引种栽培和果实加工利用的实验研究工作[1]。黑果腺肋花楸富含丰富的多酚类物质,研究表明,黑果腺肋花楸的多酚含量和抗氧化活性显著高于蓝莓、蔓越莓和越橘等浆果[2]。其中原花青素含量占总酚的41.9%~59.1%[3]。可见黑果腺肋花楸酚类物质中原花青素含量最高,对黑果腺肋花楸的生物活性起着至关重要的作用。原花青素又称缩合单宁,按聚合度的不同可分为单倍体、低聚体和多聚体[4]。单倍体是原花青素基本的结构单元,一般指儿茶素和表儿茶素,也有其它单倍体如表没食子儿茶素和表阿夫儿茶精等;低聚体由2~4个单倍体缩合而成;多聚体则是由5个以上单倍体缩合而成。原花青素低聚体的生物活性研究最为活跃,其中二聚体分布最广,研究最多,是最重要的一类原花青素[5]。
AB-8大孔树脂具有吸附量大、解吸率高、性质稳定等特点,被广泛应用于原花青素的分离纯化[6]。本文对黑果腺肋花楸原花青素在AB-8大孔树脂上的吸附和解吸条件进行探讨,并选择高效液相色谱法(HPLC)测定纯化后的黑果腺肋花楸原花青素中单倍体表儿茶素和二聚体原花青素B2含量,为黑果腺肋花楸原花青素的深度开发和综合利用提供科学依据。
1 材料与方法
1.1材料与仪器
黑果腺肋花楸果实,放置于-80 ℃低温冰箱冷冻备用 黑龙江;AB-8大孔树脂 上海阿拉丁生化科技有限公司;无水甲醇、无水乙醇、盐酸 分析纯,国药集团化学试剂有限公司;香草醛 上海阿拉丁生化科技有限公司;表儿茶素(HPLC>98%)、原花青素B2标品(HPLC>98%) 上海源叶生物科技有限公司;无水甲醇、乙腈 色谱纯,西格玛奥德里奇贸易有限公司。
JYL-C010打浆机 九阳股份有限公司;UV-6100紫外分光光度仪 上海元析仪器有限公司;KQ-100DE超声破碎仪 数控超声波清洗器;L3660D低速离心机 上海知信实验仪器有限公司;FD-18冷冻干燥机 北京德天佑科技发展有限公司;LQ-A 30002电子天平 瑞安市乐祺贸易有限公司;HL-2S恒流泵 上海青浦沪西仪器厂;色谱柱Agilent Eclipse XDB-C18,4.6×250 mm Agilent Technologies,Inc.;LC-20AD高分离度快速液相色谱系统 SHIMADZU公司。
1.2实验方法
1.2.1 黑果腺肋花楸原花青素粗提物制备 取40 g黑果腺肋花楸匀浆(预处理的花楸鲜果于打浆机中打浆3 min),在液料比25∶1、提取时间60 min、提取温度70 ℃、60%乙醇浓度条件下提取原花青素;将提取得到的原花青素粗提物真空浓缩,冷冻干燥得紫黑色膏状物质,放置于-20 ℃冰箱中,待用[7]。
1.2.2 AB-8 大孔树脂预处理 AB-8大孔树脂用无水乙醇浸泡24 h,充分溶胀后,去离子水洗至无醇;加入5% HCl溶液浸泡12 h后,去离子水洗至中性;加入5% NaOH溶液浸泡12 h后,去离子水洗至中性;抽滤吸干树脂表面水分,待用[8]。
1.2.3 AB-8大孔树脂对黑果腺肋花楸原花青素的静态吸附解吸实验
1.2.3.1 AB-8大孔树脂静态吸附与解吸实验 称取0.3 g干树脂,加入20 mL约为5.24 mg/mL的原花青素粗提液,置摇床上30 ℃、120 r/min振荡24 h,充分吸附后过滤,用盐酸-香草醛法[9]测滤液中原花青素含量;然后将吸至饱和的树脂用50 mL、95%的乙醇洗脱,测定洗脱液中原花青素含量,计算吸附量和解吸率[10]。

1.2.3.2 AB-8大孔树脂静态吸附动力学研究 步骤同1.2.3.1,但需在30 ℃摇床中以120 r/min振荡;每30 min测定一次原花青素提取液浓度的变化。
1.2.3.3 AB-8大孔树脂吸附等温线测定 准确称取预处理的大孔树脂5份,每份0.5 g,置于50 mL三角瓶中,加入不同质量浓度的原花青素溶液,置于振荡器上30 ℃、120 r/min振荡12 h,待吸附平衡后测定溶液的质量浓度,并计算吸附量,以吸附量对平衡时质量浓度作图,绘制吸附等温曲线[11]。
1.2.4 AB-8大孔树脂对黑果腺肋花楸原花青素的动态吸附解吸实验
1.2.4.1 上样流速对AB-8大孔树脂吸附效果的影响 取一定量的树脂湿法装柱,配制4 mg/mL的原花青素粗提物溶液,分别采用2、4、6 BV/h的流速流经AB-8树脂柱,2 mL/管收集馏分并测定原花青素浓度,当流出液中原花青素浓度达到上样量的1/10时,AB-8大孔树脂达到吸附通量,停止上样,绘制穿透曲线,以泄漏点最迟出现的吸附流速为宜。
1.2.4.2 上样浓度对AB-8大孔树脂吸附效果的影响 取一定量的树脂湿法装柱,分别配制2、3、4 mg/mL的原花青素粗提物溶液,以2 BV/h的流速流经AB-8树脂柱,2 mL/管收集馏分并测定原花青素浓度,当流出液中原花青素浓度达到上样量的1/10时,AB-8大孔树脂达到吸附通量,停止上样,绘制穿透曲线,以泄露点最迟出现的上样浓度为宜。
1.2.4.3 乙醇浓度对AB-8大孔树脂解吸效果的影响 取一定量的树脂湿法装柱,配制4 mg/mL的原花青素粗提物溶液,以2 BV/h的流速流经AB-8树脂柱,达到吸附通量后,以30%,50%,70%的乙醇溶液分别进行洗脱,2 mL/管收集馏分,以流出液体积为横坐标,原花青素浓度为纵坐标绘图,选择合适的乙醇洗脱浓度。
1.2.5 HPLC测定儿茶素、表儿茶素和原花青素B2含量
1.2.5.1 HPLC分析条件 色谱仪为SHIMADZU的LC-20AT,检测器为PDA检测器。Aglient Eclipse XDB-C18色谱柱(4.6 mm×250 mm,5 μm);流动相A:色谱级甲醇,流动相B:去离子水;采用梯度洗脱方式,程序如下:0~10 min,10%~30% A;10~20 min,30%~70% A;20~30 min,70%~100% A。进样量:20 μL;检测波长:280 nm;柱温:30 ℃;流速:1 mL/min;时间:30 min。
1.2.5.2 溶液配制 标准品溶液:准确称取表儿茶素和原花青素B2各5 mg,用25 mL甲醇溶液溶解,配制成0.2 mg/mL的标准溶液。再精密移取1、2、4、6、8 mL标准溶液用甲醇定容至8 mL,分别配制为0.025、0.05、0.1、0.15、0.2 mg/mL表儿茶素和原花青素B2标准溶液。再取适量的两种标准溶液混合,得到混合标准品溶液。用0.45 μm微孔滤膜将所有标准品溶液过滤,进样分析;以浓度为横坐标,峰面积为纵坐标绘图,得到线性回归方程,结果见图9。
供试品溶液:称取0.05 g经AB-8大孔树脂纯化的原花青素样品,溶于20%甲醇中,用0.45 μm微孔滤膜过滤,待用。
2 结果与分析
2.1AB-8大孔树脂静态吸附与解吸结果
2.1.1 AB-8大孔树脂的静态吸附量和解吸率 由于原花青素为极性化合物,且其分子结构中带有酚羟基,形成氢键的能力较强,因此很容易被极性树脂和弱极性树脂所吸附。弱极性AB-8大孔吸附树脂,粒径0.3~1.25 mm,比表面积480~520 m2/g,平均孔径13.0~14.0 nm,外观乳白色小球,孔容0.73~0.77 mL/g,对原花青素具有较好的吸附和解吸效果[12]。经计算,AB-8大孔树脂对黑果腺肋花楸原花青素的吸附量为225.8 mg/g,解吸率为91.597%。
2.1.2 AB-8大孔树脂静态吸附动力学特性 由图1可知,AB-8大孔树脂起始吸附量较大,此后吸附量增加较慢,在8 h 后基本可以达到平衡,平衡吸附量较大。

图1 AB-8大孔树脂静态吸附动力学曲线Fig.1 Statie absorptiondynamicscurves of AB-8 macroporousresin
2.1.3 AB-8大孔树脂吸附等温线 目前,普遍将大孔吸附树脂的吸附作用机制归结为Langmuir或Freundich模式。Langmuir 等温方程为单层分子吸附理论,其方程式如下:
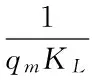
式中,qm:饱和吸附量(mg/g);KL:Langmuir等温方程参数;qe:吸附量(mg/g);Ce:平衡浓度(mg/L)。
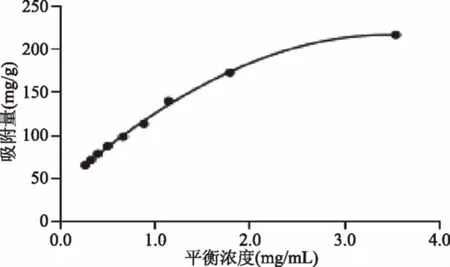
图2 AB-8大孔树脂吸附等温线Fig.2 Adsorptionisothcrrn of AB-8 macroporous resins
以1/Ce为横坐标,1/qe为纵坐标进行Langmuir 等温方程拟合曲线,截距为1/qm,斜率为1/(qmKL),根据实验数据,即可求得qm、KL,并计算出相应的R2[13]。
由qm=378.8;R2=0.99152;据此可以认为,在所研究的浓度范围内,AB-8大孔树脂对原花青素的吸附为单层吸附[14-15];理论上AB-8大孔树脂的饱和吸附量比实际实验中求得的饱和吸附量数值更高;另外由吸附等温线可以看出树脂的吸附量随原花青素浓度的增高而升高,所以适量增加原花青素浓度可以提高AB-8大孔树脂的吸附量。
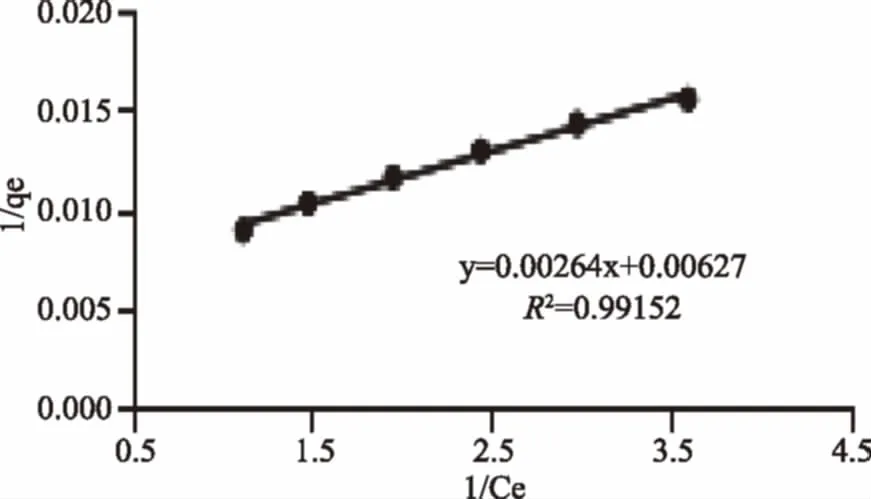
图3 Langmuir等温方程拟合曲线Fig.3 Fitting curve of Langmuir isotherm formula
2.2AB-8大孔树脂动态吸附与解吸结果
2.2.1 吸附流速对AB-8大孔树脂吸附效果的影响 由图4可知,AB-8大孔树脂的吸附通量随吸附流速的增高而降低。上样流速为2、4、6 BV/h时树脂的吸附通量分别为180、120、100 mL。结果表明随着吸附流速的降低,树脂的吸附通量增大,泄漏点出现时间延长,能够吸附更多的原花青素,所以选择2 BV/h的吸附流速为宜。
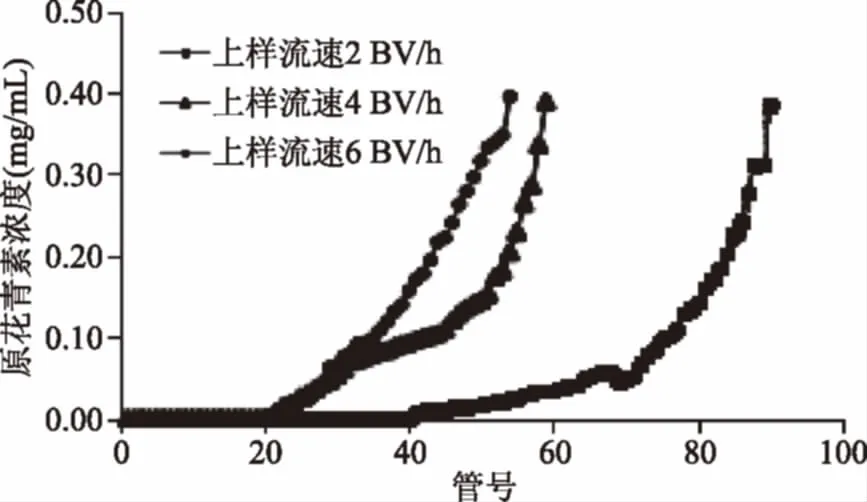
图4 上样流速对AB-8大孔树脂吸附效果的影响Fig.4 Effect of flow rate on adsorption ofAB-8 macroporous resins
2.2.2 上样浓度对AB-8大孔树脂吸附效果的影响 由图5可知,在不同的上样浓度下,AB-8大孔树脂达到吸附通量时进样量相似,均在90管(180 mL)左右达到吸附通量,但上样浓度为4 mg/mL时树脂的吸附量最大。所以为了充分利用AB-8大孔树脂,选择4 mg/mL为最佳上样浓度。

图5 上样浓度对AB-8大孔树脂吸附效果的影响Fig.5 Effect of concentration on adsorption ofAB-8 macroporous resins
2.2.3 乙醇浓度对AB-8大孔树脂解吸效果的影响 由图6可知,随着乙醇浓度的增加,AB-8大孔树脂的解吸速率逐渐加快。80 mL 30%的乙醇溶液可以将原花青素完全洗脱,但是存在拖尾现象;60 mL左右的50%乙醇溶液和70%乙醇溶液可以将原花青素完全洗脱,洗脱效果相似,洗脱峰集中。但是一些非黄烷三醇类杂质也可能被70%的乙醇洗脱,所以为了得到较高纯度的原花青素,选择50%乙醇溶液作为洗脱溶剂。
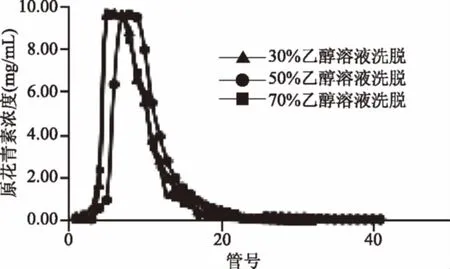
图6 乙醇浓度对AB-8大孔树脂解吸效果的影响Fig.6 Effect of ethanol concentrationon the desorption of AB-8 macroporous resins
通过上述实验结果可知,上样溶液浓度4 mg/mL,吸附流速2 BV/h,解吸液乙醇浓度50%时,AB-8大孔树脂对黑果腺肋花楸原花青素的动态吸附和解吸能力最佳。经AB-8大孔树脂纯化,得到黑果腺肋花楸原花青素含量为14.29%。
2.3HPLC分析
2.3.1 线性关系考察 分别精密吸取各标准溶液,进样并测定峰面积值。以标准液浓度为横坐标,峰面积为纵坐标,绘制标准曲线,结果如图7所示。表儿茶素、原花青素B2的线性回归方程分别为:y=2×107x-173065,R2=0.9974;y=1×107x-101750,R2=0.9985。

图7 表儿茶素和原花青素B2标准曲线Fig.7 Standard curve of epicatechin and procyanidins B2
2.3.2 精密度实验 取混合标准品溶液连续进样五次,测定表儿茶素和原花青素B2的峰面积,求出峰面积平均值,并得出RSD值,结果见表1。表儿茶素、原花青素B2的峰面积RSD值分别是1.08%和2.07%,表明仪器精密度较好。
2.3.3 稳定性实验 取原花青素纯化物0.05 g,按照1.2.5.2方法制备供试品溶液,分别于0、3、6、9、12 h重复进样6次,测定表儿茶素和原花青素B2的峰面积及RSD值,测定结果见表2。表儿茶素、原花青素B2的峰面积均值分别是1107328.2和580784.6,峰面积RSD值分别是0.37%和1.16%,表明供试品溶液在12 h内稳定性良好。

表1 精密度实验Table 1 Precision experiment
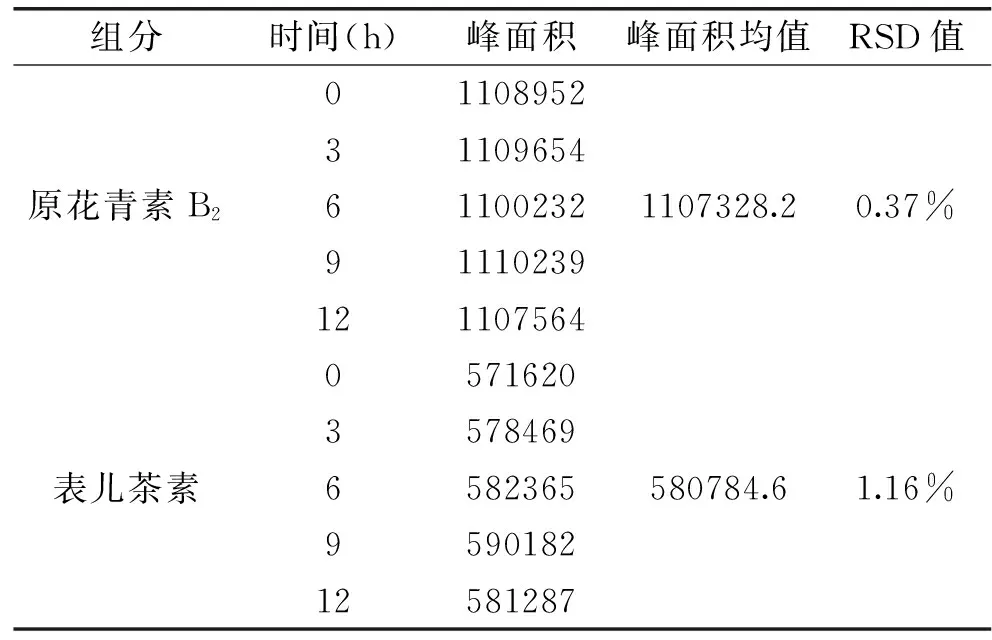
表2 稳定性实验Table 2 Stability experiment
2.3.4 加样回收率实验 取已知表儿茶素和原花青素B2含量的原花青素纯化物5份,分别加入一定量的表儿茶素和原花青素B2标准品,按1.2.5.2制备供试品溶液,按前述方法测定表儿茶素和原花青素B2的含量,并计算回收率,结果如表3[16-17]。
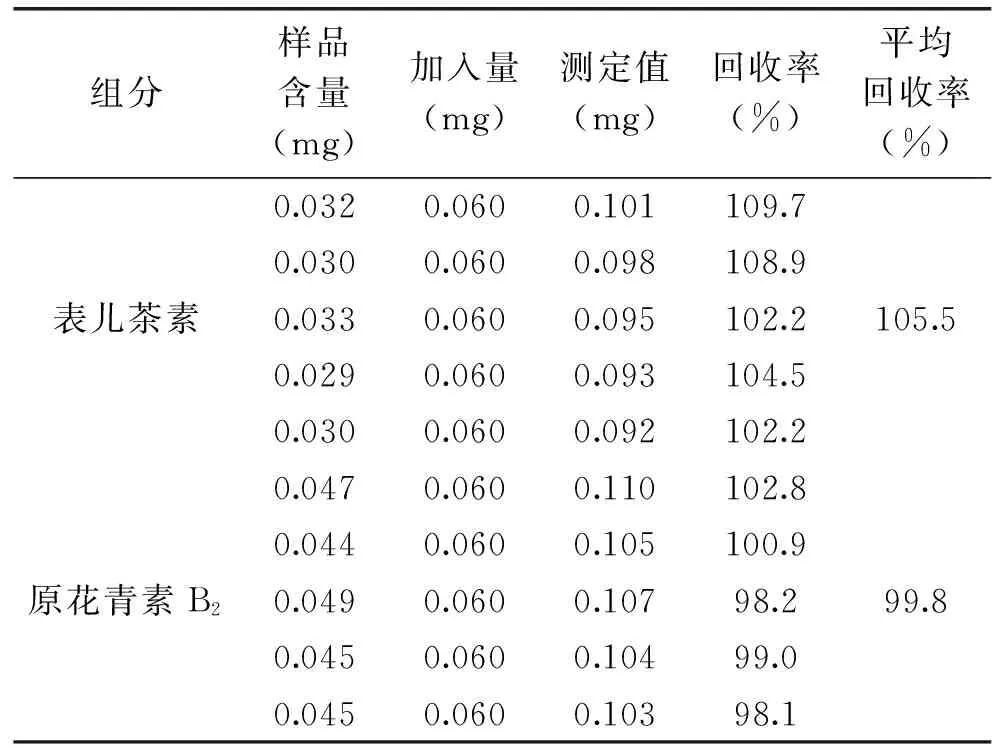
表3 加样回收实验Table 3 Sample recoveries rate experiment
2.3.5 样品含量测定 按照1.2.5.2 准确配制供试品溶液,在1.5.2.1色谱条件下进行分析,连续进样三次,按外标法进行计算,测得黑果腺肋花楸纯化物中表儿茶素和原花青素B2含量分别为14.26 mg/g和22.45 mg/g。
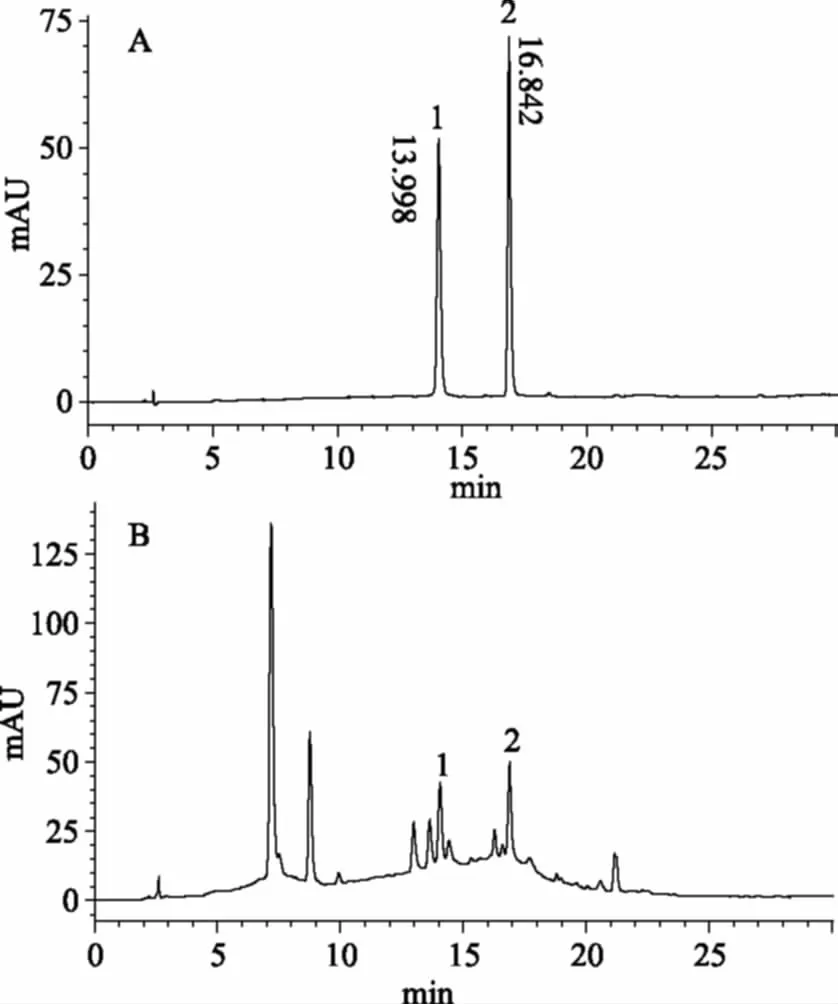
图8 混合对照品(A)与供试品溶液(B)Fig.8 HPLC chromatograms of mixed referencesubstances(A)and procyanidinssample(B)注:1. 原花青素B2(Procyanidins B2);2. 表儿茶素(Epicatechin)。
3 结论
本文首次应用AB-8大孔树脂纯化黑果腺肋花楸原花青素,并通过高效液相色谱法测定原花青素纯化物中表儿茶素和原花青素B2含量,为黑果腺肋花楸原花青素的深度开发和综合利用提供科学依据。但从原花青素纯化物的高效液相色谱图可以看出,纯化物中物质种类仍然较多,除了包含原花青素低聚体和多聚体,还可能含有花青素、酚酸等多酚类物质,有待进一步的研究鉴定[18-19]。
[1]韩文忠,姜镇荣,马兴华,等. 国内外腺肋花楸产业和技术发展概况[J]. 防护林科技,2007(03):57-58.
[2]Kulling SE R H. Chokeberry(Aronia melanocarpa)-A Review on the Characteristic Components and Potential Health Effects[J].Planta Med,2008(74):1625-1634.
[3]Oszmiański J,Wojdylo A Aronia melanocarpa phenolics and their antioxidant activity[J]. European Food Research and Technology,2005,221(6):809-813.
[4]张慧文张玉. 原花青素的研究进展[J]. 食品科学,2015,36(05):296-304.
[5]张妍. 原花青素研究进展[J]. 中药药理与临床,2011,27(6):112-116.
[6]赵平 张月萍. AB-8大孔树脂对葡萄籽原花青素的吸附过程[J]. 化工学报,2013,64(3):980-985.
[7]朱月,李奋梅,王艳丽,等. 黑果腺肋花楸原花青素的提取及抑菌性研究[J]. 食品工业科技,2017(02):302-306.
[8]周桃英,罗登宏,李国庆,等. AB-8大孔树脂纯化荷叶总黄酮的工艺研究[J]. 中国食品添加剂,2009(5):113-119.
[9]谢伟光,张黎明. 山楂叶原花青素提取分离工艺研究[J]. 食品工业科技,2008(03):216-219.
[10]孙芸.葡萄籽原花青素聚合度与功效关系的研究[D]. 无锡:江南大学,2004.
[11]李颖畅.蓝莓花色苷提取纯化及生理功能研究[D]. 沈阳:沈阳农业大学,2008.
[12]李春阳.葡萄籽中原花青素的提取纯化及其结构和功能研究[D]. 无锡:江南大学,2006.
[13]娄嵩,刘永峰,白清清,等. 大孔吸附树脂的吸附机理[J].化学进展,2012(08):1427-1436.
[14]陶莎,黄英,康玉凡,等. 大孔吸附树脂分离纯化红小豆多酚工艺及效果[J]. 农业工程学报,2013(23):276-285.
[15]Castro-López L D R,Gómez-Plaza E,Ortega-Regules A,et al. Role of cell wall deconstructing enzymes in the proanthocyanidin-cell wall adsorption-desorption phenomena[J].Food Chemistry,2016,196:526-532.
[16]陈晓静,何杰,杨建云,等. RP-HPLC法同时测定葡萄籽提取物中没食子酸、儿茶素和表儿茶素的含量[J]. 药物分析杂志,2015,4(35):723-727.
[17]谭生建,贺业谦,李勉珊,等. HPLC法测定七厘散中儿茶素和表儿茶素的含量[J]. 解放军药学学报,2012,28(1):72-73,76.
[18]尹艳廷. 黑果腺肋花楸在太原地区的引种栽培初探[J]. 防护林科技,2008(05):120-134.
[19]玄永浩,金英善. 黑果腺肋花楸化学成分及药理活性研究进展[J]. 现代农业科技,2009(20):101-102.
PurificationofblackchokeberryprocyanidinsanddeterminationofepicatechinandprocyanidinsB2byHPLC
ZHUYue,ZHANGHai-ping+,HOUYa-nan,ANJian-hui,FENGXiao-ru,WENXin-ya,LITeng,SUNAi-dong*
(Key Loboratory of Forestry Food Processing Security,College ofBiological Sciences and Biotechnology,Beijing Forestry University,Beijing 100083,China)
The adsorption and desorption properties of procyanidins from black chokeberry with AB-8 macroporous resins was studied. And the HPLC method was used to determine the content of epicatechin and procyanidins B2in procyanidins purification. The results showed that,procyanidins concentration of the sample solution was 4.0 mg/mL,adsorption flow rate was 2 BV/h,the desorption concentration of ethanol was 50%. Under the proposed conditions,the purity of procyanidins content from black chokeberry was 14.29%. Chromatographic separation was performed on the Aglient Eclipse XDB-C18,4.6 mm×250 mm.The mobile phase was methanol(A)-water(B)with the gradient elution(0~10 min,10% A-30% A;10~20 min,30% A-70% A;20~30 min,70% A-100% A). The flow rate was 1.0 mL/min and the detective wavelength was set at 280 nm.The linear ranges of epicatechin and procyanidins B2concentration were 0.025~0.2 mg/mL. The sample recoveries rate of the two components were 105.5% and 99.8% respectively. The content of epicatechin and procyanidins B2in black chokeberry procyanidins purification were 14.26 mg/g and 22.45 mg/g,respectively.
black chokeberry;AB-8 macroporous resins;procyanidins;high performance liquid chromatography;epicatechin;procyanidins B2
TS207.3
A
1002-0306(2017)19-0240-05
10.13386/j.issn1002-0306.2017.19.044
2017-04-14 +并列第一作者
朱月(1993-),女,在读硕士研究生,研究方向:天然产物与功能性食品,E-mail:zhuyue1109@ 163.com。
张海平(1992-),男,在读硕士研究生,研究方向:天然产物与功能性食品,E-mail:624571440@qq.com。
*
孙爱东(1968-),女,博士,教授,研究方向:天然产物生理活性物质的开发与利用,E-mail:adsun68@ 163.com。
国家自然科学基金(31471593);国家重点研发计划(2016YFD0400302-4)。
