全腔镜解剖性肺段切除术对比肺叶切除术在治疗早期肺癌的前瞻性研究
2017-10-19庞文广黄凤柳叶敏庞景灼伍硕允
庞文广 黄凤柳 叶敏 庞景灼 伍硕允
全腔镜解剖性肺段切除术对比肺叶切除术在治疗早期肺癌的前瞻性研究
庞文广1黄凤柳2叶敏1庞景灼1伍硕允1
目的前瞻性对比研究完全胸腔镜下解剖性肺段切除术与肺叶切除术治疗早期肺癌的临床效果,评估全腔镜解剖性肺段切除术在早期肺癌的应用价值。方法将肺部小结节(CT上直径≤2cm)患者随机分入全腔镜解剖性肺段切除术组及肺叶切除术组。比较其手术并发症、术后肺功能及手术短期效果。结果两组分别入组35例。无中转开胸,无围术期死亡,解剖性肺段切除组手术时间长于肺叶切除组(P<0. 05),但解剖性肺段切除术组术后住院时间少于肺叶切除术组(P<0. 05)。两组术中出血量、清扫淋巴结个数、术后引流时间、术后并发症发生率、术后1年生存率及复发率比较均无明显差异(P>0. 05)。两组患者术后1年用力肺活量( FVC) 、第1 秒钟用力呼气量与用力肺活量比值( FEV1% ) 及最大通气量(MVV)均较术前下降,但解剖性肺段除组术后下降比例较小(P<0. 05)。结论完全胸腔镜下解剖性肺段切除术与肺叶切除术治疗早期肺癌并发症相似,短期疗效无明显差异,但解剖性肺段切除术对于患者肺功能的保护更为好,可能对提高患者术后生活质量有帮助。
全胸腔镜;解剖性肺段切除术,肺叶切除术,早期肺癌,前瞻性研究,微创
资料与方法
一、基本资料
我院于2011年10月至2015 年3月对临床发现CT直径≤2cm肺部结节进行了胸腔镜手术治疗。患者随机分为全胸腔镜解剖性肺段切除组及全胸腔镜肺叶切除组。入组条件为既往无恶性肿瘤病史,CT上肺部结节直径≤2 cm,术前评估考虑为I期肺癌。退出条件为术中冰冻结果不是肺癌,术中淋巴结活检提示有转移者,术中切缘冰冻结果为阳性或有手术禁忌症者。分别当入组35人后实验终止。手术已经取得本医院伦理委员会讨论并同意开展,术前与患者充分沟通,并且征得患者家属签字同意。所有患者均行头部CT、腹部B超及骨扫描排除远处转移,部分病人行PET-CT检查。所有患者气管镜检查均为阴性,术前肺功能检查提示能耐受手术治疗。
二、手术方法
两组患者均采用全麻气管插管,患侧支气管行封堵器封堵,以保证该侧肺塌陷方便手术探查及操作。体位采取侧卧位,腋下垫高使肋间增宽。胸腔镜观察孔位于腋中线第7肋间,长约1.5 cm,主操作孔位于腋前线第4肋间,长约2.5cm,副操作孔位于腋后线第8 肋间,长约1.5 cm。
解剖性肺段切除术组:本次选用解剖性肺段切除术,手术关键为肺段的动脉、静脉及支气管的游离与处理。根据不同肺段的动脉、静脉及支气管位置关系,以及肺裂发育情况不同,其处理先后顺序也有所区别。具体处理方法如下:如果术中发现肺裂发育好,先从肺裂中分离出肺动脉,打开血管鞘后向远端游离出相应的肺段动脉,双重结扎后予超声刀剪断。在肺段动脉向深面游离相应的肺段支气管,予绿色的直线切割缝合器切断。最后沿肺静脉向远端游离相应的肺段静脉,予白色的直线切割缝合器切断。肺段平面确定采用支气管阻断后胀气法,即切断肺段支气管后松开支气管堵塞球囊,患侧采用低压力通气,肺部没有膨胀的区域就是要切除的肺段区域,边界予电凝肺表面标记,再用直线切割缝合器切除相应肺段。切除肺段时需注意切缘必须离开肿瘤至少2 cm,距离不够时需切除部分邻近肺段组织,术中送冰冻以保证切缘无肿瘤细胞。如果术中发现肺裂发育不良, 则先处理肺段静脉,游离肺叶静脉并再向远端游离相应的肺段静脉,予白色的直线切割缝合器切断。再向深面解剖及游离相应的肺段支气管,予绿色直线切割缝合器切断段支气管。最后游离肺段动脉,双重结扎后超声刀剪断,肺段边界按上述方法处理。术中需行肺段间及肺段内淋巴结活检,送检肿物及淋巴结,如出现淋巴结转移或切缘阳性,退出入组并改行肺叶切除术。最后常规系统清扫段间、肺门及纵隔淋巴结。
肺叶切除术组:如肺部结节位于外周浅表处,先行楔形切除活检明确是否恶性(肺部肿物小于1.0cm术前先行美兰定位),如结节靠近肺门,无法行楔形切除术则直接行肺叶切除术。胸腔镜肺叶切除术采用单向式肺叶切除术方法。首先游离相应的肺叶静脉,白色直线切割缝合器切断。向深面再游离出相应肺叶支气管,绿色直线切割缝合器切断。最后游离肺叶动脉各分支,近端双重结扎后超声刀切断。肺裂予蓝色直线切割缝合器处理。术中按常规系统清扫肺门及纵隔淋巴结送检。
三、观察指标
主要为手术时间、术中出血量、术后住院时间、术后引流量、拔除胸腔引流管天数、清扫淋巴结个数。术后并发症发生率,术后1年死亡率、复发率,以及术后1 年用力肺活量( FVC) 、第1 秒钟用力呼气量与用力肺活量比值( FEV1% ) 及最大通气量(MVV)情况。
四、统计方法
本实验采用SPSS21.0软件对数据进行统计学处理分析。计量资料采用t检验,计数资料采用χ2检验。取P≤0.05 时有统计学差异。
结 果
一、两组病例临床资料的统计分析
两组病例的临床资料(性别、年龄、肿瘤大小、肿瘤位置、肺癌种类、术前合并症)的差异无统计学意义。其中在解剖性肺段组腺癌病理分类,AIS/MIA/IA为6/9/12,肺叶组腺癌病理分类,AIS/MIA/IA为5/8/12,无明显统计学差异,P>0.05。(见表1)
二、两组病例的手术相关情况的统计分析
两组患者均无围手术其死亡病例。全胸腔镜解剖性肺段切除组在手术时间上要长于肺叶切除组(P<0.05),但在术后住院时间上优于肺叶切除组(P<0.05);两组在手术清扫淋巴结个数、出血量、术后引流量、引流管天数、术后并发症方面无明显统计学差异,P>0.05,(见表2)。
三、两组病例术后短期疗效和术后1年肺功能的统计分析
所有患者术后随访1年以上,术后1年两组病人均未发现死亡病例,均无肿瘤复发及远处转移情况。解剖性肺段切除组及肺叶切除术组在术后1 年肺功能指标(FVC、FEV1,MVV)如下,(见表3)。
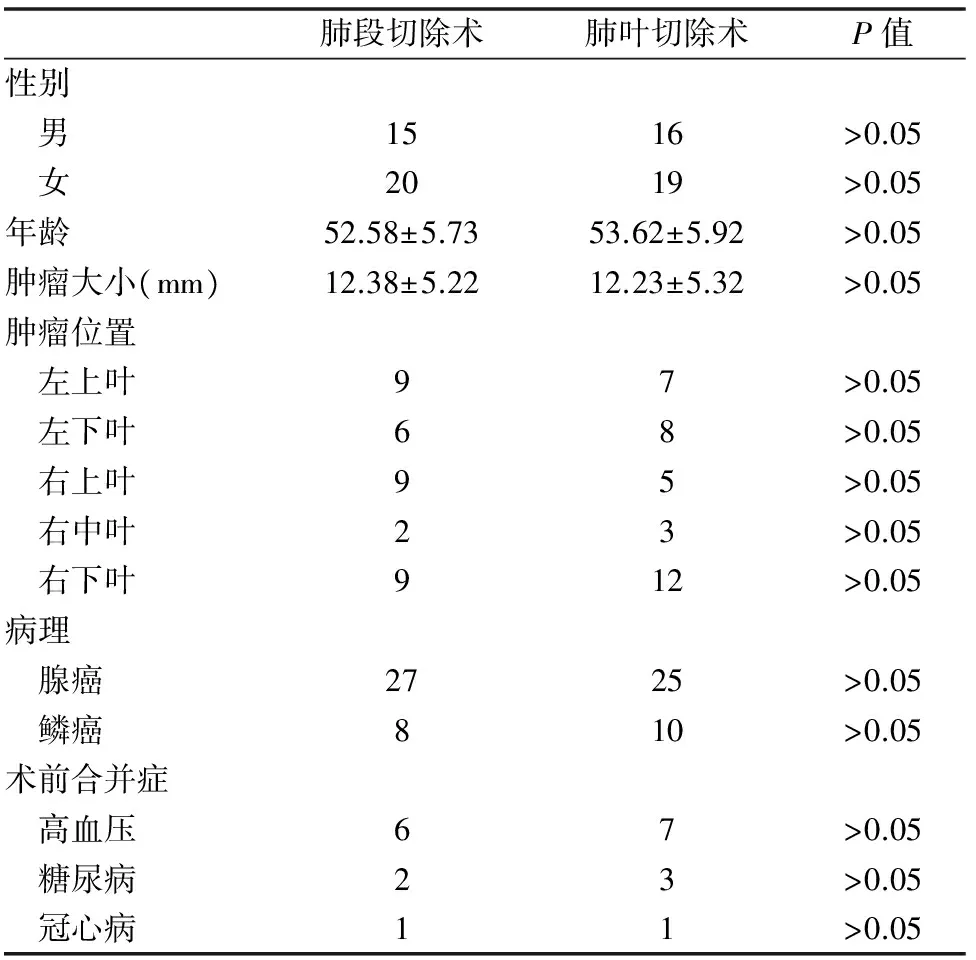
表1 两组病例临床资料的统计分析表
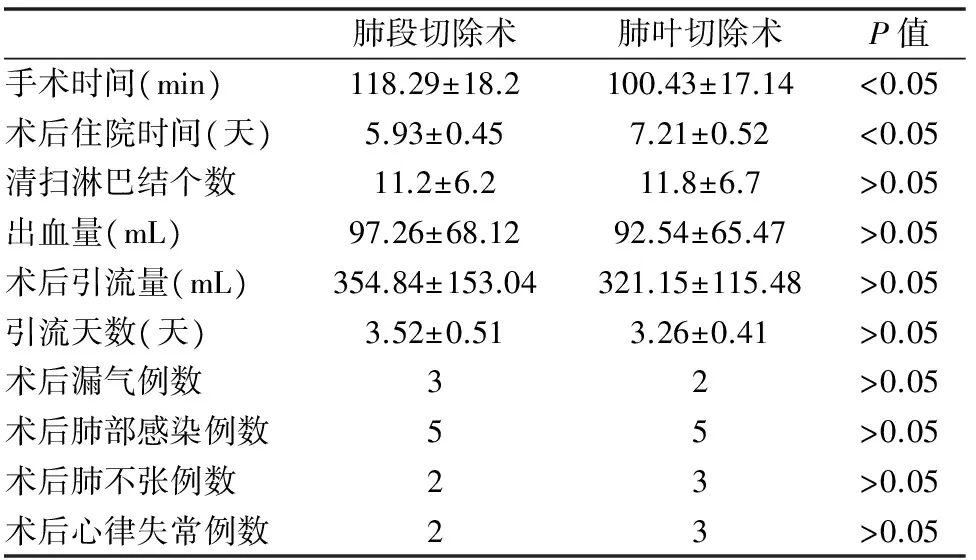
表2 两组病例的手术相关情况的统计分析表
肺功能各项指标下降百分比肺段切除术组明显优于肺叶切除组,两者差异有统计学意义,P<0.05,(见表4)。

表3 两组病例术后1年肺功能的统计分析
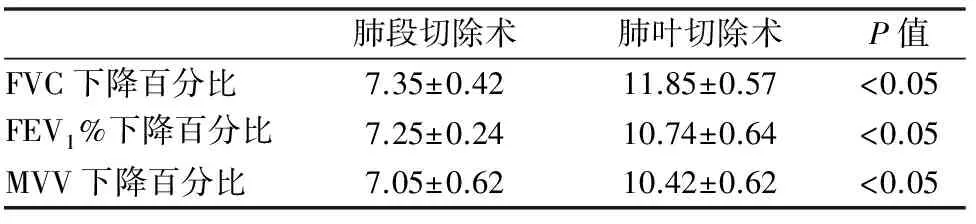
表4 两组病例术后1年肺功能的统计分析
讨 论
亚肺叶切除术包括解剖性的肺段切除术及非解剖性的肺楔形切除术,能在保证切除病变组织同时保存患者更多的肺功能,是治疗肺部良性病变的理想选择。随着腔镜技术的发展,应用胸腔镜亚肺叶切除术治疗早期非小细胞肺癌患者已经取得不错的疗效。肺段间淋巴结所在区域是行肺楔形切除无法接触的,而早期肺癌患者肺段间淋巴结就有可能出现转移,因此肺楔形切除术患者术后局部复发率要高于肺段切除者。因而本次研究采用全胸腔镜解剖性的肺段切除术。肺段切除术有着自身的解剖理论基础,即在解剖上肺的独立的单元为肺段,每一个肺段都有各自的动静脉及支气管体系。因此肺段可独立行解剖性切除术,并可处理段间可能出现转移的淋巴结。Churchill[1]等最早在1939年已经报道应用肺段切除术治疗支气管扩张症,并取得不错疗效。随后渐渐有学者应用肺段切除术治疗肺癌[2-3]。理论上任何一个肺段都可以行切除术,但临床常规的肺段切除术一般指的是上叶尖、后段切除、左上肺固有段切除、左上肺舌段切除、下叶背段切除以及下叶基底段切除,而其余的肺段手术解剖复杂,手术操作难度较大,术后的并发症较多,临床上较少应用。由于一项在1995年的随机研究发现相对于肺叶切除术,行亚肺叶切除术的术后局部复发率较高,所以肺癌术式的金标准为肺叶切除术[4]。但接着有几项回顾性研究表明对于早期肺癌患者(肿块直径<2 cm),解剖性肺段切除术拥有与肺叶切除术相似的生存率[5-8]。有临床资料表明[9],亚肺叶切除术可能是老年(大于70岁)早期肺癌患者最为恰当的手术方式。亚肺叶切除不能完全取代肺叶切除手术成为早期肺癌的标准术式,但是对于肺功能欠佳的老年患者,可能会逐渐成为主流术式[10]。NCCN (美国国家综合癌症网)的非小细胞肺癌临床实践指南也提出显示的建议:对于早期非小细胞肺癌,亚肺叶切除术(包括解剖性肺段切除及非解剖性的肺楔形切除)是可以选择的一种手术方式。并且NCCN提出了行亚肺叶切除的手术指征:① 不能耐受肺叶切除术,包括肺功能查欠佳或合并其他重要合并症的患者。② 肺部结节直径≤2 cm,且位于肺外周,并且至少具备以下特征:① 病理组织学类型是单纯细支气管肺泡癌(2B类);② 螺旋CT提示肺结节毛玻璃样成分≥50% (2B类;③ 结节的倍增时间≥400天(2B类)。随着胸腔镜技术的发展和日益成熟,解剖性肺段切除也越来越多的应用胸腔镜技术完成[11-12]。本次研究参考了NCCN的亚肺叶切除的手术指征,并进行了修改,具体手术指征为:肺部结节CT直径≤2cm,既往无恶性肿瘤病史,术前行头部CT、腹部B超及骨扫描排除远处转移,部分病人行PET-CT检查,术前评估考虑为I期肺癌,术中行肺段、肺门及纵隔淋巴结活检提示无转移,术中切缘阴性,术前肺功能检查提示能耐受手术治疗,无其他手术禁忌症者。本次研究的手术效果良好,可作为日后手术指征一个重要参考指标。
胸腔镜肺段切除术对术者要求更高,术者必须拥有丰富的肺叶切除术经验,熟悉不同肺段解剖特点,还要有立体解剖的意识及想象,掌握各肺段的动脉、静脉、支气管的分布及走行规律和变异情况[13]。胸腔镜肺段切除术一个重要争论点及难点是如何确定肺段之间的边界平面。因为肺段间平面在肺表面没有可见的天然标志,不同学者有不同方法确定肺段间平面。目前主要有两种方法判断肺段间平面:① 根据切断肺段支气管后行胀肺,在充气与萎陷界限确定肺段间平面;② 利用肺段间的静脉来确定肺段段间平面[14]。我们使用在切断段支气管后通过膨肺来判断段间平面,但膨胀肺部压力必须控制,否则气体通过肺泡小孔后会导致邻近肺段也膨起,造成切除范围不足够。有一些学者提出[15-18]肿瘤距切缘的距离影响术后生存率、局部复发率,因而在段间平面确定的同时是必须保证切缘与肿瘤有足够的距离,切缘必须为阴性,以降低术后局部复发率、提高术后生存率。Yamashita等研究提出[12]肺段切除术中切缘与肿瘤小于1cm,术后会出现较高的局部复发率,有必要改行扩大肺段切除或改行肺叶切除术。本研究所有病例肿瘤距切缘必须≥2 cm且大于肿瘤直径,而当肿瘤切缘小于2 cm或肿物跨越肺段时行联合肺段切除,术后1年均无复发及转移,手术效果良好。
肿瘤直径<2 cm是亚肺叶切除手术适应证的一个重要指标,对于直径更大的肿瘤(2 cm-3 cm),行亚肺叶切除术仍然存在着争议[9]。有研究表明[19]在直径≤2 cm的早期小肺癌中,肺门及纵隔淋巴结转移率可达20%以上,所以应用胸腔镜解剖性肺段切除治疗早期肺癌时必须行肺门及纵隔淋巴结清扫,以保证肺癌分期的准确性。也有学者建议[20-21]在决定行肺段切除术前必须先对肺段和肺门淋巴结行采样快速冰冻病理检查,如淋巴结冰冻病理为阴性,方可行肺段切除;如结果提示有转移癌,只要身体条件允许都应该改行肺叶切除术。我们的手术经验,推荐行肺段切除术时行段间、叶间、肺门及纵隔淋巴结采样送冰冻病理检查,并常规行肺门及纵隔淋巴结清扫。本次研究行肺段切除术的所有患者必须保证切缘阴性且距离肿物大于2cm,而且术中淋巴结活检明确为阴性,否则改行肺叶切除术,因而手术效果良好,1年复查患者均无复发转移病例,这对以后的患者筛选提供了临床证据。肺段切除术后一个较常见的并发症是肺断面的漏气。本次研究采用直线切割缝合器处理肺段平面,术后肺漏气发生率不高(8.5%),术后未见明显肺不张,证明直线切割缝合器处理肺段平面是安全有效。
内科医生对于影像学检查发现的良性病变的孤立性肺部小结节多采取定期随访观察,或实验性的抗感染、抗结核治疗,而这些结节中有相当比例为恶性,因而导致诊断及治疗延误,影响治疗效果[22]。有文献表明[23],对于术前诊断不明的肺内单发球形病变有34.7%术后病理诊断与术前临床诊断不同,因此对于肺部小结节,特别是CT上直径≥0.8cm的肺部小结节,可考虑积极的外科处理,行胸腔镜解剖性肺段切除术治疗既可明确病理诊断,又可及时根治性切除病灶,有助于提高早期肺癌的诊断率及生存率。本次肺段切除术标本中有8例为鳞癌,占比22.9%,符合现在肺癌以腺癌为主的流行病学特点。鳞癌有自身的特点,其转移首先以淋巴结转移为主,早期病例手术切除效果良好,而且暂无有效的靶向药物治疗。对于早期鳞癌,肺段切除术加肺段淋巴结清扫符合肿瘤学特点,可以保证手术效果同时保护患者肺功能。本次研究也证明早期非小细胞肺癌的病理类型对于肺段切除术的安全性无影响。本次研究患者无中转开胸,无围术期死亡,亚肺叶切除组手术时间长于肺叶切除组(P<0. 05),两组术中出血量、手术时间、清扫淋巴结个数、术后引流时间、术后漏气例数、拔管天数、住院天数、并发症发生率、术后1年生存率及复发率比较均无明显差异(P>0.05),初步证明胸腔镜肺段切除术安全,术后短期效果与肺叶切除术相当。为手术处理肺部结节,特别是早期肺癌患者提供一个可选择的“更加微创的”治疗方案。
胸腔镜解剖性肺段切除术相对于肺叶切除术最大的优势是对术后残肺功能的保护,这对老年及肺功能欠佳的患者有重要意义,可提高术后生活质量。有研究表明[24],拟行肺段切除肺叶的FEV1%为(51%±2l%),肺段切除能保留该肺叶(41%±24%)的肺功能,因而肺段切除患者的术后FEV1%相对于肺叶切除者有明显的提高。Takizawa等报道[25]肺段切除术患者术后1年的FEV1较肺叶切除患者高,这说明肺段切除术对术后残肺功能的保护更好。Yoshimoto等也报道[24],相对于肺叶切除术,肺段切除术术后肺功能减少程度更少,但这与切除的肺段数(<3个)和部位直接相关。有研究证实[26-27],对于高龄(年龄≥75岁)和肺功能欠佳的患者肺段切除术是一种更为安全、适合的手术选择。本研究术后1年用力肺活量( FVC) 、1 秒钟用力呼气量与用力肺活量比值( FEV1% ) 及最大通气量(MVV)两组术后均较术前有所下降,但解剖性肺段除组术后下降比例更小(P<0. 01),结果与文献结果基本一致。多因素线性回归分析结果表明,肺叶或肺段切除对术后FVC的影响无明显差异,而对术后的FEV1有明显影响,这说明肺段切除术对患者术后残肺功能保护更佳,特别是对患者术后FEV1的保护更佳。这有助于提高患者术后生活质量,特别对肺功能欠佳或老年的患者更加明显。
胸腔镜解剖性肺段切除术对于早期肺癌安全可行,术后效果与肺叶切除术相当,对患者术后肺功能保护更佳,可在临床推广,但其需要的更高的手术技巧及操作经验,并且效果还需更多更大量的前瞻性病例对照研究及长期随访证实。
[1] Churchill ED,Belsey R.Segmental pneumoneetomy in bronchiectasis:The linguh segment of the left upper lobe[J].Ann Surg,1939,109(4):481-499.
[2] Bonfils-Roberts EA,Clagea OT.Contemporary indications for pulmonary segmental resections[J].J Thorac Cardiovasc Surg,1972,63(3):433-438.
[3] Jensik RJ,Faber LP,Milloy FJ,et al.Segmental resection for lung cancer. A fifteen-year experience[J].J Thorac Cardiovasc Surg,1973,66(4):563-572.
[4] Ginsberg RJ,Rubinstein LV.Randomized trial of Lobectomy versus limited resection for T1 NO non-small cell lung Cancer[J].Ann Thorac Surg,1995,60(3):615-623.
[5] Trodella L,Granone P,Valente S,et al.Adjuvant radiotherapy in non-small cell lung cancer with pathological stage I: definitive results of a phase III randomized trial[J].Radiother Oncol,2002,62(1):11-19.
[6] Femando HC,Santos RS,Benfield JR,et al.Lobar and sublobar resection with and without brachytherapy for small stage IA non-smal1 cell lung Cancer[J].J Thorac Cardiovasc Surg,2005,129(2):261-267.
[7] Okumura M,Goto M,Ideguchi K,et al.Factors associated with outcome of segmentectomy for non-small cell lung cancer:long-term follow-up study at a single institution in Japan[J].Lung Cancer,2007,58(2):231-237.
[8] Nakamura H,Taniguchi Y,Miwa K,et al.Comparison of the surgical outcomes of thoracoscopic lobectomy,segmentectomy,and wedge resection for clinical stage I non-small cell cancer[J].Thorac Cardiovasc Surg,2011,59(3):137-141.
[9] 王俊,赵辉.亚肺叶切除治疗早期肺癌需要考虑的几个问题[J].中国肺癌杂志,2016,19(6):351-354.
[10] 马千里,刘德若,郭永庆,等.T1期非小细胞肺癌肺叶切除和亚肺叶切除的临床疗效比较[J/CD]. 中华胸部外科电子杂志,2016,3(1):29-34.
[11] Sugi K,Kobayashi S,Sudou M,et al.Long-term prognosis of video-assisted limited surgery for early lung cancer[J].Eur J Cardiothorac Surg,2010,37(2):456-460.
[12] Yamashita S,Chujo M,Kawano Y,et al.Clinical impact of segmentectomy compared with Lobectomy under complete video-assisted thoracic surgery in the treatment of stage I non-small cell lung cancer[J].J Surg Res,2011,166(1):46-51.
[13] Rami-Porta R,Tsuboi M.Sublobar resection for lung cancer[J].Eur Respir J,2009,33(2):426-435.
[14] Oizumi H,Kanauchi N,Kato H,et al.Total thoracoscopic pulmonary segmentectomy[J].Eur J Cardiothorac Surg,2009,36(2):374-377.
[15] El-Sherif A,Gooding WE,Santos R,et al.Outcomes of sublobar resection versus lobectomy for stage I non-small cell lung cancer: a 13-year analysis[J].Ann Thorac Surg,2006,82(2):408-416.
[16] Sienel W,Stremmel C,Kirschbaum A,et al.Frequency of local recurrence following segmentectomy of stage IA non-small cell lung cancer is influenced by segment localisation and width of resection margins-implications for patient selection for segmentectomy[J].Eur J Cardiothorac Surg,2007,31(3):522-528.
[17] El-Sherif A,Fernando HC,Santos R,et al.Margin and local recurrence after sublobar resection of non-small cell lung cancer[J].Ann Surg Oncol,2007,14(8):2400-2405.
[18] Sawabata N,Ohta M,Matsumura A,et al.Optimal distance of malignant negative margin in excision of nonsmall cell lung cancer:a multicenter prospective study[J].Ann Thorac Surg,2004,77(2):415-420.
[19] Watanabe S,Oda M,Go T,et al.Should mediastinal nodal dissection be routinely undertaken in patients with peripheral small-sized(2 cm or less)lung cancer Retrospective analysis of 225 patients[J].Eur J Cardiothorac Surg,200l,20(5):1007-1011.
[20] Okada M,Koike T,Higashiyama M,et al.Radical sublobar resection for small-sized non-small cell lung cancer:a multicenter study[J].J Thorac Cardiovasc Surg,2006,132(4):769-775.
[21] Wolf AS,Richards WG,Jaklitsch MT,et al.Lobectomy versus sublobar resection for small(2 cm or less)non-small cell lung cancers[J].Ann Thorac Surg,2011,92(5):1819-1825.
[22] Rieger R,Woisetschlger R,Schinko H,et al.Thoracoscopic wedge resection of peripheral lung lesions[J].Thorac Cardiovasc Surg,1993,41(3):152-155.
[23] 尚立群,李辉,姚松朝,等.209例肺内单发球形病变的诊治[J].中华胸心血管外科杂志,2000,16(6):360.
[24] Yoshimoto K,Nomori H,Mori T,et al.Quantification of the impact of segmentectomy on pulmonary function by perfusion single-photon-emission computed tomography and multidetector computed tomography[J].J Thorac Cardiovasc Surg,2009,137(5):1200-1205.
[25] Takizawa T,Haga M,Yagi N,et al.Pulmonary function after segmentectomy for small peripheral carcinoma of the lung[J].J Thorac Cardiovasc Surg,1999,118(3):536-541.
[26] Kilic A,Schuchert MJ,Pettiford BL,et al.Anatomic segmentectomy for stage I non-small cell lung cancer in the elderly[J].Ann Thorac Surg,2009,87(6):1662-1668.
[27] Shapiro M,Weiser TS,Wisnivesky JP,et al.Thoracoscopic segmentectomy compares favorably with thoracoscopie lobeotomy for patients with small stage I lung cancer[J].J Thorac Cardiovasc Surg,2009,137(6):1388-1393.
Aprospectivestudyoftotalthoracoscopicsegmentectomyandlobectomyintreatmentofearlystagelungcancer
PANGWen-guang,HUANFeng-liu,YEMin,PANGJing-zhuo,WUShuo-yun
DepartmentofThoracicSurgery,JiangmenCentralHospital,Jiangmen,Guangdong529030,China
ObjectiveTo prospectively compare clinical efficacy of total thoracoscopic segmentectomy and lobectomy in treatment of early stage lung cancer, in order to evaluate the application of totally thoracoscopic segmentectomy in early stage lung cancer.MethodsPatient with pulmonary nodules (CT diameter ≤2cm) were randomly divided into the total thoracoscopic segmentectomy group and the lobectomy group. Their surgical complications, postoperative lung function and short-term operation effect were compared.Results35 patients were successfully joined into two groups respectively. No conversion to thomcoctomy and no perioperative mortality occurred. Compared to totally thoracoscopic lobectomy, the operative time was longer (P<0.05) and the postoperative hospitalization time was lesser (P<0.05) in totally thoracoscopic segmentectomy. The intraoperative bleeding, number of the resected lymph nodes, postoperative drainage time, perioperative complications morbidity, 1-year postoperative survival and recurrence rate had no statistical discrepancy (P>0.05). The decrement rate of pulmonary function was much better in total thoracoscopic segmentectomy (P<0.05).ConclusionIn early stage lung cancer, the complications and short-term effect between total thoracoscopic segmentectomy and lobectomy are similar. It is better for protecting pulmonary function in segmentectomy and could improve the quality of life of patients after operation.
total thoracoscopy; segmentectomy; lobectomy; early stage lung cancer; minimally invasive
10.3969/j.issn.1009-6663.2017.010.035
529030 广东 江门,江门市中心医院 1.胸外科 2.呼吸科
肺癌是我国发病率及致死率最高的恶性肿瘤,早期肺癌手术效果明显。过往早期肺癌发现率较低,随着低剂量螺旋CT的应用推广,早期肺癌的发现率逐步提高,可以手术根治的早期肺癌患者也越来越多。胸腔镜肺叶切除术在早期肺癌治疗中已经证明跟开放手术有着同样的疗效,但术后恢复过程更快。解剖性肺段切除术理论上对患者肺功能保护更好,越来越多学者也应用全胸腔镜解剖性肺段切除术治疗早期肺癌,但其安全性、疗效及肺功能的保护仍然有待进一步证实,为此我们进行了一个前瞻性研究,报道如下。
2017-02-10]
