辣椒种质资源TMV抗性的鉴定与评价
2017-10-19燕默赵贵叶
秦 蕾 梁 燕默 宁 张 洋 赵贵叶
辣椒种质资源TMV抗性的鉴定与评价
秦 蕾 梁 燕*默 宁 张 洋 赵贵叶
(西北农林科技大学园艺学院,陕西杨凌 712100)
对来源于国家蔬菜种质资源中期库的51份辣椒种质资源进行烟草花叶病毒(TMV)的田间抗性调查。结果显示,各种质病情指数在17.04~75.56之间,有14份种质田间表现出了TMV抗性。各种质抗性分布基本符合正态分布,略向感病区域偏离。将筛选出的14份抗病材料和7份感病材料进行TMV苗期人工接种抗性鉴定,21份种质的病情指数在6.28~65.48之间,获得抗病材料15份。相关分析结果表明,TMV田间成株自然发病病情指数与苗期人工接种鉴定病情指数的相关系数r=0.789,呈极显著相关。结合田间抗性调查和人工接种抗性鉴定结果,利用12对与L基因连锁的分子标记对13份TMV抗病种质进行分子鉴定,6份材料中共检测到6个抗性分子标记。抗TMV辣椒种质的主要农艺性状表现出一定的多样性。
辣椒;种质资源;TMV抗性;鉴定
辣椒(Capsicum annuum L.)为茄科辣椒属一年生或多年生植物,在全国20多个省、市、自治区都有栽培。病毒病一直是威胁辣椒生产的重要因秦蕾,女,博士研究生,主要从事辣椒TMV抗性基因挖掘与功能研究,E-mail:qinlei@nwsuaf.edu.cn
常引起辣椒叶片坏死、枯斑、褪绿,植株矮化,落花、落果,对辣椒生产造成严重损失。目前,世界各地鉴定出侵染辣椒的病毒有30余种,其中烟草花叶病毒(Tobacco mosaic virus,TMV)是威胁辣椒生产的主要病毒。
TMV在世界范围内普遍发生,尤其易感染烟草、番茄、辣椒等茄科作物。TMV主要通过植物种子和汁液摩擦传毒,通过植物的维管组织,迅速侵染植株幼嫩组织,在叶片上产生浅绿或深绿色的病斑,影响植物的生长发育(程秉铨和彭湘儒,1994;Cheng et al.,2000;李明福 等,2012)。辣椒TMV抗性主要由L基因控制,L基因也是辣椒对烟草花叶病毒属最有效的抗病基因之一(Lefebvre et al.,1995)。Tomita等(2011)通过图位克隆获得L3基因,并利用同源克隆的方法获得了L的其他 6 个等位基因:L1、L1a、L1c、L2、L2b、L4,但是高效L基因主要存在于辣椒野生种当中。选育抗病品种是防治辣椒TMV最有效的措施之一。本试验对51份辣椒种质进行田间TMV抗性调查及苗期抗性评价,并利用L基因的相关分子标记对辣椒种质进行TMV抗性基因鉴定,以期为辣椒抗性遗传改良及抗病品种选育提供理论依据。
1 材料与方法
1.1 试验材料
供试辣椒种质来自国家蔬菜种质资源中期库,选取51份经初步纯化的种质作为供试材料,材料名称和来源地详见表1。TMV鉴定毒源TMV-U1株系由西北农林科技大学园艺学院番茄种质资源课题组提供。
1.2 试验方法
1.2.1 辣椒田间TMV抗性鉴定及农艺性状调查试验于2015~2016年在西北农林科技大学园艺学院蔬菜基地进行。1月播种,4月上旬定植。每份材料种植30株,随机区组排列,株距35 cm,行距50 cm。定植30 d后,采集感病材料疑似发病叶片,液氮速冻,提取叶片总RNA,利用TMVCP特异引物(F:TCTTGTCATCAGCGTGGGC;R:AACAGTGCTGTGACTAGCGGGT)对田间疑似发病叶片进行PCR鉴定,确定辣椒田间病害为TMV。农艺性状调查项目根据《辣椒种质资源描述规范和数据标准》进行(李锡香和张宝玺,2006),试验数据取两年数据的平均值。
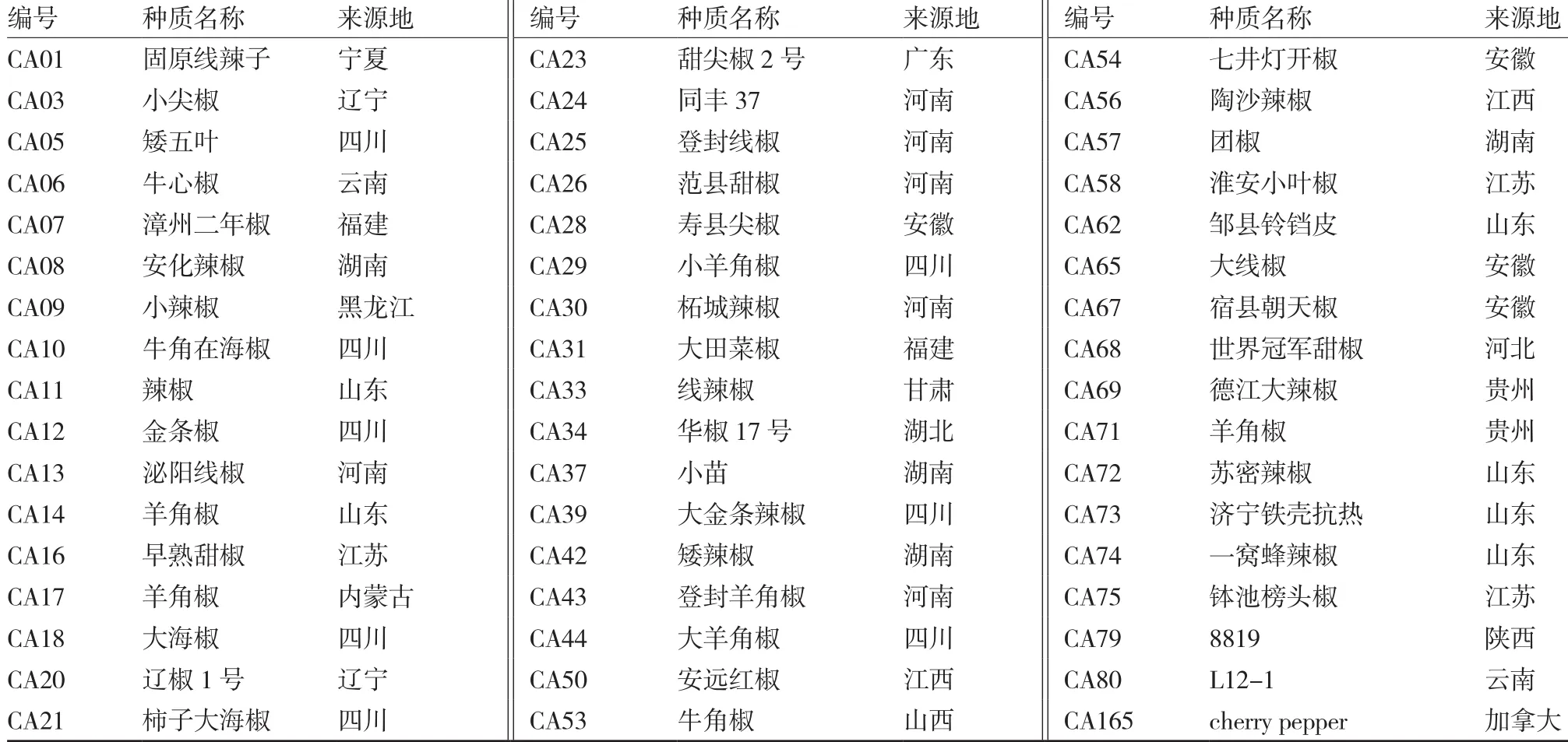
表1 参试辣椒种质名称及来源
1.2.2 TMV苗期人工接种抗性鉴定 从田间TMV调查结果进一步筛选21份辣椒种质进行苗期人工接种抗性鉴定,以七井灯开椒为感病对照。2016年7月15日将辣椒种子在55 ℃下温汤浸种催芽,播种于10 cm×10 cm 的育苗钵中,放置于人工气候箱培养。育苗期间控制白天温度25 ℃,夜间温度 23 ℃。
辣椒幼苗4叶期进行人工摩擦接种,每个材料3次重复,每重复15株。TMV-U1株系接种20 d后采摘TMV发病叶片,加入10倍于鲜叶质量的0.01 mol·L-1磷酸缓冲液(PBS,pH=7.0)中,捣碎后用双层纱布过滤,滤液立即用于接种。接种后,将幼苗置于20~28 ℃光照培养箱中诱发病害。接种5 d后调查局部症状,20 d后调查系统症状,记录病株数及病级。计算病情指数,进行抗性分类。TMV抗性调查的病情指数计算及抗性级别的划分均依据《辣椒种质资源描述规范和数据标准》(李锡香和张宝玺,2006)。
病情指数(DI)=Σ(病级数值×该病级株数)/(病级最高值×调查总株数)×100
1.2.3 TMV抗性的分子标记鉴定 利用已报道的12对与L基因连锁的分子标记(表2)对TMV抗病种质进行分子鉴定。采用CTAB法提取植物基因组DNA,采用1%琼脂糖凝胶电泳和紫外分光光度计测定DNA的质量和浓度,并将浓度稀释至100 ng·μL-1,于-20 ℃冰箱内保存备用(Sun et al.,2012)。PCR 反应体系为 20 μL:PCR-mix(2×Es Taq MasterMix)10 μL,模板 DNA 1.0 μL,引物(10 μmol·L-1)0.8 μL,ddH2O 补 齐 至 20μL。PCR扩增程序:94 ℃预变性3 min;94 ℃变性30 min,52 ℃退火40 s,72 ℃延伸2 min,共进行35个循环;最后72 ℃延伸10 min,4 ℃保存。

表2 试验所用引物
1.2.4 相关性分析 利用SPSS软件对试验数据进行Pearson相关性分析及构建回归方程。利用ORIGIN软件进行次数分布图的绘制。
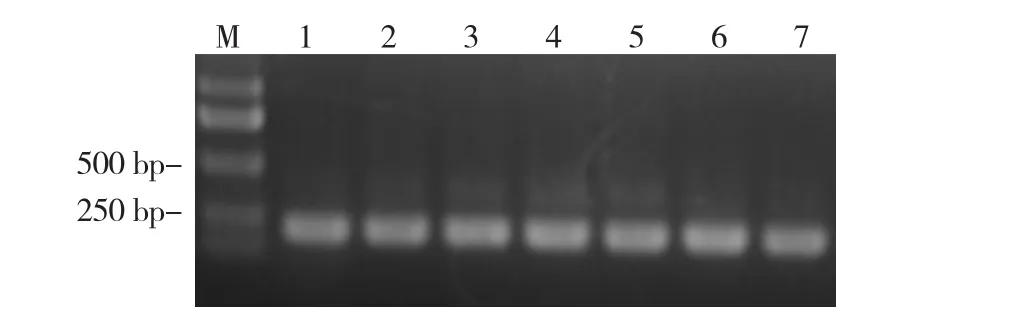
图1 辣椒植株的TMV鉴定结果
2 结果与分析
2.1 辣椒种质TMV抗性的田间鉴定结果
经TMV-CP特异性引物扩增,田间发病植株感染了TMV(图1)。田间成株自然发病抗病性调查结果显示(表3),供试51份材料病情指数为17.04~75.56。其中抗病材料3份,占5.88%,这3份材料的叶片仅有轻微的花叶或无症状;中抗材料11份,占21.57%,表现为植株少部分叶片呈现花叶,部分植株心叶微皱;感病材料31份,占60.78%,植株多数叶片花叶,心叶皱缩;高感材料6份,占11.76%,叶片表现为严重花叶和心叶畸形、皱缩,植株矮化;根据材料抗性分级,51份辣椒种质抗性分级符合正态分布,峰值向感病材料偏离(图 2)。
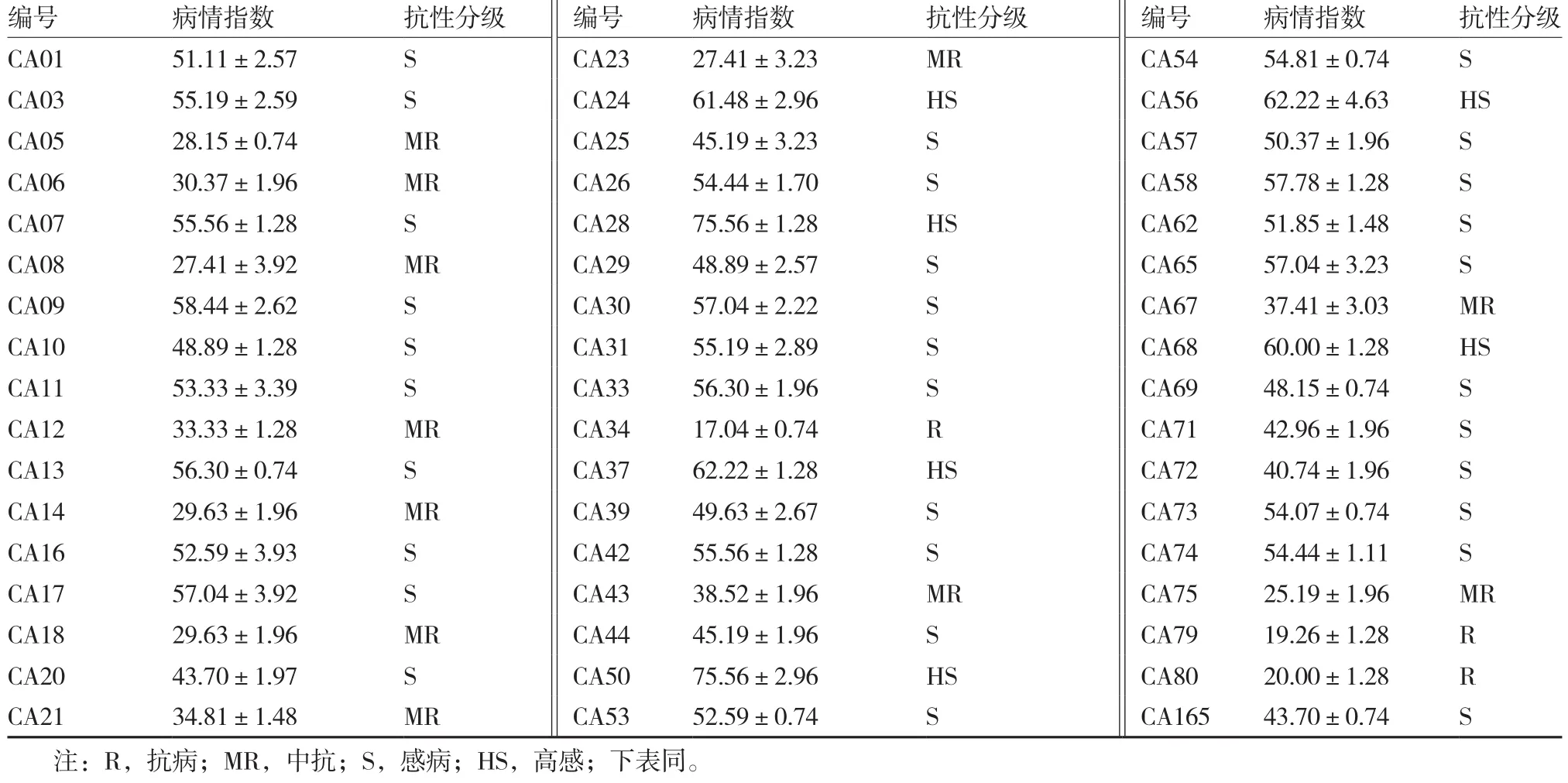
表3 辣椒种质TMV抗性田间鉴定结果

表4 辣椒种质TMV抗性人工接种鉴定结果

图2 辣椒种质对TMV抗性级别的次数分布
2.2 辣椒种质TMV抗性的人工接种鉴定
根据田间TMV抗性调查结果(表3),共筛选出抗病辣椒种质14份,另选5份感病材料、2份高感材料,进行苗期人工接种抗性鉴定。结果显示(表4),参试材料的病情指数分布在6.28~65.48之间。其中高抗材料2份、抗病材料7份、中抗材料6份、感病材料6份。对TMV田间鉴定病情指数与苗期人工接种鉴定病情指数进行抗病性相关分析,结果表明,二者的相关系数r=0.789,达到极显著水平,说明苗期抗性鉴定可以反映该种质的田间成株抗性水平。以各种质苗期鉴定病情指数为X,以田间成株自然发病病情指数为y,回归方程为y=19.176+0.575X。依据该回归方程可以预测各种质田间自然发病的病情指数(表4)。
2.3 辣椒种质TMV抗性的分子标记鉴定
利用12对已报道的辣椒TMV抗性基因相关的分子标记对16份材料进行鉴定,包括田间及人工接种鉴定筛选出的13份抗病种质CA05、CA06、CA08、CA12、CA14、CA20、CA21、CA34、CA43、CA75、CA79、CA80、CA165和3份感病种质CA18、CA42、CA56。结果表明(图3),CA06具有3、6、12号抗病分子标记;CA14具有12号抗病分子标记;CA34具有4号抗病分子标记;CA79具有1、3、4号抗病分子标记;CA80具有3、4、9号抗病分子标记;CA165具有4号抗病分子标记。其余7份种质在以上12对分子标记中未表现抗性;参试的16份种质均不含有2、5、7、8、10、11号分子标记(图3)。
2.4 抗TMV辣椒种质的主要农艺性状
基于田间抗性调查和苗期人工接种鉴定结果,从51份供试辣椒材料中筛选获得抗病材料13份,其中3份来自四川、2份来自云南,陕西、江苏、湖北、河南、湖南、安徽、山东、广东各1份,主要集中在我国中、西部地区。抗TMV辣椒种质的主要农艺性状表现出一定的多样性(表5),始花节位为第8~18节;果形包括线形2份、羊角形4份、锥形1份、牛角形3份、指形3份;单果质量最小为2.60 g,最大为30.80 g;株型主要为半直立,2份直立,无开展株型;7份材料分枝性中等,2份分枝性强,4份分枝性弱,抗病种质较感病材料株型紧凑。
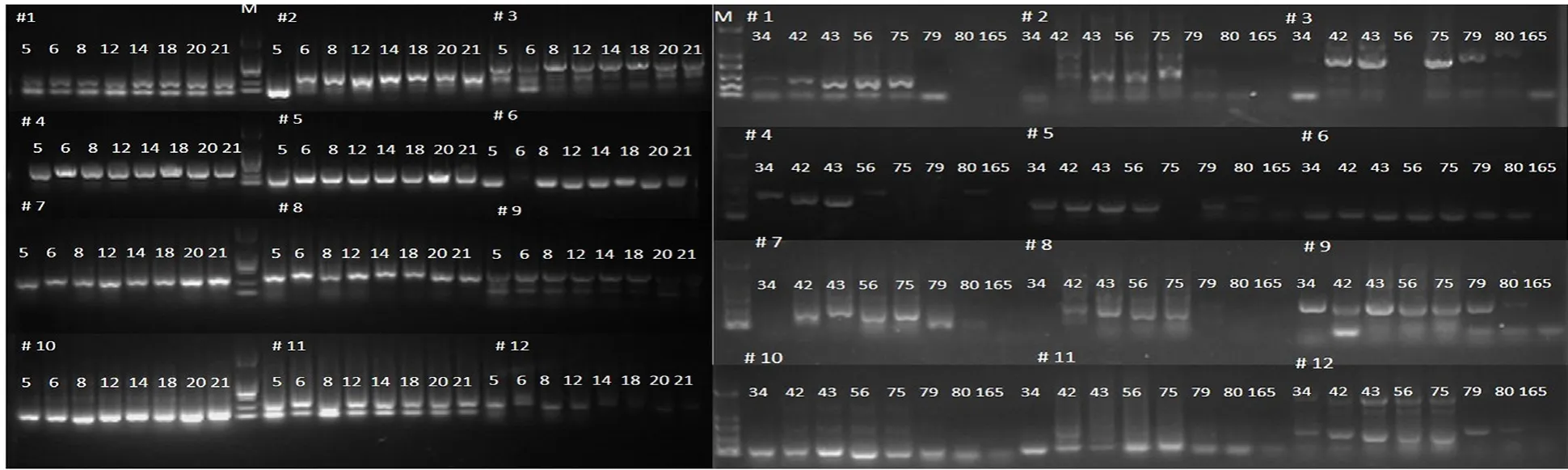
图3 辣椒种质TMV抗性分子标记筛选结果
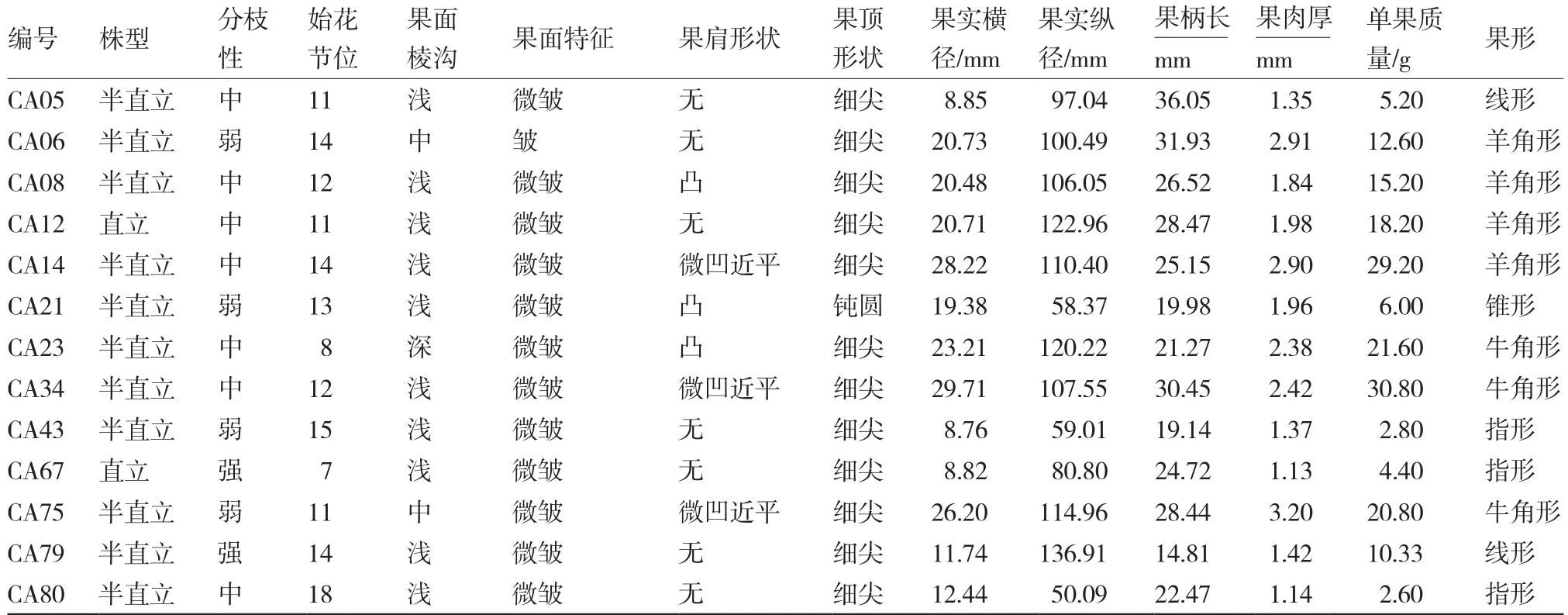
表5 抗TMV辣椒种质资源的主要农艺性状
3 结论与讨论
本试验通过田间抗性调查和苗期人工接种抗性鉴定,在51份辣椒种质中筛选出TMV抗病种质13份,这些抗病资源可以为今后的TMV抗性品种选育提供种质基础。黄启中等(2004)对280份辣椒种质进行了TMV和黄瓜花叶病毒(CMV)的田间调查和人工抗病性鉴定,获得3份抗原材料;王述彬等(2001)从154份辣椒种质资源中鉴定出5份抗TMV材料、11份抗CMV材料。吴跃勇和崔德祥(2007)对贵州地区的辣椒种质进行了TMV抗性鉴定,鉴定出的抗病材料仅占测试材料的7.6%;王飞等(2010)在74份泰国辣椒种质中筛选出7份TMV抗性材料;姚明华等(2012)在引进的42份非洲辣椒材料中筛选出9份TMV抗性材料。以往研究筛选到的抗原材料相对较少,所包含的抗病基因也不明确。本试验对51份辣椒种质进行田间抗性鉴定,结果表明,TMV的抗性分级向感病偏移,人工接种鉴定到的抗病材料也大多表现为抗病及中抗,无免疫材料。目前,辣椒TMV抗性基因L已被克隆,本试验利用已报道的12对与L基因连锁的分子标记对13份抗病种质进行评价,结果有6份种质含有抗病分子标记,但是,这12对分子标记均无法有效区分抗病材料与感病材料,这种现象可能是由于12对分子标记来源于L基因的不同等位基因,导致不同抗病材料的分子标记结果不同,而未筛选出标记的抗病材料可能含有其他TMV抗性相关基因,其抗病机制有待进一步研 究(Kim et al.,2008;Tomita et al.,2008;Yang et al.,2009;Özkaynak et al.,2014)。
辣椒TMV抗性与农艺性状的相关性分析结果显示,辣椒TMV抗性与其他农艺性状之间并不存在显著的相关性(数据未列出)。本试验中,13份抗病辣椒材料株型主要为半直立,2份直立,无开展株型;7份材料分枝性中等,2份分枝性强,抗病材料较感病材料株型紧凑。此外,抗病材料始花节位大多高于11,高于感病材料,即花期较晚的材料中,抗病性强的比率较高。耿广东等(2009a,2009b)研究表明,植株性状(侧芽个数、株高、叶片纵横比、茎粗)、果实性状(果皮厚度、单果质量)与辣椒白粉病抗性相关。邹学校等(2004)利用灰色关联方法分析了40份湖南地方辣椒品种和12个杂交组合,结果表明辣椒TMV抗性与始花节位、株高、开展度、分枝数等植株性状的关系较近。本试验也发现辣椒对TMV的抗性强于甜椒,但是抗性是否与辣椒素含量相关还有待进一步研究。除了进行苗期人工接种鉴定外,开发有效的分子标记对于辣椒TMV抗性材料的筛选具有重要意义。目前辣椒TMV抗性相关分子标记主要来自L基因,未来的工作需要挖掘鉴定其他TMV抗性基因,开发来源更广泛的分子标记用于辣椒TMV种质的筛选。
程秉铨,彭湘儒.1994.辣椒种皮传带烟草花叶病毒(TMV)的证明.电子显微学报,(5):371.
耿广东,张素勤,盛霞.2009a.辣椒种质资源主要表型性状的典型相关分析.中国农学通报,25(5):209-211.
耿广东,张素勤,盛霞.2009b.辣椒种质资源主要表型性状的聚类分析.长江蔬菜,(8):8-10.
黄启中,吕中华,黄任中,林清,史思茹,雷蕾.2004.辣椒抗病毒病种质资源创新研究初报.辣椒杂志,(4):27-31.
李明福,徐宁生,许建辉,张丽芬,陈萍,段云华.2012.烟株不同叶位及接种方式对TMV传播的影响.西南师范大学学报:自然科学版,37(5):111-118.
李锡香,张宝玺.2006.辣椒种质资源描述规范和数据标准.北京:中国农业出版社.
王飞,姚明华,焦春海.2010.泰国辣椒种质资源鉴定与评价.湖北农业科学,49(9):2146-2148.
王述彬,袁希汉,邹学校,马艳青,李海涛,印东生.2001.中国辣椒优异种质资源评价.江苏农业学报,17(4):244-247.
吴跃勇,崔德祥.2007.贵州地方辣椒种质资源抗病性评价.种子,26(10):58-59.
姚明华,焦春海,王飞,李宁.2012.非洲辣椒种质资源鉴定与评价.辣椒杂志,(3):16-19.
邹学校,戴雄泽,马艳青,张竹青,刘荣云,陈文超,李雪峰,周群初.2004.湖南辣椒地方品种资源与湘研辣椒品种选育的灰色关联分析.植物遗传资源学报,(3):233-238.
Cheng N H,Su C L,Carter S A,Nelson R S.2000.Vascular invasion routes and systemic accumulation patterns of Tobacco mosaic virus in Nicotiana benthamiana.The Plant Journal,23:349-362.
Kim H J,Han J H,Yoo J H,Cho H J,Kim B D.2008.Development of a sequence characteristic amplified region marker linked to the L4 locus conferring broad spectrum resistance to tobamoviruses in pepper plants.Molecules and Cells,25:205-210.
Lefebvre V,Palloix A,Caranta C,Pochard E.1995.Construction of an intraspecific integrated linkage map of pepper using molecularmarkers and doubled-haploid progenies.Genome,38:112-121.
Özkaynak E,Devran Z,Kahveci E,Doğanlar S,Başköyl ü B,Doğan F,İşleyen M,Y ü ksel A,Y ü ksel M.2014.Pyramiding multiple genes for resistance to PVY,TSWV and PMMoV in pepper using molecular markers.European Journal of Horticultural Science,79:233-239.
Sugita T,Yamaguchi K,Sugimura Y,Nagata R,Yuji K,Kinoshita T,Todoroki A.2004.Development of SCAR markers linked to L3gene in Capsicum.Breeding Science,54:111-115.
Sun Y D,Liang Y,Wu J M,Li Y Z,Cui X,Qin L.2012.Dynamic QTL analysis for fruit lycopene content and total soluble solid content in a Solanum lycopersicum × S.pimpinellifolium cross.Genitics and Moleculor Research,11:3696-3710.
Tomita R,Murai J,Miura Y,Ishihara H,Liu S,Kubotera Y,Honda A,Hatta R,Kuroda T,Hamada H.2008.Fine mapping and DNA fiber FISH analysis locates the tobamovirus resistance gene L3of Capsicum chinense in a 400-kb region of R-like genes cluster embedded in highly repetitive sequences.Theoretical and Applied Genetics,117:1107-1118.
Tomita R,Sekine K T,Mizumoto H,Sakamoto M,Murai J,Kiba A,Hikichi Y,Suzuki K,Kobayashi K.2011.Genetic basis for the hierarchical interaction between Tobamovirus spp.and L resistance gene alleles from different pepper species.Molecular Plant-microbe Interactions,24:108-117.
Yang H B,Liu W Y,Kang W H,Jahn M,Kang B C.2009.Development of SNP markers linked to the L locus in Capsicum spp.by a comparative genetic analysis.Molecular Breeding,24:433-446.
Abstract:Fifty-one pepper(Capsicum annuum L.)local varieties were selected as experimental material for identifying their resistance to TMV in fields. The result showed that 14 collections were resistant to TMV and the disease index of each collection was 17.04-75.56. The resistance distribution of various varieties was normal with a little deviation from the disease infectious area. Resistance identification in TMV seedling stage by artificial inoculation was carried out on these 14 disease resistant material and 7 susceptible material. The disease indexes of 21 varieties were 6.28-65.48,and 15 of them were disease resistant. The results of correlation analysis indicated that the correlation coefficient between TMV field plant natural disease occurrance index and artificial inoculation identification disease index was r=0.789,a significant positive correlation. Twelve molecular markers from TMV resistant gene L were used to identify the 13 selected pepper germplasm resources. Six resistant molecular markers were detected from 6 TMV resistant germplasm resources. The major agronomic traits of TMV resistant pepper germplasm resources showed certain diversity.
Key words:Pepper;Germplasm resources;TMV resistance;Identification
Identif i cation and Evaluation of Resistance to TMV in Pepper(Capsicum annuum L.)Germplasm Resources
QIN Lei,LIANG Yan*,MO Ning,ZHANG Yang,ZHAO Gui-ye
(College of Horticulture,Northwest A&F University,Yangling 712100,Shaanxi,China)
*通讯作者(Corresponding author):梁燕,教授,博士生导师,主要从事番茄遗传育种及蔬菜种质资源研究,E-mail:liangyan@nwsuaf.edu.cn
2017-03-13;接受日期:2017-08-14
“十二五”国家科技支撑计划项目(2013BAD01B04-14)
