川产葛根、粉葛总黄酮和多糖含量的对比分析
2017-10-19黄再强张燕飞陈玲王馨瑶谢云彤马逾英
黄再强,张燕飞,陈玲,王馨瑶,谢云彤,马逾英
川产葛根、粉葛总黄酮和多糖含量的对比分析
黄再强,张燕飞,陈玲,王馨瑶,谢云彤,马逾英
目的:对四川不同产地、来源的葛根、粉葛药材进行总黄酮和多糖含量测定,并对比分析其异同。方法:采用紫外分光光度法(UV),葛根素作对照,250 nm 波长测定总黄酮含量;葡萄糖作对照,490 nm波长测定多糖含量;采用聚类分析方法进行数据分析。结果:不同产地、来源的葛根、粉葛药材中总黄酮和多糖含量存在差异。粉葛以1、2、8、9、13、16样品含量较高,分别产自广元、简阳、江油、射洪、资阳,峨眉葛人工栽培品种总黄酮和多糖含量与粉葛相近;葛根以32~37样品含量较高,分别产自平武、青川、北川,葛根多糖含量无明显差异。聚类分析结果与数据分析结果相符。结论:四川不同产地、来源的葛根、粉葛药材总黄酮和多糖含量存在差异。该研究为川产葛根类药材质量评价及栽培选址提供了参考依据。
葛根;粉葛;总黄酮;多糖;紫外分光光度法
2015年版《中国药典》收载葛根为豆科植物野葛Pueraria lobata(Willd.)Ohwi的干燥根,粉葛为同属植物甘葛藤Pueraria thomsoniiBenth. 的干燥根[1]。据文献报道[2],同属其他植物在部分区域也作中药葛根或粉葛使用。川产葛根类药材资源丰富,除上述药典收载品种外,尚有以野生或栽培的峨眉葛(Pueraria.omeiensisWang et Tang)做粉葛使用,并有商品药材。
目前葛根、粉葛的成分含量、药理作用及质量研究主要集中在野葛和甘葛藤[3~6],尚见将同属其他在部分区域也作中药葛根或粉葛使用的品种进行比较研究。现行版药典中仅以葛根素含量为指标控制葛根、粉葛药材的质量,单一成分含量并不能完全反应药材质量的优劣及临床疗效。总黄酮和多糖是葛根、粉葛中主要的两大类成分,具有较好的药理作用,且含量较高,其在药材质量方面的影响不可忽略,且目前尚见相关研究。故实验采用紫外分光光度法,通过测定四川不同产地、不同来源的葛根和粉葛药材中总黄酮及多糖含量,并进行对比分析,为川产葛根类药材质量评价及栽培选址提供参考依据。
1 材料与仪器
1.1 材料
葛根素对照品(纯度99.71%,中国科学院成都生物研究所,批号: MUST-16011207),无水葡萄糖对照品(纯度99.78%,中国药品生物制品检定所,批号: MUST-12122601),实验涉及试剂苯酚、硫酸等试剂均为分析纯;实验样品共71批(见表1),其中自采产地对口药材44批,均于2015年10 ~12月采自四川各产地,商品药材27批,均于2016年3月购于成都荷花池药材市场。经成都中医药大学药学院卢先明、马逾英教授鉴定品种,1~18、45~ 48、50、51、53~61号来源于甘葛藤Pueraria.lobata var.thomsoniiBenth;18~31、49、52号来源于峨眉葛Pueraria.omeiensisWang et Tang(作粉葛使用);31~44、62~71来源于野葛Pueraria.lobata(Willd)Ohwi。
1.2 仪器
A580型外可见分光光度计(翱艺仪器有限公司),电子天平(赛多利斯科学仪器有限公司),SB-3200DTD型超声仪(宁波新艺超声设备有限公司),HWS-26型电恒温水浴锅(上海一恒科技有限公司),SHB-III型循环水式多用真空泵 (郑州长城科工贸有限公司),101-2型电热鼓风干燥箱(北京中星伟业仪器有限公司),RE-5203型旋转蒸发仪(上海亚荣生化仪器厂)。
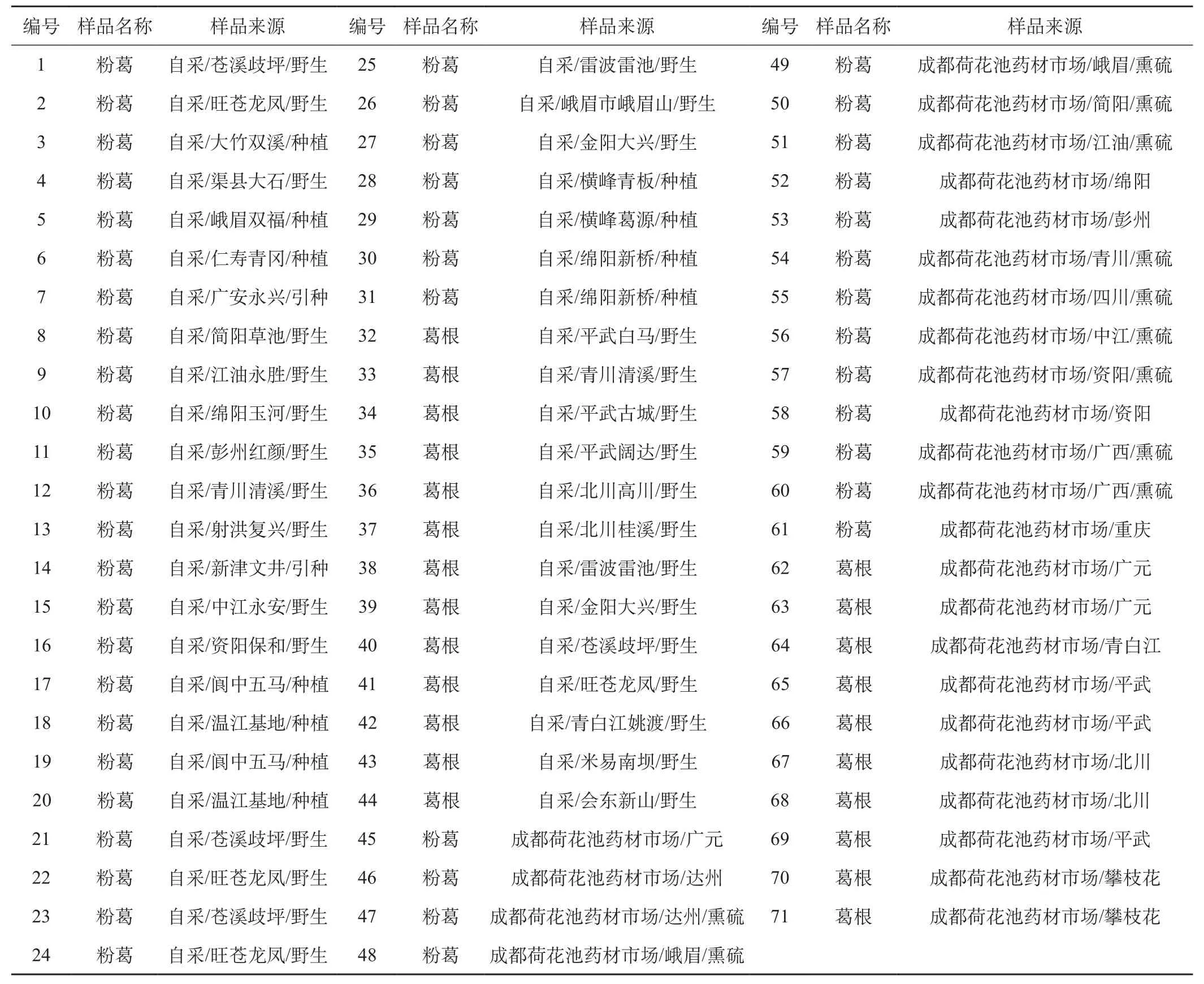
表1 药材样品信息表
2 方法与结果
2.1 标准溶液的配制
精密称取葛根素对照品适量,用50 % 乙醇制成60.40 μg.mL-1的溶液,备用。
精密称取葡萄糖标准品适量,用蒸馏水制成0.5080 mg.mL-1,低温保存,备用。
2.2 葛根素标准曲线的制作
精密移取标准品溶液适量置于10 mL容量瓶中,用50 % 乙醇稀释至刻度,波长250 nm 测定吸光度。曲线回归方程为:A=0.06073 C+0.24791,R2=0.9999,表明葛根素在1.208 ~ 14.49 μg.mL-1线性良好。
2.3 葡萄糖标准曲线的制作
采用硫酸-苯酚法,取葡萄糖标准溶液适量置于试管中,用水补足至2 mL,空白组加水2 mL,加5%苯酚2 mL,迅速加入98% 浓硫酸5 mL,放置5 min,置沸水中加热15 min,波长490 nm 处测吸光度。曲线回归方程为:A=6.143 C+0.1481,R2=0.9998,葡萄糖标准溶液在0.02541 ~ 0.2540 mg.mL-1线性良好。
2.4 供试品溶液的制备
2.4.1总黄酮供试品溶液制备 称取样品适量0.5 g,加50% 乙醇100 mL,称重,50℃超声提取30 min,冷却,补足重量,过滤即得。精密移取粉葛黄酮提取滤液400 μl,用容量瓶稀释至10 mL;精密移取葛根黄酮提取滤液100 μl,稀释至25 mL,备用。
2.4.2 多糖供试品溶液制备 采用水提醇沉法,称取样品2 g,按料液比1:40,80℃超声提取两次,每次0.5 h。冷却,离心,浓缩,加95 % 乙醇适量,静置过夜,真空抽滤,烘干,即得多糖提取样品。将提取得到的多糖样品加热水溶解,过滤,用容量瓶定溶稀释至50 mL,备用。
2.5 方法学考察
试验进行了精密度、稳定性、重复性考察,RSD(n=7)值均小于0.5%,此仪器精密度较好,符合要求;葛根素和葡萄糖溶液在30h内,稳定性良好;该方法重复性良好。本试验还进行了加样回收率考察,总黄酮的加样平均回收率为99.12 %;多糖的加样平均回收率为99.61% ,RSD(n=7)值均小于0.35%,说明此方法回收率良好,方法可行。
2.6 含量测定
按2.4项下样品处理方法进行,平行3份,取平均值。结果见表3,粉葛总黄酮含量为0.14% ~ 0.62%,多糖含量为30.14% ~ 60.74%,以1、2、8、9、13、16样品含量较高,分别产自广元、简阳、江油、射洪、资阳;峨眉葛总黄酮含量为0.29% ~ 2.54% ,多糖含量18.42% ~ 50.18% ,峨眉葛人工栽培品种总黄酮和多糖含量与粉葛相近;葛根总黄酮含量为3.36%~ 9.54% ,多糖含量为11.03% ~ 22.10% ,以32 ~ 37样品含量较高,分别产自平武、青川、北川。葛根总黄酮含量比粉葛高,相差近40倍,粉葛多糖含量高于葛根,相差可达6倍。粉葛商品药材,总黄酮含量为0.12% ~ 0.65% ,多糖含量为27.10% ~ 65.94%;葛根商品药材总黄酮含量为3.28% ~ 9.21% ,多糖含量为11.21% ~ 20.89% 。商品药材与产地对口药材总黄酮和多糖含量情况相符。

表2 样品总黄酮和多糖含量(n=3)
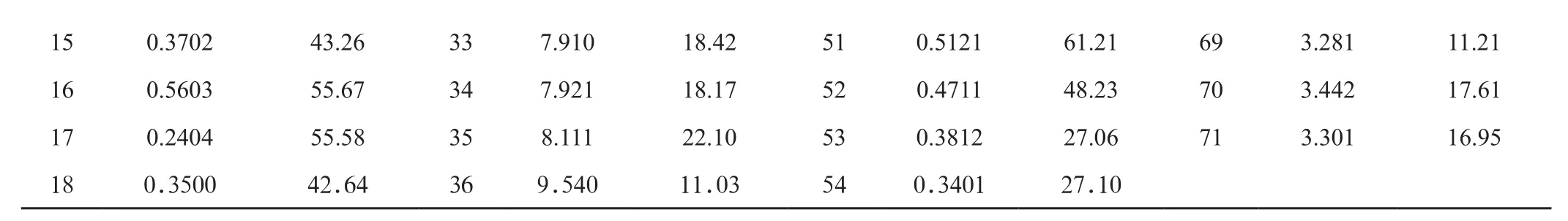
150.370243.26337.91018.42510.512161.21693.28111.21 160.560355.67347.92118.17520.471148.23703.44217.61 170.240455.58358.11122.10530.381227.06713.30116.95 180.350042.64369.54011.03540.340127.10
2.7 聚类分析
以总黄酮含量和多糖含量,通过SPSS 22 软件进行聚类分析,采用组间平均连接聚类,平方Euclidean 距离作为样品聚类公式,聚类结果见图1、图2。聚类结果将不同来源粉葛样品分为三类,总黄酮和多糖含量顺序为II > I > III。野生峨眉葛分布在I和III类中,人工栽培峨眉葛分布在I类中,人工栽培峨眉葛与粉葛没有明显的单独聚分类,表明两个品种总黄酮和多糖含量相近。聚类结果将个产地对口的葛根药材分为四类,总黄酮和多糖含量顺序为II >I > IV > III。聚类将粉葛商品药材分为三类,总黄酮和多糖含量顺序为II > I > III,熏硫粉葛在III类占比例较大;聚类将葛根商品药材分为两类,总黄酮和多糖含量顺序为I > II ,与数据分析结果相符。

图1 产地对口药材聚类分析结果

图2 商品药材聚类结果
4 讨论
葛根、粉葛药材中总黄酮和多糖的含量情况存在差异,葛根中总黄酮含量高于粉葛约40倍,而粉葛中多糖含量高于葛根约6倍,研究总黄酮和多糖的含量情况可一定程度上反映药材的质量情况。黄酮和多糖都是葛根、粉葛的主要成分,具有较好的药理作用,在研究葛根、粉葛的质量情况时,不可将其忽略。
紫外分光光度法在总黄酮和多糖含量测定领域已得到广泛应用,具有简便快速,灵敏度高,专属性强等特点。紫外的吸光度受溶液浓度、杂质和石英杯等因素影响,应注意样品前处理和石英杯的配对等方面的研究。聚类分析可以有效地帮助我们分析数据的分布、了解数据的特征、确定数据类,可以从中寻找隐藏在数据中的有用信息,直观简明的显示结果,有利于数据的分析和研究,具有较好的应用前景。
[1] 国家药典委员会.中国药典[S].北京:中国医药科技出版社,2015.
[2] 楼之岑.常用中药材品种整理和质量研究[M].北京:北京大学医学出版社,2003:380.
[3] 王颖莉,李亚妮,孙伟卫,等.基于FTIR和HPLC的葛根化学成分整体介析与评价[J].世界科学技术-中医药现代化★中药研究,2014,16(2):279.
[4] 李生茂,刘琳,谭睿,等.葛根和粉葛高效液相色谱指纹图谱及化学模式识别[J].辽宁中医,2016,43(5):1035.
[5] 楚纪明,马树运,李海峰,等.葛根有效成分及其药理作用研究进展[J].食品与药品,2015,17(2):142.
[6] 尤春雪,张振秋,李峰,等.HPLC波长切换技术对葛根中8种成分的测定及指纹图谱研究[J].2013,44(5):616.
(责任编辑:胡慧玲)
Comparative study of the content of total fl avonoids and polysaccharides in pueraria lobata and pueraria thomsonii from Sichuan
/HUANG Zai-qiang, ZHANG Yan-fei, CHEN Lin, WANG Xin-yao, XIE Yun-tong, MA Yu-ying// (School of Pharmacy,Chengdu University of Traditional Chinese Medicine; Key Laboratory of Standardization for Chinese Herbal Medicine, Ministry of Education; National Key Laboratory Breeding Base of Systematic Research, Development and Utilization of Chinese Medicine Resources, Chengdu 611137, Sichuan)
Objective:To investigate the total flavonoids and polysaccharides content in Pueraria lobata and Pueraria thomsonii sources medicinal from different producing area of Sichuan.Method:The determinations of flavonoids and polysaccharide were performed by UV at wavelength of 250 and 490 nm using puerarin and glucose as control, and data was analyzed by clustering analysis method.Result:Different origins, and different sources of Pueraria lobata and Pueraria thomsonii from Sichuan had difference total fl avonoids and polysaccharides contents. Pueraria thomsonii sample 1, 2, 8, 9, 13, 16 had higher component content which were collected from Guangyuan, Jianyang, Jiangyou, Shehong, Ziyang and Emei. The result showed that the content of fl avonoids and polysaccharide in cultivated Pueraria lobata was close to Pueraria thomsonii.The fl avonoids in Pueraria lobata sample 32~37 had higher component content which were collected from PingWu, Qingchuan and BeiChuan, but the polysaccharide content was almost the same. The results of cluster analysis were in conformity with the data analysis results.Conclusion:The different Pueraria lobata and Pueraria thomsonii sources of Sichuan have different contents of fl avonoids and polysaccharide, which provides the scienti fi c basis for choosing location for cultivation and the quality research of Pueraria lobata and Pueraria thomsonii from Sichuan.
Pueraria lobata; Pueraria thomsonii; total fl avonoids; polysaccharides; UV
R 282
A
1674-926X(2017)03-004-04
四川省科技计划项目(编号:2014SZ0131)
成都中医药大学药学院 中药材标准化教育部重点实验室 四川省中药资源系统研究与开发利用重点实验室省部共建国家重点实验室培育基地,四川 成都 611137
黄再强,在读硕士,从事中药品种、质量与资源开发研究
Tel:18380186079 Email:1164375439@qq.com
马逾英,教授,本科,从事中药品种、质量与资源开发研究 Email:ma-yuying@126.com
2016-12-20
