泉州地区急性呼吸道感染儿童肺炎支原体抗体结果分析
2017-10-18肖辉建王秋菊凌月明
肖辉建,王秋菊,吴 双,凌月明
·论 著·
泉州地区急性呼吸道感染儿童肺炎支原体抗体结果分析
肖辉建,王秋菊,吴 双,凌月明
目的对福建泉州地区14岁以下儿童进行肺炎支原体的检测,探讨其在本地区的流行情况及规律。方法回顾性分析2015年1-12月于本地区因急性呼吸道感染就诊的门诊及住院的14岁以下儿童血清标本1665份,采用间接免疫荧光法进行检测。结果①检出肺炎支原体阳性222份,阳性率为13.3%,男童与女童阳性率分别为13.9%、12.6%,差异无统计学意义(P>0.05)。②四季阳性率分别为16.0%、9.7%、15.1%、11.7%,夏季与春季、秋季阳性率比较差异有统计学意义(P<0.05)。③不同年龄段儿童对肺炎支原体的易感性不同,按<1岁(婴幼儿期)、1~2岁(幼儿期)、3~5岁(学龄前期)、6~14岁(学龄期)的阳性率分别为6.5%、10.7%、15.3%、20.8%,差异有统计学意义(P<0.05)。结论肺炎支原体在泉州地区全年散发,男女童无差异,有明显的季节性,发病高峰期为春秋季节,夏季最低,<1岁阶段阳性率最低,6~14岁学龄期儿童为高发人群,为本地区儿童急性呼吸道感染的防治提供了数据资料。
儿童;呼吸道感染;肺炎支原体;间接免疫荧光法
肺炎支原体是引起学龄期儿童急性呼吸道感染的主要病原体之一[1-2],可引起非典型性肺炎和常见的上呼吸道感染,可通过气溶胶引起,人类是该病原体的唯一宿主。急性感染常见于6~15岁的儿童中。人与人之间密切的接触可加速支原体的传播,感染后10~20 d的潜伏期后,可出现持续性的咳嗽、发热、和头痛等症状。另外,在一些病例中还可出现咽喉炎和中度的耳部疾病,但在大部分的感染无任何症状,也可发生再次感染。感染肺炎支原体后1周可出现IgM和IgA型抗体,数周后可出现IgG抗体滴度升高,并持续数月。抗肺炎支原体抗体可与其他支原体属发生交叉反应。在鉴别诊断时,须排除肺炎支原体感染、病毒性肺炎、鹦鹉热和Q热。抗肺炎支原体特异性的IgM抗体最早可发生在发病1周左右出现,可持续存在3~6个月。泉州位于我国东南沿海地区,有其特有的呼吸道肺炎支原体感染的流行病学情况,本文对泉州地区2015年所检测的肺炎支原体IgM抗体结果进行总结分析,现报道如下。
1 资料与方法
1.1一般资料 选取2015年1-12月本地区门急诊就诊或住院患儿,就诊医院都为三级甲等医院,病源覆盖泉州市各县区,年龄最小1个月,最大14岁,咳嗽≥1周,伴或不伴发热,临床符合急性上呼吸道感染、急性扁桃体炎、咽炎、支气管炎、肺炎等非慢性呼吸道疾病的诊断[3],予采血查肺炎支原体IgM者1665例,其中男童913例,女童752例。已剔除年度内6个月内阳性患儿第二就诊检查。
1.2方法 患儿均抽取空腹静脉血。全血留取3.5 mL,在37 ℃恒温箱内放置10 min促凝,3500 r/min离心8 min,分离血清,置4 ℃冰箱冷藏待检,采用间接免疫荧光法行肺炎支原体-IgM检测,严格按照本实验室标准操作规范进行操作,在奥林巴斯荧光显微镜下判读,出现典型荧光模型为阳性。试剂盒由欧蒙医学实验诊断股份公司提供,均在有效期内使用。
1.3统计学分析 应用SPSS17.0软件,对于不同性别、季节、年龄阶段的儿童肺炎支原体阳性率的比较分析采用χ2检验,采用SPSS软件中的线性对线性关联进行不同年龄段阳性率的趋势检验,P<0.05为差异有统计学意义。
2 结 果
2.1肺炎支原体阳性情况 检出肺炎支原体感染病例222例,总阳性率为13.3%;肺炎支原体男童阳性数127(13.9%),女童阳性数95(12.6%),男女童阳性率比较差异无统计学意义(P>0.05)。
2.2肺炎支原体在不同季节的分布情况 春季与秋季、冬季阳性率比较差异均无统计学意义(P均>0.05),夏季与春季、秋季阳性率比较差异有统计学意义(P均<0.05),冬季与夏季、秋季的阳性率比较差异无统计学意义(P均>0.05);春季阳性率最高,秋季阳性率次之,夏季阳性率最低。见表1。
表1不同季节急性呼吸道感染儿童肺炎支原体阳性情况

季节检测数(n)阳性数(n)阳性率(%)春季(3-5月)52484160∗夏季(6-8月)3803797秋季(9-11月)35153151∗冬季(12-2月)41048117∗合计1665222133与夏季比较,∗P<005
2.3肺炎支原体病原检出年龄分布情况 各年龄段按<1岁为婴幼儿期,1~2岁为幼儿期,3~5岁为学龄前期,6~14岁为学龄期。<1岁与其他各年龄段阳性率比较差异均有统计学意义(P<0.05),1~2岁与3~5岁、6~14岁的阳性率比较差异均有统计学意义(P<0.05),3~5岁与6~14岁的阳性率比较差异有统计学意义(P<0.05);其中6~14岁阳性率最高,占20.8%,<1岁阳性率最低,占6.5%,且儿童各年龄段的阳性率有线性关系(P<0.05),随着年龄的增大肺炎支原体阳性率逐渐增高。见表2。
表2各年龄段急性呼吸道感染儿童肺炎支原体阳性情况
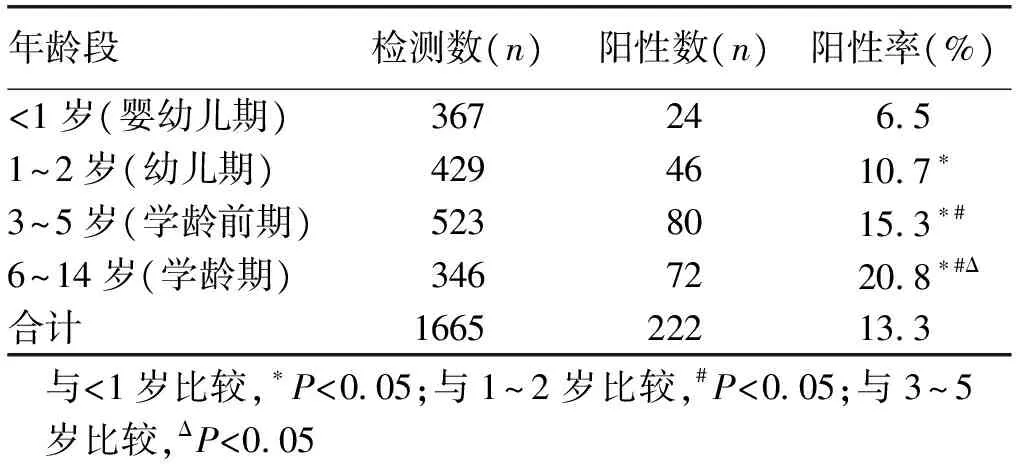
年龄段检测数(n)阳性数(n)阳性率(%)<1岁(婴幼儿期)36724651~2岁(幼儿期)42946107∗3~5岁(学龄前期)52380153∗#6~14岁(学龄期)34672208∗#Δ合计1665222133与<1岁比较,∗P<005;与1~2岁比较,#P<005;与3~5岁比较,ΔP<005
3 讨 论
肺炎支原体是一种介于细菌与病毒之间无细胞壁的病原体[4],无细胞壁、能独立生存并能进行自我复制的原核微生物,形态呈丝杆状、球形等,革兰染色呈阴性。对热的抵抗力一般与细菌相似,耐冷,对干燥敏感,主要以气溶胶的形式通过飞沫传播,全年均可发病,呈散发,间断性小流行,是引起儿童呼吸道感染的重要病原体之一[5]。由肺炎支原体引起的急性呼吸道感染,多有发热、头痛、咽痛及剧烈咳嗽(常为干性呛咳)等症状,同时还常伴有广泛多器官、多系统的肺外并发症,并且与支气管哮喘的发作关系密切[6-7]。近年来泉州地区儿童在急性呼吸道感染的阳性率逐年升高,已引起临床的重视。世界各地报道[8-10]感染率差异颇大(9.6%~66.7%),提示肺炎支原体阳性率存在地区差异或实验方法敏感性不同等[11]。不同地域的气候,包括气温、湿度等均可影响[12],泉州地区属于亚热带季风气候,温暖多雨,夏长冬短,在秋季较热,冬季较为干燥,具有本地区特有的气候条件,儿童感染肺炎支原体也有其特点。
本组结果分析显示,泉州地区儿童在急性呼吸道感染肺炎支原体的阳性率为13.3%,提示肺炎支原体在儿童急性呼吸道感染患者中占有重要地位;感染特点为全年均有儿童感染,男童与女童阳性率无明显统计学差异。大部分研究显示男童与女童在肺炎支原体感染上无差异[13],刘海平等[14]研究结果也是男女阳性率稍有差别,可能与选择病例时纳入性别不均有关。在不同季度间比较差异有统计学意义,具有明显的季节性,春季和秋季较高,夏季最低,原因可能是春秋季节为学生在校时间[15],在不同年龄分布中,感染好发于5~14岁儿童,考虑因>3岁的儿童日常的生活、活动的大部分时间是在托儿机构或学校等人群集聚的集体场所中,相互间长时间密切接触,增加了支原体感染的机会[16],也与处在密闭环境中有关[13];0~1岁的婴幼儿阳性率最低,该年龄段幼儿对肺炎支原体的免疫反应是低滴度应答[17-18],对从未接触的抗原尚未建立免疫记忆[19],感染症状不典型,易被漏诊,所以在整个儿童时期随着年龄的增大肺炎支原体阳性率逐渐增高。
早期明确病原,并予及时有效的治疗尤为重要[20]。肺炎支原体的分离培养阳性率不高,优势需20 d以上的时间,对临床快速诊断意义不大;凝集试验采用凝集素中含有IgG型抗体,不利于阳性结果的判断,直接荧光法在标本留取上不能标准化,常导致结果阴性。本试验结果采用间接免疫荧光法,已被广泛使用,有快速、高特异性、高敏感性的特点,基本保证了本结果分析的可靠性。国内已有医院将实时PCR技术应用于肺炎支原体检测,是目前公认最准确的方法。曾志奇等[21]应用此技术在痰液中检测广州地区的肺炎支原体,感染率准确,为流行病学分析提供了可靠的结果。但此技术成本较高、痰液采集错误等问题需要处理,未来可与间接免疫荧光法联合检测以降低漏诊及误诊率。
由于肺炎支原体自身的结构特点和儿童处于生长发育时期的特殊性,大环内酯类抗生素是治疗肺炎支原体感染的首选药物,但其耐药的细菌有增加趋势[22]。常为临床医师在没有明确病原时,仅根据症状使用抗生素所致。本结果分析为福建泉州地区儿童急性呼吸道感染的防治提供了数据资料,有助于合理使用抗生素和控制耐药性,对指导临床诊治也有重要价值。不足之处是在各季度的比较中,缺少与往年的纵向比较。Rastawicki等[24]分析表明28年间有6个流行高峰,下一步将进行基于泉州地区往年儿童阳性率的评估以进一步分析本地区儿童肺炎支原体感染的特点及流行规律。
[1] 张 泓,叶信予,徐晓刚,等.儿童呼吸道分离肺炎支原体药物敏感性分析[J].中国感染与化疗杂志,2015,15(1):63.
[2] 倪语星,尚 红.临床微生物学与检验[M].4版.北京:人民卫生出版社,2008:304.
[3] 胡哑荚,江载芳.渚福棠实用儿科学[M].7版.北京:人民卫生出版社,2005:1167-1216.
[4] 王佳境,牛慧彦,白 雪,等.3种肺炎支原体感染检测方法的临床效果比较[J].新乡医学院学报,2011,28(1):5l-53.
[5] 张新星,季 伟 顾文婧,等.2005年至2014年苏州地区儿童呼吸道肺炎支原体感染流行病学分析[J].中华传染病杂志,2015,33(10):594-597.
[6] 田红义.肺炎衣原体和肺炎支原体感染与儿童哮喘的关系[J].吉林医学,201l,32(20):4163.
[7] 陆月明,秦玉波,丁小丽.支原体肺炎临床特征的研究[J].东南国防医药,2009,11(4):308-309.
[8] Gaillat J,Flahault A,de Barbreyrac B,etal.Community epidemiology of Chlamydia pneumoniae in LRTI in France over 29 months[J]. Eur J Epidemiol,2005,20(7):643-651.
[9] Macfarlance J,Holmes W,Gard P,etal.Prospective study of the incidence,aetiology and outcome of adult lower respiratory tract illness in the community[J]. Thorax,2001,56(2):109-114.
[10] Nagalingam NA,Adesiyon AA,Swanaton WH,etal.Prevalence of Mycoplasma pneumoniae and Chlamydia pneumoniae in pneumonia patients in four major hospitals in Trinidad[J]. New Microbial,2004,27(4):345-351.
[11] 韩玉芳,魏 琴,冯艳广,等.新乡市小儿肺炎支原体、肺炎衣原体感染情况[J].实用儿科临床杂志,2012,27(10):784-785.
[12] 廖嘉仪,张 涛.急性呼吸道感染患儿肺炎支原体、肺炎衣原体、嗜肺军团菌检测结果分析[J].中华实用儿科临床杂志,2013,28(22):1719-1722.
[13] 陆 权,陆 敏.肺炎支原体感染的流行病学[J]. 实用儿科临床杂志,2007,22(4):241-243.
[14] 刘海平,陈国华.顺德区伦教街道健康儿童血清肺炎支原体抗体水平分析[J].广东医学,2016,35(16):2601-2602.
[15] 崔京涛,吴叶丽,李 倩,等.肺炎支原体感染者血清流行病学分析及其抗菌药物疗效评价[J].中华检验医学杂志,2011,34(9):820-823.
[16] 方爱姿,钟亮尹,曾淑珍,等.肺炎支原体抗体检测结果及流行病学分析[J].实用医学杂志,2012,28(15):2611-2612.
[17] 董宗祈.肺炎支原体感染的致病机制与治疗的关系[J].实用儿科临床杂志,2007,22:243-245.
[18] 宋应健,王立新,洪永青,等.淮安地区成人社区获得性肺炎感染病原体分析[J].医学研究生学报,2010,23(12):1279-1281.
[19] 张宪伟,孙 杭,穆 原.不同年龄儿童感染肺炎支原体体液免疫的变化分析[J].东南大学学报,2016,35(3):384-388.
[20] 肖 妍.米本勇.小儿咳嗽变异性哮喘肺炎支原体、肺炎衣原体感染及冶疗脱察[J].实用医院临床杂志,2010,7(3):77-78.
[21] 曾志奇,刘文宽,陈德晖,等.广州地区儿童呼吸道合胞病毒与肺炎支原体流行病学分析[J].中华实用儿科临床杂志,2015,30(22):1701-1704.
[22] 李舟文,肖光文,张国雄,等.梅州地区2010-2014年儿童肺炎支原体感染及耐药情况分析[J].中国人兽共患病学报,2016,32(3):306-311.
[23] Rastawiciki W,Kaluzewski S,Jagielski M,etal. Epidemiology of Mycoplasma pneumoniae in Poland:28 years of surveillance in Warsaw 1970-1997[J]. Eur Surveill,1998,3(10):99-100.
AnalysisofMycoplasmapneumoniaeantibodyinchildrenwithacuterespiratorytractinfectioninQuanzhouarea
XIAO Hui-jian,WANG Qiu-ju,WU Shuang,LING Yue-ming
(DepartmentofClinicalLaboratory,The180thHospitalofPLA,Quanzhou362000,Fujian,China)
AbstractObjectiveDetection of Mycoplasma pneumoniae in children under 14 years old in Quanzhou area of Fujian province was carried out to investigate the prevalence and regularity of Mycoplasma pneumoniae in this area.MethodsA retrospective analysis of serum samples of 1665 children with acute respiratory infections under 14 years old in this area of outpatient and hospitalization from January 2015 to December 2015 was performed by indirect immunofluorescence method.Results①222 were positive for Mycoplasma pneumonia, with13.3% of the positive rate, and the positive rates of boys and girls were 13.9% and 12.6%, respectively. There was no significant difference between the two groups (P>0.05). ②The positive rates of the four seasons were 16.0%, 9.7%, 15.1%, 11.7% respectively. There was significant difference between summer and spring and autumn (P<0.05). ③Children of different age groups had different susceptibility to Mycoplasma pneumoniae. According to < 1 year old (babies), 1-2 years old (early childhood), 3-5 years old (preschool), 6-14 years old (school-age), the positive rate were 6.5%, 10.7%, 15.3%, 20.8% respectively, and the difference was statistically significant (P<0.05).ConclusionMycoplasma pneumoniae distributes throughout the year in Quanzhou area, without statistical difference between boys and girls; There is a clear seasonality, the peak incidence for the spring and autumn season, the lowest for summer. The lowest positive rate was from <1 years old, and 6-14 years old school-age children were high risk population. It provides data for the prevention and treatment of acute respiratory tract infections in children in this area.
Children; Respiratory tract infection; Mycoplasma pneumonia; Indirect immunofluorescence method
R725.6
A
1672-271X(2017)05-0481-03
10.3969/j.issn.1672-271X.2017.05.008
2017-03-25;
2017-07-03)
(本文编辑:叶华珍; 英文编辑:王建东)
362000 泉州,解放军第180医院检验科
肖辉建,王秋菊,吴 双,等.泉州地区急性呼吸道感染儿童肺炎支原体抗体结果分析[J].东南国防医药,2017,19(5):481-483.
