马铃薯干腐病镰刀菌的分离及生物学特性研究
2017-10-18刘丽萍方鹏鹏
刘丽萍,方鹏鹏
(陇东学院 生命科学与技术学院,甘肃 庆阳 745000)
马铃薯干腐病镰刀菌的分离及生物学特性研究
刘丽萍,方鹏鹏
(陇东学院 生命科学与技术学院,甘肃 庆阳 745000)
为确定华池县马铃薯干腐病的病原菌,采集有干腐病症状的马铃薯块茎为试验材料,采用组织块法和孢子稀释法分离纯化病原菌,参照镰刀菌分类系统进行形态学鉴定;并采用单因素法考察了氮源、温度、碳源和pH值对病原菌生长的影响。结果表明:从采样区分离纯化出35株镰刀菌,鉴定为F.acuminatum和F.sambicinum,优势菌是F.acuminatum,分离频率为62.9%,按照科赫氏法对其进行致病性测定,证实了两种镰刀菌对马铃薯块茎的致病性。优势菌F.acuminatum的最佳生长条件为最适温度为28℃,最佳氮源是玉米粉,最适pH值为9,最佳碳源是蔗糖。
马铃薯干腐病;致病力测定;生物学特性;分离纯化;F.acuminatum
Abstract: In order to clarify pathogenic bacteria of potato dry rot and growth characteristic,potato tuber of dry rot in Huachi County were used as the experimental material.The pathogen was isolated and purified by tissue block method and single separation,the relationships of growth rate and temperature,pH,carbon source and nitrogen source have been studied.The results shows that 35 pathogenic stains was isolated and purified,preliminary identification of the stains wasF.sambicinumandF.acuminatum,F.acuminatumwas dominant pathogen in Huachi County with a frequency of 62.9%.F.sambicinumandF.acuminatumwas pathogenic according to pathogenicity determination.The best temperature,pH,carbon source and nitrogen were 28℃,9,sucrose and corn flour.
Keywords: potato dry rot;pathogenicity determination;biological characteristic;isolation and purification;F.acuminatum
马铃薯是继水稻、小麦和玉米之后世界第四大粮食作物,我国是马铃薯种植面积最大的国家之一[1-4],但马铃薯储藏期病害严重,其中主要病害之一就是马铃薯干腐病[5];干腐病对种薯和商品薯的安全储藏威胁很大,其常年发病率最高可达60%[6]。终致薯块干腐僵缩,严重降低马铃薯的外在观感、内在品质及利用率[7,8]。携带致病菌的土壤或种薯生长期的马铃薯块茎通过昆虫、病菌及伤口侵入,在储藏期发展为干腐病[9]。据报道F.sambicinum、F.sulphureum、F.avenaceum、F.redolens、F.solani、F.moniliforme、F.oxysporum、F.equiseti等多种镰刀菌均可引起马铃薯干腐病[10-16]。为实现干腐病病害的准确诊断和科学防控,需要明确不同地区的干腐病致病菌种类。本试验以甘肃庆阳市华池县患有干腐病的马铃薯薯块为研究对象,分离纯化出干腐病的病原菌,并对优势病原菌的生长特性进行研究,从而为揭示当地马铃薯干腐病的病原菌种类及科学防治提供理论依据。
1 材料与方法
1.1试验材料
1.1.1 材料采集
于2014年3月,从庆阳市华池县悦乐镇、城壕乡、柔远镇、南梁乡四个采样点的贮藏窖中,用随机抽样法采集干腐病症状的薯块35~40个作为镰刀菌分离材料。
1.1.2 试验药品
葡萄糖,琼脂,尿素,木糖,硫酸链霉素,蛋白胨,麦芽糖,磷酸二氢钾,酵母粉,乳糖,蔗糖,盐酸,玉米粉,硫酸镁,淀粉,氯化铵,氢氧化钠等,所用试剂均为分析纯。
1.1.3 培养基
PDA培养基:用于培养干腐病镰刀菌,常规方法配制,用时需加1%链霉素。
WA培养基的配方:用于单孢分离镰刀菌,配制方法为100ml水中加入琼脂粉2g,用时需加1%链霉素。
SNA培养基:磷酸二氢钾1.0g,氯化钾0.5g,硝酸钾31.0g,葡萄糖0.2g,蔗糖0.2g,硫酸镁0.5g,琼脂粉20g,水1L,临用时加入1%链霉素;用于观察孢子和保存。
1.2试验方法
1.2.1 病原菌分离
每个样点分别选取有干腐病症状的马铃薯块茎各6个,置于流水中冲洗30min,将病薯放入无菌操作台内,用70%乙醇擦拭块茎表面消毒,用解剖刀以组织块分离的方法分离干腐病病斑[14],每个病薯选择1~2个病斑,每病斑分离出4块组织,病斑组织切成6mm×6mm左右的小块。再将病斑组织块放入3%~5%次氯酸钠中消毒,取出并用无菌水冲洗后,放入PDA培养基上,在25℃培养7d。待长出菌落,先用无菌水制成菌悬液,再用龙胆紫染液染色制片,然后置于油镜下观察。依据分离菌落和镜检特征,选取马铃薯干腐病镰刀菌,将其菌落接种到新鲜的PDA培养基上纯化培养。
1.2.2 孢子分离
釆用孢子稀释法。从培养好的镰刀菌菌落上挑取孢子放入无菌水中制成孢子悬浮液,吸取1ml镰刀菌孢子悬浮液放入WA平板上,然后将WA平板置于显微镜下镜检,在10×10倍镜下要求每视野1~3个孢子。再用解剖刀将含孢子液的培养基划成1cm2左右的小块,在10×10倍镜下检查时,每个视野1个孢子即可。最后用解剖刀将培养基小块切成1mm2大小,选择只有一个孢子的小块转移到PDA培养基上培养。
1.2.3 形态学鉴定与分离频率的计算
切取直径6mm的镰刀菌菌饼分别在25℃和30℃黑暗条件下培养3d后,测量菌落直径。依据镰刀菌在PDA培养基上的菌落特征,以及大型、小型分生孢子和厚垣孢子的有无及形态等进行鉴定。
统计纯化得到的镰刀菌菌株数、种类和总数,计算镰刀菌菌株总数中各种镰刀菌的所占比例,即为镰刀菌不同种类在该采样地的分离频率。
1.2.4 致病力测定
选择健康、大小均匀的马铃薯块茎流水冲洗干净,用70%乙醇对块茎表面消毒3min后自然干燥。将分离纯化得到的干腐病镰刀菌接种于PDA培养上培养48h,用打孔器从培养基菌落上打取直径为6mm的菌饼,用于接种健康马铃薯块茎。之后再用打孔器从马铃薯块茎中取出一块茎组织,将打取的菌饼放入块茎的穴窝中,盖上取出的块茎组织[17,18],以接种PDA培养基的薯块为空白对照。将接种后的马铃薯都放入25℃的恒温培养箱中黑暗培养20d,选择在干腐病症状明显的块茎中重新分离镰刀菌并进行鉴定。
1.2.5 单因子对病原菌生物学特性的影响
(1)温度对干腐病镰刀菌生长的影响。在PDA镰刀菌菌落边缘打取直径为6mm的菌饼,接种到新鲜培养基的中央,然后分别放入4℃、10℃、16℃、22℃、28℃、34℃和40℃的培养箱内培养3d,每个处理进行5次重复,测量不同培养温度下镰刀菌菌落直径并计算平均生长速率。
(2)碳源对干腐病镰刀菌生长的影响。培养基的其他成分保持不变,分别添加3g葡萄糖、木糖、蔗糖、乳糖、麦芽糖、淀粉为碳源配制供试培养基,在新鲜培养基中央接种直径6mm的菌饼,每个处理进行5次重复,放入25℃培养箱内培养3d,测量不同碳源上镰刀菌菌落直径并计算平均生长速率。
(3)氮源对干腐病镰刀菌生长的影响。在PDA培养基中分别添加3g尿素、蛋白胨、酵母粉、氯化铵、玉米粉为氮源配制供试培养基,对照组是PDA培养基。在新鲜培养基中央接种直径6mm的菌饼,每个处理进行5次重复,放入25℃培养箱内培养3d,测量不同氮源上镰刀菌菌落直径并计算平均生长速率。
(4)pH值对干腐病镰刀菌生长的影响。将培养基的pH值分别调整为6、7、8、9、10和11,对照组的PDA pH值自然。在新鲜培养基中央接种直径6mm的菌碟,每个处理进行5次重复,放入25℃培养箱内培养3d,测量不同pH值下镰刀菌的菌落直径并计算平均生长速率。
平均生长速率=(测定菌落平均直径-初始菌碟直径)/培养天数。
2 结果与分析
2.1干腐病病原菌的分离鉴定
2.1.1 马铃薯干腐病病害特征
患有干腐病的马铃薯块茎表面皱缩,病斑从受害部位向周边健康组织扩展,受害部位下陷、皱缩,形成腔穴,内部变成褐色,空心且长满白色、粉色、黄色的菌丝或孢子团块,造成块茎糜烂。严重时,整个马铃薯块茎糜烂皱缩,块茎干而硬,并变轻,不能食用,在湿润环境下则转变成软腐。
2.1.2 病原菌的分离鉴定
将采集的马铃薯块茎采用组织块分离法接种到PDA培养基上,放入25℃培养箱黑暗培养7d,在培养基上发现病斑组织周围长出白色致密的羊毛状菌丝,部分菌丝为淡玫红色。依据菌落特征和显微特征选取镰刀菌的菌落,经孢子稀释法纯化后获得共35株镰刀菌。根据镰刀菌形态学分类系统,对得到的35株镰刀菌株进行形态鉴定,发现这些镰刀菌株为F.sambicinum和F.acuminatum两种,其中13株为F.sambicinum,分离频率为37.1%;22株为F.acuminatum,分离频率为62.9%,优势种为F.acuminatum。
F.acuminatumPDA培养基上培养3d,随着培养时间的延长,镰刀菌菌落表面逐渐呈现淡玫瑰红色,菌落边缘为白色,中间为黄棕色,从反面培养基着色且为淡玫瑰红色,菌丝生长较快,产生大量卷毛状白色菌丝。显微镜下菌株的菌丝存在很多分枝,分叉出的菌丝呈尖细状,倒棍棒状;大型分生孢子镰刀形,几乎没有小型分生孢子。在25℃下平均生长速率为17.3mm/d,30℃下平均生长速率为18.7mm/d。
F.sambicinumPDA培养基上培养3d,菌丝卷毛状、稀疏,菌丝白色后变为淡黄色,菌落中间为棕黄色。基物表面和培养基背面颜色不改变,培养基上形成许多肉色孢子,孢子聚集使得菌落透光成放射状,复杂的孢子梗产生大量孢子。菌丝分叉少,但存在很多呈圆柱状分隔菌丝,产孢细胞单瓶梗,瓶状小梗为圆柱形、倒棍棒形。未观察到小分生孢子和厚坦孢子。在25℃下平均生长速率为17.8mm/d,30℃下平均生长速率为16.4mm/d。
2.1.3 致病力测定
为确定分离到的镰刀菌是否具有致病性,对F.acuminatum和F.sambicinum进行回接试验。试验设置3次重复,每次选取10个健康马铃薯块茎,以接种培养基为对照。接种两种病原菌观察马铃薯块茎表面的变化,在第4d开始产生明显症状,接种区域表皮局部略凹陷且颜色变暗、变褐或发黑,孔内出现少量白色菌丝。在第6d,块茎接种伤口处形成摺叠,可看见白色的绒状子实体。接种后第10d,病斑扩展,接种区域周围组织变褐发黑,出现坏死,接种凹窝内长有白色或者粉色的菌丝体。接种后20d,接种F.sambicinum的马铃薯表面坏死薯肉增多,在接种区域形成较大空腔,出现较多白色霉状物;接种F.acuminatum的马铃薯表面病斑在马铃薯表面扩展慢,形成了较小的空腔。
将接种两种病原菌的马铃薯切开如图1所示,发现接种F.acuminatum的马铃薯块茎如图2(b),可看出接种部位下陷、皱缩,形成腔穴,内部变成褐色,空心且长满白色菌丝或孢子块,内部僵缩干腐,薯肉变为深褐色,病原菌形成空心腔范围较大,纵向和横向扩展较深,形成的染病空腔多在马铃薯的中央部位。接种F.sambicinum的马铃薯块茎如图2(c)所示,观察到薯块表面下陷皱缩形成腔穴,内部变为灰黑色,腔穴内形成白色菌丝,空心腔范围较大,健康薯肉没有变色。两种病原菌相比,F.sambicinum横向扩展直径较大,纵向扩展较浅。两种镰刀菌接种的马铃薯块茎全部发病,出现干腐症状,病情较重;而接种PDA培养基的对照组如图2(a),马铃薯无干腐症状出现。

图1 镰刀菌培养特征
2.2单因子对马铃薯干腐病镰刀菌生物学特性的影响
为明确马铃薯干腐病优势菌F.acuminatum的最佳生长条件,考察了温度、碳源、pH值和氮源对镰刀菌菌丝生长和平均生长速度的影响。
2.2.1 温度对F.acuminatum生长的影响
温度的变化会影响镰刀菌的生长发育,特别是菌丝的生长。镰刀菌F.acuminatum在4℃、10℃、16℃、22℃、28℃、34℃和40℃不同温度环境中,菌落与菌丝生长差异显著。在10~28℃范围内,温度升高,菌落逐渐增大,且菌丝的长度和密度也增加。28℃时菌落直径最大,菌丝生长迅速且菌落致密,菌丝呈羊毛状且长而致密。在10℃和34℃时,菌丝生长明显受到抑制,仅能在菌饼边缘发现有少量白色卷毛状细菌丝长出;4℃和40℃抑制作用最为明显,菌落不生长,无菌丝出现。
温度对平均生长速率的影响如图3所示,在10~28℃范围内,随着温度的升高平均生长速率逐渐增大,28℃时平均生长速率最高,可达到25.5mm/d。超过28℃后平均生长速率迅速下降;当温度达到40℃时,菌落不生长。方差分析结果显示:不同温度对平均生长速率的影响达到了极显著水平,多重比较发现不同温度之间对生长速度的影响均达到了极显著水平。从菌落菌丝生长和平均生长速率两个方面综合考虑,F.acuminatum的最佳生长温度是28℃。
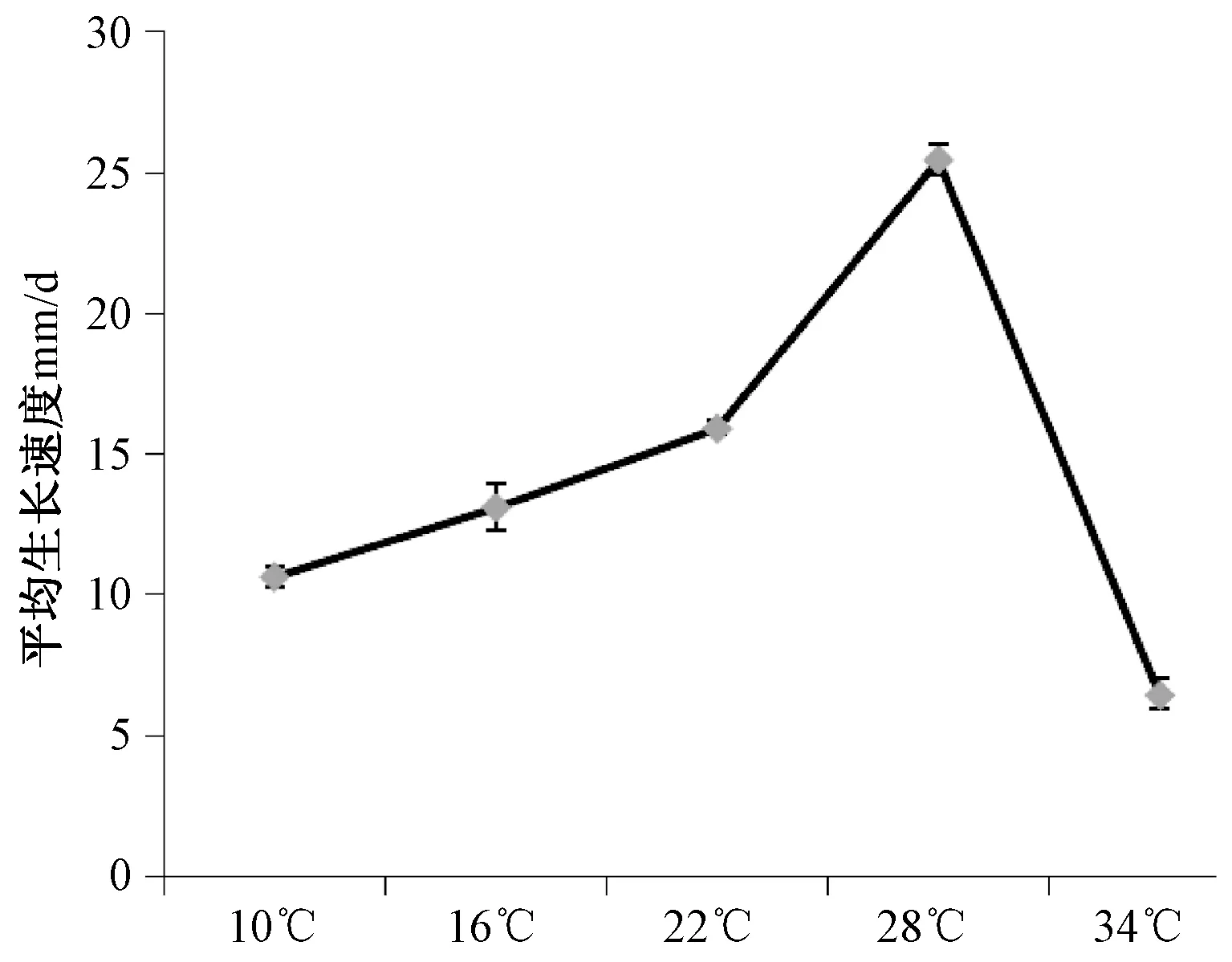
图3 温度对F.acuminatum生长的影响
2.2.2 碳源对F.acuminatum生长的影响
在供试碳源的培养基上F.acuminatum都能正常生长,在蔗糖、乳糖、淀粉的培养基上生长迅速,菌落生长旺盛,菌丝呈羊毛状且延伸短;但菌落颜色与菌丝密度不同,蔗糖培养基上菌落为白色,葡萄糖和淀粉培养基上为淡玫瑰红色;蔗糖培养基上的菌丝致密,葡萄糖次之。以乳糖、木糖为碳源的培养基上,菌落生长旺盛,但菌丝延伸较长而稀疏;以麦芽糖为碳源的培养基,菌丝延伸长而致密,但菌落生长速度慢。
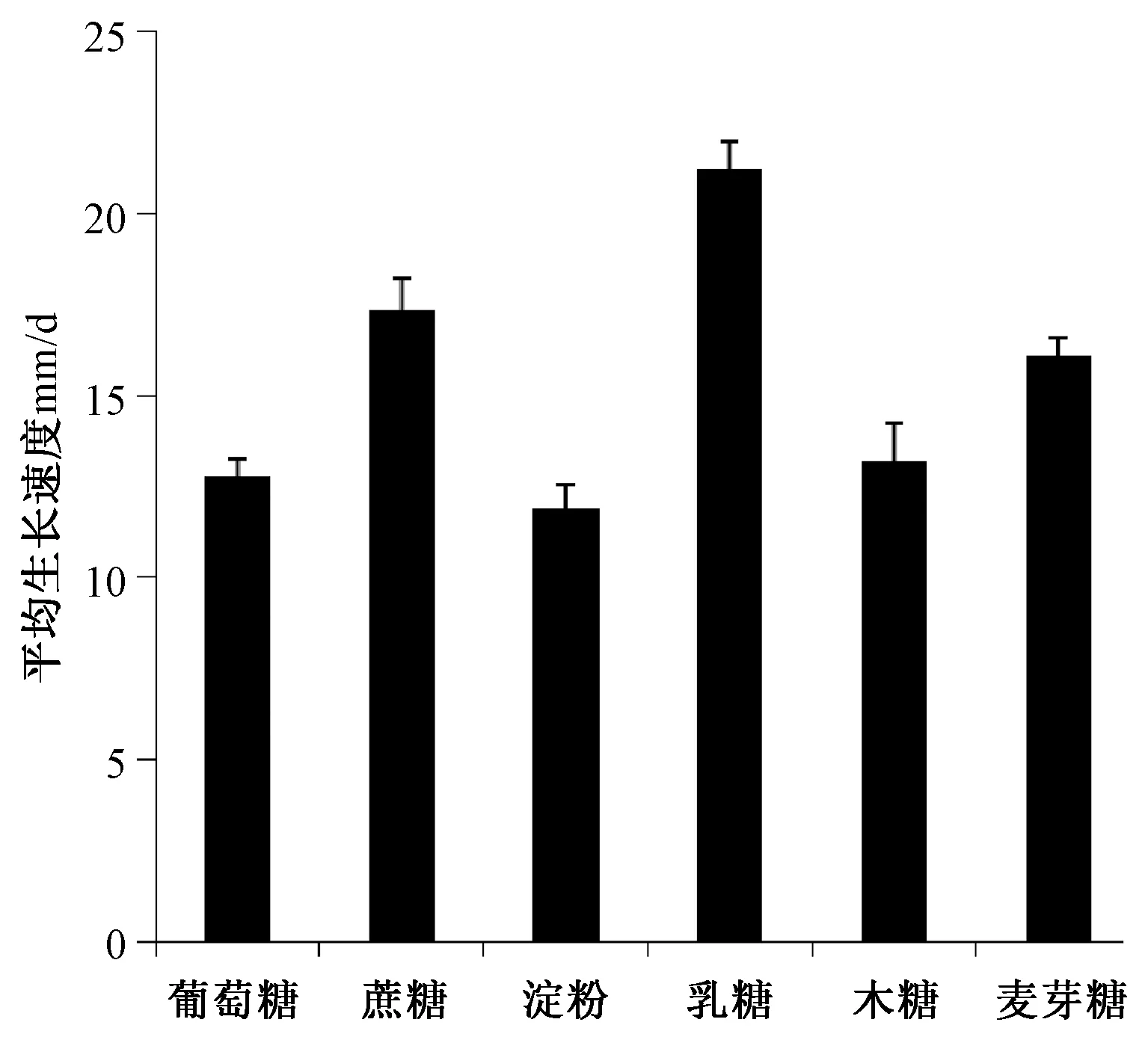
图4 碳源对F.acuminatum生长的影响
不同碳源的平均生长速率如图4所示,菌种在各种碳源环境下都生长,当碳源为乳糖时,生长速率最快,可达到21.2mm/d;其次为蔗糖与麦芽糖;淀粉、木糖与葡萄糖的生长速率相差不大。方差分析结果显示不同碳源对平均生长速率的影响达到了极显著水平,多重比较发现乳糖与其他碳源处理对生长速度的影响差异达到了极显著水平。从镰刀菌平均生长速率和菌落菌丝生长两方面综合考虑,得知蔗糖为最佳碳源。
2.2.3 氮源对F.acuminatum生长的影响
在供试氮源的培养基上F.acuminatum均能生长,但生长差异较大。不添加氮源时,菌落生长较快,但菌丝延伸稀疏。添加玉米粉后,羊毛状菌落生长最旺盛,菌丝长而致密,生长最好。添加蛋白胨和酵母粉后,菌落生长旺盛,菌丝短而致密,且菌落为淡玫瑰红色。添加氯化铵后,菌落生长缓慢,菌丝延伸慢且稀疏。添加尿素的培养基上,菌落不生长,仅在菌碟周围延伸出致密的白色菌丝。因此,添加蛋白胨和酵母粉菌丝生长致密却不利于菌丝延伸,添加尿素和氯化铵后不利于菌落直径增大与菌丝的生长。
不同氮源的生长速率如图5所示,可看出添加玉米粉的培养基上F.acuminatum的平均生长速率最快,可达到28.2mm/d;其次是添加蛋白胨和酵母粉的培养基,平均生长速率最慢的是含有尿素的培养基,添加蛋白胨、酵母粉和玉米粉后的镰刀菌的平均生长速度都高于对照组。方差分析结果显示不同氮源对平均生长速率的影响达到了极显著水平,多重比较显示蛋白胨与酵母粉处理对生长速度的影响无显著差异,其它处理对生长速度的影响均达到了极显著水平。综合考虑平均生长速率和菌落菌丝生长,可知最佳氮源为玉米粉。
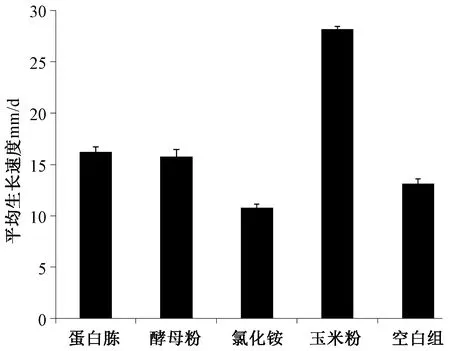
图5 氮源对F.acuminatum生长的影响
2.2.4 pH值对F.acuminatum生长的影响
依据菌落生长特征发现pH值在6~11的范围内F.acuminatum在PDA上都能正常生长,在pH值为6时,菌落生长最慢,菌丝延伸短而稀疏,在pH值为10、11与不调整pH值相比,菌落生长速度差距较小,但菌丝延伸慢而稀疏。当pH值为8、9时,菌落生长速度快,菌丝延伸快而密集,呈羊毛状,且pH值为9时,菌丝生长最佳。
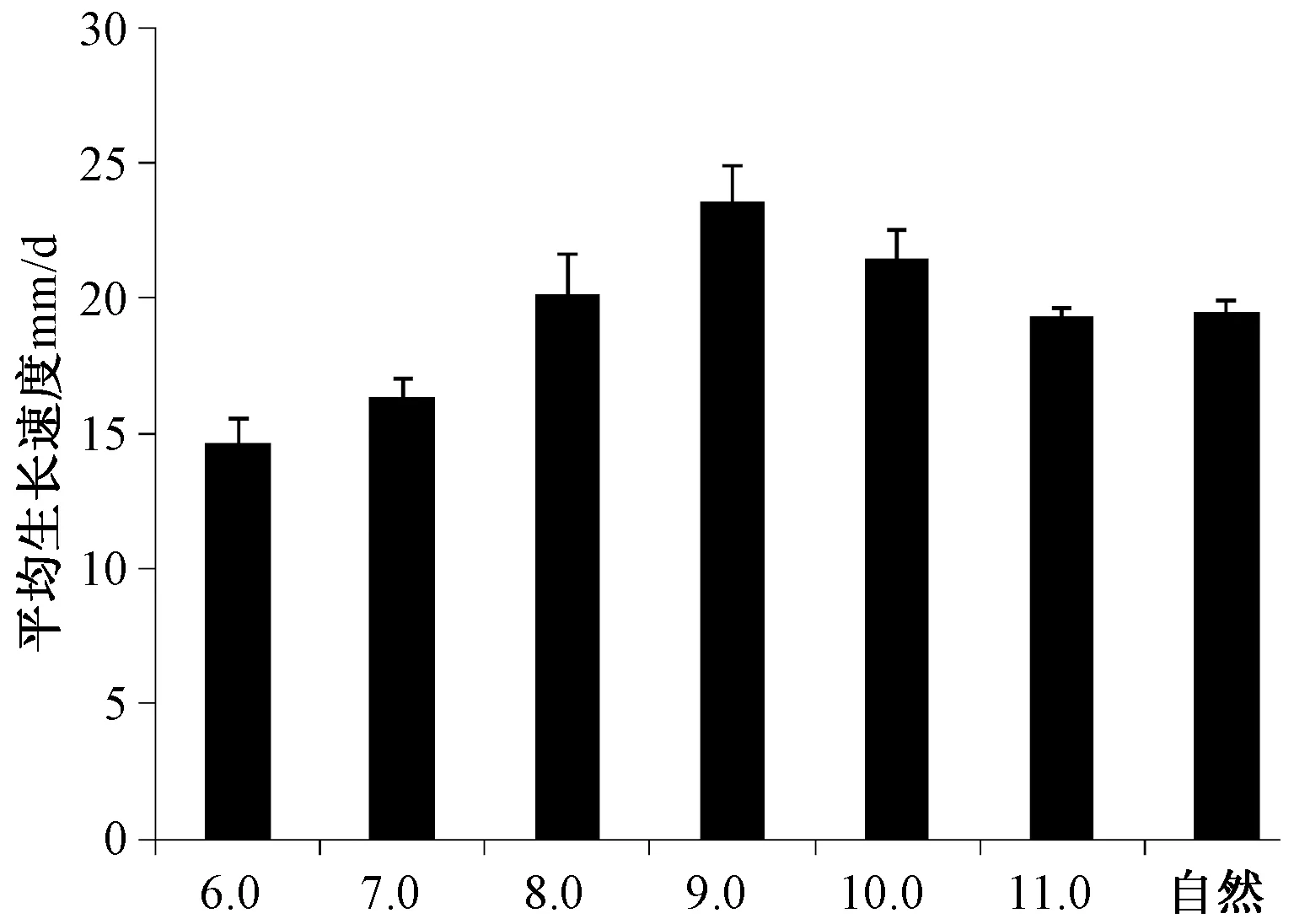
图6 pH值对F.acuminatum生长的影响
从图6可看出:当培养环境的pH值为偏碱性的9时,长势最为突出,平均生长速度可达到23.6mm/d。在酸性和中性环境下,平均生长速度低于自然条件下的生长速度,在碱性环境平均生长速度高于或接近自然组的生长速度,说明F.acuminatum喜偏碱性环境。方差分析结果显示不同pH值对平均生长速率的影响达到了极显著水平,多重比较发现pH值为9、10对生长速度的影响无显著差异。从菌丝生长和平均生长速度综合考虑F.acuminatum的最佳生长pH值为9。
3 结论与讨论
马铃薯储藏期病害严重,常见的是马铃薯干腐病,引起干腐病的镰刀菌种类很多,不同地区镰刀菌优势菌不同。从华池县采集的患有干腐病的马铃薯块茎为试验材料,经分离纯化共得到35株镰刀菌,依据病原菌的菌落特征和形态学观察,鉴定这些菌株为F.acuminatum和F.sambicinum。其中13株为F.sambicinum,分离频率为37.1%;22株为F.acuminatum,分离频率为62.9%。明确了华池县马铃薯干腐病的致病种群是F.acuminatum和F.sambicinum两种镰刀菌,优势菌为F.acuminatum。
F.sambicinum适应能力强,分布范围广,是北方地区马铃薯干腐病的优势种。目前对F.sambicinum的报道较多,如F.sambicinum和F.acuminatum两种是河北马铃薯干腐病的致病菌,内蒙古马铃薯干腐病的优势菌为F.sambicinum[9]。黑龙江马铃薯致病力较强的是F.sambicinum[5]。甘肃的西和、临洮、永登的马铃薯干腐病病原菌以F.sambicinum为主[7,19]。杜密茹[20]报道了内蒙古地区马铃薯干腐病的主要致病菌是F.sambicinum与F.avenaceum。本研究通过对F.sambicinum的培养与致病力测定,发现F.sambicinum的致病能力较强。但关于F.acuminatum的报道较少,本文发现F.acuminatum马铃薯块茎致病力较强,接种病原菌的马铃薯全部发病,而且病情较重。
对优势菌F.acuminatum的生物学特性进行初步研究,发现其生长温度范围为10~34℃,最佳生长温度为28℃,最佳碳源为蔗糖,最佳氮源为玉米粉,生长pH值范围为6~11,最佳pH值为9。
马铃薯在温度10~30℃时均能生长,而F.acuminatum适宜的生长温度范围是10~34℃,因此,通过温度并不能控制F.acuminatum的生长及薯块发病,但通过控制初次侵染源则是预防干腐病的有效途径。本研究表明F.acuminatum适合在偏碱性、温度高和湿度高的环境下生长,华池地区土壤偏碱性,春夏温度高,雨水多,为F.acuminatum的浸染和生长创造了有利条件。因此,可通过控制土壤酸碱度、储藏温度与湿度等方法防治马铃薯干腐病。
需指出的是,由于采集样品仅来自于庆阳市华池县,是否能代表陇东地区马铃薯干腐病镰刀菌的全部种类,尚需进一步研究和探讨。
[1]刁小琴,关海宁,魏雅冬,等.窖藏马铃薯干腐病病原菌的分离及绿色防治技术研究[J]食品研究与开发,2015,36(1):122-125.
[2]汪沛,熊兴耀,雷艳,等.马铃薯土传病害的研究进展[J].中国马铃薯,2014,2:111-116.
[3]奚安.马铃薯贮藏期干腐病病害防治研究进展[J].生物技术世界,2014,6:35.
[4]Jansky S H,Jin L P,Xie K Y,et al.Potato production and breeding in China[J].European Association for Potato Research,2009,52:57-65.
[5]闵凡祥,王晓丹,胡林双,等.黑龙江省马铃薯干腐病菌种类鉴定及致病性[J].植物保护,2010,36(4):112-115.
[6]Carnegie S F,Ruthven A D,Lindsay D A,et al.Effects of fungicides applied to seed potato at harvest or after grading on fungal storage diseases and plant development[J].Ann Appl Biol,1990,116:61-72.
[7]李金花,王蒂,柴兆祥,等.甘肃省马铃薯镰刀菌干腐病优势病原的分离鉴定[J].植物病理学报,2011,41(5):456-463.
[8]李凤兰,蒋先锋,史丽娟,等.两株马铃薯干腐病病原菌的分离与鉴定[J].作物杂志,2013,4:125-128.
[9]魏巍,朱杰华,张宏磊,等.河北和内蒙古马铃薯干腐病菌种类鉴定[J].植物保护学报,2013,40(4): 296-300
[10]Peters J C,Lees A K,Cullen D W,et al.Characterization of Fusarium spp.responsible for causingdry rot of potato in Great Britain[J].Plant Pathology,2008,57(2):262-271.
[11]Chehri K,Mohamed N F,Salleh B,et al.Occurrence and pathogenicity of Fusarium spp.on the potato tubers in Malaysia[J].African Journal of Agricultural Research,2011,6(16):3706-3712.
[12]叶琪明,王拱辰.浙江马铃薯干腐病病原研究初报[J].植物病理学报,1995,25(2):148.
[13]何苏琴,金秀琳,魏周全,等.甘肃省定西地区马铃薯块茎干腐病病原真菌的分离鉴定[J].云南农业大学学报,2004,19(5):550-552.
[14]彭学文,朱杰华.河北省马铃薯真菌病害种类及分布[J].中国马铃薯,2008,22(1):31-33.
[15]张志铭,田世民.河北省马铃薯真菌性病害种类及4种新记录[J].河北农业大学学报,1995,18(3):59-62.
[16]Theron D J,Holz G.Effect of temperature on dry rot development of potato tubers inoculated with different Fusarium spp.[J].Potato Research,1990,33(1):109-117.
[17]魏周全,张廷义,杜玺.马铃薯块茎干腐病发生危害及防治[J].植物保护,2006,32(2): 103-105.
[18]于俊琴.马铃薯种薯贮藏期间干腐病的发生及防治措施[J].天津农林科技,2002(4):9.
[19]李金花,柴兆祥,王蒂,等.甘肃马铃薯贮藏期真菌性病害病原菌的分离鉴定[J].兰州大学学报,2007,43(2):39-42.
[20]杜密茹.马铃薯干腐病病原菌鉴定及病害防治的研究[D].呼和浩特: 内蒙古大学,2008:1-2.
【责任编辑赵建萍】
TheIsolationandBiologicalCharacteristicofFusariumAssociatedwithPotatoDryRot
LIU Li-ping,FANG Peng-peng
(Collegeoflifescienceandtechnology,LongdongUniversity,Qingyang745000,Gansu)
S435.32
A
1674-1730(2017)05-0062-05
2016-07-17
刘丽萍(1985—),女,山东潍坊人,讲师,硕士,主要从事微生物与生物制药方面的教学与研究。
