电催化合成酸性过氧化氢的研究
2017-10-17俞红梅邵志刚
赵 亚,俞红梅,宋 微,迟 军,邵志刚
(1.中科院大连化学物理研究所,辽宁大连116023;2.中国科学院大学,北京100039)
电催化合成酸性过氧化氢的研究
赵 亚1,2,俞红梅1,宋 微1,迟 军1,2,邵志刚1
(1.中科院大连化学物理研究所,辽宁大连116023;2.中国科学院大学,北京100039)
在燃料电池型反应器中,以基于BP2000/PTFE材料制备的气体扩散电极作为阴极电极,以循环流动的硫酸溶液作为电解液,进行电化学合成过氧化氢的研究。探讨了电催化氧还原反应制备过氧化氢的反应过程及机理,同时分析了不同催化剂、电解液pH及电解电压对电解效果的影响。结果表明较优的电解条件是:阴极催化剂采用BP2000的担载量为2 mg/cm2,外加电压为1.5 V。在0.5mol/L H2SO4溶液中生成过氧化氢的电流效率可达70%,过氧化氢浓度达到1.38mol/L(质量分数约为4.7%)。
过氧化氢;气体扩散电极;电催化;燃料电池
Abstract:With circular-flow H2SO4solution as the electrolyte and gas diffusion electrode prepared with BP2000/PTFE as the cathode electrode,the reaction mechanism of hydrogen peroxide production through fuel-cell reactor was studied.The effect of different catalysts,pH and electrolytic voltage on hydrogen peroxide yield was investigated.The results show that the optimum conditions of electrolysis are with BP2000 loading of 2 mg/cm2as cathode catalyst and the electrolytic voltage of 1.5 V.Current efficiency of hydrogen peroxide production was up to 70%in 0.5mol/L H2SO4solution,and the concentration of H2O2was up to 1.38mol/L(about 4.7%).
Key words:hydrogen peroxide;gas diffusion electrode;electrocatalytic;fuel cell
过氧化氢(H2O2)是一种适应性广、用途多样的化学药剂,可作为氧化剂、漂白剂、消毒剂、脱氯剂,被广泛地应用在各种领域。过氧化氢分解产物只有H2O和O2而不产生其他物质,使用后无二次污染的特性符合当前清洁环保的理念,被称为“绿色化学品”;过氧化氢分解时可产生氧化能力很强的游离羟基,因此在污水处理和环境治理领域的应用备受关注[1-7]。过氧化氢的生产方法有电化学法、蒽醌法、异丙醇法、氢气和氧气直接制取法等,其中以蒽醌法应用最广泛,但其整个工艺过程中氢氧混合易发生爆炸,高浓度的过氧化氢极不稳定、易分解、存在爆炸的危险,存储和运输都极为不便,因此如何原位高效生产过氧化氢成为研究热点[1,3-6]。
电化学法作为一种氧还原合成过氧化氢的方法,因其具有效率高、操作安全与可实现更高的电流密度等优点,且合成的过氧化氢溶液无杂质、纯度高,被认为非常有发展前景。燃料电池型反应器是一种利用电催化法合成酸性过氧化氢的低温型反应装置,在其工作过程中,氢气和氧气作为反应物,在电极的三相界面(由电解液、O2/H2与电极构成)上氧气发生两电子氧还原反应,并实现在线生产过氧化氢[2-6,8-11]。
在酸性溶液中,反应装置阴阳极的电极反应如下[12]:

酸性过氧化氢的电化学合成受氧电极的电化学反应动力学所限,在弱酸性条件下难以获得具有工业化应用价值的电流效率和高浓度的H2O2,因此,越来越多的研究倾向于碱性燃料电池[2,5,9-11]。李俊等[13]曾在燃料电池反应器中进行了过氧化氢和电能共生的研究,但过氧化氢产量较低,且生成H2O2的电流效率小于40%;Otsuka等[3-4,11]在质子膜型燃料电池反应器中成功地生产出过氧化氢,并通过对反应器的一系列改进,将“零间隙”膜电极换成质子交换膜和电极之间充满电解液的结构,在酸性条件下生成H2O2浓度质量分数达到1.1%;Yamanaka等[12]以AC+VGCE/PTFE制备的阴极电极,研究了电解液类型及浓度、氧分压、催化剂担量和憎水剂PTFE担量等对电流密度及过氧化氢产量的影响,获得质量分数1.2%双氧水,电流效率CE为40.1%。
对于氧气两电子还原生成H2O2且活性较高的催化剂主要是碳材料[12,14-18],如炭黑XC-72R、石墨、活性炭、活性炭纤维等,或者在碳材料表面修饰[Fe(II),蒽醌基等有机化合物]和掺杂其他催化剂(CoxOy,CeO2等金属氧化物)以增加还原反应速率。
本文利用自制带有隔膜体系的双腔室燃料电池型反应器,并采用碳材料和粘结剂制备了具有三相界面(气、液、固)的气体扩散电极(GDE),通过对催化剂和电解条件的优化,合成酸性H2O2,并对该技术的稳定性进行了初步的考察。
1 实验
1.1 材料与试剂
浓硫酸,AR;PTFE乳液,质量分数60%;Nafion溶液,质量分数为5%;Vulcan XC-72R,Nafion 115膜;碳纸,TGP-H-060;KMnO4,AR;BP2000。
1.2 溶液的配制
采用不同pH的H2SO4溶液作为电解液;滴定法测H2O2浓度时采用0.04mol/L高锰酸钾溶液;PTFE乳液采用质量分数5%。
1.3 氮气吸附测试
用AutoSorb-iQ2型气体吸附分析仪对电极材料样品的孔径分布及比表面积等孔径结构参数进行测试。
1.4 样品元素分析及表征
XPS光谱表征在Thermo Scientific ESCA Lab250 Xi spectrometer测试仪进行,测定电极材料样品中元素C、O、N及含氧官能团的含量。
拉曼光谱表征(Raman spectra)在SENTERRA RamanScope(BRUKER)测试仪进行,激发源波长为532nm,功率约为2 mW。
1.5 电极制备及反应装置单电池组装
电池阴极采用碳材料BP2000作为催化剂,并采用下面工艺制备GDE型电极:取少量催化剂放入乙醇中超声分散均匀,然后滴加PTFE乳液质量分数为5%,其中催化剂与PTFE干重质量比为4︰1,搅拌均匀后滚涂在憎水处理后的碳纸上,最后将样品置于充氮烘箱中,在240、350℃各烧结30、90min即得到电极,实验中催化剂载量为2 mg/cm2。
电池阳极采用Pt/C(Pt质量分数为40%)作为催化剂,并采用与阴极相同的制备工艺来制备GDE型电极,实验中催化剂Pt载量为0.6 mg/cm2。
某矿069-2工作面在试生产时发生一次严重冲击地压事故,为了确保安全回采,需要在开采前进行充分卸压。为了制定有针对性的卸压措施,采用震波CT探测系统对整个工作面进行CT扫描探测。探测后的冲击危险性指数分布如图3所示,该工作面应力分布具有明显的局部化特征,在高C值区存在较大冲击危险,根据CT探测划分了5个冲击危险区域,并对危险区域采取了煤层卸压爆破和断顶爆破。在对危险区域进行充分卸压后,再次进行了CT探测,以检验卸压效果。如图4所示,在工作面采取卸压措施后,C值分布明显趋于分散,表明冲击危险性显著降低,卸压工作取得了良好效果。
将上述制备的电极以聚酯框作为封边材料进行固定,在0.1 MPa压力140℃下,进行热压1min,之后迅速冷却,之后用于组装成单电池,有效面积2 cm×2 cm。单电池由有机玻璃端板、石墨流场、电极、有机玻璃液腔和Nafion 115膜组成,电池部件经密封圈和螺杆固定并密封,如图1所示。

图1 燃料电池型反应器结构示意图
1.6 电化学性能测试
(1)半电池测试
使用CHI730电化学工作站对阴极氧还原催化剂进行半电池测试,包括循环伏安曲线(CV)和线性扫描曲线(LSV)。测试在三电极体系中进行,Pt片电极和饱和甘汞电极(SCE)分别作为辅助电极与参比电极,以涂覆薄层催化剂的旋转环-盘电极(RRDE,型号为PINE AFE7R9GCPT)为工作电极,其制备方法如下:将5 mg催化剂、2.5mL无水乙醇和30 μL质量分数为5%Nafion溶液,超声混合成均匀的浆料,取10 μL浆料转移至玻碳电极(直径为5.61 mm)上,晾干后成薄膜电极。电解质溶液为0.05mol/L H2SO4溶液,室温测试。
循环伏安曲线测试和线性扫描曲线测试的电势扫描范围为0.05~1.1 V,扫速5 mV/s,转速1600 r/min。LSV曲线主要用于研究催化剂的ORR性能,作为催化剂用于阴极性能指标。RRDE其包含Pt圆环电极(内径6.25 mm,外径7.92 mm)和玻碳圆盘电极(直径5.61 mm)。环电极电位保持在1.15 V。ORR电子转移数(n)和过氧化氢产率(%H2O2)采用式(1)和式(2)计算:

式中:Id和Ir分别是RRDE测试得到的盘电流和环电流。N为收集系数,此处为0.37。
(2)单电池测试
采用实验室自制测试系统进行单电池性能测试,并考察电池的稳定性。电池运行条件:阴阳极气体的操作压力均为0.1 MPa;氧气和氢气的气流量分别为76mL/min和64mL/min(化学计量比为1.2∶1);阴阳极电解液为0.5mol/L H2SO4溶液(8.5mL),采用蠕动泵将电解液以10mL/min的流量循环通入阴阳极腔室;电池运行温度是室温。

计算方法如下:
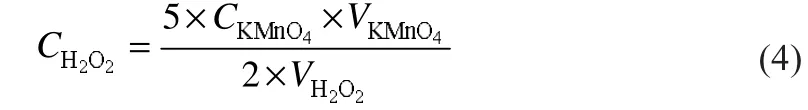
电解时,H2O2电化学合成的电流效率为:

式中:n为H2O2合成时的电子转移数,即2;F为法拉第常数,96500 C/mol;CH2O2,V分别为阴极液中H2O2的浓度及阴极液的体积;I为电解电流,A;t为电解持续的时间,s。
2 结果与讨论
2.1 催化剂的影响
2.1.1 催化剂微观结构分析
催化剂的种类确定后,其微观结构决定了有效表面积,对催化效果也有很大影响。表1为两种碳材料催化剂物性对比,可以看出BP2000具有更高的比表面积和孔体积,其中孔径集中在2~7nm,主要以中孔为主,并且含有少量微孔。

表1 催化剂的BET物性参数表
2.1.2 催化剂元素分析
氧分子在催化剂表面的吸附方式决定了其还原途径,端吸附有利于2e还原过程(Pauling model)的发生[16],且O2吸附在C=O表面C上是端吸附模式,C=O的存在会削弱C-O键,因此O-C=O或HO-C=O作为表面活性位点提高了2e氧还原活性[16]。图2为XC-72R和BP2000的XPS谱图,表2给出了C1s和O1s峰的分峰结果。从表2中看出XC-72R和BP2000中碳主要是以C=C、C-C和O-C=O状态存在,这与图2中C1s谱图是一致的。由表2中O/C比值表明BP2000表面氧含量更高,主要是以O-H和O-C=O状态存在,其中BP2000表面O-C=O的含量 (31.8636)高于XC-72R表面HO-C=O的含量(11.0600),因此BP2000催化2e氧还原活性高于XC-72R。
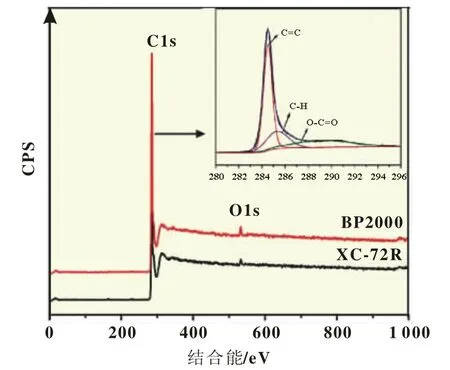
图2 XC-72R和BP2000的XPS谱图及C1s谱图分析

表2 表面元素的含量O/C比及含氧官能团
Raman谱图能够反映出碳材料的石墨化程度,图3中主要有两个峰:D峰1350 cm-1,与材料的无序化有关;G峰1580 cm-1,反应了碳材料的有序化结构。D峰与G峰强度的比值ID/IG大小表明碳材料的缺陷位点的多少,从图3中看出BP2000的ID/IG略高于XC-72R,表明BP2000表面缺陷位点更多,根据XPS谱图结果可以推测可能是由于BP2000表面有更多的含氧基团。

图3 XC-72R和BP2000的Raman谱图
2.1.3 半电池测试
图4为旋转环-盘电极在扫描速率为1 mV/s时阴极催化氧还原反应的线性扫描曲线,从图4中可见,相对于XC-72R的氧还原起始电位0.30 V(vs.RHE),催化剂BP2000的氧还原起始电位约为0.43 V(vs.RHE),正移约0.13 V,这表明BP2000催化氧还原的活性更高,其可能的原因是BP2000具有更高的比表面积及表面更多的含氧官能团。采用式(1)和式(2),计算ORR电子转移数(n)和过氧化氢产率(%H2O2),结果如表3所示。

图4 XC-72R和BP2000催化剂的RRDE测试结果对比
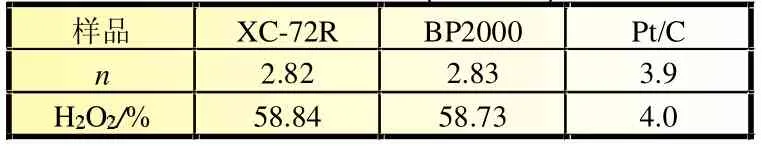
表3 不同催化剂的ORR电子转移数(n)和过氧化氢产率(%H2O2)
2.2 电解液pH的影响
图5为电解液pH对反应体系极化曲线的影响。在酸性水溶液中,H2O2/H2O体系的标准平衡电势要比O2/H2O体系的标准平衡电势正得多,且溶液中过氧化氢浓度是由电化学反应动力学所决定,即电极表面的氧还原反应速率与过氧化氢的分解速率决定了过氧化氢浓度。氧气在阴极上发生两电子还原反应或四电子还原反应,当以碳材料BP2000为催化剂时,主要发生两电子还原过程而生成H2O2或H2O-。在酸性电解液中,往往伴随着其他的副反应,H+被还原为H2,或所产生的过氧化氢可能进一步电化学还原或催化分解为水,反应如下:

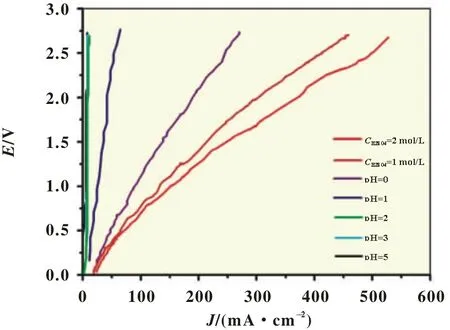
图5 电解液pH对反应体系极化曲线的影响
当外加电压为1.5 V时,电解2 h后,反应系统得到的过氧化氢浓度如表4。
根据电极反应机理,增加H+的浓度,有利于反应向过氧化氢的生成方向进行,同时提高了溶液的导电性,利于反应的进行[19]。从实验结果可以看出,pH=1(CH2SO4=0.05mol/L)时电流效率最大52.2%,但电流较小,故过氧化氢浓度较小;pH=0(CH2SO4=0.5mol/L)时电流效率开始减小,但电流明显增大,故过氧化氢浓度显著变大;当pH<0后,电流效率继续减小,此时过氧化氢浓度没有明显的增大。pH越小,反应电流越大,过氧化氢生成速率较快,然而更易被进一步分解,致使过氧化氢实际生成量和电流效率较小;pH值较大时,反应电流较小,过氧化氢生成速率较慢,且过氧化氢较易分解,因而过氧化氢的产率和电流效率均较小。故较优电解液pH=0,以后的实验中采用0.5mol/LH2SO4电解液。

表4 电解液H2SO4浓度对台成的过氧化氢浓度的影响
2.3 外加电压的影响
在不同的电位下,氧气在阴极可能发生4e或2e还原产生H2O或者H2O2,也可能发生析氢反应产生H2。电压较低时,阴极氧化还原反应进行得较慢,过氧化氢产率较低;电流随着电压的升高而增加,过氧化氢的产生效率随之增加,同时副反应越来越严重,但是当电压增大到1.5 V,过氧化氢生成速率与分解速率达到平衡,使得过氧化氢的浓度较大。因此,必须控制在一个恰当的电压,过高或过低都不利于过氧化氢的产生。
图6是反应体系在0.5mol/L H2SO4溶液中的I-V曲线,当外加电压为1.5 V时,电流密度为150 mA/cm2。当以不同的外加电压施加于反应体系,反应4 h,测不同时间段的H2O2浓度,并采用式(4)和式(5)计算电流效率CE和CH2O2,结果如图7和图8所示。从图7看出,不同外加电压下的电流效率均随反应时间逐渐减小,且相同的时间段内,外加电压越大电流效率越小,其减小得越快。图8给出了H2O2浓度随不同外加电压的变化,反应相同时间,外加电压为1.5 V时对应合成的H2O2浓度基本最大,4 h后CH2O2达到1.38mol/L(质量分数约为4.7%)。当外加电压超过1.5 V时,过氧化氢的浓度反而减小,这是由于当阴极电位变得更加负时,H2O2可进一步还原为H2O,而且O2可能被直接还原成H2O,上述副反应成为阴极的主要反应,最终过氧化氢的富集浓度减小。

图6 以BP2000为催化剂时反应体系的I-V曲线

图7 外加电压对合成过氧化氢的电流效率的影响
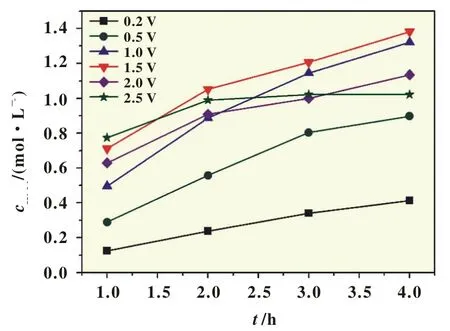
图8 外加电压对合成的过氧化氢浓度的影响
2.4 稳定性测试
在相同反应条件下,通过重复运行反应器合成H2O2来做稳定性测试,对运行次数与合成H2O2的极化曲线和电流效率做了比较。在0.5mol/L H2SO4溶液中得到极化曲线I-V曲线,并在外加电压为1.5 V时反应2 h后测得H2O2浓度,测试结果如图9和表5所示。结果表明,在经过10次运行后极化曲线基本不变,H2O2浓度及其电流效率变化率相对很小。因此该反应装置能稳定运行并连续产生H2O2,以满足不同的用途。

图9 稳定性测试中运行次数与I-V曲线的关系

表5 稳定性测试结果
3 结论
本文中以燃料电池型反应器来合成酸性过氧化氢,并研究了不同催化剂、pH及外加电压对合成过氧化氢的影响,当以0.5mol/L H2SO4溶液为电解液、外加电压为1.5 V时,采用BP2000作为阴极催化剂,反应过程中产生的电流密度为150 mA/cm2,电流效率最大达60%以上,4 h后,获得过氧化氢的浓度可达1.38mol/L(质量分数约为4.7%)。
[1]陈迪航,李绵庆.过氧化氢的应用领域与主要生产方法[J].化工技术与开发,2011,40(3):32-35.
[2]宋天顺,徐源,徐夫元,等.燃料电池型反应器产过氧化氢的研究进展[J].现代化工,2007,27(7):9-12.
[3]YAMANAKA I,HASHIMOTO T,OTSUKA K.Direct synthesis of hydrogen peroxide(>1 wt%)over the cathode prepared from active carbon and vapor-grown-carbon-fiber by a new H2O2fuel cell system[J].Chem Lett,2002(8):852-853.
[4]YAMANAKA I,HASHIMOTO T,TAKENAKA S,et al.Direct and continuous production of hydrogen peroxide with 93%selectivity using a fuel-cell system[J].Angew Chem Int Ed,2003,42:3653-3655.
[5]YAMANAKA I,ONISAWA T,HASHIMOTO T,et al.A fuel-cell reactor for the direct synthesis of hydrogen peroxide alkaline solutions from H2and O2[J].Chem Sus Chem,2011(4):494-501.
[6]REIS R M,BEATI A A G.F,ROCHA R S,et al.Use of gas diffusion electrode for the in situ generation of hydrogen peroxide in an electrochemical flow-by reactor[J].Ind Eng Chem Res,2012,51:649-654.
[7]LI W,BONAKDARPOUR A,GYENGE E,et al.Drinking water purification by electrosynthesis of hydrogen peroxide in a powerproducing PEM fuel cell[J].Chem Sus Chem,2013(6):2137-2143.
[8]衣宝廉.燃料电池-原理·技术·应用[M].北京:化学工业出版社,2003:1-7.
[9]徐源,宋天顺,徐夫元,等.碱性燃料电池产过氧化氢的外部影响因素[J].过程工程学报,2008,8(3):550-554.
[10]莫一平,褚有群,钱晓峰,等.低碱比H2O2的电化学合成[J].浙江工业大学学报,2012,40(4):374-378.
[11]OTSUKA K,YAMANAKA I.One step synthesis of hydrogen peroxide through fuel cell reaction[J].Electrochim.Acta,1990,35(2):319-322.
[12]YAMANAKA I,HASHIMOTO T,ICHIHASHI R,et al.Direct synthesis of H2O2acid solutions on carbon cathode prepared from activated carbon and vapor-growing-carbon-fiber by a H2/O2fuel cell[J].Electrochimica Acta,2008,53:4824-4832.
[13]李俊,赵玲,张新胜,等.燃料电池反应器中过氧化氢的生产:Ⅰ实验研究[J].化学反应工程与工艺,2001,17(3):222-227.
[14]YAMANAKA I,ICHIHASHI R,IWASAKI T,et al.Electrocatalysis of heat-treated cobalt-porphyrin/carbon for hydrogen peroxide formation[J].Electrochimica Acta,2013,108:321-329.
[15]ASSUMPCAO M H M T,MORAESA A,SOUZAR.F.B.D,et al.Low content cerium oxide nanoparticles on carbon for hydrogen peroxide electrosynthesis[J].Applied Catalysis A:General,2012(411/412):1-6.
[16]ZHONG R S,QIN Y H,NIU D F,et al.Effect of carbon nanofiber surface functional groups on oxygen reduction in alkaline solution[J].Journal of Power Sources,2013,225:192-199.
[17]MATSUBARA K,WAKI K.The effect of o-functionalities for the electrochemical reduction of oxygen on MWCNTs in acid media[J].Electrochemical and Solid-State Letters,2013,13(8):7-9.
[18]SILVA F L,REIS R M,BARROS W R P,et al.Electrogeneration of hydrogen peroxide in gas diffusion electrodes:application of iron(II)phthalocyanine as a modifier of carbon black[J].Journal of Electroanalytical Chemistry,2014(722/723):32-37.
[19]徐科峰,李忠,黎华亮,等.采用环境友好电解法制备过氧化氢[J].华南理工大学学报,2007,35(5):122-125.
Study on synthesis of H2O2acid solution by electrocatalysis
ZHAO Ya1,2,YU Hong-mei1,SONG Wei1,CHI Jun1,2,SHAO Zhi-gang1
(1.Dalian Institute of Chemical Physics,Chinese Academy of Sciences,Dalian Liaoning 116023,China;2.University of Chinese Academy of Sciences,Beijing 100039,China)
TM 911
A
1002-087X(2017)09-1287-05
2017-02-12
辽宁省自然科学基金(2014020088)
赵亚(1990—),女,山东省人,硕士生,主要研究方向为电化学合成过氧化氢。
俞红梅
