3.0T MR扩散张量成像在胶质瘤分级中的临床诊断价值
2017-10-17广西壮族自治区人民医院放射科广西南宁530021
广西壮族自治区人民医院放射科(广西 南宁 530021)
韩 武 毛一朴 马隆佰 李 传
论 著
3.0T MR扩散张量成像在胶质瘤分级中的临床诊断价值
广西壮族自治区人民医院放射科(广西 南宁 530021)
韩 武 毛一朴 马隆佰 李 传
目的探讨MR扩散张量成像在胶质瘤分级中的研究价值。方法31例胶质瘤患者行3.0T MR常规及扩散张量成像(DTI)检查,定量测量各向异性系数FA及表观弥散系数值(ADC),对低级别、高级别胶质瘤组间定量参数的比较采用Mann-Whitney U检验。以肿瘤ROI中ADC与FA值作为临界点绘制出ROC曲线,计算曲线下面积,确定诊断阈值,评价其诊断效能。结果14例低级别胶质瘤的FA值为(139.4±81.3);ADC值为(1.36±0.21)×10-3mm2/s;17例高级别胶质瘤FA值为(103.1±41.5),ADC值为(1.09±0.28)×10-3mm2/s.;2两组间参数差异有统计学意义(P<0.05)。以ADC值作为临界点判断肿瘤低高级并绘制ROC曲线,曲线下面积为0.79。以ADC值等于1.11×10-3mm2/s作为诊断阈值,区分低高级肿瘤的敏感度为58.8%,特异度为92.9%。以FA值作为临界点判断肿瘤低高级 并绘制ROC曲线,曲线下面积为0.62。以FA值等于178.9作为诊断阈值,区分低高级肿瘤的敏感度为94.1%,特异度为35.7%。结论DTI中FA值及ADC值对胶质瘤病理分级有重要的评估价值。
胶质瘤;MR动态增强扫描;扩散张量成像;病理学
磁共振弥散张量成像(Diffusion Tensor Imaging,DTI)主要反映胶质瘤对周围脑白质纤维束的侵蚀及破坏情况,其恶性程度与肿瘤细胞的增殖、肿瘤血管生成破坏纤维束的完整性和连续性相关[1]。本研究中对31例胶质瘤定量测量DTI指标,探讨DTI技术在胶质瘤分级及临床运用价值。
1 资料与方法
1.1 临床资料回顾性分析2013年6月至2015年1月31例经手术及病理证实为胶质瘤患者的DTI数据。男15例,女16例,年龄4~70岁,中位年龄43岁。根据2007年WHO中枢神经系统肿瘤分类及分级标准[2],胶质瘤Ⅰ、Ⅱ级为低级别胶质瘤(low grade glioma,LGG)共14例,Ⅲ、Ⅳ级为高级别胶质瘤(high grade glioma,HGG)共17例。其中毛细胞型星形细胞瘤(Ⅰ级)2例,原浆型星形细胞瘤(Ⅱ级)3例,弥漫型星形细胞瘤(Ⅱ级)4例,少突星形细胞瘤(Ⅱ级)5例。间变性星形细胞瘤(Ⅲ级)9例,间变性少突胶质星形细胞瘤(Ⅲ级)3例,间变性室管膜瘤(Ⅲ级)3例,胶质母细胞瘤(Ⅳ级)2例。主要临床症状为头痛、头晕、恶心、呕吐、抽搐及肢体感觉、活动障碍等。入组患者一般临床情况,见表1。
1.2 MR设备及扫描方案使用德国Siemens Skyra 3.0T超导型MR扫描仪,扫描序列包括常规平扫T1WI、T2WI、液体衰减反转恢复序列(FLAIR)、DTI及常规增强MRI扫描。
DTI序列:采用单次激励自旋回波平面回波成像,成像FOV取220cm×220cm,TR时间为5400ms,总层数40,层厚3.0mm,层间距0mm,相位编码方向取从前到后方向,使用并行采集技术GRAPPA缩短采集信号时间,加速因子为2个,基础分辨率为128×128,采用MDDW(多方向弥散成像)方式扫描,在30个方向上施加扩散敏感梯度,b值取2个,分别为0和1000s/mm2,b值0s/mm2采集信号的平均次数12次,b值1000s/mm2采集信号的平均次数2次。在参数选项卡里面设置完成扫描后自动处理出DWI图,ADC图,指数ADC图,FA图。
增强对比剂采用钆喷酸葡胺注射液(马根维显),剂量0.2mmol/kg,注射速率:2.0ml/s,注射完毕后再追加注射同等剂量生理盐水。本研究入组患者均未出现造影剂过敏。
1.3 图像处理DTI图像处理与分析:将扫描所得的DTI原始数据传输到Siemens Syngo MMWP工作站,利用Neuo 3D软件包对DTI原始数据进行后处理。结合方向编码彩色图(directionally encoded color,DEC)、各向异性分数(fractional anisotropy,FA)图,在横断面肿瘤最大层面实质区手工绘制4个ROI,ROI大小30mm2,实质区的选取要注意参考T1,T2,FLAIR图和三个方向的DCE图像,多种权重图像联合观察,判断并尽量避开水肿区域,测量其各向异性系数值(FA)及表观弥散系数值(ADC),测量时同时要注意避开肿瘤囊变、坏死及出血区域。同时取病灶镜面侧正常脑白质FA值作为参考值,病变区与正常脑白质的比值为各向异性系数值(FA)。ADC值要在ADC图上测量,也是在横断面肿瘤最大层面实质区手工绘制4个ROI,ROI大小30mm2。ROI位置的选取要尽量和测量FA值时保持一致。取四次测量值的平均值。
1.4 统计学方法使用SPSS 16.0进行统计学分析。对FA值及ADC值采用Kolmogorov-Smirnov法进行正态性检验,符合正态性分布,其定量数据以表示,两组间数据的比较均采用t和X检验。应用受试者工作特征(ROC)曲线分析FA值及ADC值鉴别诊断阈值特异性和敏感性。
2 结 果
2.1 不同病理类型的胶质瘤FA值和ADC值分析我们对入组的31名不同病理类型的胶质瘤FA值和ADC值进行统计分析后发现,不同病理类型的的胶质瘤患者FA值和ADC值无明显统计学差异(P>0.05)。见表2。
2.2 不同级别胶质瘤FA值和ADC值分析结果进一步,我们对不同级别的胶质瘤患者FA值和ADC值进行统计分析。结果显示:低级别胶质瘤FA平均值高于高级别胶质瘤组,同时低级别胶质瘤ADC高于高级别胶质瘤组,差异有统计学意义,见表3。
2.3 ROC曲线下面积分析结果以肿瘤ROI中的ADC/FA值作为临界点判断肿瘤的高低级别并绘制ROC图(图9)。ADC/FA的曲线面积为0.79/0.62,当ADC/FA阈值为1.11×10-3(mm2/s)/178.9时,低于此阈值可诊断高级恶性肿瘤,具有敏感度为58.8%/94.1%,特异度为92.9%/35.7%。相对于FA,ADC对肿瘤级别的区分具有更大的优势。
2.4 常规及DTI联合扫描之间的灵敏度特异度分析我们以高级别胶质瘤为阳性,对常规MRI及DTI联合扫描之间的灵敏度,特异度,准确度,阳性预测值和阴性预测值之间进行分析,结果发现,DTI联合扫描的灵敏度,特异度,准确度均明显高于常规扫描。差异具有统计学意义(P<0.05),见表4-5。

表1 入组患者的一般临床情况分析
表2 不同病理类型的胶质瘤FA值和ADC值分析
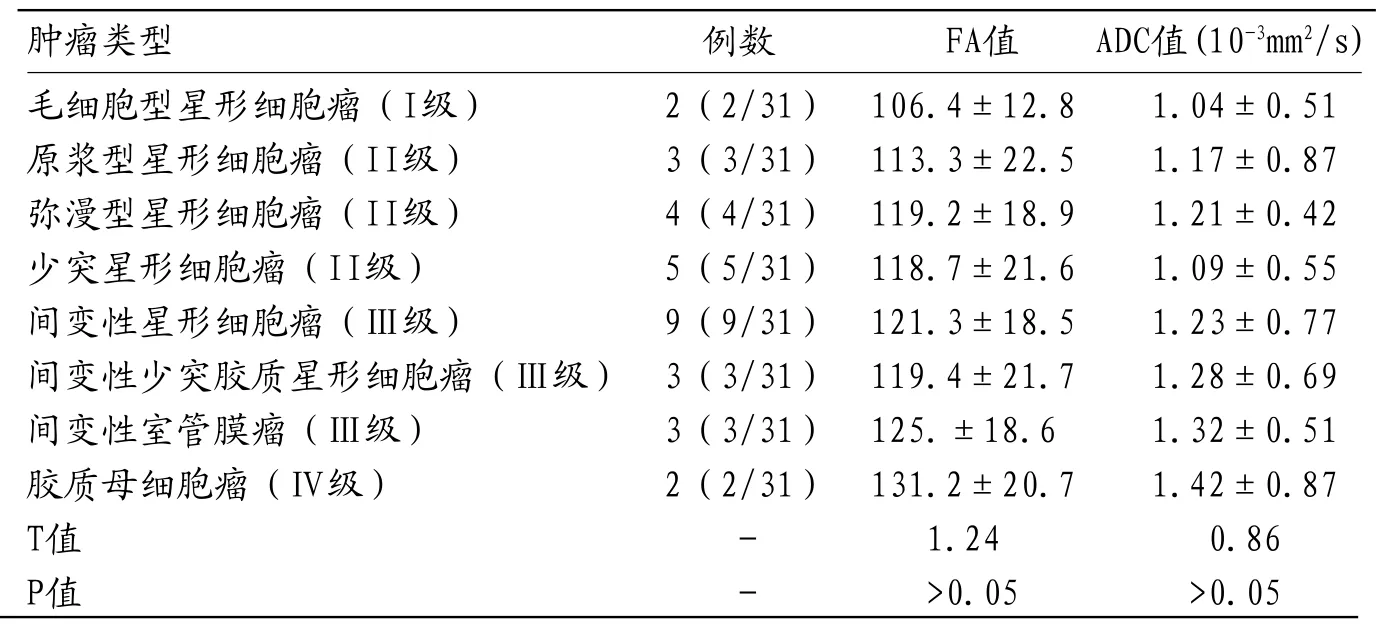
表2 不同病理类型的胶质瘤FA值和ADC值分析
肿瘤类型 例数 FA值 ADC值(10-3mm2/s)毛细胞型星形细胞瘤(I级) 2(2/31) 106.4±12.8 1.04±0.51原浆型星形细胞瘤(II级) 3(3/31) 113.3±22.5 1.17±0.87弥漫型星形细胞瘤(II级) 4(4/31) 119.2±18.9 1.21±0.42少突星形细胞瘤(II级) 5(5/31) 118.7±21.6 1.09±0.55间变性星形细胞瘤(Ⅲ级) 9(9/31) 121.3±18.5 1.23±0.77间变性少突胶质星形细胞瘤(Ⅲ级) 3(3/31) 119.4±21.7 1.28±0.69间变性室管膜瘤(Ⅲ级) 3(3/31) 125.±18.6 1.32±0.51胶质母细胞瘤(Ⅳ级) 2(2/31) 131.2±20.7 1.42±0.87 T值 - 1.24 0.86 P值 - >0.05 >0.05
表3 不同级别胶质瘤FA值与ADC值比较

表3 不同级别胶质瘤FA值与ADC值比较
注:FA:各向异性系数;ADC:表观扩散系数
肿瘤分级 例数 FA值 ADC值(mm2/s)高级别胶质瘤 17 103.1±41.5 (1.09±0.28)×10-3低级别胶质瘤 14 139.4±81.3 (1.36±0.21)×10-3统计值 t=-4.610 t=-3.03 P值 <0.05 <0.05
3 讨 论
MR扩散张量成像指标的指导意义:由于肿瘤分级对于治疗与预后非常重要,影像学对于肿瘤分级能提供的辅助作用也就相应不可或缺。DTI主要反映了神经纤维解剖结构的完整性,能无创性评估脑白质纤维束的微观生理及病理状态。同时,DTI技术使用可以有效评判肿瘤细胞密度并评估肿瘤细胞入侵白质程度的技术。
ADC值在肿瘤中的变化,很大程度上是受到肿瘤细胞结构的影响[3]。随着恶性程度的上升,肿瘤细胞结构密度增加,形态更为复杂,水分子的布朗运动受到进一步的限制,直接导致ADC值的下降。本研究中,ADC值在高级别胶质瘤中明显低于低级别胶质瘤,间接证明了肿瘤细胞结构随着恶性程度的增加而变得更为复杂。同时,高级别胶质瘤恶性程度高,肿瘤内异常肿瘤血管增生,肿瘤细胞微结构完整性破坏,使自由水浸润神经纤维轴突间隙,FA值降低。本研究通过对比FA值发现,高级别胶质瘤FA值较低级别胶质瘤FA值明显降低。反映出高级别胶质瘤间质内血管侵蚀、破坏神经纤维束,使自由水浸润神经纤维轴突间隙,FA值降低,间接反映了肿瘤微血管空间分布情况[6-8]。
此前研究结果显示高低级别肿瘤中FA与ADC差异有统计学意义,本研究也有类似结论,两者都能区分不同级别的肿瘤[4]。但从诊断效能角度来比较,以不同级别中的FA值作为临界点区分肿瘤级别,曲线面积为0.62,略低于ADC的曲线面积,显示ADC具有更好的诊断效能。但FA具有较强的敏感度,较低的特异度;而ADC则敏感度略低,特异性较强。这种差异性主要是因为这两个参数不同的理论差异所导致的[9]。FA更多的是反映出肿瘤内部结构的各向异性,而ADC则是反映肿瘤内部水分子扩散受限制程度,是综合的平均效果,不包含各向异性的成分[10-12]。由于肿瘤本身的异质性,例如,水肿、实质部分并存,低级,高级肿瘤并存。从FA和ADC两个不同出发点的指标来评价,可能会得到有差异的不同分析结果[13-15]。
表4 常规及DTI联合扫描之间的灵敏度特异度分析
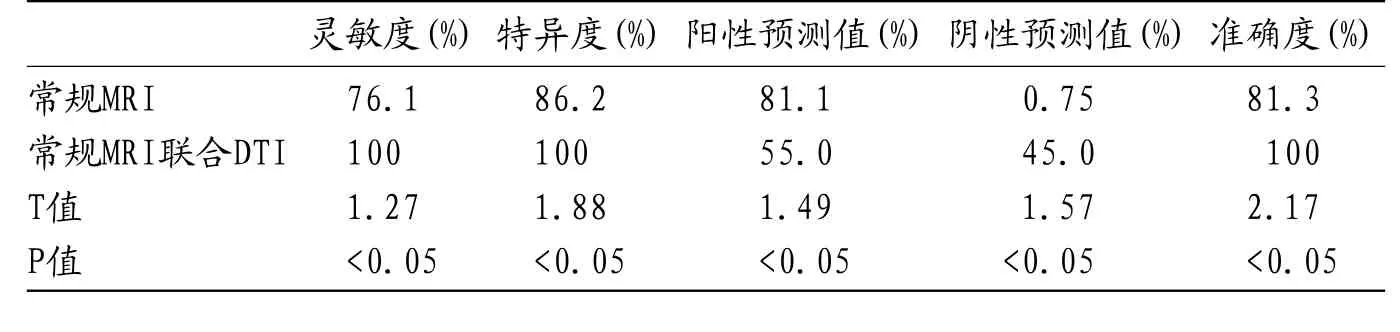
表5 不同检测方法对脑胶质瘤的准确度、敏感度、特异度、阳性预测值、阴性预测值比较(%)

图1 以肿瘤的ADC和FA值作为临界点区分低级与高级肿瘤的ROC曲线。线下面积分别为0.79(ADC)和0.622(FA)。
本研究利用FA和ADC两个指标来评价肿瘤的高低级别,显示了两个指标都可以区分肿瘤的级别。两者联合的使用,对于更大样本的研究一定会对肿瘤级别区分,与内部结构理解会有更好的帮助。我们对常规MRI和MRI联合DTI的方法的灵敏度,特异度,准确度,阳性预测值和阴性预测值进行检测,发现,MRI联合DTI的诊断效能明显高于常规MRI,差异具有统计学意义(P<0.05)。我们推测,由于DTI方法在评价间质内血管侵蚀、破坏神经纤维束,使自由水浸润神经纤维轴突间隙等方面有较好的优越性,因此对临床诊断有较好的提示作用,有助于影像科医生对胶质瘤的级别进行诊断。
但是,本研究最大的局限在于,收集的临床病例数较少,在评价诊断效能方面存在一定的偏倚。综上,通过常规及DTI联合扫描检查能够更加全面地评估胶质瘤新生血管增生及对神经纤维束破坏程度,为肿瘤的诊断、生长和转移的监测及术后复发提供了新的方法。
[1]江晶晶,谈晓飞,张顺,等.磁共振灌注加权成像与扩散张量成像在脑胶质瘤分级诊断中的应用[J].中华实验外科杂志,2014,31(7):1585-1587.
[2]占传家,朱文珍,王承缘.2007年世界卫生组织对于中枢神经系统肿瘤的分类[J].放射学实践,2008,23(2):29-35.
[3]Field AS,Alexander AL.Diffusion tensor imaging in cerebral tumor diagnosis and therapy[J].Top Magn Reson hanging,2004,15(5):315-324.
[4]姜亮,孙军,刘文等.3.0T扩散张量成像定量参数在脑胶质瘤分级中的应用[J].中国医学影像学杂志,2015,4:250-254.
[5]Mersiha Hadziahmetovic,Katsuyuki Shirai,Arnab Chakravarti.Recent advancements in multimodality treatment of gliomas[J].Future Oncology,2011,7(10):1169-1183.
[6]Kun Yao,Haixiang Wang,Zejun Duan,et al.Mixed granular cell astrocytoma and fibrosarcoma of the brain: a case report[J].Int J Clin Exp Pathol,2014,7(7):4473-4478.
[7]Mersiha Hadziahmetovic,Katsuyuki Shirai,Arnab Chakravarti.Recent advancements in multimodality treatment of gliomas[J].Future Oncol,2011,7(10):1169-1183.
[8]J.E.Leestma.Brain tumors[J].Am J Pathol.1980 July,100(1):239-316.
[9]Hangzhou Wang,Xue-tao Li,Chun Wu,et al.miR-132 can inhibit glioma cells invasion and migration by target MMP16 in vitro[J].Onco Targets Ther,2015,8:3211-3218.
[10]Sabrina Doblas,Ting He,Debbie Saunders,et al.Glioma morphology and tumor-induced vascular alterations revealed in 7 rodent glioma models by in vivo magnetic resonance imaging and angiography[J].J Magn Reson Imaging,2010,32(2):267-275.
[11]Louisa Bokacheva,Ellen Ackerstaff,H. Carl LeKaye,et al.High Field Small Animal Magnetic Resonance Oncology Studies[J].Phys Med Biol,2014,59(2):R65-R127.
[12]Jessica Lohrke,Thomas Frenzel,Jan Endrikat,et al.25 Years of Contrast-Enhanced MRI:Developments,Current Challenges and Future Perspectives[J].Adv Ther,2016,33(1):1-28.
[13]Margarita Gutova,Joseph A.Frank,Massimo D'Apuzzo,et al.Magnetic Resonance Imaging Tracking of Ferumoxytol-Labeled Human Neural Stem Cells:Studies Leading to Clinical Use[J].Stem Cells Transl Med,2013,2(10):766-775.
[14]Jayashree Kalpathy-Cramer,Elizabeth R. Gerstner, Kyrre E.Emblem,et al.Advanced Magnetic Resonance Imaging of the Physical Processes in Human Glioblastoma[J].Cancer Res,2014,74(17):4622-4637.
[15]Jinyuan Zhou, Erik Tryggestad,Zhibo Wen,et al.Differentiation between glioma and radiation necrosis using molecular magnetic resonance imaging of endogenous proteins and peptides[J].Nature medicine,2011,17(1):130-134.
(本文编辑: 张嘉瑜)
To Evaluate the Value of 3.0 MR Diffusion Tensor Imaging in Cerebral Glioma Grading
HAN Wu, MAO Yi-pu, MA Long-mo,et al.,
Department of Radiology, Guangxi Zhuang Autonomous Region People's Hospital, Nanning 530021, Guangxi Province,China
ObjectiveTo evaluate the value of diffusion tensor imaging(DTI)in cerebral glioma grading at 3.0T.MethodsThirty-one patients with pathologically confirmed cerebral glioma underwent DTI measurement. The values of FA of tumor tissues were measured and were correlated to the grade of cerebral gliomas by Kruskal-Wallis H test. ROC analysis was used to assess the FA and ADC to distinguish between low-grade glioma (LGG) and high grade glioma (HGG).ResultsThe FA values were(139.4±81.3) and (103.1±41.5) for LGG) and HGG, respectively. The ADC values were (1.36±0.21)×10-3mm2/s and (1.09±0.28)×10-3mm2/s for LGG and HGG,respectively. Statistical significance of FA and ADC values were found between LGG and HGG (P<0.05). Area under curve (AUC) of ADC/FA was 0.79/0.62, the sensitivity was 58.8%/94.1% and the specificity was 92.9%/35.7%, with a threshold value of 1.11×10-3(mm2/s)/178.9.ConclusionThe DTI parameter-FA and ADC have the potential clinical importance for cerebral glioma grading.
Cerebral Glioma; Diffusion Tensor Imaging; Pathology
10.3969/j.issn.1672-5131.2017.10.005
2017-09-06
韩 武
R246.5
A
