大孔树脂AB-8分离纯化伦晚脐橙总黄酮
2017-10-16,,,,2,*
,,,,2,*
(1.西南大学园艺园林学院,重庆 400716;2.南方山地园艺学教育部重点实验室,重庆 400715)
大孔树脂AB-8分离纯化伦晚脐橙总黄酮
聂超1,赵梓燕1,徐晓丹1,周志钦1,2,*
(1.西南大学园艺园林学院,重庆400716;2.南方山地园艺学教育部重点实验室,重庆400715)
考察了不同大孔树脂对伦晚脐橙残次果总黄酮的吸附与解吸性能,筛选出适宜纯化的大孔树脂AB-8。以芸香柚皮苷、橙皮苷、香蜂草苷、甜橙黄酮、川陈皮素、橘皮素6种标准品绘制标准曲线,采用高效液相色谱法(HPLC)进行定性、定量分析。通过静态与动态吸附、解吸,得出大孔树脂AB-8纯化伦晚脐橙残次果总黄酮的最佳工艺条件为:0.75 mg/mL的pH=3上样液,上样体积为3.5倍柱体积(BV),上样流速为2 BV/h;80%乙醇为洗脱剂,2 BV/h流速洗脱,洗脱体积为5 BV,解吸率达90.73%。经大孔树脂纯化后,提取物中总黄酮含量由纯化前36.04 mg/g增加到纯化后334.54 mg/g。HPLC分析结果表明,AB-8分离纯化伦晚脐橙总黄酮不会造成单体黄酮组成变化,其中主要黄酮类物质是芸香柚皮苷、橙皮苷,占总量的91.14%。该工艺能有效地富集伦晚脐橙黄酮类,去除糖、色素等物质,且对伦晚脐橙黄酮组分没有影响。
伦晚脐橙,总黄酮,高效液相色谱法,大孔树脂,分离纯化
Abstract:The adsorption and desorption of total flavonoids from lane late navel orange fruits were investigated by using 3 macroporous resins. Results indicated that AB-8 resin was appropriate to purify the total flavonoids. Then the polyphenols from orange fruits were qualitatively and quantitatively by HPLC(high performance liquid chromatography). To optimize the separation process,the static and dynamic of adsorption and desorption experiments were carried out,the optimal adsorption conditions were as follows:initial concentrations in sample solution 0.75 mg/mL,pH3.0,sample loading amount 3.5 BV,flow rate 2 BV/h. The optimal desorption parameters were 80% ethanol 5 BV,flow rate of 2 BV/h,the desorption ratio was 90.73%.After purification,the content of flavonoids in product was increased from 36.04 mg/g to 334.54 mg/g. HPLC analysis results found that the flavonoids profiles of lane late navel orange were not changed after adsorption and desorption by AB-8 macroporous resin. The main flavonoids were narirutin and hesperidin,the percentage content to the total flavonoids was 91.14%.The results showed that AB-8 resin revealed a good ability to enrichment total flavonoids from lane late navel orange,and the method can be referenced for the enrichment of total flavonoids from other material.
Keywords:lane late navel orange;total flavonoids;high performance liquid chromatography;macroporous resin;separation and purification
脐橙属于芸香科柑橘属甜橙类,素有“柑桔之王”的美誉。近年来,为了优化柑橘品种结构[1],晚熟柑橘得到了大力发展。伦晚脐橙(Citrus sinensis Osbeck cv.Lane late)是我国主要推广发展的晚熟品种之一,其经济效益明显。但在实际生产过程中,伦晚脐橙落果现象严重,以及存在残次果较多等问题,造成了资源浪费,其合理开发利用对提高农产品利用率具有重大意义[2]。黄酮是一类大量存在于植物中的,具有抗炎、抗氧化、抗菌等活性的次生代谢物质[3-4]。伦晚脐橙残次果中含有丰富黄酮类物质,其中多甲氧基黄酮(polymethoxyflavones,PMFs)是柑橘属水果特有的一类高度甲氧化的黄酮类化合物[5],PMFs易于吸收代谢,且生物活性高于一般黄酮类化合物[6]。
目前,黄酮类物质的纯化方法主要有大孔树脂、硅胶柱、聚酰胺、葡糖凝胶和高速逆流色谱等,由于大孔树脂具有成本低、效率高、易操作等优点,被广泛应用于食品和天然药物行业[7],尤其是纯化植物化学物质[8]。汪洋等[9]发现大孔树脂D101适合于柑橘皮渣总黄酮的纯化,程灏旻等[10]利用AB-8纯化血橙果皮总黄酮,使得黄酮类化合物的纯度从6.00%提高到23.32%。但是,前人的研究大都是针对柑橘皮渣进行纯化,对于落果和残次果总黄酮分离纯化还鲜有报道。
本研究采用HPLC对黄酮含量进行精确定量,利用不同大孔树脂对伦晚脐橙残次果总黄酮提取物进行吸附、解吸,筛选出适宜纯化的树脂类型,并对其动态吸附条件进行优化,确定最优工艺参数。以期为大孔树脂分离纯化伦晚脐橙残次果总黄酮的应用提供理论依据,对解决资源浪费,提高脐橙残次果的综合利用具有一定的参考意义。
1 材料与方法
1.1 材料与仪器
伦晚脐橙残次果 落果以及有损伤的成熟果,2016年收集于重庆市云阳县,洗净、切至5~10 mm厚度,烘箱内60 ℃烘干;大孔树脂AB-8、NKA-9 天津市光复精细化工研究所;大孔树脂D101 成都市科龙化工试剂厂;标准品芸香柚皮苷、橙皮苷、香蜂草苷、甜橙黄酮、川陈皮素、橘皮素 纯度为98%以上,美国Sigma公司;甲醇 色谱纯,美国Sigma公司;甲酸 色谱纯,美国Fisher公司;无水乙醇 分析纯,成都市科龙试剂厂。
Milli-Q Advantange A10超纯水系统 美国密理博(Millipore)公司;DHG-9240A电热恒温鼓风干燥箱 上海齐欣科学仪器有限公司;KQ5200DE数控超声清洗器 昆山市超声仪器有限公司;Waters e2695高效液相色谱仪、Waters 2998光电二极管阵列检测器 美国Waters公司;Sartorius BSA224S电子天平 感量0.1 mg,Max 220 g,赛多利斯科学仪器(北京)有限公司;EYELA N1100旋转蒸发仪 东京理化器械株式会社;SHB-Ⅲ循环水式多用真空泵 郑州长城科工贸有限公司;HH-S电子恒温水浴锅 江苏省金坛市医疗仪器厂;SHA-C水浴恒温振荡器 金坛市宏业实验仪器厂;SevenCompact-S210 pH计 梅特勒-托利多仪器有限公司;LGJ-12真空冷冻干燥机 北京松源华兴科技发展有限公司。
1.2 实验方法
1.2.1 伦晚脐橙残次果总黄酮粗提液的制备 根据本实验室前期对提取条件的优化,得到伦晚脐橙残次果总黄酮粗提液的制备方法。伦晚脐橙残次果切片后,烘干,粉碎机磨粉,过60目筛。用体积分数为95%乙醇,在温度90 ℃,料液比为1∶5 (g/mL)条件下热回流提取2 h,重复两次。将提取液过滤,旋转蒸发回收乙醇(蒸至无醇味),用少量蒸馏水溶解,得到伦晚脐橙残次果总黄酮粗提液,作为原液在4 ℃冷藏备用。
1.2.2 黄酮含量测定 黄酮含量采用HPLC测定,称取6种黄酮类标准品各10.00 mg,用甲醇定容至10.00 mL,配制成1.00 mg/mL的母液,保存于-20 ℃待用。色谱条件参考张元梅[11]等,色谱柱:Sunfire-C18柱(5 μm,250 mm×4.6 mm);检测波长:280 nm(黄烷酮)、330 nm(多甲氧基黄酮);流速:0.7 mL/min;柱温:25 ℃;进样体积为10 μL;流动相:A 0.1%甲酸高纯水,B甲醇。梯度洗脱:0~20 min,37%~50% B;20~35 min,50%~80% B;35~40 min,80%~100% B;40~50 min,100% B;50~60 min,37% B;流速:0.7 mL/min。
根据样品出峰时间与标准品保留时间进行对照,判断黄酮种类,进行定性分析。以标准品的质量浓度与相应峰面积为横纵坐标,绘制标准曲线,进行定量分析。
1.2.3 大孔树脂静态吸附与解吸附
1.2.3.1 大孔树脂预处理 分别取大孔树脂AB-8、D101、NKA-9,首先用95%乙醇浸泡大孔树脂24 h,蒸馏水洗至无醇味。接着用质量分数为5%的NaOH浸泡3 h,蒸馏水不断冲洗至中性。质量分数为5%的HCl浸泡3 h,蒸馏水洗至中性。最后用体积分数为95%乙醇浸泡4 h,蒸馏水洗至无醇味,备用。
1.2.3.2 静态吸附 称取2.0 g树脂于100 mL锥形瓶中,加入20 mL浓度为0.75 mg/mL的总黄酮粗提液,密封后置于恒温振荡器中吸附24 h(25 ℃、150 r/min)平衡后,过滤,测定吸附后溶液中的黄酮含量,按式(1)、式(2)计算吸附量、吸附率。
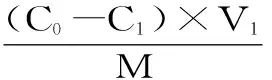
式(1)
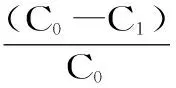
式(2)
式中:qe为吸附量,mg/g;E为吸附率,%;C0为起始液黄酮含量,mg/mL;C1为吸附后溶液中的黄酮含量,mg/mL;V1为上样液体积,mL;M为树脂质量(烘干),g。
1.2.3.3 静态解吸 将上述过滤溶液后的树脂用蒸馏水清洗两次,用滤纸吸干表面水分。加入30 mL体积分数为80%乙醇溶液,密封于振荡器中解吸24 h(25 ℃、150 r/min),过滤,测定滤液中黄酮含量,按式(3)、式(4)计算解析量、解吸率。
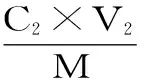
式(3)

式(4)
式中:qd为解吸量,mg/g;D为解吸率,%;C0为起始液黄酮含量,mg/mL;C1为吸附后溶液中的黄酮含量,mg/mL;C2为洗脱液黄酮含量,mg/mL;V1为上样液体积,mL;V2为洗脱液体积,mL;M为树脂质量(烘干),g。
1.2.3.4 树脂的筛选 称取预处理后的三种大孔树脂各2.0 g,按照1.2.3.2的方法进行静态吸附,测定吸附前后总黄酮含量,根据式(1)、式(2)计算吸附量和吸附率。按照1.2.3.3的方法进行静态解吸,测定洗脱液中总黄酮含量,按式(3)、式(4)计算解吸量和解吸率。
1.2.3.5 静态吸附与解吸动力学 综合考虑树脂的吸附量和解吸率,筛选出最适合的树脂类型,测定其静态吸附动力学曲线。按照1.2.3.2所述方法,分别测定0.5、1、2、5、8、10、24 h吸附后溶液中的黄酮含量,绘制该大孔树脂的静态吸附动力学曲线。按照1.2.3.3所述方法,分别在0.5、1、2、5、8、10、24 h时测定洗脱液中黄酮含量,绘制该大孔树脂的静态解吸动力学曲线。
1.2.3.6 pH对吸附效果的影响 准确称取2.0 g树脂于100 mL锥形瓶中,分别加入20 mL pH为2.0、3.0、4.0、5.0、6.0的总黄酮粗提液,振荡器中吸附24 h(25 ℃、150 r/min)平衡后,测定平衡液中黄酮含量,计算不同pH下树脂的吸附率。
1.2.3.7 洗脱液浓度对树脂解吸效果的影响 吸附后的树脂用蒸馏水清洗两次,用滤纸吸干表面水分。加入30 mL体积分数为10%、20%、30%、50%、60%、70%、80%、90%的乙醇溶液,于振荡器中解吸24 h(25 ℃、150 r/min),平衡后,测定洗脱液中黄酮含量,计算解吸率,确定适合解吸的乙醇体积分数。
1.2.4 大孔树脂的动态吸附与解吸 将预处理好的20.0 g树脂采用湿法上柱,装入(30 mm×300 mm)玻璃层析柱中。取质量浓度为0.45、0.75、1.05、1.52 mg/mL上样液,以1、2、3、4 BV/h流速上样,收集流出液,15 mL为一管,测定流出液中黄酮的质量浓度,以流出液的体积和黄酮浓度作图,绘制动态吸附曲线,确定上样流速与上样浓度。
吸附饱和后的树脂用蒸馏水清洗3次去除树脂表面杂质,水洗至无色,并用苯酚-浓硫酸法[12]检测至无糖。用体积分数为80%的乙醇溶液分别以2 BV/h洗脱,15 mL为一管收集洗脱液,测定洗脱液中黄酮含量。以体积为横坐标,流出液黄酮浓度为纵坐标,绘制动态解吸曲线。
1.2.5 纯化前后伦晚脐橙残次果总黄酮提取物的组成与含量分析 按照上述方法分离纯化伦晚脐橙残次果总黄酮提取物,将洗脱液减压浓缩,采用真空冷冻干燥冻干,得到伦晚脐橙黄酮纯化物。在280 nm(黄烷酮)、330 nm(多甲氧基黄酮)下,采用HPLC测定纯化前后黄酮组成与含量。
1.2.6 统计分析 采用Excel和SPSS 19软件对数据进行统计分析,采用Origin 8作图,实验重复3次,结果以均值±标准差表示。
2 结果与分析
2.1 黄酮标准品HPLC分析与标准曲线绘制
如图1所示,6种类黄酮标准品物质在60 min内完全分离,可以满足对类黄酮物质的定性。6种主要类黄酮标准品回归方程、相关系数等结果如表1所示,芸香柚皮苷等类黄酮标准品质量浓度与相应峰面积呈良好线性关系,符合定量要求。
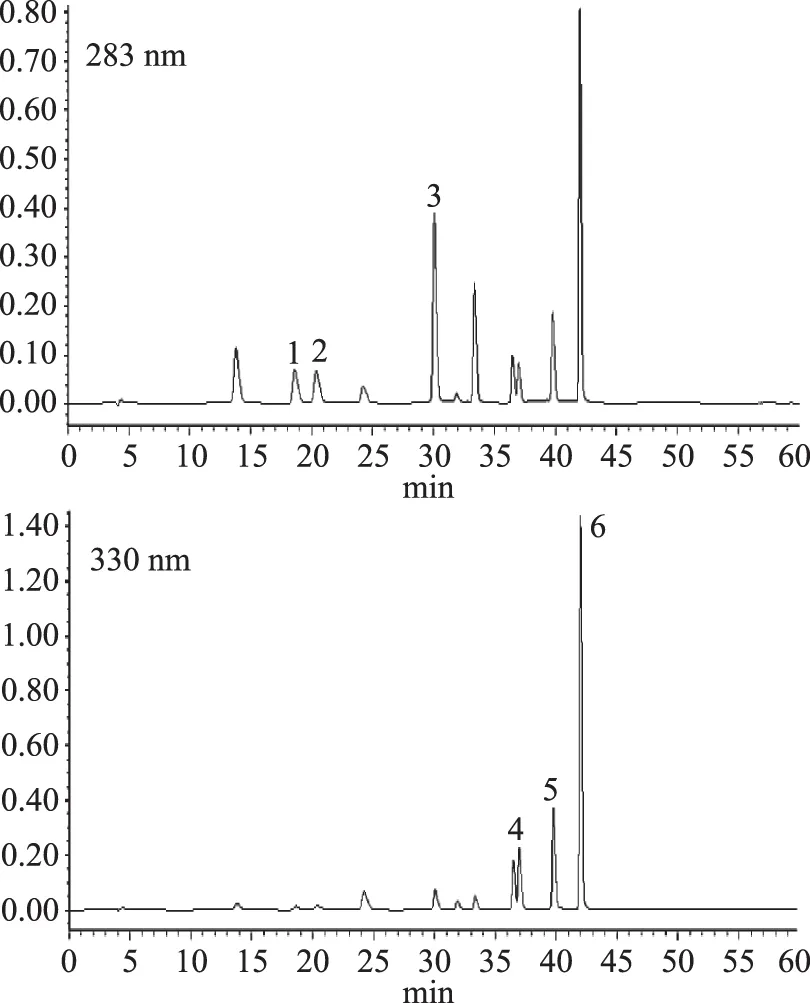
图1 类黄酮标准品的高效液相色谱图Fig.1 HPLC chromatograms of flavonoids standards注:1-芸香柚皮苷;2-橙皮苷;3-香蜂草苷;4-甜橙黄酮;5-川陈皮素;6-橘皮素。
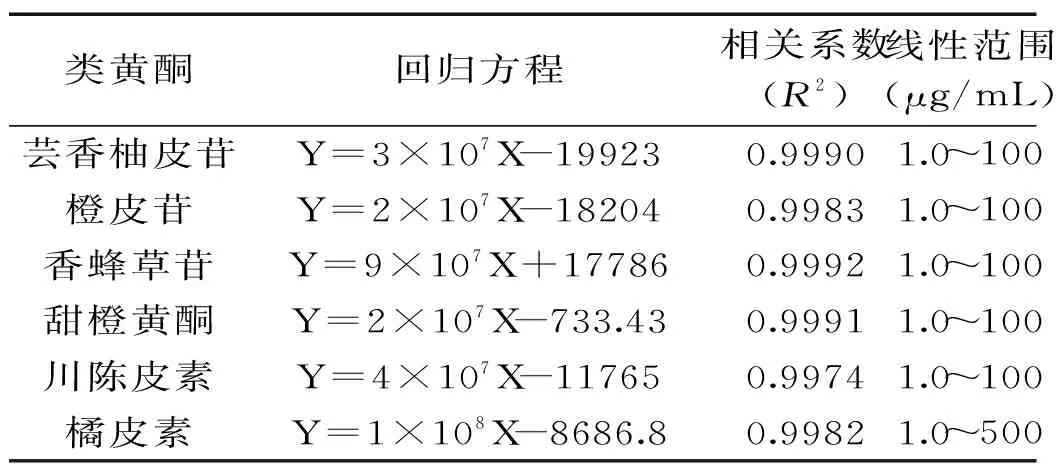
表1 黄酮物质标准品回归方程、相关系数、线性范围Table 1 Regression equations,correlation coefficients,linearity range of flavonoids compositions
2.2 树脂筛选结果
树脂的吸附能力遵循“相似相溶”原理,由于类黄酮物质既具有非极性的苯环结构,也有极性的多羟基结构,结合他人研究[13-15],选择AB-8、NKA-9、D101三种树脂用于类黄酮物质分离纯化。
本研究结果如图2所示,AB-8、NKA-9和D101三种树脂对黄酮物质的吸附性能差异极显著(p<0.01),吸附量分别为23.81、16.88、21.02 mg/g。结果表明,AB-8对黄酮的选择吸附能力最强,其次是D101。从解吸性能来看,AB-8解吸率达到89.75%,极显著高于其他树脂(p<0.01)。因此,AB-8最适用于类黄酮分离纯化。
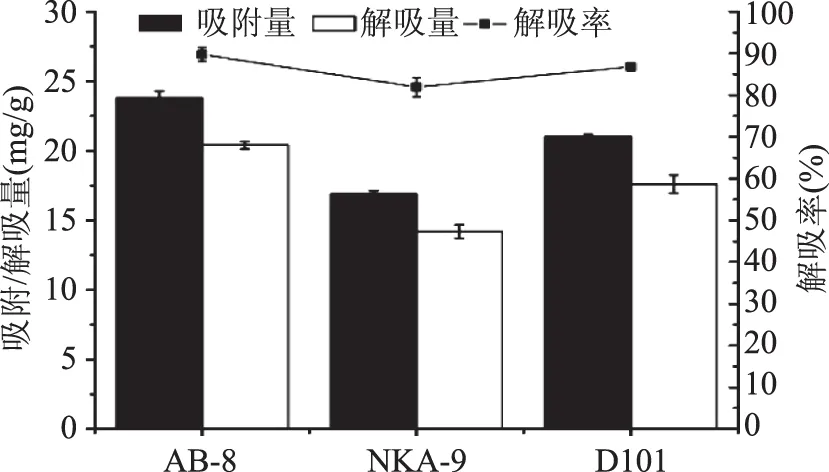
图2 不同类型树脂对伦晚脐橙全果总黄酮的吸附与解吸性能Fig.2 The static adsorption and desorption tests of 3 macroporous resins
2.3 静态吸附、解吸曲线
静态吸附曲线反映了溶质吸附速率随吸附时间的变化,是衡量吸附性能的重要参数[16]。本研究结果如图3所示,在0~3 h内,AB-8大孔树脂对伦晚脐橙残次果总黄酮的吸附量迅速增大,在3 h时吸附达到平衡状态。AB-8大孔树脂对伦晚脐橙残次果总黄酮的吸附时间短,吸附效果好,符合实验要求。
由解吸曲线(图3)可知,树脂吸附的伦晚脐橙残次果总黄酮在80%乙醇洗脱下,在0~2 h时解吸量迅速增加,3 h后,随着解吸时间增加解吸量变化不太明显,达到解吸平衡状态。AB-8大孔树脂解吸时间短,可以满足实际操作。

图3 AB-8树脂静态吸附与解吸动力学曲线Fig.3 Static adsorption and desorption kinetic scurve of AB-8 macroporous resins
2.4 上样液pH对吸附性能的影响
上样液的pH影响溶质的电离程度,是影响大孔树脂吸附量的关键参数[17]。如图4所示,pH为3时,AB-8大孔树脂对伦晚脐橙残次果总黄酮物质的吸附率最高。随着pH继续增高,吸附率开始下降。

图4 上样液pH对黄酮吸附率的影响Fig.4 Effect of sample solution pH value on the adsorption ratio of the total flavonoids
这表明上样液的pH可能通过影响溶质的电离程度从而影响大孔树脂的吸附率。当pH较高时,黄酮酚羟基分离H+,氢键相互作用减少,从而导致较低的吸附能力。因此,将样品溶液的pH调整到3.0最利于AB-8对伦晚脐橙残次果总黄酮的吸附。
2.5 洗脱液体积浓度对解吸性能的影响
由于黄酮类物质具有抗氧化、抗炎、抗癌等药理保健性质,从安全角度出发,本实验选择乙醇作为洗脱剂。如图5所示,将不同体积分数的乙醇加入已吸附饱和的AB-8大孔树脂中,考察乙醇浓度对树脂解吸率的影响。

图5 乙醇浓度对黄酮解吸率的影响Fig.5 Effect of ethanol concentration on the desorption properties of the total flavonoids
在乙醇浓度为10%~50%时,随着乙醇浓度的增加,解吸率迅速增大。进一步提高乙醇的浓度,解吸率增加变缓,80%的乙醇浓度解吸率最大,这与乙醇溶液的极性有关。综合考虑成本等因素,本实验选择80%乙醇作为洗脱剂的浓度。
2.6 动态吸附与解吸条件优化
2.6.1 上样浓度对树脂吸附效果的影响 大孔树脂AB-8对不同浓度伦晚脐橙残次果总黄酮的动态吸附性能如图6所示。通常,将流出液总黄酮浓度达到上样液起始浓度10%作为泄漏点[18]。上样液黄酮浓度为1.52 mg/mL时,在1.5 BV左右开始泄露,泄漏点出现太早,容易堵塞树脂,不利用大孔树脂吸附;黄酮浓度为1.05 mg/mL时,在上样体积为2.5 BV时发生泄露;当样品浓度为0.45、0.75 mg/mL时,泄漏点同时出现在3.5 BV附近。上样液黄酮浓度为0.45、0.75、1.05 mg/mL,发生泄露时,大孔树脂吸附量分别为45.92、75.83、73.88 mg黄酮。在0.75、1.05 mg/mL浓度下,树脂吸附能力相差不明显(p>0.05),但1.05 mg/mL上样粘度较大,有一定沉淀物,容易冲散树脂。因此,将上样液的浓度确定为0.75 mg/mL最利于树脂的吸附。
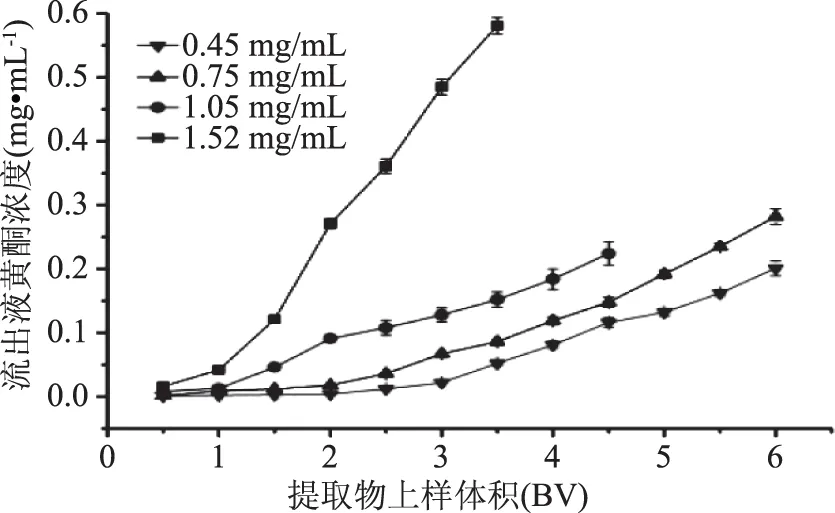
图6 上样浓度对AB-8树脂吸附效果的影响Fig.6 Effect of samples concentration on the adsorption properties of AB-8
2.6.2 上样流速对树脂吸附效果的影响 上样流速主要通过影响黄酮类化合物与树脂表面活性区域的相互作用时间,从而影响吸附性能[19]。流速太快,不利于树脂与样品充分接触,降低树脂吸附量;流速太慢,虽有利于吸附,但不利于生产实际。AB-8大孔树脂对不同上样流速的动态吸附性能如图7所示。
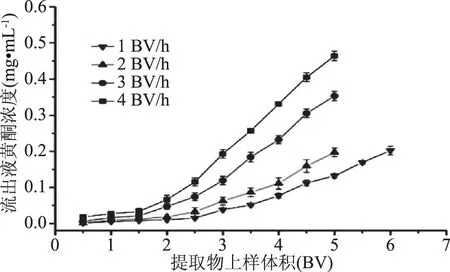
图7 上样流速对AB-8树脂吸附效果的影响Fig.7 Effect of flow ingrate on the adsorption properties of AB-8
上样流速为4.0 BV/h时,在2 BV左右就开始泄露,泄漏点出现太早,不利于大孔树脂吸附。上样流速为1、2、3 BV/h时,泄漏点分别出现在4.0、3.5、2.5 BV附近,此时AB-8的吸附量分别为87.29、75.78、53.88 mg黄酮。上样流速为1.0 BV/h,尽管泄漏点出现较晚且吸附量最高,但上样时间太长,效率低下。上样速度为3.0 BV/h时,泄漏点出现相对较早,同时树脂吸附量较低。综合考虑,选择2 BV/h为最佳上样流速。
2.6.3 动态解吸曲线 从图8可以看出,随乙醇溶液体积的增加洗脱液中黄酮含量呈先升高再降低趋势。当洗脱到2 BV时,洗脱液中黄酮含量达到最大值,之后增加洗脱液体积,黄酮质量浓度下降。5 BV后洗脱液中黄酮含量很少,此时,解吸率达到90.73%,说明5 BV的80%乙醇就可将大部分吸附在树脂上总黄酮洗脱下来。因此,采用5 BV的80%乙醇洗脱即可满足实验要求。
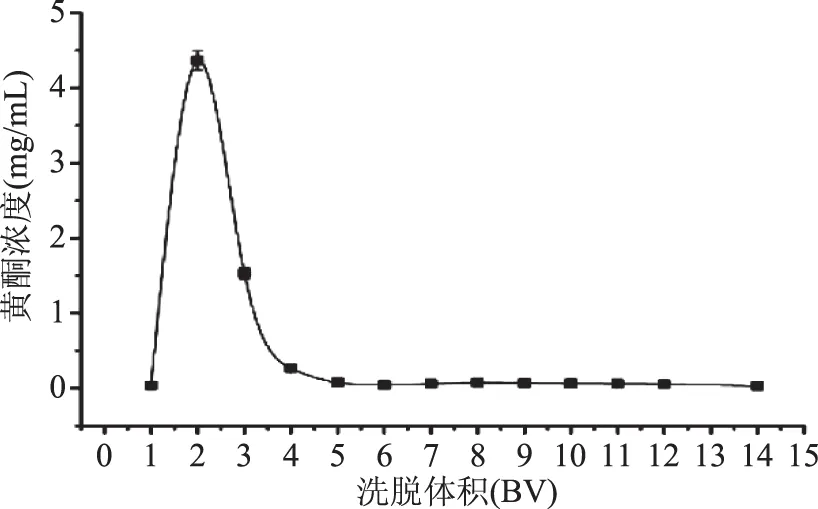
图8 AB-8大孔树脂对脐橙全果黄酮的动态解吸曲线Fig.8 Dynamic desorption curve of the AB-8 resin
2.7 纯化前后伦晚脐橙残次果总黄酮的组成及含量
以6种黄酮单体制成混标,采用HPLC法对纯化前后提取物中的总黄酮进行分析。由图9可知,经过AB-8大孔树脂纯化后黄酮的组成并未发生明显改变。伦晚脐橙残次果总黄酮提取物在纯化前,3~10 min内有较多杂峰,纯化后杂峰明显降低,且主要黄酮物质均被很好地保留,说明AB-8大孔树脂适用于伦晚脐橙残次果总黄酮的分离纯化。
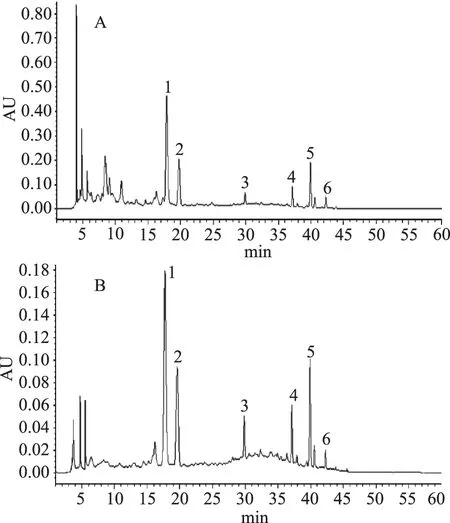
图9 AB-8树脂纯化前后脐橙全果提取物HPLC图谱Fig.9 HPLC chromatograms of lane late navelsfruit extract before and after AB-8 resin purification注:A纯化前;B纯化后;1-芸香柚皮苷;2-橙皮苷;3-香蜂草苷;4-甜橙黄酮;5-川陈皮素;6-橘皮素。
采用HPLC法对6种黄酮进行了定量分析,纯化前后的黄酮含量见表2。含量最高的是芸香柚皮苷、橙皮苷、甜橙黄酮,占总黄酮含量的91.27%。经大孔树脂AB-8纯化后,伦晚脐橙残次果提取物中总黄酮含量由纯化前36.04 mg/g增加到纯化后334.54 mg/g,纯度达到33.45%。唐巧玉[20]等利用大孔树脂纯化金橘果皮总黄酮,纯化后的总黄酮纯度可达38.2%,与本实验结果相近。石磊[9]等纯化芦柑果皮总黄酮后纯度达到51.6%,高于本实验的33.45%。这可能与材料本身有关,果实中的其他杂质影响了产物的纯度。
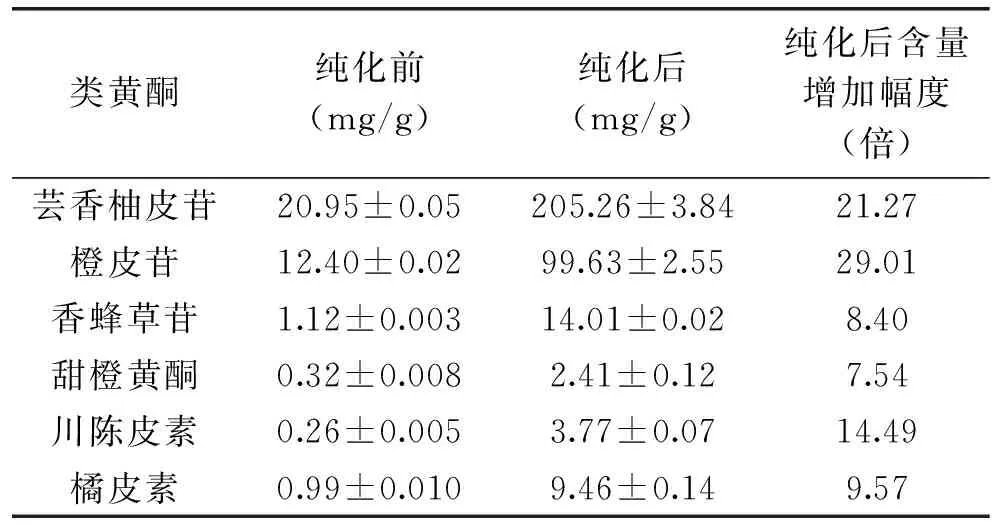
表2 AB-8纯化前后脐橙全果提取物中黄酮单体的种类与含量变化Table 2 Composition and content of flavonoids compounds of lane late navels before and after AB-8 resin purification
3 结论
通过对3种不同型号的大孔树脂进行筛选,确定AB-8更适合于伦晚脐橙残次果总黄酮的分离纯化。AB-8分离纯化伦晚脐橙残次果总黄酮提取物的最佳条件:上样液浓度0.75 mg/mL,pH=3的上样液以2 BV/h流速上样;采用80%乙醇作为洗脱剂,在2 BV/h流速下洗脱5 BV,解吸效果较好,解吸率达90.73%。经AB-8大孔树脂纯化后,黄酮组成没有发生改变,总黄酮含量达到334.54 mg/g,纯度从3.61%提高到33.45%,较纯化前提高了8.28倍。
由此可以得出,AB-8适合伦晚脐橙残次果总黄酮提取物的分离纯化,该纯化工艺简单、易操作,经该工艺处理后,伦晚脐橙残次果总黄酮纯度大大提高,对于解决残次果的资源浪费问题具有重大意义,其纯化最优条件对工业生产有一定参考价值。
[1]谢宗周,邓秀新,伊华林,等.晚熟脐橙新品种——伦晚脐橙的选育[J]. 果树学报,2011(4):733-734,548.
[2]黄林华,吴厚玖.我国水果副产物综合利用的研究及应用[J]. 食品安全质量检测学报,2015(11):4446-4452.
[3]丁晓波,张华,周志钦,等.柑橘果品营养学研究现状[J]. 园艺学报,2012(9):1687-1702.
[4]Huang Y S,Ho S C. Polymethoxy flavones are responsible for the anti-inflammatory activity of citrus fruit peel[J]. Food Chemistry,2010,119(3):868-873.
[5]陈嘉景,彭昭欣,石梅艳,等. 柑橘中类黄酮的组成与代谢研究进展[J]. 园艺学报,2016(2):384-400.
[6]Zhou D Y,Xing R,Xu Q,et al. Polymethoxylated flavones metabolites in rat plasma after the consumption of Fructusaurantii extract:Analysis by liquid chromatography/electrospray ion trap mass spectrometry[J]. Journal of Pharmaceutical and Biomedical Analysis,2008,46(3):543-549.
[7]Dong Y,Zhao M,Sun-Waterhouse D,et al. Absorption and desorption behaviour of the flavonoids fromGlycyrrhizaglabraL. leaf on macroporous adsorption resins[J]. Food Chemistry,2015,168:538-545.
[8]张旭,王锦玉,仝燕,等. 大孔树脂技术在中药提取纯化中的应用及展望[J]. 中国实验方剂学杂志,2012(6):286-290.
[9]汪洋,吴剑,曾凡坤,等. 大孔树脂纯化柑橘皮渣类黄酮的工艺研究[J]. 食品工业,2011(10):34-37.
[10]程灏旻,杨祖全,唐振洋,等. 大孔树脂对血橙皮中黄酮类化合物的纯化研究[J].广州化工,2015(4):62-63,89.
[11]张元梅,周志钦,叶兴乾,等. 高效液相色谱法同时测定柑橘果实中18种类黄酮的含量[J]. 中国农业科学,2012(17):3558-3565.
[12]豆浩然,倪健,夏振文,等.大孔树脂纯化展毛地椒总黄酮工艺研究[J]. 辽宁中医杂志,2015(9):1726-1729.
[13]骆党委,叶静,肖美添,等.AB-8大孔吸附树脂精制芦柑皮总黄酮及黄酮类化合物的分离[J]. 食品科学,2014(6):30-35.
[14]廖春燕,杨欣绿.D101型大孔树脂纯化鸡骨草总黄酮的工艺优选[J]. 中国实验方剂学杂志,2013(2):38-40.
[15]苗修港,余翔,梁峻彬,等. NKA-9大孔树脂纯化香椿叶黄酮类物质工艺优化[J]. 食品科学,2016(8):32-38.
[16]Bi Y G,Tan Y Q. Study on Macroporous Resin Separation and Purification of Total Flavonoids of Plantago Process[C]//Advanced Materials Research. Trans Tech Publications,2012,550:987-992.
[17]Zhao Z,Dong L,Wu Y,et al. Preliminary separation and purification of rutin and quercetin from Euonymus alatus(Thunb.)Siebold extracts by macroporous resins[J]. Food and Bioproducts Processing,2011,89(4):266-272.
[18]Zhang Y,Jiao J,Liu C,et al. Isolation and purification of four flavone C-glycosides from antioxidant of bamboo leaves by macroporous resin column chromatography and preparative high-performance liquid chromatography[J]. Food Chemistry,2008,107(3):1326-1336.
[19]童鑫,张瑞芬,张名位,等. 米糠酚类物质的大孔树脂分离纯化工艺[J]. 中国农业科学,2016(19):3818-3830.
[20]唐巧玉,周毅峰,阎婷. HPD300大孔树脂纯化金橘皮黄酮类化合物的工艺研究[J]. 食品科学,2008(8):355-358.
SeparationandpurificationoftotalflavonoidsfromlanelatenavelorangebyAB-8macroporousresins
NIEChao1,ZHAOZi-yan1,XUXiao-dan1,ZHOUZhi-qin1,2,*
(1.College of Horticulture and Landscape Architecture,Southwest University,Chongqing 400716,China;2.Key Laboratory of Horticulture Science for Southern Mountainous Regions,Ministry of Education,Chongqing 400715,China)
TS202.1
B
1002-0306(2017)18-0221-06
2017-02-28
聂超(1993-),男,硕士研究生,研究方向:果品营养与质量安全,E-mail:niechao@email.swu.edu.cn。
*通讯作者:周志钦(1964-),男,博士,教授,研究方向:果品营养与质量安全,E-mail:zzqswu@yahoo.com。
重庆市现代特色效益农业技术体系创新项目(20174-4)。
10.13386/j.issn1002-0306.2017.18.042
