罗非鱼-豆粕共沉淀蛋白的提取工艺及蛋白组成分析
2017-10-16,,,,
,,, ,
(广东海洋大学食品科技学院,广东省水产品加工与安全重点实验室,水产品深加工广东普通高等学校重点实验室,广东湛江 524088)
罗非鱼-豆粕共沉淀蛋白的提取工艺及蛋白组成分析
齐慧红,周春霞*,朱潘红,李婷,洪鹏志
(广东海洋大学食品科技学院,广东省水产品加工与安全重点实验室,水产品深加工广东普通高等学校重点实验室,广东湛江524088)
以罗非鱼肉和脱脂豆粕为原料,采用pH调节法制备罗非鱼-大豆共沉淀蛋白(Co-p),探讨溶解pH、不同质量比混合的原料、溶解时间对可溶性蛋白得率的影响及沉淀pH对蛋白沉淀得率的影响。结果表明,pH调节法回收罗非鱼-豆粕共沉淀蛋白的最佳酸溶pH2.0、3.0,碱溶pH11.0、12.0,原料比1∶1,溶解时间30 min;SDS-PAGE分析显示,可溶性共沉淀蛋白条带深/浅(极端pH2.0蛋白降解),表明可溶性蛋白含量高/低,从分子量分布范围可知,共沉淀蛋白主要由肌球蛋白重链、7 S抗原蛋白的三个亚基、肌动蛋白、肌球蛋白轻链、11 S抗原蛋白的两个亚基和小分子水溶性蛋白组成,表示可溶性共沉淀蛋白组成齐全;酸/碱可溶性共沉淀蛋白最佳沉淀pH为4.5,在此条件下,溶解、沉淀过程的蛋白得率分别为88.05%~94.70%。经冷冻干燥得到共沉淀蛋白粉即Co-p(1∶1),其蛋白含量高于85%,脂肪含量在0.84%左右,灰分含量低于4.17%;可用pH调节法回收罗非鱼-豆粕共沉淀蛋白。
罗非鱼肉,脱脂豆粕,共沉淀蛋白,蛋白得率
Abstract:Co-precipitation protein was prepared from Tilapia muscle and defatted soybean meal by pH-shifting. Effect of pH value,mixing ratios of tilapia to defatted soybean meal,dissolving time on soluble protein yield was determined in the extraction process. And then effect of pH value on precipitated protein yield was examined as well. The results showed that the solubility of co-precipitation protein was best under the conditions of dissolution that the optimal pH value was 2.0,3.0,11.0,and 12.0,the tilapia to defatted soybean meal 1∶1,and the dissolving time of 30 min. The SDS-PAGE results showed that soluble co-precipitation protein bands of deep/shallow showed that the content of soluble co-precipitation protein of high/low(protein degradation at pH2.0). According to the distribution of molecular weight,it was found that the co-precipitation protein consisted mainly of myosin heavy chain,actin,myosin light chain,small molecule water soluble protein,three subunits of the antigen protein of 7 S and two subunits of the antigen protein of 11 S,which showed that the composition of soluble co-precipitation protein was complete. The precipitation condition of soluble co-precipitation protein was pH4.5. In the above four conditions,the recovered protein yields from tilapia muscle and soybean meal were 88.05%~94.70% by acid/alkaline solubilization and precipitation processing. The co-precipitated protein powder,Co-p(1∶1),was obtained by freeze-drying. The protein content was above 85%,the fat content was about 0.84%,and the ash content was less than 4.17%. The use of pH-shifting method was beneficial for the recovery of co-precipitated protein.
Keywords:tilapia muscle;defatted soybean meal;co-precipitate protein;protein yield
共沉淀蛋白(Co-precipitates protein,Co-p)是指采用等电点沉淀、酸-热沉淀、或酸-热诱导并辅以沉淀剂如CaCl2等方法,从一种或者多种原料中得到的一种混合蛋白[1],其提取工艺和其功能特性的研究,国外研究文献报道较多,主要分为三大类[1]:用酸-热诱导并辅以CaCl2制备乳制品共沉淀蛋白(乳清-酪蛋白共沉淀蛋白)[2]、等电点沉淀制备的植物共沉淀蛋白(大豆-花生共沉淀蛋白)[3]、酸-热沉淀法制备的乳植物共沉淀蛋白(乳清-大豆共沉淀蛋白)[4]。不同来源的蛋白质制备的共沉淀蛋白,不仅在营养上可以实现氨基酸的互补[5],而且具有良好的功能特性[2-4]和理想的感官特性[1,6]。添加1%乳蛋白共沉淀的猪肉香肠与未添加的猪肉香肠相比有较好的乳化性和风味、多汁和较低的胆固醇含量[6];等电点沉淀法制备的鹰嘴豆-芝麻共沉淀蛋白与单个分离蛋白相比较,有较高的营养价值、较好的功能特性(如乳化性、持水性、发泡性等)和较好的必需氨基酸组成,含有较低水平的抗营养因子,且易于人体消化吸收[5];用酸热沉淀法制备的乳清-大豆共沉淀蛋白,其凝胶性和持水性均优于两种分离蛋白[4];牛乳与大豆组成的双蛋白发挥各自的生理调节功效,且有混合消化吸收效率,混合蛋白与单一乳清蛋白相比,能够持续性的激活mTORC1信号通路,有助于运动后肌肉蛋白的合成,从而改善人体肌肉健康[7]。
因此,共沉淀蛋白在食品工业中有巨大的潜在应用。本研究结合罗非鱼蛋白(fish protein isolate,FPI)的营养优势[8]和大豆蛋白(soybean protein isolate,SPI)的功能特性优势[9],以罗非鱼肉和脱脂豆粕为原料,用pH调节法制备共沉淀蛋白,开发新型“双蛋白”制品,扩大优质动物蛋白和优质植物蛋白相结合的健康型食品的应用范围。
1 材料与方法
1.1 材料与仪器
低温脱脂豆粕(粗蛋白含量43.75%±0.06%) 购于湖北荆州三菱湖小渔村生产,在实验室经万能粉碎机粉碎后过100目筛备用;罗非鱼(粗蛋白含量15.76%±0.23%) 购于湛江水产市场,鲜活迅速运回实验室,取背部白肉,绞碎后分装(500 g/袋),于-20 ℃冷冻备用;试剂 均为分析纯。
PHSJ-4A型数显pH计 上海雷磁仪器厂;JJ-1型电动搅拌器 江苏省金坛市环宇科学仪器厂;Avanti J-26sxp高效离心机 美国Beckman公司;ECP3000电泳仪、DYCZ-24DN双垂直电泳槽 北京六一仪器厂;UVP凝胶成像系统 美国UVP公司;VAP-450凯氏定氮消化炉、凯氏定氮蒸馏器 德国Gerhardf公司;FDU-1100真空冷冻干燥机 日本托普仪器有限公司。
1.2 实验方法
1.2.1 罗非鱼-豆粕共沉淀蛋白制备工艺 罗非鱼鱼肉(实验之前取样,室温解冻)和脱脂豆粕粉以不同的质量比混合(干基计)→加冰蒸馏水[物料∶水=1∶9 (g∶mL)]→均质2 min→调pH→室温溶解一定的时间→离心(10000 r/min,20 min,4 ℃)→过滤→上清液→调pH使其沉淀→离心(10000 r/min,20 min,4 ℃)→沉淀加少量冰水分散,调pH7.0→真空冷冻干燥(开启制冷开关,待温度降至-30 ℃以下之后,放置样品,开启真空泵,真空降至10 Pa以下)→Co-p→真空包装-20 ℃保存备用。
1.2.2 罗非鱼-豆粕共沉淀蛋白溶解曲线实验 按照上述制备工艺流程,罗非鱼鱼肉和脱脂豆粕粉分别按1∶1、1∶2和2∶1的质量比混合(干基计),以不添加脱脂豆粕粉(1∶0)和不添加罗非鱼肉(0∶1)为对照组,固定溶解时间30 min,调pH为2~12(变化区间为0.5或者1个pH单位),离心后收集上清液即为可溶性鱼肉蛋白、大豆蛋白和共沉淀蛋白,采用自动凯氏定氮法[10]测定上清液和原料中的粗蛋白含量(N×6.25),计算公式如下:
溶解得率(%)=上清液中粗蛋白含量(g)/所用原料中粗蛋白的含量(g)×100
式(1)
1.2.3 SDS-PAGE电泳 对不同pH和原料比溶解条件下(见1.2.2)的可溶性蛋白上清液进行SDS-PAGE电泳分析。SDS-PAGE电泳采用分离胶浓度为12%、浓缩胶浓度为5%[11]的变性聚丙烯酰胺凝胶进行还原电泳。样品上清液与SDS-PAGE上样缓冲液相混合(4∶1,v/v),加入电泳槽之前煮沸6 min,等体积即上样体积均为10 μL,用R-250考马斯亮蓝进行染色,脱色采用高甲醇的醋酸溶液,即加75 mL的醋酸,50 mL甲醇,然后用水定容至1 L。
1.2.4 罗非鱼-豆粕共沉淀蛋白溶解时间实验 在最适酸溶pH2.0、3.0和碱溶pH11.0、12.0条件下,罗非鱼鱼肉和脱脂豆粕粉分别按1∶1、1∶2和2∶1的质量比混合(干基计),考察溶解时间(10~60 min)对蛋白得率的影响。离心后收集上清液,采用自动凯氏定氮法(N×6.25)[10]测定样品中粗蛋白含量,计算参考公式(1)。
1.2.5 罗非鱼-豆粕共沉淀蛋白沉淀pH实验 罗非鱼鱼肉和脱脂豆粕粉分别按1∶1、1∶2和2∶1的质量比混合(干基计),在最适酸溶pH2.0、3.0和碱溶pH11.0、12.0,溶解30 min,制备罗非鱼-豆粕共沉淀蛋白,考察沉淀pH对可溶性共沉淀蛋白沉淀得率的影响。沉淀和可溶性蛋白中粗蛋白含量采用自动凯氏定氮法(N×6.25)[10]检测,计算公式如下:
沉淀得率(%)=沉淀中粗蛋白含量(g)/可溶性蛋白中粗蛋白的含量(g)×100
式(2)
1.2.6 基本成分的测定 水分的测定:直接干燥法GB/T5009.3-2010《食品中水分的测定》[12];粗蛋白的测定:自动凯氏定氮法GB/T5009.5-2010《食品中蛋白质的测定》[10];粗脂肪的测定:索氏抽提法GB/T14772-2008《食品中脂肪的测定》[13];灰分的测定:干法灰化法GB/T5009.4-2010《食品中灰分的测定》[14]。
1.2.7 数据分析 采用SPSS 13.0软件,以p<0.05为差异进行显著性分析。
2 结果与分析
2.1 罗非鱼-豆粕共沉淀蛋白溶解条件的确定
2.1.1 罗非鱼-豆粕共沉淀蛋白溶解曲线的确定 不同pH和原料比对可溶性蛋白溶解性的影响,如图1所示。在实验范围内,可溶性鱼肉蛋白、大豆蛋白及共沉淀蛋白溶解性随pH的变化趋势基本一致,溶解曲线均呈现U型,类似于罗非鱼和大豆[15]、大豆[16]、鱿鱼[17]的溶解曲线。1∶1制备的可溶性蛋白在pH4.5~5.5范围内,可溶性蛋白溶解得率最低,主要是在等电点pH范围内,蛋白质分子表面净电荷几乎为零,分子间的静电斥力消失,水合作用最弱,分子容易聚集沉淀,溶解度降低[18]。偏离等电点的酸性和碱性pH范围内,可溶性蛋白得率呈现上升趋势,且在极端酸碱pH2.0、3.0、11.0、12.0条件下得率达到最大。这是因为酸性条件下,由于天门冬氨酸和谷氨酸的残基的支链羧基所带的负电荷被中和,所以蛋白分子带有净正电荷;碱性条件下,部分氨基酸的碱性基团,如精氨酸和赖氨酸的支链胍基或者氨基等发生了去质子化反应,导致蛋白分子带有净负电荷,蛋白与水分子作用增加,蛋白溶解性也增大[19]。另外,在其他条件相同时,不同质量比混合得到的可溶性蛋白的溶解得率也不完全相同,在酸性范围内,如极端pH2.0和3.0时,可溶性鱼肉蛋白的溶解得率最高,在73%左右,其次分别是罗非鱼肉和脱脂豆粕粉以质量比(干基计)2∶1、1∶1和1∶2制备的可溶性共沉淀蛋白,但其溶解得率均低于70%;而在碱性范围内,如极端pH11.0和12.0时,2∶1制备的可溶性共沉淀蛋白的溶解得率在70%以上,可溶性鱼肉蛋白与1∶1、1∶2制备的可溶性共沉淀蛋白溶解得率差异不大,溶解得率均在67%左右,可能是在酸性范围内,鱼肉蛋白的水合作用占主导地位,在碱性范围内,则是大豆蛋白的水合作用占优势,以及鱼肉蛋白与大豆蛋白的相互作用;由此设定进一步研究的最适酸溶pH为2.0和3.0,碱溶pH为11.0和12.0,沉淀pH范围为4.5~5.5。
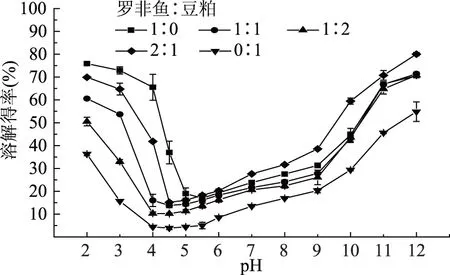
图1 pH和原料比对可溶性蛋白溶解得率的影响Fig.1 Effect of pH value and raw material ratio on the solubility of soluble protein
2.1.2 罗非鱼-豆粕共沉淀蛋白的电泳分析 上述各pH和原料比条件下提取的可溶性蛋白上清液,(等体积)进行SDS-PAGE电泳分析,结果见图2。对于溶解得率较低的pH范围,电泳结果显示的只有轻链条带,未见重链,蛋白条带颜色较浅,说明在等电点范围内,可溶性蛋白的溶解性比较低。在极端酸性条件(pH2.0)伴随肌球蛋白重链发生降解[20],小分子蛋白有所形成。极端酸性pH3.0(除大豆蛋白)和极端碱性pH11.0、12.0处理下得到的电泳图谱的蛋白条带颜色较深,表明可溶性蛋白含量较高,这与图1可溶性鱼肉蛋白、大豆蛋白及不同共沉淀蛋白的溶解曲线相符合。
可溶性鱼肉蛋白电泳图谱显示,分子量在200~6.5 kDa范围内是连续分布的,且在200、44.3、20.1、6.5 kDa处均出现比较明显的蛋白条带,分别对应肌球蛋白重链、肌动蛋白、肌球蛋白轻链和小分子水溶性蛋白,类似于不同pH条件下可溶性鱼肉蛋白的电泳图谱[18]。由图1可知,可溶性大豆蛋白在碱性条件下较酸性溶解性好,碱性范围大豆蛋白主要由大豆球蛋白(11 S球蛋白)和β-大豆伴球蛋白(7 S球蛋白)组成,可溶性大豆蛋白电泳图谱也显示,在pH11.0~12.0之间,蛋白条带颜色较深,溶解性较好。分子量约为71、67、50 kDa分别对应着大豆蛋白中7 S抗原蛋白的三个亚基,分子量约为32、20 kDa分别对应着大豆蛋白中11 S抗原蛋白的两个亚基。可溶性共沉淀蛋白电泳图谱与鱼肉蛋白和大豆蛋白电泳图谱不完全相同,SDS-PAGE电泳图谱显示其蛋白组成齐全,共沉淀蛋白主要由肌球蛋白重链、7 S抗原蛋白的三个亚基、肌动蛋白、肌球蛋白轻链、11 S抗原蛋白的两个亚基和小分子水溶性蛋白组成,且共沉淀蛋白对鱼肉蛋白的肌动蛋白和大豆蛋白的7 S抗原蛋白有一定的降解,还出现了其他的杂蛋白组分,可能是制备共沉淀蛋白时,两种蛋白相互作用形成新的蛋白。由此进一步表明可溶性蛋白的最适酸溶pH为2.0和3.0,碱溶pH为11.0和12.0,而最佳沉淀pH范围在4.0~6.0。
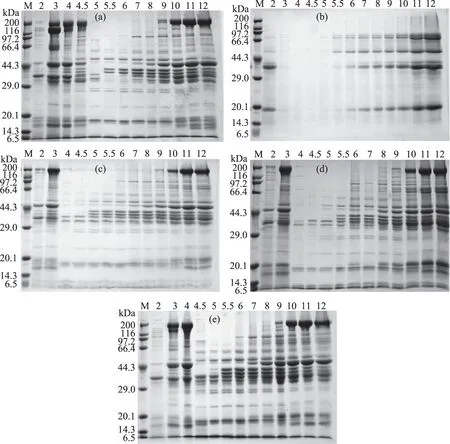
图2 不同pH和原料比下可溶性蛋白的SDS-PAGE图Fig.2 SDS-PAGE patterns of soluble proteins with different pH values and raw materials注:(a)、(b)、(c)、(d)、(e)分别表示可溶性鱼肉蛋白、大豆蛋白和原料比1∶1、1∶2、2∶1可溶性共沉淀蛋白的电泳图谱。
2.1.3 罗非鱼-豆粕共沉淀蛋白溶解时间的确定 罗非鱼与脱脂豆粕以不同质量比混合,在pH2.0、3.0、11.0、12.0室温溶解,实验溶解时间(10~60 min)对可溶性蛋白溶解得率的影响,结果如图3所示。随着溶解时间的延长,可溶性蛋白的溶解得率也略有增大;但不同pH条件下的大豆蛋白的溶解得率变化较大(p<0.05),且pH12.0时溶解30 min的蛋白溶解得率最高为55.28%左右;而不同pH条件下的鱼肉蛋白的溶解得率有所差异,且pH12.0时溶解60 min的蛋白得率最高为83.36%左右;相同时间,可溶性蛋白在碱性条件下的溶解得率高于酸性条件,表明pH对可溶性蛋白的溶解影响作用较明显。另外,在相同时间内不同质量比混合提取的可溶性共沉淀蛋白的溶解得率也有差别。在不同pH,30 min溶解时,1∶1制备的可溶性共沉淀蛋白的溶解得率为54.57%~76.85%,与鱼肉蛋白的蛋白溶解得率(66.97%~78.20%)较接近,而2∶1制备的可溶性共沉淀蛋白的溶解得率高于可溶性鱼肉蛋白,可能是由于增加了一倍的鱼肉才导致蛋白的溶解得率较高,但这会导致购买的原料及费用增加。可溶性蛋白在极端酸性/碱性条件下的溶解及相应蛋白质分子的化学展开是在瞬间进行的[18],进一步说明pH及不同质量比混合的原料对可溶性蛋白溶解过程影响最明显。考虑到溶解时间太短,大豆蛋白的溶出得率较低[21],时间太长,可溶性蛋白的水解程度变大,因此为了尽可能的避免可溶性共沉淀蛋白的水解变性,设定溶解时间为30 min。

图3 溶解时间对可溶性蛋白溶解得率的影响Fig.3 Effect of extraction time on the solubility of soluble protein注:(a)、(b)、(c)、(d)、(e)分别表示不同溶解时间下可溶性鱼肉蛋白、大豆蛋白、2∶1、1∶1及1∶2制备的可溶性共沉淀蛋白的溶解得率,每张图的字母表示不同pH和不同时间下的所有溶解得率的显著性差异,不同的字母表示差异显著(p<0.05)。

表1 不同原料蛋白粉的基本成分(%)Table 1 Basic ingredients of different raw protein powder(%)
注:同列不同的字母表示差异显著(p<0.05)。
2.2 罗非鱼-豆粕共沉淀蛋白沉淀pH的确定
在最适酸溶pH2.0和3.0,碱溶pH11.0和12.0,溶解30 min,罗非鱼和脱脂豆粕分别按1∶1、1∶2和2∶1的质量比混合(干基计)提取酸/碱可溶性共沉淀蛋白,结合上述溶解曲线,考查pH4.5~5.5范围内可溶性共沉淀蛋白的沉淀得率,结果如图4所示。由图4可知,在实验pH范围内,三种可溶性共沉淀蛋白溶液在pH4.5~5.5沉淀,其沉淀蛋白的得率均在79.63%以上,原料比1∶1提取的可溶性蛋白溶液在pH2.0、3.0、11.0和12.0溶解,pH4.5沉淀时,沉淀得率分别达到88.05%、89.25%、94.70%、94.01%,且三种不同原料比得到的可溶性蛋白液,均在pH4.5沉淀时的得率高于pH5.0和pH5.5的沉淀得率,由此表明酸/碱可溶性共沉淀蛋白的最适等电点为4.5。乳清-大豆共沉淀蛋白的最大得率是在40 ℃条件下提取,并在pH4.5、98 ℃沉淀[4],而对于植物蛋白酸沉等电点pH一般相对较低[22]。有可能罗非鱼与豆粕混合后,酸沉等电点的pH偏向于豆粕的等电点。
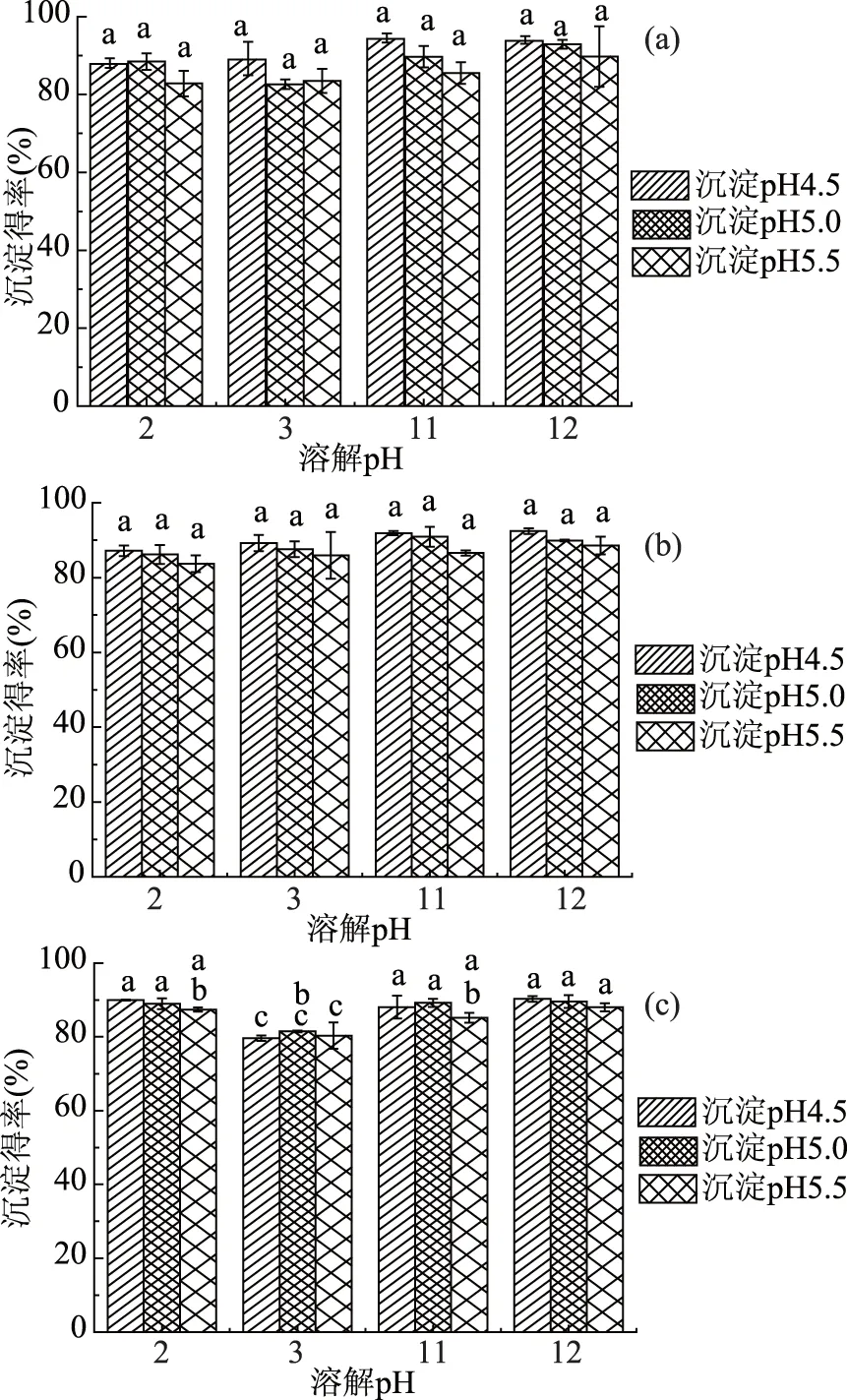
图4 沉淀pH对酸/碱可溶性共沉淀蛋白沉淀得率的影响Fig.4 Effect of pH value on precipitating yield of acid/alkali-soluble co-precipitates protein注:(a)、(b)、(c)分别表示1∶1、2∶1及1∶2制备的可溶性共沉淀蛋白的沉淀得率,每张图的字母表示不同溶解pH和不同沉淀pH下的所有沉淀得率的显著性差异,不同的字母表示差异显著(p<0.05)。
2.3 不同原料比制备的分离蛋白粉基本成分分析
在图1溶解曲线的基础上,选取极端酸碱(pH2.0、12.0)条件下可溶性蛋白溶解得率差异比较大的几种可溶性蛋白,然后可溶性鱼肉蛋白(沉淀pH5.5)、大豆蛋白(沉淀pH4.5)[23]、共沉淀蛋白(沉淀pH4.5)在各自等电点沉淀,经冷冻干燥得到罗非鱼分离蛋白粉(FPI)、大豆分离蛋白粉(SPI)及共沉淀蛋白粉(Co-p)。Co-p、FPI、SPI的基本成分见表1。由表1可知,各分离蛋白粉粗蛋白含量比较高,均大于83.94%。与FPI和SPI粗蛋白含量相比,罗非鱼与脱脂豆粕以质量比2∶1混合,pH12.0溶解,pH4.5沉淀制备的Co-P(2∶1)的粗蛋白含量最高(89.55%);其次是pH2.0溶解,pH4.5沉淀制备的Co-P(1∶1),为88.05%,两者无显著性差异(p>0.05)。各蛋白粉样品的粗脂肪均低于1.06%,且碱溶酸沉脂肪含量低于酸溶酸沉含量。另外,不同分离蛋白粉的灰分含量均低于6.73%,且Co-P(1∶2)和Co-P(2∶1)的灰分含量高于Co-P(1∶1),表明原料按1∶1采用pH调节法得到的共沉淀蛋白粉可以有效除去罗非鱼肉和脱脂豆粕粉中含有的Mg、Fe等盐类和其他不容性杂质。总体而言,经冷冻干燥得到共沉淀蛋白粉即Co-p(1∶1),其蛋白含量均在85%以上,脂肪含量在0.84%左右,灰分含量低于4.17%;考虑到原料的费用及粗蛋白含量,选取原料1∶1制备共沉淀蛋白更为合理,所得蛋白粉的蛋白含量较高,适于做蛋白功能性质的研究。
3 结论
采用pH调节法制备罗非鱼-豆粕共沉淀蛋白的最佳溶解条件为罗非鱼肉与脱脂豆粕以原料比1∶1混合(干基计),最适酸溶pH为2.0和3.0,碱溶pH为11.0和12.0,溶解时间30 min;SDS-PAGE分析显示,可溶性共沉淀蛋白条带深/浅(极端pH2.0蛋白降解),表明可溶性蛋白含量高/低,共沉淀蛋白主要由肌球蛋白重链、7 S抗原蛋白的三个亚基、肌动蛋白、肌球蛋白轻链、11 S抗原蛋白的两个亚基和小分子水溶性蛋白组成,表示可溶性共沉淀蛋白组成齐全;酸/碱可溶性共沉淀蛋白的最佳沉淀条件为pH4.5,在此条件下,溶解、沉淀过程的蛋白得率分别为88.05%、89.25%、94.70%和94.01%;经pH2.0、4.5、pH12.0、4.5冷冻干燥得到Co-p(1∶1),蛋白含量均在85%以上,脂肪含量在0.84%左右,灰分含量低于4.17%。因此,采用pH调节法更适于回收罗非鱼-豆粕共沉淀蛋白。
[1]Alu’datt M H,Al-Rabadib G J,Alli I,et al. Protein co-precipitates:A review of their preparation and functional properties[J]. Food and Bioproducts Processing,2013,91(4):327-335.
[2]Al-saadi J M S,Deeth H C. Preparation and functional properties of protein coprecipitate from sheep milk[J]. International Journal of Dairy Technology,2011,64(4):461-466.
[3]Hagan R C,Dahl S R,Villota R. Texturization of Co-Precipitated Soybean and Peanut Proteins by Twin-Screw Extrusion[J]. Journal of Food Science,1986,51(2):367-370.
[4]Alu’datt M H,Alli I,Nagadi M. Preparation,characterization and properties of whey-soy proteins co-precipitates[J]. Food Chemistry,2012,134(1):294-300.
[5]Youssef A M,Abu-Foul N S,Moharram Y G. Preparation and characteristics of coprecipitate proteins from oilseeds and legumes seeds[J]. Food,1995,39(5-6):475-482.
[6]Eswarapragada N M,Reddy P M,Prabhakar K. Quality of low fat pork sausage containing milk-co-precipitate[J]. Journal of Food Science and Technology,2010,47(5):571-573.
[7]任广旭,伊素芹,卢林纲,等. “牛乳与大豆”双蛋白运动营养功能的研究进展[J]. 中国食品学报,2015,15(6):154-161.
[8]李来好,郝淑贤,魏涯,等. 2种养殖模式罗非鱼肉品质的比较[J].南方水产科学,2013,9(5):1-6.
[9]Nishinari K,Fang Y,Guo S,et al. Soy proteins:A review on composition,aggregation and emulsification[J]. Food Hydrocolloids,2014,39:301-318.
[10]中华人民共和国卫生部 中国国家标准化管理委员会. GB/T 5009.5-2010食品中蛋白质的测定[S]. 北京:中国标准出版社,2010.
[11]郑惠娜,张晶晶,周春霞,等. pH调节法提取牡蛎蛋白及氨基酸、蛋白组成分析[J].中国食品学报,2014,14(7):231-235.
[12]中华人民共和国卫生部 中国国家标准化管理委员会. GB/T 5009.3-2010食品中水分的测定[S].北京:中国标准出版社,2010.
[13]中华人民共和国卫生部 中国国家标准化管理委员会. GB/T 14772-2008食品中脂肪的测定[S]. 北京:中国标准出版社,2008.
[14]中华人民共和国卫生部 中国国家标准化管理委员会. GB 5009.4-2010食品中灰分的测定[S]. 北京:中国标准出版社,2010.
[15]Foh M B K,Xia W S,Amadou I,et al. Influence of pH Shift on Functional Properties of Protein Isolated of Tilapia(Oreochromisniloticus)Muscles and of Soy Protein Isolate[J]. Food and Bioprocess Technology,2012,5(6):2192-2200.
[16]王中江,江连洲,魏冬旭,等. pH对大豆分离蛋白构象及表面疏水性的影响[J]. 食品科学,2012,33(11):47-51.
[17]Palafox H,Co’rdova-Murueta J H,Navarrete del Toro M A,et al. Protein isolates from jumbo squid(Dosidicusgigas)by pH-shift processing[J]. Process Biochemistry,2009,44(5):584-587.
[18]刘诗长. 罗非鱼分离蛋白的制备及其性质研究[D]. 湛江:广东海洋大学,2011.
[19]洪伟. pH调节诱导鳄蛇鲻肌球蛋白分子展开/折叠行为的研究[D]. 湛江:广东海洋大学,2014.
[20]孙月娥,王卫东,付湘晋. 酸碱法提取鲢鱼肌肉蛋白的凝胶特性[J]. 食品科学,2012,33(6):123-126.
[21]Zhang Y,Yang R,Zhang W,et al. Structural characterization and physicochemical properties of protein extracted from soybean meal assisted by steam flash-explosion with dilute acid soaking[J]. Food Chemistry,2017,219:48-53.
[22]Wong A,Pitts K,Jayasena V,et al. Isolation and foaming functionality of acid-soluble protein from lupin(Lupinusangustifolius)kernels[J]. Journal of the Science of Food and Agriculture,2013,93(15):3755-3762.
[23]代振清,张梦霞,郑惠娜,等. 罗非鱼蛋白-大豆蛋白共沉淀物的乳化性[J]. 食品与发酵工业,2015,41(2):63-69.
Extractionprocessandcompositionanalysisofco-precipitatedproteinfromtilapiamuscleandsoybeanmeal
QIHui-hong,ZHOUChun-xia*,ZHUPan-hong,LITing,HONGPeng-zhi
(College of Food Science and Technology,Guangdong Ocean University,Guangdong Provincial Key Laboratory of Aquatic Product Processing and Safety,Key Laboratory of Advanced Processing of Aquatic Products of Guangdong Higher Education Institution,Zhanjiang 524088,China)
TS201.1
B
1002-0306(2017)18-0201-06
2017-02-07
齐慧红(1992-),女,硕士研究生,研究方向:罗非鱼-豆粕共沉淀蛋白,E-mail:13078279613@163.com。
*通讯作者:周春霞(1979-),女,博士,副教授,研究方向:水产品加工与贮藏,E-mail:chunxia.zhou@163.com。
广东省科技计划项目(2015A020209168)。
10.13386/j.issn1002-0306.2017.18.038
