响应面法优化莲子多糖提取工艺的研究
2017-10-16,,,,,
,, ,,,
(福建农林大学食品科学学院,福建福州 350002)
响应面法优化莲子多糖提取工艺的研究
陈钏杰,陈培琳,陈丽,郑宝东,曾红亮*,张怡*
(福建农林大学食品科学学院,福建福州350002)
为优化莲子多糖的提取工艺,以热水浸提方法,考察浸提温度、浸提时间、液料比三因素对莲子多糖得率的影响,在此基础上,设计响应面法Box-Benhnken中心组合实验,对莲子多糖热水浸提工艺进行优化,得到莲子多糖热水浸提的最佳提取条件:浸提温度为83 ℃、浸提时间为3 h、液料比为30∶1 mL/g,莲子多糖得率为8.13%±0.04%,与理论预测值基本一致(相差百分比小于1%),响应面法能较好地应用在莲子多糖热水浸提工艺中。采用环境扫描电镜观察和分析浸提前后莲子粉末的微观形态,结果显示:经热水浸提,莲子细胞完整性被破坏,粉末呈大小不一的片状,且表面粗糙,呈不规则裂痕及沟壑状纹路,浸提前后莲子粉末微观结构差异明显。可见,所采用的热水浸提工艺能较好地将莲子细胞及细胞壁中可溶性多糖浸提出来。
莲子,多糖,热水浸提,响应面法,环境扫描电镜
Abstract:In order to obtain the best condition of hot water extraction of lotus seed polysaccharides,the effects of three single factors(extraction temperature,extraction time,ratio of water volume to raw material weight(w/m ratio))on the yield of lotus seed polysaccharides were investigated. Based on the data of single factor experiments,the optimal extraction technology of lotus seed polysaccharides was obtained by response surface methodology was as follows.:extraction temperature was 83 ℃,extraction time was 3 h,the ratio of water volume to raw material weight(w/m)was 30∶1 mL/g. Under these conditions,the yield of polysaccharides was 8.13%±0.04%,which was consistent with the theoretical prediction value(difference value lower than 1%). Moreover,the microstructure of lotus seed powder before extraction and after extraction were observed and compared by environmental scanning electron microscopy. The results showed that:the whole cells of lotus seed powder were destroyed after hot-water extraction. The powder was different sizes,and its surface displayed schistose shapes,rough and irregular cracks. The microstructure of lotus seed powder before and after extraction was significantly different. It indicated that the soluble polysaccharides could be extracted greatly from lotus seed powder using the optimized hot water extraction process.
Keywords:lotus seed;polysaccharide;hot water extraction;response surface methodology;environmental scanning electron microscopy
莲子为睡莲科植物莲(Nelumbonucifera)的干燥成熟种子。又名藕实、水芝丹、莲实、莲蓬子、莲肉,我国南北均有分布,是重要的经济作物。具有补脾止泻,止带,益肾涩精,养心安神之功效,是重要的经济作物[1]。现代研究表明,莲子中含有多种功效成分,包括多糖、总黄酮、多酚、低聚糖等[2]。其中,莲子水溶性多糖在提高免疫、改善肠道菌群、抗衰老等方面有明显功效[3-4]。
植物多糖分子量大,结构复杂。多糖由单糖通过各种键及分子间作用力连结而成,易因外界环境干扰而降解。植物体内的多糖根据存在部位可归纳为三类:细胞内多糖、细胞壁多糖和细胞外多糖。细胞内多糖一部分以颗粒状的淀粉粒存在,另一部分以溶液或高度水合状态存在于液泡中;细胞壁多糖主指半纤维素和果胶类;细胞外多糖主指树胶和粘胶等[5]。另外多糖在植物中的存在形式往往是与蛋白质、脂质等结合成多糖复合物,给多糖的提取分离带来了困难[6]。
目前,植物多糖提取主要有水提法、酸提法、碱提法、酶提法、超声波法、微波法等方法。其中,酸提法、碱提法需要在酸性或碱性条件下进行,需要加入化学试剂,不仅成本消耗相对较大,且若废液处理不当,可能会对环境造成破坏[7-8]。而在酶解法中,温度、pH、时间和底物量等都会影响酶的活性,条件过高或过低都会造成酶失活,加之酶制剂用量大且成本高,限制了大规模的应用[9]。在超声波法、微波法提取多糖过程中,若超声或微波作用的强度过大或者处理时间过长,则多糖结构可能受到破坏[10-11]。另外,由于超声波及微波本身的传播特性,作用强度随距离递减,使得作用强度分布不均匀,这使得在使用大直径设备提取过程中,近超声(微波)源范围多糖破坏率与远超声(微波)源范围多糖溶出率之间难以平衡[12-13]。而水提取[14]具有无需添加任何化学试剂、不污染环境、设备要求低、成本低等优点,适合大批量工业化生产。
为了尽可能充分地从莲子中提取出多糖,改善多糖提取工艺。本研究以莲子为原料,采用更适合工业化生产的水提法提取莲子多糖,优化其工艺参数,以期提高莲子多糖得率,为莲子多糖分离纯化、结构表征和功能活性等进一步研究提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
去心干莲 产于福建建宁;无水乙醇等试剂 分析纯;实验用水 二次蒸馏水。
RE-52A型旋转蒸发器 上海亚荣生化仪器厂;FZ102植物粉碎机 天津市泰斯特仪器有限公司;AL104型精密分析天平 梅特勒-托利多仪器(上海)有限公司;L530型台式低速离心机 长沙高新技术产业开发区湘仪离心机仪器有限公司;XL30 ESEM-TMP环境扫描电镜 荷兰Philips-FEI公司;丹瑞HH-6型数显恒温水浴锅 江苏省金坛市荣华仪器制造有限公司;101-1A 型数显电热鼓风恒温干燥箱 上海阳光实验仪器有限公司;LG-1.0型真空冷冻干燥机 新阳速冻设备制造有限公司;卤素快速水分测定仪 深圳市冠亚电子科技有限公司。
1.2 实验方法
1.2.1 样品前处理 取适量去心干莲子于植物粉碎机中粉碎1 min,倒出过40目筛,得莲子粉末样品。取5 g莲子粉末,置于卤素快速水分测定仪中测定粉末样品的水分含量,所制得莲子粉末的水分含量小于3%。
1.2.2 提取工艺流程 取定量1.2.1所制得莲子粉末样品于锥形瓶,加定量二次蒸馏水,置于预热后的水浴锅中水浴,样品浸提液离心(4000 r/min,20 min)得滤液,加入4倍体积的常温无水乙醇,室温下静置沉降20 h后,再次离心(4000 r/min,20 min)。弃上清液,取沉淀,用二次蒸馏水溶解沉淀后冷冻干燥,得莲子多糖(lotus seed polysaccharides,LSP),称重记录。
1.2.3 多糖得率的测定 将1.2.2中冷冻干燥后莲子多糖于分析天平上,测量重量,重复3次取平均值。
多糖得率计算公式如下:
式(1)
1.2.4 单因素实验 取5.00 g实验样品,以莲子多糖得率为指标,固定浸提时间为2.0 h,液料比为40∶1 mL/g,考察浸提温度为50、60、70、80、90、100 ℃对莲子多糖提取得率的影响;固定浸提温度为80 ℃,液料比40∶1 mL/g,考察浸提时间0.5、1.0、1.5、2.0、2.5、3.0、3.5 h对莲子多糖提取得率的影响;固定浸提时间为2.0 h,浸提温度为80 ℃,考察液料比为10∶1、20∶1、30∶1、40∶1、50∶1、60∶1、70∶1 mL/g对莲子多糖提取得率的影响。每次实验重复3次。
1.2.5 响应面实验 根据单因素实验结果,采用响应面分析法研究浸提温度、浸提时间和液料比对多糖得率的影响,计算得到二次回归方程,通过分析预测最佳工艺参数。各实验因素和水平见表1。
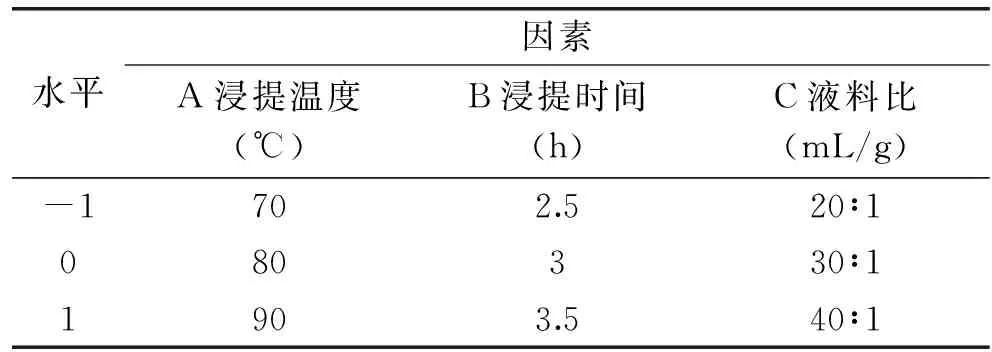
表1 中心组合设计的因素和水平表Table 1 Factors and levels table of Box-Behnken Design(BBD)
1.2.6 浸取前后莲子粉末形态观察 分别取一定量的提取前莲子粉末及提取后莲子粉末,将样品粘着于样品台上,置真空喷镀仪内镀导电层铂(Pt),厚度10 nm,采用扫描电镜观察,电子枪加速电压:5 keV。
1.2.7 数据处理 采用Design-Expert 8.0.6和SPSS 13.0软件对热水提取数据进行分析。SPSS分析方法采用单因素方差分析。
2 结果与分析
2.1 单因素实验
2.1.1 浸提温度对莲子多糖得率的影响 浸提温度对莲子多糖得率的影响如图1所示,在50~80 ℃之间,莲子多糖得率随着浸提温度的升高而增大;在80 ℃之后多糖得率随着浸提温度的升高而减小。这可能是因为50~80 ℃之间,随着温度的升高,浸提液的粘度降低,多糖分子扩散过程中阻力变小,分子运动速率加快,分子扩散系数增大,使此阶段多糖的溶出率升高[15];80 ℃之后,由于热作用程度增强,过高温度使较多多糖分子结构受到破坏,导致多糖得率降低[16]。因此,本实验所设定温度梯度中,选择80 ℃进行下一步的优化实验。
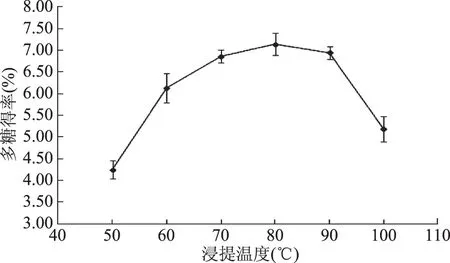
图1 浸提温度对莲子多糖得率的影响Fig.1 Effect of extraction temperature on the yield of LSPs
2.1.2 浸提时间对莲子多糖得率的影响 浸提时间对莲子多糖得率的影响如图2所示。0.5~3.0 h内,莲子多糖得率随浸提时间延长而增大;3.0~3.5 h内,多糖得率随浸提时间延长而下降。这可能是因为热水浸提过程中,热作用及细胞吸水膨胀导致细胞破裂,多糖溶出;浸提时间增加,细胞受破坏数量及程度随之增加,使细胞中多糖更易溶出,溶出量增加[17]。多糖受热时间过长,分子亦会降解,且程度及数量随受热时间延长而增加[18]。当降解速率快于溶出速率时,多糖得率则呈下降趋势。本实验所设定时间梯度中,选择3 h进行下一步的优化实验。
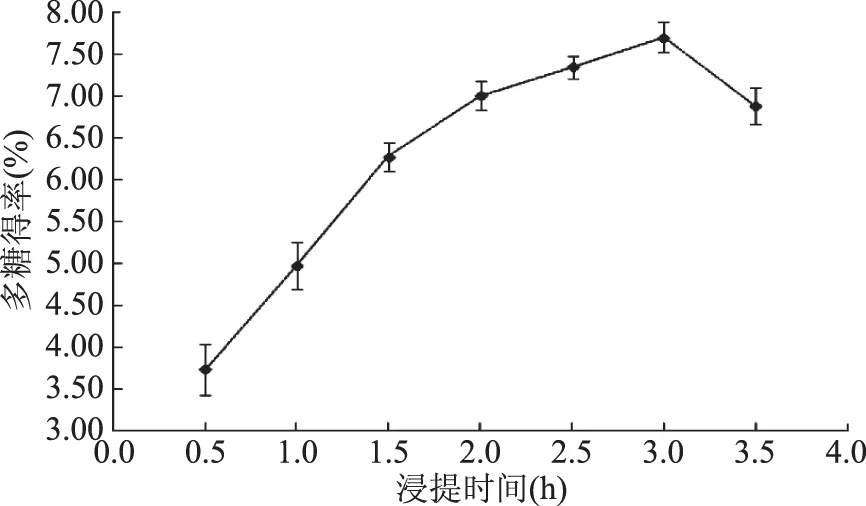
图2 浸提时间对莲子多糖得率的影响Fig.2 Effect of extraction time on the yield of LSPs
2.1.3 液料比对莲子多糖得率的影响 液料比对莲子多糖得率的影响如图3所示。莲子多糖得率在液料比在10∶1~30∶1 mL/g范围内随液料比增大而增大;当液料比在30∶1~70∶1 mL/g范围内,多糖得率随液料比增大而下降。这可能是因为液料比在10∶1~30∶1之间时,水量增多使得其能溶解的多糖量也随之变多,则多糖得率增高。料液比在30∶1~70∶1时,提取液整体处于较低浓度水平,溶液中的多糖较少。理论上多糖的溶出量将增多,实际上过多液料将对热传播造成一定的阻碍作用,热扩散距离增大使提取容器中心温度偏低,对多糖溶出不利[19]。另外一种原因可能是:本实验中多糖浸提后期需要通过旋转蒸发器进行加热浓缩,由于液料比的增加,加热浓缩的时间也需延长,导致多糖降解率增加,最终得率也会减少[20]。因此,本实验所设定液料比梯度中,选择30∶1 mL/g进行下一步的优化实验。

图3 液料比对莲子多糖得率的影响Fig.3 Effect of liquid/material ratio on the yield of LSPs
2.2 响应面实验设计和结果
根据单因素实验结果,选取A:浸提温度(℃)、B:浸提时间(h)和C:液料比(mL/g)为自变量,采用中心组合设计进行3因素3水平的实验设计,以莲子多糖得率(%)为响应值,进行响应面分析。
实验设计及结果见表2。实验1~12是析因实验点,实验13~19是中心实验点。

表2 实验设计和结果Table 2 Experimental design and results
各因素经二次多项式回归拟合后,得到莲子多糖得率对浸提温度、浸提时间和液料比3个因素的二次多项回归方程为:
Y=8.0371+0.3988A+0.4338B+0.6750C+0.1025AB-0.0950AC-0.1800BC-0.7434A2-1.0023B2-0.5348C2
式(2)
2.3 模型的建立及显著性分析
采用Design-Expert 8.0.6对表2中的实验数据进行多元回归拟合,对回归系数和回归模型进行方差分析,分析结果如表3所示。
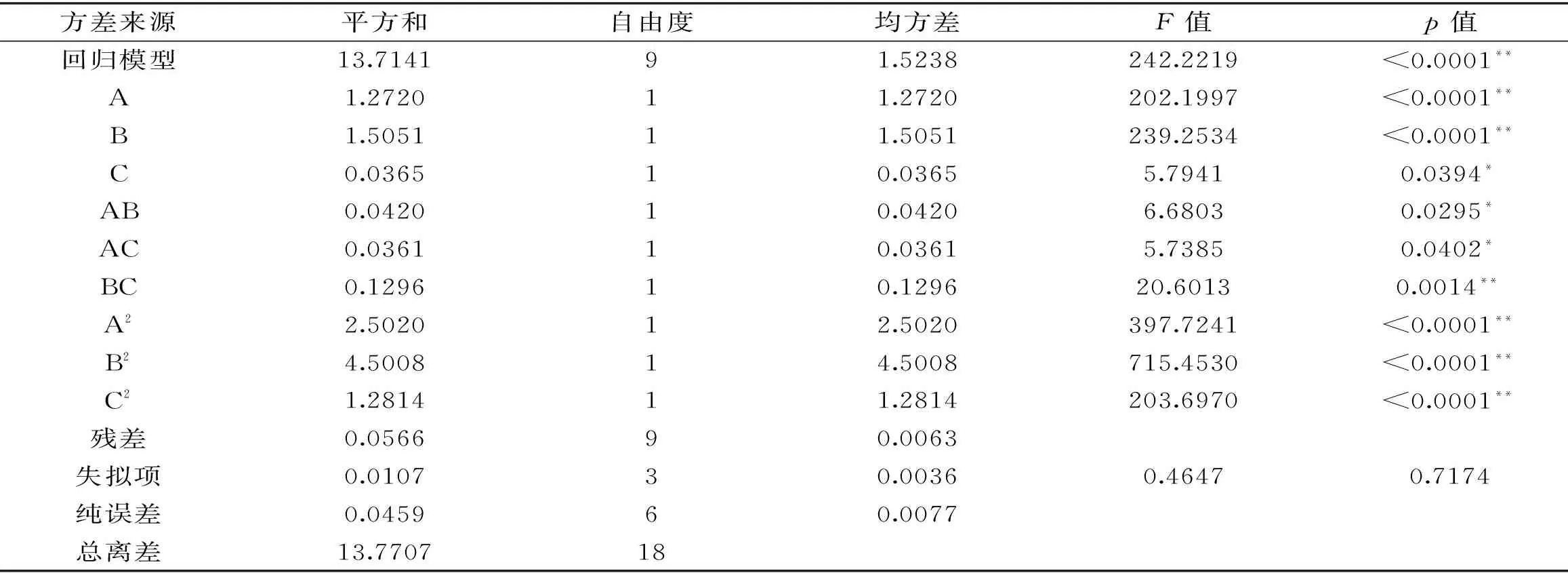
表3 方差分析表Table 3 The table of variance analysis
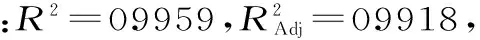
在一次项中,A和B对多糖得率的影响达到极显著水平;在交互项中,BC达到极显著水平;在二次项中,A2、B2和C2对多糖得率的影响达到极显著水平;在所选取的各因素水平范围内,各因素对莲子心多糖得率的影响程度依次为:浸提时间>浸提温度>液料比。
2.4 响应面分析
A、B和C二次项系数均为负值,方程表示的抛物面开口向下有极大值点。响应面3D图分析如下。
2.4.1 浸提温度和浸提时间交互作用对莲子多糖得率的影响 由图4可知,当液料比为30∶1 mL/g时,当浸提温度在70~95 ℃之间,浸提时间在1.7~2.9 h的范围内,莲子多糖的得率最高。浸提时间轴向等高线分布密集,说明在浸提多糖过程中,浸提时间对多糖得率的影响较浸提温度显著。

图4 浸提温度和浸提时间交互作用对多糖得率影响的响应面图Fig.4 Response surface of extraction temperature and time on the yield of polysaccharide
2.4.2 浸提温度和液料比交互作用对莲子多糖得率的影响 由图5可知,当浸提时间为3.0 h时,浸提温度在72.5~92.5 ℃之间,液料比在28∶1~52∶1 mL/g范围内,莲子多糖的得率最高。两个轴向上的等高线分布都较为稀疏,浸提温度轴向上的密度较液料比稍高,说明浸提温度对多糖得率的影响较液料比显著。
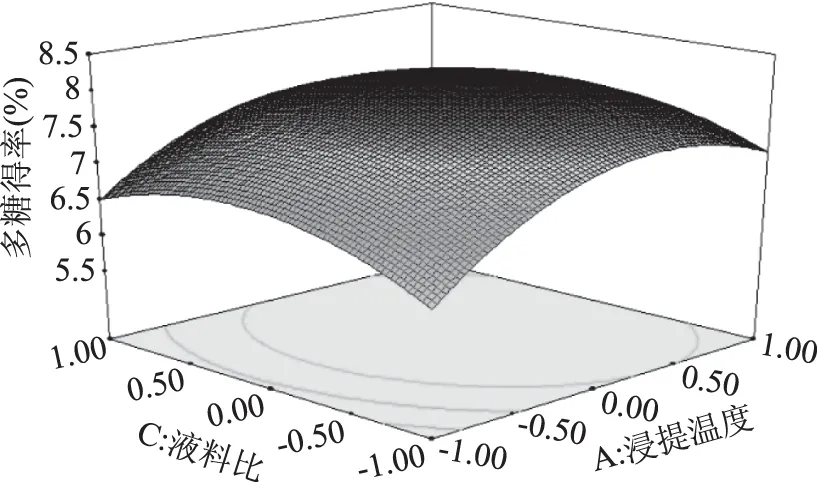
图5 浸提温度和液料比交互作用对多糖得率影响的响应面图Fig.5 Response surface of extraction temperature and liquid/material ratio on the yield of polysaccharide
2.4.3 浸提时间和液料比交互作用对莲子多糖得率的影响 由图6可知,当浸提温度为80 ℃时。浸提时间在1.85~2.9 mL/g之间,液料比在28∶1~52∶1 mL/g范围内,莲子多糖的得率最高。等高线在两个轴向上的分布都较为稀疏,浸提时间轴向上的等高线密度较液料比稍高,说明浸提时间对多糖得率的影响较液料比显著。
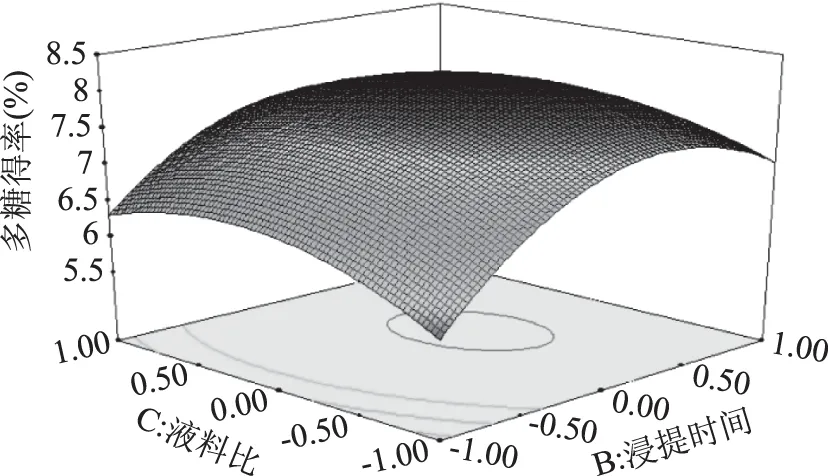
图6 浸提时间和液料比交互作用对多糖得率影响的响应面图Fig.6 Response surfaceof extraction time and liquid/material ratio on the yield of polysaccharide
2.5 提取工艺的确定
结合回归模型,由Design-Expert 8.0.6软件分析得到莲子多糖最佳的热水浸提工艺条件为:浸提温度为82.56 ℃、浸提时间为3.12 h、液料比为29.47∶1 mL/g,在此条件下,莲子多糖的理论得率为8.14%。考虑到实际操作条件,将最佳工艺条件修正为:浸提温度为83 ℃、浸提时间为3 h、液料比为30∶1 mL/g。在此条件下重复3次实验,莲子心多糖得率分别为8.09%、8.16%、8.14%,平均值为8.13%±0.04%,与理论预测值基本一致(相差百分比不超过1%),说明回归模型可靠。莲子心多糖实际值与预测值的线性关系见图7,其实际值与回归模型预测值呈现良好的线性关系,说明模型的预测值能较好地反映热水浸提法的实际莲子多糖得率。
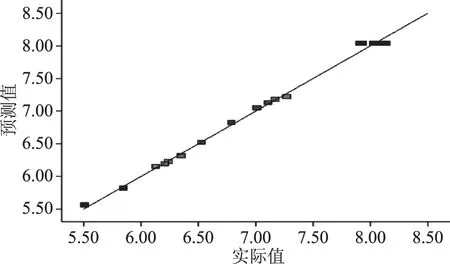
图7 实际值与预测值的线性关系图Fig.7 Linearity plot of the predicted and actual values
2.6 提取前后莲子粉末形态观察
水提前的莲子粉末在环境扫描电镜下的形态如下图8所示。

图8 水提前莲子粉末在不同放大倍数下的环境扫描电镜图Fig.8 The picture of sample(before extraction)in different multiples by environmental scanning electron microscopy注:Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ的放大倍数分别为500、1000、5000、5000、5000。
从图8中Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ观察可知:Ⅰ中可明显看到大量粒径在10~20 μm之间的椭球状颗粒物质(如Ⅲ所示),以及部分粒径在40~60之间的不规则团块(如Ⅴ所示),还有分散在颗粒间的无规则叠放的薄膜状物质(如图Ⅳ所示),通过对比前人对莲子淀粉及细胞的研究,推测Ⅲ中椭球状物质为莲子淀粉[21],Ⅴ中团块为被物质包埋的莲子细胞[22],Ⅳ中膜状物质可能是部分莲子细胞在粉碎过程中剪切破碎,内容物流失后残留下的细胞壁、细胞膜、细胞器膜等物质[23]。这说明莲子粉末经粉碎后,有大量细胞被机械力破坏,导致内容物流出。但是,粉末中还有较多细胞颗粒还保持完整状态,内容物还处于被包埋状态。而薄膜状物质表面光滑,无明显孔状。
水提后的莲子粉末形态在环境扫描电镜下的颗粒形态如图9所示。a、b、c经过热水浸提多糖之后的莲子粉末,由图9a中可以看出粉末中原本数量众多的椭球状颗粒已被破坏,呈大小不一的片状,且表面粗糙,有明显不规则裂痕及沟壑状纹路,可能是部分淀粉遇热水后不完全糊化形成片状(图9c)[24]。从图9a观察整体样品,提取前的团块状(如图Ⅴ所示)已消失不见,薄膜状物质已基本消失,但可观察到部分表面有不规则孔状的薄片。说明前文所推测的细胞颗粒完整性已被破坏,且膜状结构等被破坏。出现该现象主要是由于热水浸提时,细胞内外的浓度差引起的细胞吸水和在加热的条件下细胞表面受热发生扭曲的共同作用,细胞涨破,细胞的内容物被释放出来,出现不规则褶皱,使细胞发生溃陷[25]。而细胞壁中可溶性物质溶解到提取液中,细胞壁中不溶于水的组分留下形成与糊化淀粉一样的片状,也会可能被糊化淀粉包埋。通过对比分析莲子粉末在热水浸提前后的扫描电镜图,热水浸提前后莲子粉末微观结构差异明显,这表明所采用的经响应面优化后的热水浸提条件对莲子多糖的提取具有较好的效果。

图9 水提后莲子粉末在不同放大倍数下的环境扫描电镜图Fig.9 The picture of sample(after extraction)in different multiples by environmental scanning electron microscopy注:a、b、c的放大倍数分别为500、1000、5000。
3 结论
莲子多糖热水浸提的最佳工艺条件为:浸提温度为83 ℃、浸提时间为3 h、液料比为30∶1 mL/g。在此条件下,莲子多糖得率为8.13%±0.04%,与理论预测值基本一致(相差百分比不超过1%)。
环境扫描电镜观察结果表明,热水浸提多糖前后的莲子粉末微观结构有明显变化。可观察到浸提前较为完整的细胞在经过长时间浸泡和热作用后,细胞壁破裂,细胞的完整性被破坏,细胞的内容物流入浸提液,细胞形状完全改变。浸提后观察到的薄片状为破裂后的细胞壁等非水溶性组织。这表明,响应面分析法所得到的热水浸提条件用于莲子多糖的浸提可获得较好效果。
[1]逸菲. 药食兼用之莲子[J]. 食品与健康,2007(8):29.
[2]郑宝东,郑金贵,曾绍校. 我国主要莲子品种中三种功效成分的研究[J]. 营养学报,2004,26(2):158-160.
[3]Miao M S,Yang Y L,Fang X Y. Effect of semen nelumbinis polysaccharide on the immune function of cyclophosphamide induced immunosuppressed mice[J]. Journal of Clinical Rehabilitative Tissue Engineering Research,2008,12(53):10477-10480.
[4]苗明三,徐瑜玲,方晓艳. 莲子多糖对衰老模型小鼠抗氧化作用的研究[J]. 中国现代应用药学,2005,22(1):11-12.
[5]叶勇. 植物多糖的分离纯化与制备[J]. 中国食品添加剂,2001(5):29-31.
[6]薛丹,黄豆豆,黄光辉,等. 植物多糖提取分离纯化的研究进展[J]. 中药材,2014,37(1):157-161.
[7]Ren C J,Yao H J,Wang C M,et al. Study on Acid Extraction Technology of Polysaccharide from Peanut Meal[J]. Food Science,2007.
[8]Tian L,Xuan Y F,Fan R J,et al. Ethanol-alkali Extraction Method of Astragalus Polysaccharides[J]. Journal of Jilin University,2006,44(4).
[9]You Q,Yin X,Zhao Y. Enzyme assisted extraction of polysaccharides from the fruit of Cornus officinalis[J]. Carbohydrate Polymers,2013,98(1):607-610.
[10]Chen R,Li Y,Dong H,et al. Optimization of ultrasonic extraction process of polysaccharides from Ornithogalum Caudatum Ait and evaluation of its biological activities[J]. Ultrasonics Sonochemistry,2012,19(6):1160-1168.
[11]Tao X,Zhan Y,Zhou Q Y,et al. Optimization of Ultra-High Pressure Extraction Process of Polysaccharides from Dendrobium Candidum by Response Surface Method[J]. Advanced Materials Research,2012,550-553:1796-1800.
[12]廖维良,赵美顺,杨红. 超声波辅助提取技术研究进展[J]. 广东药学院学报,2012,28(3):347-350.
[13]樊亚鸣,周叶燕,陈永亨,等. 工业化微波提取工艺及设备的关键技术研究[J]. 广州大学学报:自然科学版,2011,10(4):20-23.
[14]Li P,Wang Y H,Ma R Y. Water extraction conditions of polysaccharide from Fructus corni[J]. Journal of Beijing University of Chemical Technology,2003,30(1):13-16.
[15]郑朋朋,李珊,陈玉惠,等. 响应面法优化萌发菌HL-003胞内多糖提取工艺[J]. 食品工业科技,2015,36(15):219-223.
[16]马艺丹,刘红,马思聪,等. 神秘果种子多糖的响应面优化提取及其抗氧化活性研究[J]. 食品工业科技,2016,37(10).
[17]刘军海,黄宝旭,蒋德超. 响应面分析法优化艾叶多糖提取工艺研究[J]. 食品科学,2009,30(2):99-103.
[18]李颖畅,王亚丽,齐凤元,等. 响应面法优化蓝莓叶多糖提取工艺[J]. 食品工业科技,2015,36(3):227-231.
[19]王超,甄润英. 海芦笋多糖超声波辅助提取工艺及抗氧化活性研究[J]. 食品与机械,2012,28(6):138-141.
[20]应芝,励建荣,韩晓祥. 响应面分析法优化桑叶多糖提取工艺的研究[J]. 中国食品学报,2008,8(4):39-45.
[21]曾绍校,郑宝东,林鸳缘,等. 莲子淀粉颗粒特性的研究[J]. 中国粮油学报,2009,24(8):62-64.
[22]高德禄,张和民,苏秀珍. 扫描电镜下的植物细胞结构[J]. 植物杂志,1989(5):2.
[23]周苹,柴颖,黄祥辉,等. 元麦叶肉原生质体细胞壁再生过程中的扫描电镜观察及过氧化物酶活性[J]. Journal of Molecular Cell Biology,1986(2):12-20.
[24]严青. 不完全糊化法研究淀粉颗粒的外壳和小体结构[D].西安:陕西科技大学,2015.
[25]薛芳,颜瑞,王承明. 超声辅助碱提取花生多糖的研究[J]. 食品科学,2008,29(8):158-163.
Optimizationofextractionprocessofpolysaccharidesfromlotusseedbyresponsesurfacemethodology
CHENChuan-jie,CHENPei-lin,CHENLi,ZHENGBao-dong,ZENGHong-liang*,ZHANGYi*
(College of Food Science,Fujian Agriculture and Forestry University,Fuzhou 350002,China)
TS244.4
B
1002-0306(2017)18-0177-06
2017-03-20
陈钏杰(1994-),男,在读硕士研究生,研究方向:食品化学与营养,E-mail:1352572587@qq.com。
*通讯作者:曾红亮(1986-),男,博士,讲师,研究方向:食品科学与工程,E-mail:zhlfst@163.com。 张怡(1975-),女,博士,教授,研究方向:食品科学与工程,E-mail:zyifst@163.com。
福建省科技创新领军人才项目(KRC16002A);福建省高等学校科技创新团队支持计划(闽教科[2012]03号);福建农林大学科技发展资金使用计划项目(KF2015101)。
10.13386/j.issn1002-0306.2017.18.034
