西番莲果皮中果胶的复合酶法提取工艺研究
2017-10-16妙云
, ,*,,妙云
(1.华南农业大学食品学院,广东广州 510642;2.潮州市正一品生物科技有限公司,广东潮州 521000)
西番莲果皮中果胶的复合酶法提取工艺研究
刘运花1,黄苇1,*,郭美媛2,黄妙云2
(1.华南农业大学食品学院,广东广州510642;2.潮州市正一品生物科技有限公司,广东潮州521000)
实验以西番莲果皮为原料,以酶解pH、酶解时间、酶解温度、酶浓度与液料比为单因素,分别研究了四种酶(纤维素酶、半纤维素酶、木质素酶、淀粉酶)对西番莲果皮中果胶提取的影响,并确定将纤维素酶、半纤维素酶与木质素酶三者进行复配,然后以酶解pH、酶解时间、酶解温度和液料比为因子进行四因素三水平正交实验,以优化复合酶酶解工艺,最后通过响应面实验,确定了复合酶的添加量。实验优选得复合酶最适配比和最适酶解提取条件为:将纤维素酶0.8 g/100 g、半纤维素酶1.2 g/100 g、木质素酶0.2 g/100 g进行复配,液料比为6∶1 mL/g,pH为4,提取温度40 ℃,提取3.5 h,此时西番莲果皮的果胶提取得率可以达到2.63%±0.021%。
西番莲,果胶,酶,提取
Abstract:Passionflower peel was used as raw materials in the reseach.With enzyme solution pH,hydrolysis time,hydrolysis temperature,enzyme concentration and ratio of liquid to material as single factors,the effects of four kinds of enzyme(cellulase,hemicellulase and lignin enzymes,amylase)on pectin extraction from the passionflower peel were studied. And the enzyme combination consists cellulose,hemicellulase and lignin enzymes were determined. Through L9(34)orthogonal experiment and response surface test,the enzymatic hydrolysis and enzyme concentration were optimized. the optimal enzymatic hydrolysis conditions were as follows:cellulose enzymes 0.8 g/100 g,hemicellulase 1.2 g/100 g,and lignin 0.2 g/100 g,ratio of liquid to material(mL/g)6∶1,pH value 4,extraction lasts for 3.5 h under the temperature of 40 ℃,the pectin gain rate can reach 2.63%±0.021%.
Keywords:Passionflower;pectin;enzyme;extraction
果胶(pectin)是以D-吡喃半乳糖醛酸为基本单位,由α-1,4-糖苷键链接而成的聚合高分子亲水性胶状杂多糖,其结构中还含有部分中性糖,如木糖、葡萄糖、甘露糖、鼠李糖、阿拉伯糖等以及少量非糖成分[1],如甲醇、乙酸、阿魏酸。果胶具有稳定、凝胶、增稠、乳化等作用,被广泛应用于食品工业中[2];果胶还具有杀菌、止血、解毒、抗辐射等功能,可作为一种天然的药物制剂[3],在医学工业上也广有应用[4];此外,果胶优良的成膜性能也被应用到了制膜工业[5]和日用品工业中[6]。果胶的安全性与利用价值促成果胶资源的开发成为近年来的研究热点[7]。
果胶在高等植物的根、茎、叶、果中广泛存在,如柑橘、柠檬、柚子等果皮中约含30%果胶,是果胶的丰富来源,其中西番莲果皮作为一种新型果胶资源,有待进一步开发[8-9]。西番莲果皮果胶含量丰富,果皮重占整个果实鲜重的53%~71%[10],加工过程中,果皮常以废物的形式被丢弃,既浪费了资源又增加了排污成本[11]。郑荣珍等[12]探究了酸法提取紫果西番莲果皮中果胶的提取工艺,其鲜皮提取得率达到了2.5%、干皮提取得率可达12.0%。酸法、草酸铵逆流法[13]等果胶提取工艺常常导致工业污染,且提取得率较低,而离子交换法[14]、微波法[15]等温和型提取方法对工艺操作与设备要求高,相比而言生物酶法具有设备成本低、绿色环保[16]的优点。苏东林[17-18]等以酶法提取橘皮果胶,不仅提高了果胶提取得率,且由于提取条件更温和,得到的果胶性质也明显高于酸法。
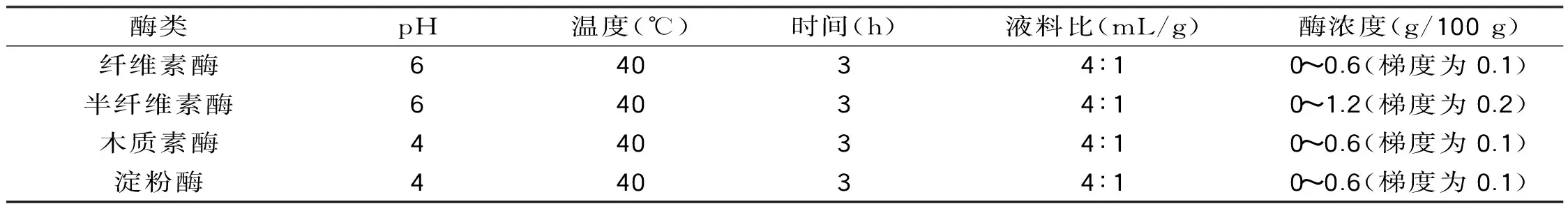
表2 酶浓度的单因素实验参数Table 2 Parameters for enzyme concentration single factor experiment
本研究以单因素实验为基础,结合正交优化实验探究西番莲果皮中果胶的酶法的提取工艺,并以响应面优化设计[19]确定复合酶添加比例,以得出一种温和高效的西番莲果皮果胶提取方法,为进一步开发果胶资源充分利用西番莲果皮提供参考。
1 材料与方法
1.1 材料与仪器
新鲜紫果西番莲 产自广西荣棠;纤维素酶(酶活20万U/g) 上海博奥生物科技有限公司;半纤维素酶酶(酶活20 U/g) 河南锐阳生物科技有限公司;木质素酶(酶活40万U/g) 河南盛泰源化工厂;淀粉酶(酶活3700 U/g) 广州齐云生物技术有限公司;无水乙醇(Ar) 国药集团化学试剂有限公司。
12-ND型冷冻干燥机 购自宁波新芝生物科技股份有限公司;pHS-3C 型数显pH计 购自上海雷磁创益仪器仪表有限公司;TU-1800紫外可见分光光度计 购自北京普析通用仪器有限公司;RE-5203型旋转蒸发仪 购自上海亚荣生化仪器厂;SHZ-Ⅲ型循环水真空泵 上海锦华層析设备厂。
1.2 实验方法
1.2.1工艺流程 果皮→灭酶(沸水浴处理5 min)→破碎加酶→酶解→灭酶(沸水浴处理10 min)→胶渣分离(真空泵抽滤)→滤液(果胶提取液)→无水乙醇沉淀→过滤、脱色、烘干→粉碎→果胶
1.2.2 果胶的测定 采用硫酸咔唑分光光度法[20]。
1.2.2.1 果胶标准曲线的绘制 取D-半乳糖醛酸标准品100 mg,溶解于水中,加入0.5 mL 1 mol/L氢氧化钠溶液,定容至100 mL,混匀移取上述原液0、1.0、2.0、3.0、4.0、5.0、6.0、7.0 mL,分别注入100 mL容量瓶中,用蒸馏水稀释至刻度。分别取各浓度稀释液进行比色测定并绘制曲线,即取1 mL标准品稀释液于25 mL比色管,加入0.5 mL 0.1%的咔唑-乙醇溶液,摇匀后立刻加入浓硫酸溶液6 mL,于85 ℃水浴反应5 min后冷却至室温,立刻用分光光度计在525 nm波长处用1 cm比色皿测量吸光值,得到标准曲线:y=0.0067x+0.0295(R2=0.9997),其中y为吸光值;x为果胶含量(μg/mL)。
1.2.2.2 样品果胶的测定 取果胶提取液25 mL,加25 mL水,活性炭1 g/100 mL,60 ℃搅拌15 min,抽滤,取1 mL样液加入0.5 mL 1 mol/L氢氧化钠溶液水解消化2 h以上,定容至250 mL,得到提取样品稀释液。取1 mL样品稀释液进行比色测定。
1.2.3 西番莲果皮果胶的酶提取工艺
1.2.4 单因素实验设计
1.2.4.1 pH对果胶提取得率的影响 酶的添加量(g/100 g)以果皮重量(100 g)计(下文同),按照表1所示的参数设计pH的单因素实验。
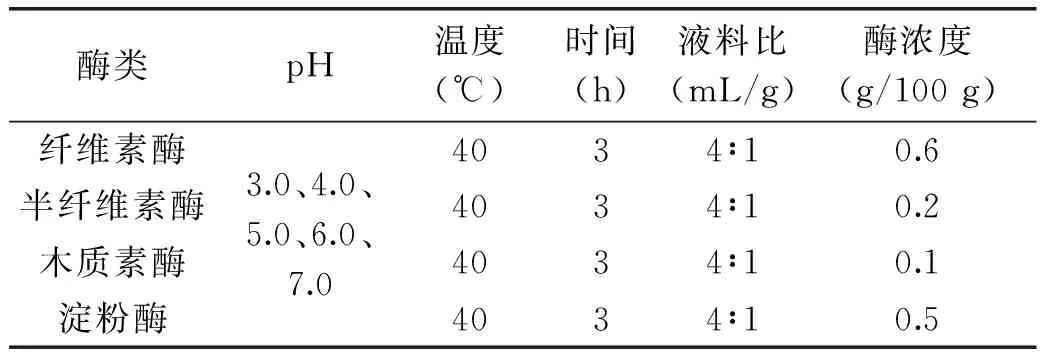
表1 pH单因素实验参数Table 1 Parameters for pH single factor experiment
1.2.4.2 酶浓度对果胶提取得率的影响 按照表2所示的参数条件设计酶浓度的单因素实验。
1.2.4.3 温度对果胶提取得率的影响 按照表3所示的参数条件设计酶解温度的单因素实验。
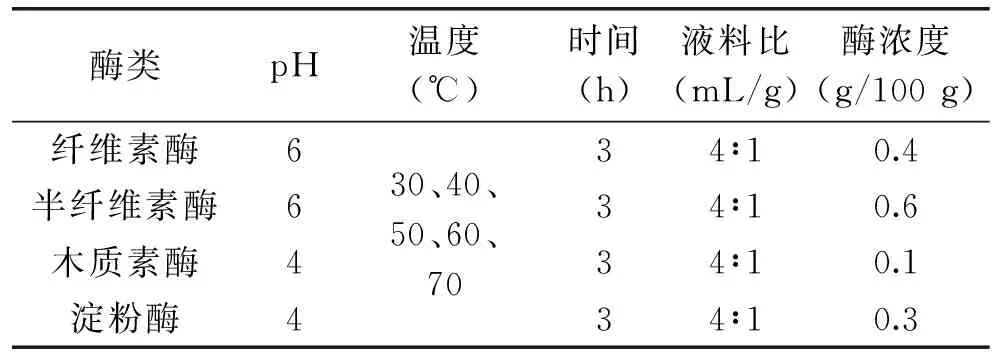
表3 酶解温度的单因素实验参数Table 3 Parameters for temperature single factor experiment
1.2.4.4 时间对果胶提取得率的影响 按照表4所示的参数条件设计酶解时间的单因素实验。

表4 酶解时间单因素实验参数Table 4 Parameters for temperature single factor experiment
1.2.4.5 液料比对果胶提取得率的影响 按照表5所示的参数条件设计酶解温度的单因素实验。
1.2.5 复合酶酶解条件的正交优化 基于单因素实验结果,选取纤维素酶0.4 g/100 g、半纤维素酶0.6 g/100 g、木质素酶0.1 g/100 g复合添加进行酶解,以液料比、提取时间、pH、温度为因子,提取得率为指标进行正交实验,因素水平见表6。
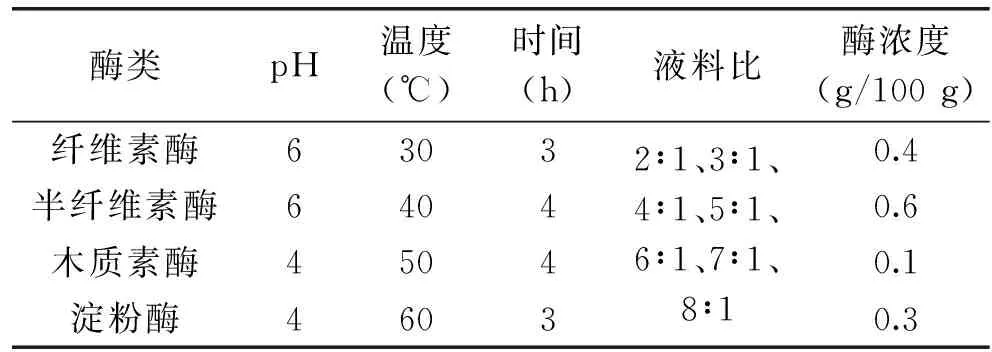
表5 液料比单因素实验参数Table 5 Parameters for liquid ratio single factor experiment
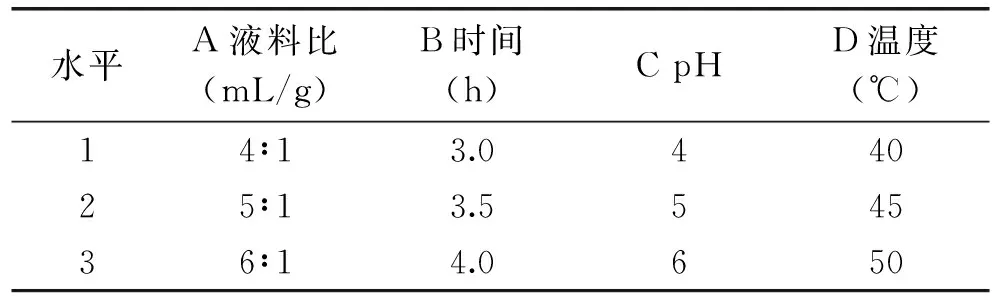
表6 L9(34)正交实验因素水平表Table 6 Independent variables and levels of L9(34)orthogonal experiment
1.2.6 复合酶添加比例的响应面优化 以纤维素酶、半纤维素酶、木质素酶三种的酶浓度为因子,提取得率为指标设计响应面优化实验,因素水平见表7。
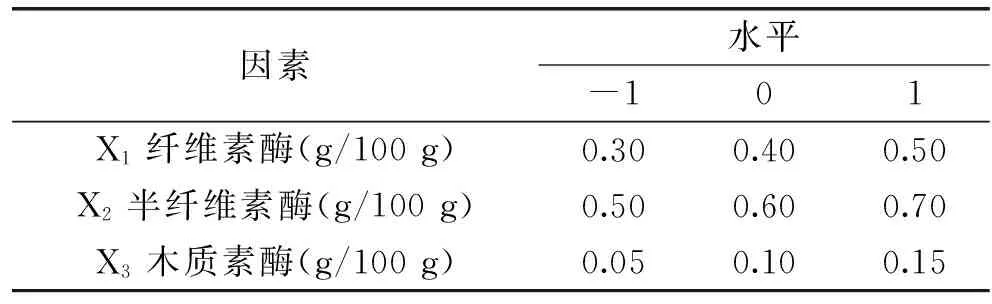
表7 响应面实验因素水平Table 7 Independent variables and levels of Box-Behnken experiment
1.2.7 果胶提取得率的计算 公式如下:
其中:A-吸光值,12500-稀释倍数,M-果皮重量(g);0.0295、0.0067分别为标准曲线的截距和斜率。
1.3 数据处理
每次实验均进行3次平行实验,以Origin、Design-expert、SPSS处理分析数据。
2 结果与分析
2.1 单因素实验结果与分析
2.1.1 pH对果胶提取得率的影响 从图1可以看到,不同pH对四种酶提取果胶的提取得率均有影响。其中淀粉酶较为敏感,在pH为4时提取得率较高,之后随着pH增大呈急剧下降趋势。纤维素酶与半纤维素酶均在pH6处提取得率较高。木质素酶的提取能力与pH呈抛物线关系,并在pH4处表现较好。由此得出纤维素酶与半纤维素酶的较适提取pH为6,木质素酶与淀粉酶的较适pH为4。
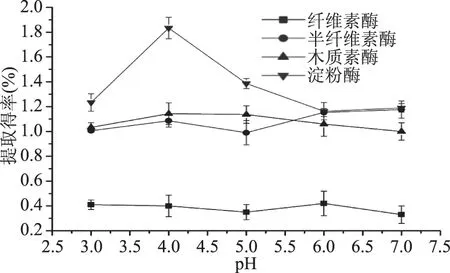
图1 pH对各单一酶提取果胶能力的影响Fig.1 Effect of pH on extraction of pectin by single enzyme
2.1.2 酶浓度对果胶提取得率的影响 由图2知,酶浓度对四种酶的果胶提取得率均有影响,果胶提取得率随着酶的添加量增大呈现先增后减的趋势。在供试浓度水平下,酶浓度对淀粉酶、纤维素酶、半纤维素酶的果胶提取得率影响较大,木质素酶作用受酶浓度影响较小。纤维素酶提取西番莲果皮果胶的最适浓度为0.4 g/100 g,木质素酶为0.1 g/100 g,淀粉酶为0.3 g/100 g,半纤维素酶的较适添加浓度为0.6 g/100 g。
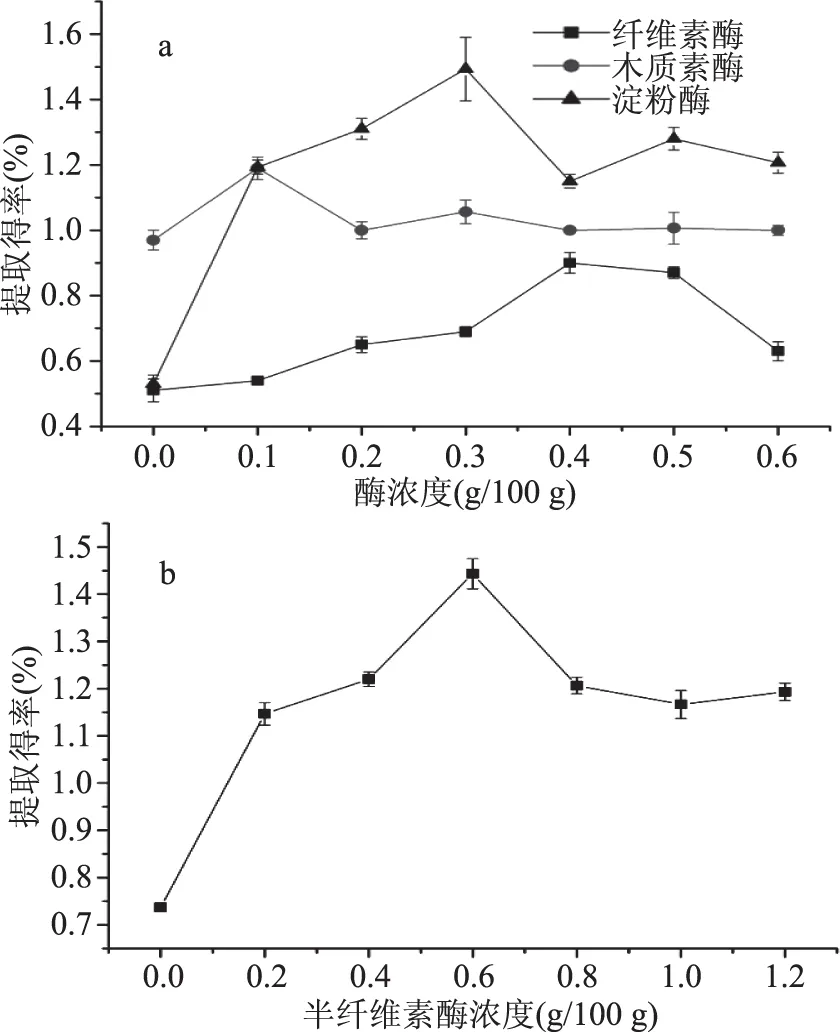
图2 酶浓度对果胶提取得率的影响Fig.2 Effect of enzyme concentration on extraction rate of pectin
2.1.3 温度对果胶提取得率的影响 从图3可以看出,温度对四种酶的果胶提取得率均有显著影响,在供试的温度范围内,果胶提取得率随温度升高呈现先上升再下降的趋势。其中纤维素酶和半纤维素酶均在温度40 ℃时,果胶的提取得率达到最大,但在温度70 ℃时,提取得率略有提升,这是因为一方面,热效应能增加果胶溶出的传质动力[21];另一方面,果胶黏度随温度上升而下降的流变性质导致提取液黏度降低[22],果胶的溶出阻力进一步减小。纤维素酶、半纤维素酶的较适提取温度均为40 ℃,木质素酶为50 ℃,淀粉酶为60 ℃。
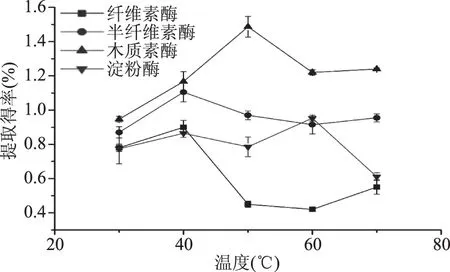
图3 温度对果胶提取得率的影响Fig.3 Effect of temperature on extraction rate of pectin
2.1.4 提取时间对果胶提取得率的影响 由图4可以看出,提取时间对酶提取果胶提取得率有影响,果胶提取得率随着时间的增加而逐渐增大,然后趋于平稳。纤维素酶和淀粉酶在提取时间小于3 h,果胶的提取得率均随着时间的增加而上升;之后基本稳定。对于木质素和半纤维素酶,当处理时间达4 h后,果胶的提取得率逐渐趋于平稳,但有略微下降,这是因为,一方面,随着果胶浓度增大,提取液的黏度增大,果胶的溶出受到一定程度的阻碍;另一方面,果胶提取充分后,在过度酶解作用下,果胶可能会发生裂解、酯解,酶制剂中存在的杂酶也可能对果胶的降解产生影响[23]。由此得出,纤维素酶和淀粉酶的较适酶解时间为3 h,半纤维素酶和木质素酶的较适酶解时间为4 h。
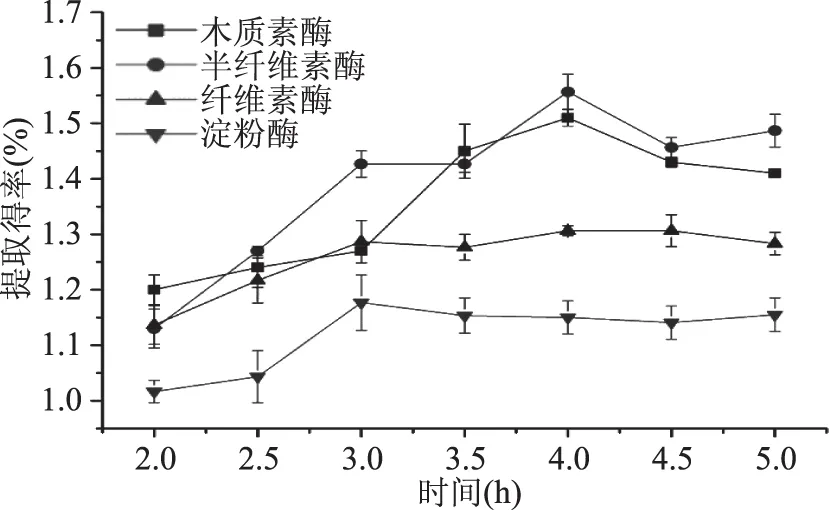
图4 提取时间对果胶提取得率的影响Fig.4 Effect of extraction time on extraction rate of pectin
2.1.5 液料比对果胶提取得率的影响 由图5可以看出,不同液料比对酶提取果胶的提取得率有一定影响,其中对半纤维素酶及木质素酶的影响较大,对淀粉酶及纤维素酶的影响较小,不同的酶的最适液料比略有不同。当液料比较小时,由于溶剂过少,高粘度的果胶质阻止了纤维组织中果胶的进一步溶出;当液料比适当时果胶和酶分子充分接触,果胶的提取效果好,果胶的提取得率达到最大;当液料比过大,酶分子由于稀释作用,不能与底物充分接触,导致果胶的提取效果逐渐降低[18]。在供试液料比范围内,半纤维素酶最适液料比是4∶1,纤维素酶最适液料比为3∶1,木质素酶最适液料比为6∶1,淀粉酶最适液料比为5∶1。
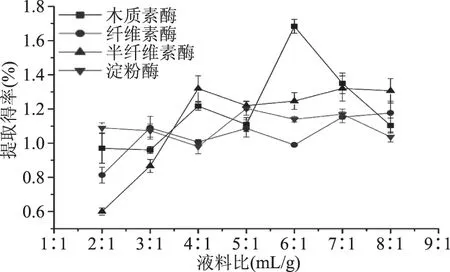
图5 液料比对果胶提取得率的影响Fig.5 Effect of liquid ratio on pectin extraction rate
2.2 酶解能力的比较分析
如图6所示,通过比较,得出纤维素酶、半纤维素酶、木质素酶、淀粉酶在较优条件下的提取能力大小依次为:木质素酶(2.27%)>纤维素酶(1.83%)>淀粉酶(1.81%)>半纤维素酶(1.63%)。鉴于淀粉酶的最适作用温度与其他酶相差甚远,不利于多种酶复配后酶解条件的协调,实验选择木质素酶、纤维素酶、半纤维素酶三种酶组成复合酶系。
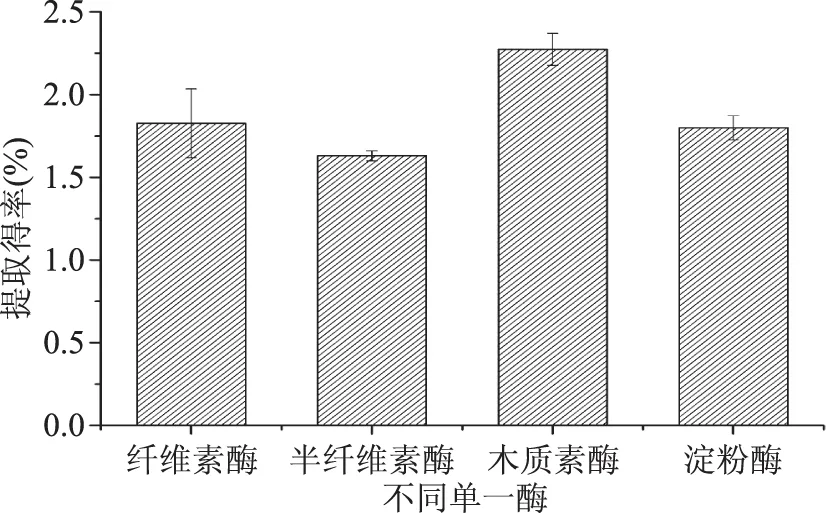
图6 单一酶果胶提取能力的对比Fig.6 Comparison of pectin extraction capacity of single enzyme
2.3 复合酶酶解条件的正交优化实验结果分析
优选的三种酶进行复配,其酶解条件的L9(34)正交实验结果如表8所示。由K值可得最优组合为
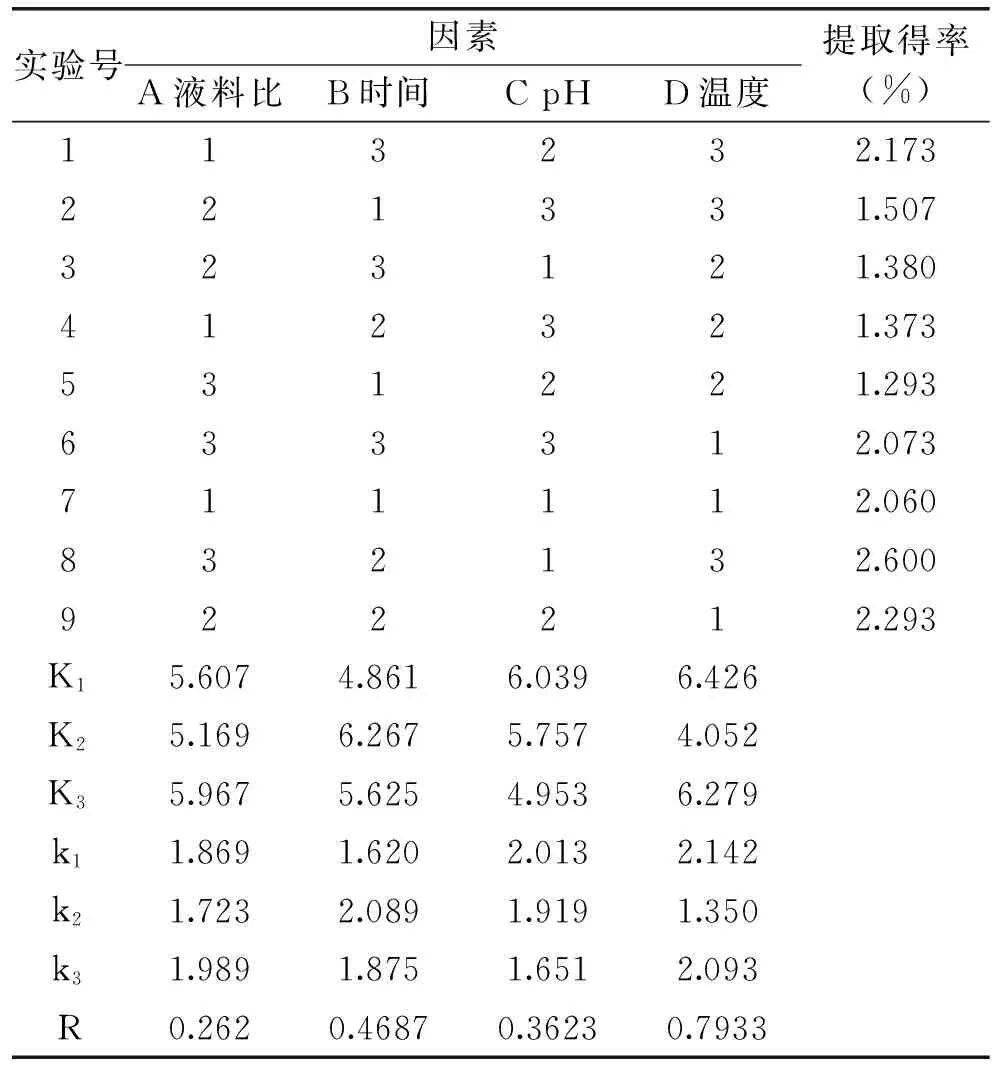
表8 L9(34)正交实验结果Table 8 The results of orthogonal experiment L9(34)
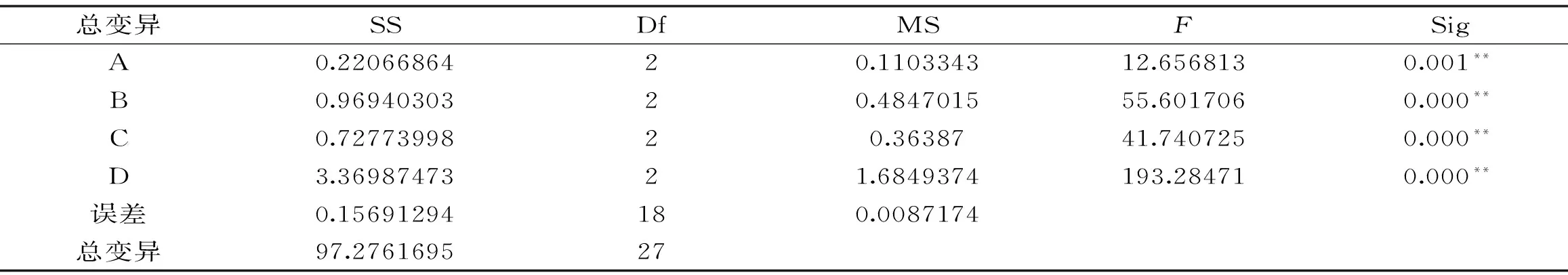
表9 正交实验方差分析结果Table 9 Variance analysis results of orthogonal experiment
注:α=0.01的显著性水平标注为**,表11同。A3B2C1D1,即液料比为6∶1 mL/g,提取时间为3.5 h,pH为4,提取温度为40 ℃。
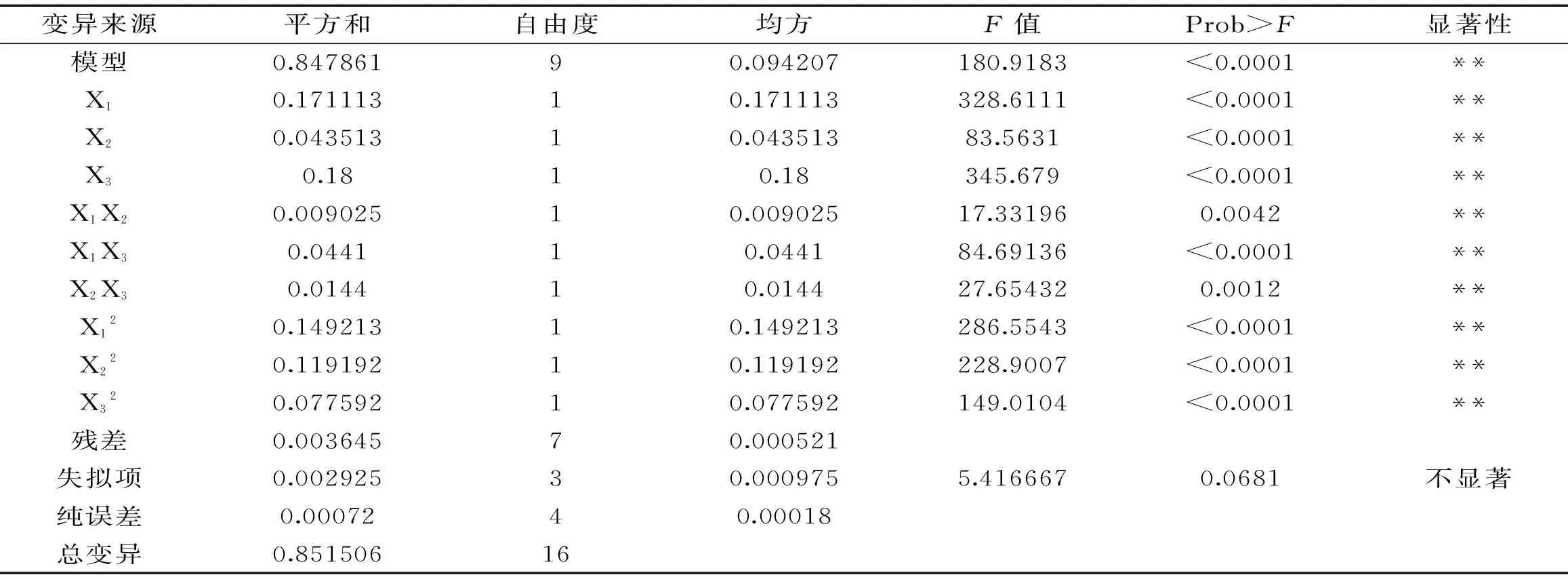
表11 响应面实验结果方差分析表Table 11 Variance analysis response surface test results
由方差分析结果表9可知四种因素对果胶提取得率的影响均极显著,其影响大小依次为D>B>C>A,即温度>提取时间>pH>液料比。经三次平行验证实验表明,提取得率可达到2.61%。
2.4 酶浓度的响应面优化结果及分析
在复合酶最优提取条件下对三种酶的添加量进行优化,结果如表10所示。
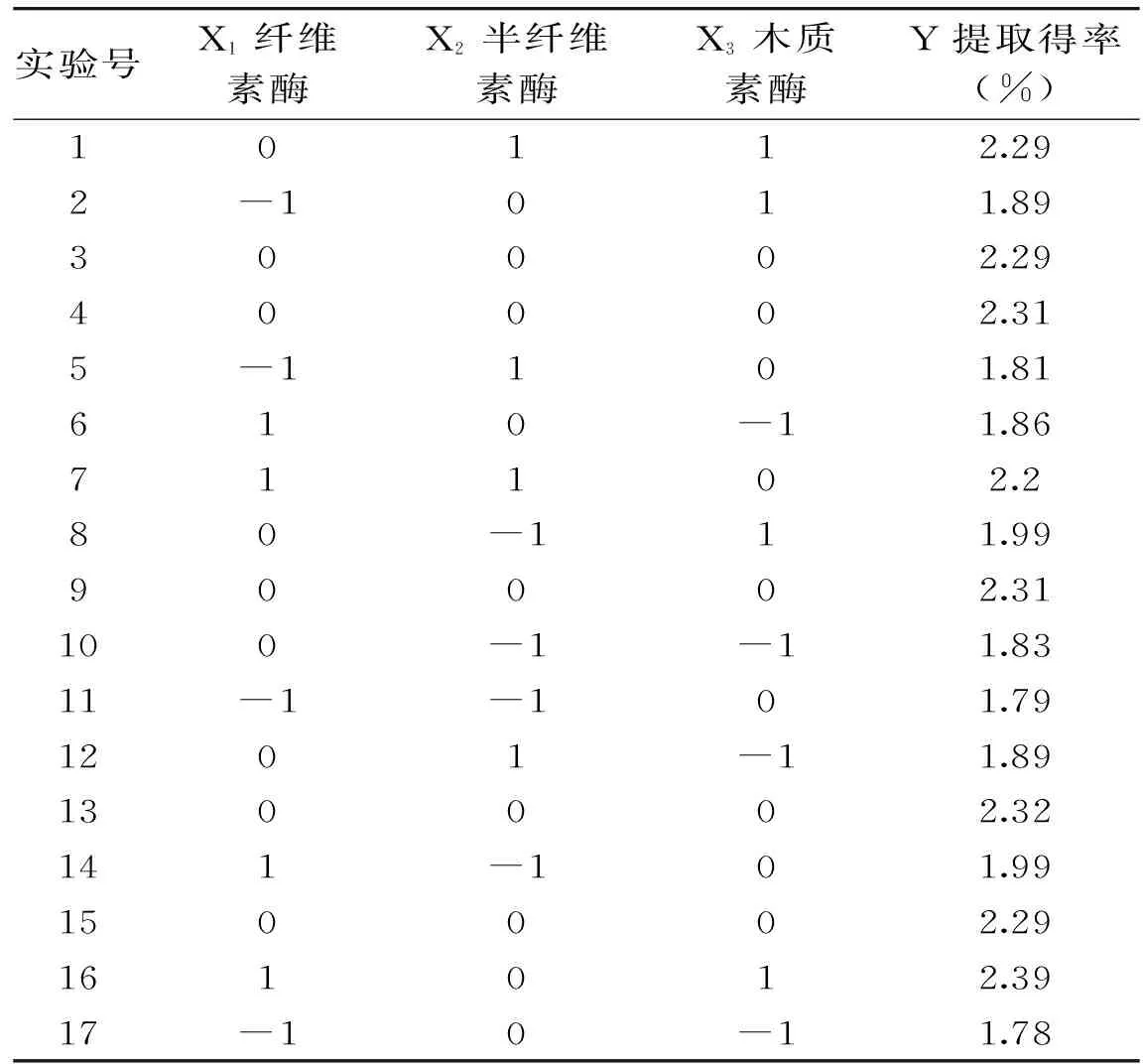
表10 酶浓度的响应面优化结果Table 10 Box-Behnken optimizationresults for enzyme additions
运用Design-Expert 8.5对实验数据进行二次多元回归分析,得到回归方程:Y=2.304+0.14625X1+0.07375X2+0.15X3+0.0475X1X2+0.105X1X3+0.06X2X3-0.18825X12-0.16825X22-0.13575X32,由表11响应面回归模型与方差分析表可知,实验模型p<0.001,失拟项不显著p=0.0681,决定系数R2=0.855,说明所建模型比较理想,回归方程预测性良好,能够较准确地预测各酶的添加量对果胶提取得率的影响。
由方差分析显著性结果可见,一次项和二次项p<0.01,说明各因素对果胶的提取效果影响均为极显著,三种酶浓度对结果的影响并非单一的线性关系,存在交互作用(p<0.01),且三因素间交互响应面(图7)呈现椭圆,均有最值,表明因素间交互作用影响极为显著。
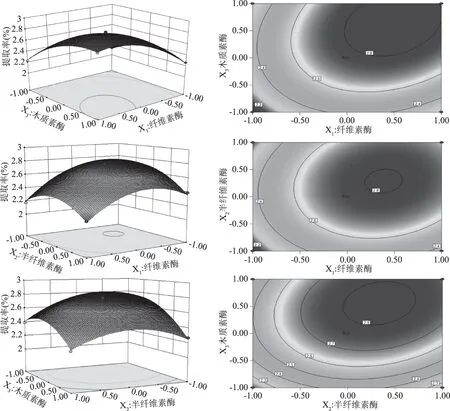
图7 各因素交互影响果胶提取得率的响应面图Fig.7 Response surface of pectin extraction rate affected by each factor
通过响应面软件预测得到最佳的复合酶浓度为:纤维素酶0.8 g/100 g,半纤维素酶1.2 g/100 g,木质素酶浓度为0.2 g/100 g,此时果胶提取得率可达2.81%,验证实验表明果胶实际提取得率可达2.63%±0.021%。
3 结论
综合考虑复合酶作用条件的协调性,通过正交实验得出优选酶类复合酶解条件为:液料比为6∶1 mL/g,提取时间为3.5 h,pH为4,提取温度为40 ℃。在该条件下,通过响应面实验获得复合酶各组分最佳添加量为:纤维素酶0.8 g/100 g,半纤维素酶1.2 g/100 g,木质素酶浓度为0.2 g/100 g。在上述优条件下,果胶提取得率可达到2.63%±0.021%。
[1]Dam S M,Nguyen D V. Optimization of pectin extraction from fruit peel of purple passion fruit(passiflora edulis sims)in Vietnam[J]. Acta Horticulturae,2013(989):279-284.
[2]赵苹,焦懿,赵虹. 西番莲的研究现状及在中国的利用前景[J]. 资源科学,1999,21(3):77-80.
[3]陈靖,陈孔荣. 果胶——一种有开发前途的药物制剂基质[J]. 现代应用药学,1997(3):22-23.
[4]Vorwerk S,Somerville S,Somerville C. The role of plant cell wall polysaccharide composition in disease resistance[J]. Trends in Plant Science,2004,9(4):203-209.
[4]段红,曹稳根. 果胶及其应用研究进展[J]. 宿州学院学报,2006(6):80-83.
[5]Endress H U. Nonfood Uses of Pectin[M].The Chemistry and Technology of Pectin,1991:251-268.
[6]Gholamreza Mesbahi,Jalal Jamalian,Asgar Farahnaky. A comparative study on functional properties of beet and citrus pectins in food systems[J]. Food Hydrocolloids,2005,19(4):731-738.
[7]冯洪建,黄国林. 果胶提取的研究进展[J]. 广东化工,2013,40(21):84-85.
[8]黄永春,马月飞,谢清若,等. 超声波辅助提取西番莲果皮中果胶的研究[J]. 食品科学,2006,27(10):341-344.
[9]刘艳梅. 超声波辅助提取西番莲果皮中果胶的研究[J].企业科技与发展,2009(16):7-10.
[10]Kulkarni S G,Vijayanand P. Effect of extraction conditions on the quality characteristics of pectin from passion fruit peel(Passifloraedulisf. flavicarpa L.)[J]. Lebensmittel-Wissenschaft und-Technologie,2010,43(7):1026-1031.
[11]陈智毅,李升峰,吴继军,等. 西番莲的加工利用研究[J].现代食品科技,2006(1):186-189.
[12]郑荣珍,钟永聪,叶海辉. 从西番莲果皮中提取果胶[J]. 热带农业科学,1998(2):32-35.
[13]赵利,王杉. 果胶的制备及其在食品工业的应用综述[J]. 食品科技,1999(5):32-34.
[14]张燕,毛桂枝,刘蕴哲. 离子交换树脂法提取桔皮中果胶[J]. 食品研究与开发,2003,24(4):52-54.
[15]Fishman M L,Chau H K,Hoagland P,et al. Characterization of pectin,flash-extracted from orange albedo by microwave heating,under pressure[J]. Carbohydrate Research,2000,323(1-4):126-138.
[16]赵广河,沈育林,陈振林. 酸法与酶法提取香蕉皮果胶工艺比较[J]. 广东农业科学,2013(12):104-106.
[17]苏东林,李高阳,陈亮,等.橘皮果胶生产工艺优化及品质分析[J].食品科学,2011,32(18):95-101.
[18]王卉,黄朝晖,徐云升,等.香蕉皮果胶纤维素酶法提取工艺[J].农业工程,2013,4(3):74-76.
[19]Zhang Q A,Zhang Z Q,Yue X F,et al. Response surface optimization of ultrasound-assisted oil extraction from autoclaved almond powder[J]. Food Chemistry,2009,116(2):513-518.
[20]张小玲. 果胶的咔唑硫酸分光光度测定法研究[J]. 甘肃农业大学学报,1999(1):75-78.
[21]刘义武,孔昭华,王碧,等. 酶法提取血橙皮果胶[J]. 食品研究与发,2013(24):81-84.
[22]Chou T D,Kokini J L. Rheological Properties and Conformation of Tomato Paste Pectins,Citrus and Apple Pectins[J]. Journal of Food Science,2006,52(6):1658-1664.
[23]张娜,陈锦屏,严静,等. 柿皮果胶纤维素酶法提取工艺[J].食品科学,2011(12):160-163.
Researchonthecompoundenzymaticextractionprocessofpectinfrompassionflowerpeel
LIUYun-hua1,HUANGWei1,*,GUOMei-yuan2,HUANGMiao-yun2
(1.College of Food Science,South China Agricultural University,Guangzhou 510640,China;2.ZhengYiPin Biological Technology Co.,Ltd. of Chaozhou City,Chaozhou 521000,China)
TS201.1
A
1002-0306(2017)18-0117-07
2017-01-09
刘运花(1990-),女,硕士研究生,研究方向:农产加工与贮藏工程,E-mail:jlaufefe10109@163.com。
*通讯作者:黄苇(1967-),女,硕士,教授,研究方向:农产品加工与贮藏,E-mail:weih007@scau.edu.cn。
广东省级科技计划项目(2014B010102002)。
10.13386/j.issn1002-0306.2017.18.023
