亚油酸和α-亚麻酸对脂肪干细胞活力及成脂分化的影响
2017-10-16梁媛,赵馨怡,张靖伟,简路洋,梁帅,王晗,王际辉
梁 媛, 赵 馨 怡, 张 靖 伟, 简 路 洋, 梁 帅, 王 晗, 王 际 辉
( 1.大连工业大学 食品学院, 辽宁 大连 116034;2.大连工业大学 生物工程学院, 辽宁 大连 116034 )
亚油酸和α-亚麻酸对脂肪干细胞活力及成脂分化的影响
梁 媛1, 赵 馨 怡2, 张 靖 伟1, 简 路 洋1, 梁 帅1, 王 晗2, 王 际 辉2
( 1.大连工业大学 食品学院, 辽宁 大连 116034;2.大连工业大学 生物工程学院, 辽宁 大连 116034 )
应用MTT比色法检测不同浓度的亚油酸和α-亚麻酸对脂肪干细胞活力的影响,利用油红O染色法和甘油三酯质量摩尔浓度测定法检测亚油酸和α-亚麻酸对脂肪干细胞成脂分化的影响。MTT结果表明,在一定浓度范围内,α-亚麻酸能够显著增强细胞活力,但在较高浓度(60 μmol/L)体现出明显的细胞毒性作用;而亚油酸能够显著抑制脂肪干细胞活力。油红O染色和甘油三酯测定结果表明,与对照组相比,亚油酸和α-亚麻酸均能促进脂肪干细胞成脂分化;与α-亚麻酸相比,亚油酸对脂肪干细胞成脂分化的促进作用更强,且呈现剂量依赖性。
亚油酸;α-亚麻酸;脂肪干细胞;细胞活力;成脂分化
Abstract: The adipose tissue-derived stromal cells (ADSCs) were treated with different contentions of linoleic acid (LA) and alpha-linolenic acid (ALA). MTT assay was used to measure the effects of LA and ALA on cell viability. The effects of LA and ALA on adipogenic differentiation were detected by oil red O staining and triglyceride (TG) content assay. MTT assay showed that ALA could enhance the cell viability significantly, but significant cytotoxic effect on contentions of 60 μmol/L. LA could suppress the cell viability significantly. The result of oil red O staining and TG content assay showed that both LA and ALA could promote the adipogenic differentiation of ADSCs when compared to the control group, LA show higher adipogenic differentiation than ALA in a dose-dependent manner.
Keywords: linoleic acid; alpha-linolenic acid; adipose tissue-derived stromal cells; cell viability; adipogenic differentiation
0 引 言
脂肪酸是人体必需的营养物质之一,它不仅是人体细胞的重要组成成分,更参与调节体内的多种代谢[1]。日常膳食中,多不饱和脂肪(PUFAs) 摄入的种类和数量与人体健康密切相关。有研究表明,PUFAs具有调节免疫、抗氧化、促进大脑发育、防治心脑血管疾病等多种生理功能[2-3]。PUFAs主要包括n-3和n-6脂肪酸两种亚型,其中亚油酸(LA,n-6)和α-亚麻酸(ALA,n-3)被认为是人体自身不能合成、必须从食物中获得的必需脂肪酸[4]。LA和ALA不仅能够在体内通过去饱和酶的作用延长、转化成花生四烯酸、二十碳五烯酸、二十二碳六烯酸等多种脂肪酸[5],而且是参与合成前列腺素、血栓素及白三烯等类二十烷酸的重要前体物质[6]。
肥胖已成为一个世界性的健康问题,由肥胖所引起的一系列代谢综合征也随之突显。肥胖的产生受遗传、社会环境等多种因素的影响,其根本表现为脂肪细胞数目的增多和体积的增大[7],而脂肪细胞数目的增多与干细胞和前脂肪细胞的成脂分化密切相关[8]。脂肪干细胞(adipose tissue-derived stromal cells,ADSCs)是一类来源于脂肪组织的多潜能干细胞,能多向分化成脂肪细胞、骨细胞、软骨细胞等多种细胞类型[9]。脂肪干细胞的细胞活力直接影响其功能的发挥。同时,在脂肪组织发育的过程中,脂肪干细胞的成脂分化也发挥着至关重要的作用。
据报道,n-3和n-6脂肪酸的摄入对肥胖起不同作用。体内实验表明,摄入富含n-3 PUFAs的鱼油能够减少脂肪的累积[10],而摄入含LA高脂饲料的母鼠会导致其哺乳幼崽体内白色脂肪组织的增生和肥大[11]。体外实验表明,n-3和n-6脂肪酸对前脂肪细胞的增殖和分化的影响存在差异[12]。多不饱和脂肪酸对ADSCs细胞活力和成脂分化的影响尚未完全阐明。本研究以LA和ALA为对象,研究其对ADSCs细胞活力和成脂分化的影响,以期为研究饮食中脂肪酸的摄入与肥胖等脂类代谢异常的相关性提供科学依据。
1 材料与方法
1.1 材 料
1.1.1 实验动物
6~8周龄的C57BL/6J小鼠,大连医科大学实验动物中心。
1.1.2 主要试剂
亚油酸,Cayman公司;α-亚麻酸,Cayman公司;MTT,上海源叶生物科技有限公司;成骨分化培养基,武汉维诺赛生物技术有限公司;碱性磷酸酶钙钴法染色试剂盒,江苏凯基生物技术股份有限公司;油红O,Sigma公司;甘油三酯测定试剂盒,南京建成生物科技有限公司。
1.2 方 法
1.2.1 ADSCs的体外培养
取6~8周龄C57BL/6J小鼠,断颈处死,75%酒精浸泡消毒5 min。无菌条件下取腹股沟处脂肪组织,剔除筋膜和血管,用含2%双抗的PBS反复冲洗3次。将组织盲剪成糜,加等体积0.1%Ⅰ型胶原酶,37 ℃水浴中消化30 min,每10 min吹打均匀。加入等体积含有10%胎牛血清的DMEM/F12,1 500 r/min离心5 min。沉淀用PBS洗涤2次,加完全培养基重悬接种于培养瓶,于37 ℃、5% CO2饱和湿度细胞培养箱中培养,每3 d换液。待细胞融合至80%~90%时,用0.25%胰蛋白酶消化,1∶2传代。
1.2.2 ADSCs多向诱导分化
[9]进行实验,取对数生长期细胞,用0.25%胰酶消化后制成细胞悬液,调整密度为105个/mL,重新接种于24孔板。待细胞融合至90%时,分别更换成DMEM/F12、10% FBS、1%双抗、1 μmol/L地塞米松、0.5 mmol/L IBMX、200 μmol/L吲哚美辛和10 μg/mL牛胰岛素的脂分化培养基和成骨培养基,每3 d更换一次培养基。成脂诱导至14 d时,细胞用10%中性甲醛固定10 min,用PBS洗涤2次,油红O工作液染色10 min,蒸馏水清洗,加入苏木精染色液复染10 min,再用蒸馏水清洗,加入1% NaHCO3,显微镜下观察染色结果。成骨诱导至14 d时,细胞用70%乙醇固定10 min,按照试剂盒说明书用碱性磷酸酶钙钴法染色试剂盒染色,显微镜下观察染色结果。
1.2.3 MTT法检测亚油酸和α-亚麻酸对ADSCs 增殖的影响
细胞以5×104个/mL重新接种于96孔板。待细胞融合至90%时,分别加入稀释过的LA和ALA处理细胞,使其终浓度为20、40、60 μmol/L,并设空白对照孔和调零孔。培养3 d后每孔加入20 μL MTT溶液,置于37 ℃、5% CO2培养箱中孵育3~4 h。弃旧培养基,每孔加入150 μL二甲基亚砜溶液,轻轻振荡10 min,使结晶充分溶解,于490 nm处测得吸光度OD。
1.2.4 油红O染色法检测亚油酸和α-亚麻酸对ADSCs成脂分化的影响
细胞以105个/mL重新接种于24孔板。待细胞融合至90%时,更换成脂分化培养基,同时分别加入稀释过的LA和ALA处理细胞,使其终浓度为20、40 μmol/L,并设空白对照组。成脂诱导至第3天,对细胞进行油红O染色,方法同“1.2.2”,显微镜下观察染色结果。
1.2.5 甘油三酯质量分数的测定
细胞以2×105个/mL重新接种于6孔板。待细胞融合至90%时,更换成脂分化培养基,同时分别加入稀释过的LA和ALA处理细胞,使其终浓度为20和40 μmol/L,并设空白对照组。培养至第3天,弃去培养基,用PBS洗涤细胞2次。以1% Triton X-100的裂解液处理细胞30 min。分别加入标准品、样品、蒸馏水各20 μL和工作液200 μL,混匀。37 ℃孵育5 min,546 nm处测定各孔吸光度。
1.2.6 数据分析
实验数据以(平均值±标准差)表示,不同处理之间采用Ducan’s多重比较,P<0.05具有显著差异。
2 结果与讨论
2.1 ADSCs多向诱导分化
ADSCs体外培养24 h后,镜下观察已有细胞贴壁,继续培养72 h,细胞单层分布均匀,多呈纤维状和不规则多角形,传代后细胞增殖迅速,呈旋涡状生长。
利用化学诱导方法诱导ADSCs向脂肪细胞和骨细胞方向分化,以证明其多向分化潜能。成脂诱导至14 d时进行油红O染色,结果如图1所示。由图1可以看出,细胞形态发生变化,由长梭形变为扁圆形。细胞体积增大,油红O染色发现胞质内大量脂滴形成。
在成骨细胞分化过程中,碱性磷酸酶可以作为一种特异性标志蛋白。如图2所示,成骨诱导至14 d 时进行碱性磷酸酶染色后,可以观察到细胞形态的明显改变,细胞内累积了较多黑色颗粒状沉淀。

图2 ADSCs的骨脂分化Fig.2 Osteogenic differentiation of ADSCs
2.2 亚油酸和α-亚麻酸对ADSCs细胞活力的影响
利用MTT法检测LA和ALA对ADSCs细胞活力的影响,用酶标仪在490 nm处测吸光度。MTT在活细胞中能被还原为蓝紫色结晶甲臜,DMSO能够将结晶溶解。在一定范围内,结晶生成量与活细胞数成正比,可间接反映细胞活力的大小。如图3所示,与对照组相比,ALA能够显著增强细胞活力,但在较高浓度(60 μmol/L)体现出明显的细胞毒性作用,而LA能够显著抑制ADSCs细胞活力。

图3 不同浓度LA和ALA对ADSCs细胞 活力的影响Fig.3 Effects of different concentrations of LA and ALA on cell viability of ADSCs
2.3 亚油酸和α-亚麻酸对ADSCs成脂分化的影响
利用油红O染色法检测LA和ALA在ADSCs 成脂分化过程中对细胞内脂滴的形成和积累的影响,如图4所示。图4(a)中,与对照组相比,LA能够明显促进脂肪干细胞的成脂分化,随着LA浓度的升高,细胞内脂滴的大小和数量均呈现明显增加趋势;图4(b)中,ALA组脂滴的数量和大小也有所增加,但与LA相比,ALA对ADSCs成脂分化的促进相对较弱。
进一步检测细胞内TG的质量分数。如图5所示,与油红染色结果相一致,LA和ALA处理组细胞内TG质量分数均有所增加,但LA处理组细胞内TG质量分数呈现出明显的剂量依赖性,而ALA处理组细胞内TG质量分数则不随ALA质量分数的增加而变化。

图4 不同浓度的LA和ALA对ADSCsc成脂分化的影响Fig.4 Effects of different concentrations of LA and ALA on adipogenic differentiation in ADSCs
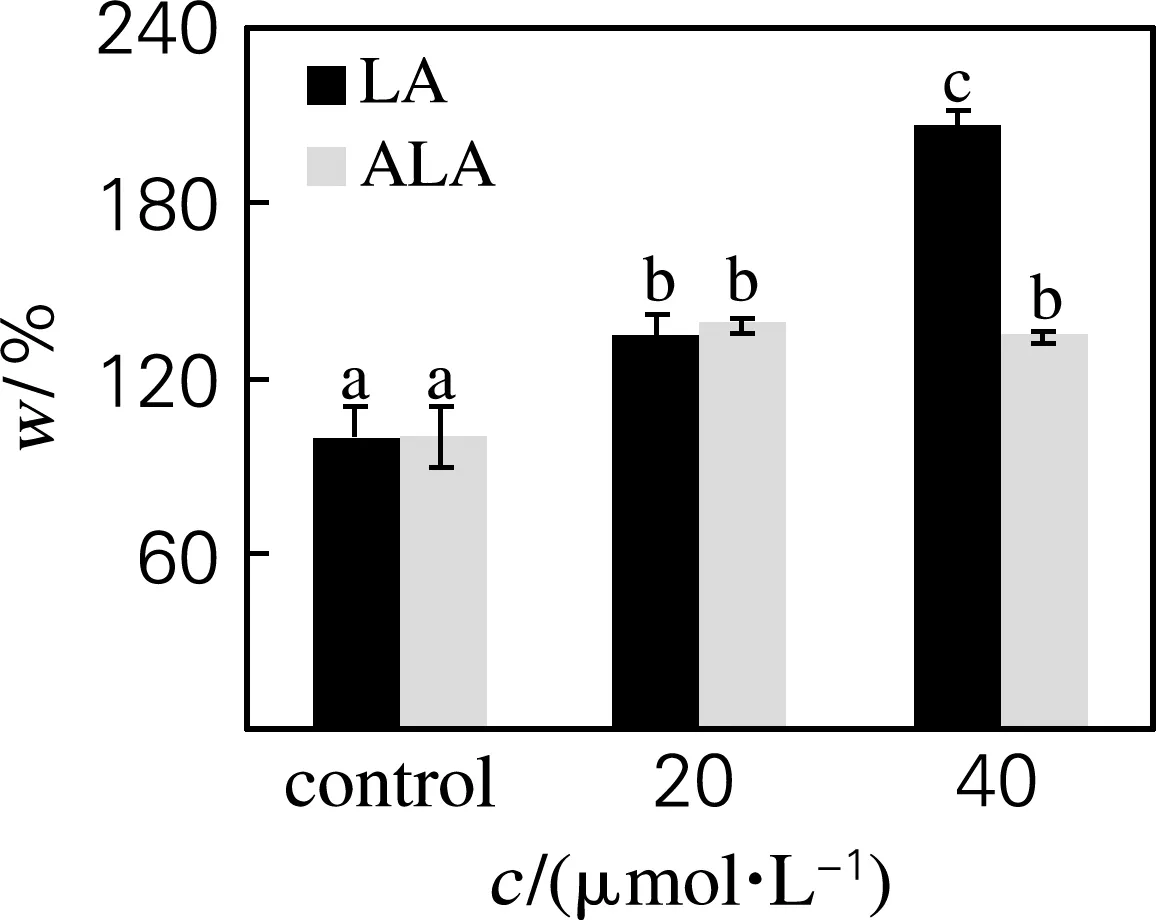
图5 不同浓度的LA和ALA对ADSCs细胞内TG质量分数的影响
Fig.5 Effects of LA and ALA on TG content in ADSCs
研究表明,饮食摄入脂肪酸的种类与肥胖等疾病的发生具有一定的相关性。但是,多不饱和脂肪酸对脂肪干细胞的细胞活力的影响及其对脂肪细胞分化的作用尚不明确。
已有学者研究表明,部分脂肪酸对成脂分化的影响存在差异。在人骨髓间充质干细胞成脂分化过程中,花生四烯酸促进其成脂分化的作用明显强于二十二碳六烯酸和二十碳五烯酸[13]。在对前脂肪细胞3T3-L1成脂分化的研究中发现,与二十碳五烯酸相比,硬脂酸和油酸作用更强[14]。本研究发现,与ALA相比,LA对ADSCs成脂分化的促进作用更强,提示不同脂肪酸对脂肪干细胞成脂分化的影响可能存在差异,这可能与脂肪酸的饱和程度和双键位置的不同有关。
此外,某些信号通路也可能参与调控多不饱和脂肪酸对成脂分化的影响。作为成脂分化关键的调控因子,C/EBPα和PPARγ能够共同诱导成脂分化过程中脂滴的生成和脂肪相关蛋白如FAS、脂蛋白酯酶等的表达[15-16]。Wnt、Hedgenhog、Notch和TGF-β等信号通路也参与调控成脂分化过程[17-19]。因此,脂肪酸在体内模型或在体外影响成脂分化的分子机制还有待进一步研究和阐明。
3 结 论
本实验研究了LA和ALA对ADSCs细胞活力和成脂分化的影响,发现LA能够抑制ADSCs细胞活力,而ALA在较低浓度(60 μmol/L)下能够增强ADSCs细胞活力,较高浓度下抑制ADSCs 细胞活力;与ALA相比,LA对ADSCs成脂分化的促进作用更强,且呈现剂量依赖性。
参考文献:
[1] CI L, LIU Z Q, GUO J, et al. The influence of maternal dietary fat on the fatty acid composition and lipid metabolism in the subcutaneous fat of progeny pigs[J]. Meat Science, 2015, 108: 82-87.
[2] 周大勇,王君妍,刘潇阳,等.南极磷虾油对小鼠免疫功能的调节作用[J].大连工业大学学报,2015,34(2):97-100.
[3] STONEHOUSE W, CONLON C A, PODD J, et al. DHA supplementation improved both memory and reaction time in healthy young adults: a randomized controlled trial[J]. American Journal of Clinical Nutrition, 2013, 97(5): 1134-1143.
[4] RUSSO G L. Dietaryn-6 andn-3 polyunsaturated fatty acids: from biochemistry to clinical implications in cardiovascular prevention[J]. Biochemical Pharmacology, 2009, 77(6): 937-946.
[5] 邹彩霞,夏中生.必需脂肪酸及其代谢转化产物的营养生理功能研究进展[J].湖南环境生物职业技术学院学报,2001,7(3):1-6.
[6] ELMES M, GREEN L R, POORE K, et a1. Raised dietaryn-6 polyunsaturated fatty acid intake increases 2-series prostaglandin production during labour in the ewe[J]. Journal of Physiology, 2005, 562(2): 583-592.
[7] BUDGE H, SEBERT S, SHARKEY D, et al. Adipose tissue development, nutrition in early life and its impact on later obesity[J]. Proceedings of the Nutrition Society, 2009, 68(3): 321-326.
[8] TANG W, ZEVE D, SUH J M, et al. White fat progenitor cells reside in the adipose vasculature[J]. Science, 2008, 322(5901): 583-586.
[9] KIM M, LEE Y J, JEE S C, et al. Anti-adipogenic effects of sesamol on human mesenchymal stem cells[J]. Biochemistry Biophysical Research Communication, 2016, 469: 49-54.
[10] WANG L.ω3和ω6脂肪酸在体脂增加及肥胖发展中的作用[J].中华高血压杂志,2015,23(1):7-14.
[11] MASSIERA F, SAINT M P, SEYDOUX J, et al. Arachidonic acid and prostacyclin signaling promote adipose tissue development: a human health concern[J]. Journal of Lipid Research, 2003, 44(2): 271-279.
[12] 陈蓉,郭莉霞,殷钟意,等.多不饱和脂肪酸对小鼠3T3-L1前脂肪细胞增殖和分化的影响[J].现代食品科技,2014,30(7):17-22.
[13] CASADO D A, SANTIAGO M R, DORADO G, et al. The omega-6 arachidonic fatty acid, but not the omega-3 fatty acids, inhibits osteoblastogenesis and induces adipogenesis of human mesenchymal stem cells: potential implication in osteoporosis[J]. Osteoporosis International, 2013, 24(5): 1647-1661.
[14] MANICKAM E, SINCLAIR A J, CAMERON S D. Suppressive actions of eicosapentaenoic acid on lipid droplet formation in 3T3-L1 adipocytes[J]. Lipids in Health and Disease, 2010, 9(11): 1697-1697.
[15] ROSEN E D, HSU C H, WANG X, et al. C/EBPα induces adipogenesis through PPARγ: a unified pathway[J]. Genes and Development, 2002, 16(1): 22-26.
[16] FILIPPIS B D, LINCIANO P, AMMAZZALORSO A, et al. Structural development studies of PPARs ligands based on tyrosine scaffold[J]. European Journal of Medicinal Chemistry, 2015, 89: 817-825.
[17] BENNETT C N, ROSS S E, LONGO K A, et al. Regulation of Wnt signaling during adipogenesis[J]. Journal of Biological Chemistry, 2002, 277(34): 30998-31004.
[18] MARGONL A, FOTIS L, PAPAVASSILIOU A G. The transforming growth factor-beta/bone morphogenetic protein signaling pathway in adipogenesis[J]. International Journal of Biochemistry and Cell Biology, 2012, 44(3): 475-479.
[19] TEPERINO R, AMANN S, BAYER M, et al. Hedgehog partial agonism drives Warburg-like metabolism in muscle and brown fat[J]. Cell, 2012, 151(2): 414-426.
Effectoflinoleicacidandalpha-linolenicacidoncellviabilityandadipogenicdifferentiationinadiposetissue-derivedstromalcells
LIANG Yuan1, ZHAO Xinyi2, ZHANG Jingwei1, JIAN Luyang1,LIANG Shuai1, WANG Han2, WANG Jihui2
( 1.School of Food Science and Technology, Dalian Polytechnic University, Dalian 116034, China;2.School of Biological Engineering, Dalian Polytechnic University, Dalian 116034, China )
TS201.4
A
1674-1404(2017)05-0323-05
2016-03-07.
国家自然科学基金项目(31371764,31370554);辽宁省自然科学基金项目(2014026016).
梁 媛(1991-),女,硕士研究生;通信作者:王 晗(1972-),女,副教授.
梁媛,赵馨怡,张靖伟,简路洋,梁帅,王晗,王际辉.亚油酸和α-亚麻酸对脂肪干细胞活力及成脂分化的影响[J].大连工业大学学报,2017,36(5):323-327.
LIANG Yuan, ZHAO Xinyi, ZHANG Jingwei, JIAN Luyang, LIANG Shuai, WANG Han, WANG Jihui. Effect of linoleic acid and alpha-linolenic acid on cell viability and adipogenic differentiation in adipose tissue-derived stromal cells[J]. Journal of Dalian Polytechnic University, 2017, 36(5): 323-327.
