小麦黄花叶病对不同类型小麦品种生物学性状及籽粒产量的影响
2017-10-16崔正勇高国强阚海礼杜振翠张凤云孙明柱李新华
崔正勇,李 鹏,高国强,阚海礼,杜振翠,张凤云,孙明柱,李新华
(1.山东省农业科学院原子能农业应用研究所,山东济南 250100; 2.山东省莒南县植物保护站,山东临沂 276600)
小麦黄花叶病对不同类型小麦品种生物学性状及籽粒产量的影响
崔正勇1,李 鹏1,高国强1,阚海礼2,杜振翠2,张凤云1,孙明柱1,李新华1
(1.山东省农业科学院原子能农业应用研究所,山东济南 250100; 2.山东省莒南县植物保护站,山东临沂 276600)
为了给小麦科学防病和抗(耐)病品种的筛选提供参考依据,在小麦黄花叶病重发区,以当地种植品种和黄淮冬麦区主推品种为试验材料,研究了小麦黄花叶病对不同小麦品种叶片SPAD(Soil and Plant Analyzer Development)值、春季总茎数、干物质积累量以及成熟期产量性状的影响。结果表明,感病小麦品种临麦4号和矮抗58于起身期(3月11日)开始出现症状,与无症状的临麦4号植株(LM4-N)相比,发病的临麦4号植株(LM4-S)的叶片SPAD值由52.4降至37.3;拔节后期(4月10日)所有品种SPAD值之间均无显著差异。然而,与LM4-N相比,拔节后期LM4-S单位面积总茎数减少51.4%,干物质积累量降低42.2%;成熟期LM4-S单位面积穗数降低21.2%,穗粒数降低24.5%,籽粒产量降低2 944.3 kg·hm-2,降幅38.3%。而该病对本研究中的其他抗病表现较好的品种鲁原502、济麦22、良星99和烟农24均未产生显著影响。结合各品种的产量表现,建议在小麦黄花叶病发病地区种植推广鲁原502、济麦22等高产、抗(耐)病性较好的品种。
SPAD值;小麦黄花叶病;品种;产量
Abstract: To provide references for prevention against wheat disease and select resistant or tolerant cultivars,the local cultivars and major cultivars in Huang-Huai winter wheat region were investigated to observe the leaf SPAD (soil and plant analyzer development) value,total stem number,dry matter in the spring and grain yield components of tested cultivars at maturity in the wheat yellow mosaic viral(WYMY) disease endemic area.The experimental results indicated that the disease symptoms appeared on susceptible cultivars at heading stage(March 11th),such as LM4 and AK58. Compared with LM4-N,the leaf SPAD value of LM4-S decreased from 52.4 to 37.3. There was no significant difference among the leaf SPAD values of all cultivars at late jointing stage(April 10th). Nevertheless,Compared with LM4-N,total number of stems per unit area of LM4-S decreased by 51.4%,and dry matter decreased by 42.4%. Spike number at maturity of LM4-S decreased by 21.2%,and kernel number decreased by 24.5%. As a result,the yield of wheat decreased by 38.3% with a drop of 2 944.3 kg·hm-2. No significant effect of the disease on other cultivars was observed,such as LY502,JM22,LX99 and YN24. Combined with the yield performance of different cultivars,the cultivars with high yield and resistance to WYMV are suggested to be planted in the disease endemic area,for example,LY502 and JM22.
Keywords: SPAD value; Wheat yellow mosaic viral disease; Cultivars; Yield
小麦黄花叶病是一种侵染力非常强的土传病毒性病害,以禾谷多黏菌(Polymyxagraminis)为传播介体,病原为小麦黄花叶病毒(Wheat yellow mosaic virus,WYMV)[1-3]。通常感病小麦在苗期被病毒侵染,越冬前无明显症状。返青期病株开始显症,先从新生叶片开始褪绿,逐渐加重表现为花叶、黄化甚至枯死现象,最后造成病株矮缩、分蘖消亡、生育期延迟。随着气温上升,在抽穗期前后病株症状快速消退并恢复生长,但此时已经对小麦造成不可逆的损失[4-5]。一般发病田块小麦产量损失30%左右,病害严重的田块损失可超过50%,甚至绝收[4,6-7]。近年来,由于耕作制度和品种抗病性等因素,该病在山东、河南、江苏和安徽等地危害日趋严重[8-9]。
由于传毒介体具有极强的抗逆性,传统化学防治技术难以对该病进行有效防控[10]。所以,选育、推广抗病品种是当前针对小麦黄花叶病最有效的防控手段。目前国内研究多集中于抗病品种的鉴定和筛选[11-13],缺乏小麦黄花叶病对不同小麦品种生物学性状、产量性状等方面影响的研究。本研究以发病区当地种植品种和黄淮冬麦区主推品种为试验材料,分析了小麦黄花叶病对不同品种植株叶片SPAD值、春季总茎数、干物质积累量以及成熟期产量性状的影响,以期为该病的科学防控和抗(耐)病品种的选择提供参考依据。
1 材料与方法
1.1 试验设计
试验以黄淮冬麦区主推小麦品种鲁原502(LY502)、济麦22(JM22)、良星99(LX99)、烟农24(YN24)为试验材料,以当地大面积种植的小麦品种临麦4号(LM4)和矮抗58(AK58)作为对照。为比较发病和无明显感病症状临麦4号的差异,感病记为LM4-S;无症状的记为LM4-N。试验于2015年10月至2016年6月在山东省临沂市莒南县板泉镇葛家宅子村(地理坐标35°11′N,118°40′E,海拔76 m)进行,地点位于山东省东南部,属暖温带半湿润大陆性季风气候,平均气温为25.5 ℃,光照充足,无霜期长。病田是小麦黄花叶病(WYMV)常年严重发病区。前茬作物为夏玉米,收获后粉碎秸秆,深耕还田。
试验采用随机区组试验设计,小区面积15 m2,6次重复。其中3个重复用于取样调查,剩余3个重复进行收获计产。播种前施用复合肥(N∶P2O5∶K2O = 18∶12∶15)750 kg·hm-2,施肥后旋耕整地,进行播种,各小区基本苗数约为210 万株·hm-2,行距25 cm。进入越冬期后浇冬水,确保小麦安全越冬。拔节期追施尿素(含氮量46%)225 kg·hm-2,施肥后随即浇水。其他管理措施同一般高产田。
1.2 测定项目与方法
1.2.1 SPAD值的测定
叶绿素测定仪测得的叶片SPAD值为叶绿素含量的相对值,原理是利用叶片对不同波长光吸收的差异来估算叶绿素含量[14-15]。从植株显现症状开始,使用叶绿素测定仪SPAD-502 Plus测定叶片的SPAD值,上午10点左右,每个小区取代表性植株10株,测量10个单茎顶部叶片中段的SPAD值。每隔10 d,即分别于3月11日、3月21日、3月31日和4月10日测定各处理叶片SPAD值的变化动态。
1.2.2 总茎数变化动态的测定
植株显症后,于测定叶片SPAD值的当天,每个小区选择长势均匀一致的1 m2小麦植株,调查各处理的单位面积总茎数。
1.2.3 干物质积累量的测定
将用于调查总茎数的全部植株自地表处剪下,然后带回实验室,置于恒温干燥箱中105 ℃杀青15 min,后降至70 ℃烘至恒重后,取出称其干重并记录。
1.2.4 产量性状的测定
成熟期调查单位面积穗数、穗粒数及千粒重。蜡熟末期及时收获。测产的小区用小型收割机收获整个小区,晒干后称重计产,籽粒含水量以12.5%计算。
1.3 数据处理与统计分析
试验数据采用Microsoft Excel 2007软件进行数据处理,用SigmaPlot 12.5作图,用DPS 7.05数据处理系统进行方差分析,采用LSD法进行多重比较(P<0.05)。
2 结果与分析
2.1 小麦黄花叶病对不同品种叶片SPAD值的影响
感病品种LM4和AK58的植株于3月11日开始显症,由图1可知,各品种叶片SPAD值的变化动态对小麦黄花叶病响应不一。3月11日,各品种叶片SPAD值表现为LM4-N、LY502、JM22、LX99、YN24显著高于LM4-S和AK58,而品种LY502、JM22、LX99、YN24与LM4-N的叶片SPAD值之间无显著差异。与LM4-N相比,LM4-S的叶片SPAD值由52.4降至37.3,降低了28.8%,表明感病品种显症后,叶片SPAD值迅速下降。3月21日,不同品种叶片的SPAD值表现为JM22和YN24>LM4-N > AK58 > LM4-S,LY502、LX99与LM4-N差异不显著。与LM4-N相比,LM4-S的SPAD值由56.7降至35.5,降低了37.4%。3月31日,不同品种叶片的SPAD值表现为YN24 > AK58 > LM4-S,LM4-N、LY502、JM22、LX99与AK58差异不显著。与LM4-N相比,LM4-S的SPAD值由61.1降至46.2,降低了24.4.%。与3月21日相比,LM4-S和AK58的SPAD值逐渐升高。4月10日,所有品种SPAD值之间均不存在显著差异,田间所有品种在叶色上均表现正常。由此可见,小麦黄花叶病对各品种叶片SPAD值的影响不同,其变化动态表明,无明显症状的小麦品种LY502、JM22、YN24、LX99在发病期间叶片SPAD值的波动范围较小;而感病品种AK58和LM4的感病植株LM4-S,起身期(3月11日)叶片SPAD值较低,此后逐渐升高,拔节期以后与其他品种SPAD值之间差异不显著。
2.2 小麦黄花叶病对不同品种小麦春季总茎数的影响
由图2可知,各品种总茎数之间存在显著差异。3月11日,各品种总茎数表现为YN24 > LY502、JM22和LX99>LM4-N和AK58>LM4-S。与LM4-N相比,LM4-S的总茎数由1 366×104·hm2降至1 158×104·hm-2,降低了15.2%,表明感病品种显症后总茎数显著降低。与3月11日相应品种的总茎数相比,3月21日,LY502、JM22、LX99和YN24的总茎数升高,LM4-N和AK58基本保持不变,LM4-S则呈下降趋势;与LM4-N相比,LM4-S的总茎数由1 357×104·hm-2降至968×104·hm-2,降低了28.7%。3月31日,各品种总茎数表现为YN24 > LY502和JM22 > LX99>LM4-N > AK58 > LM4-S;与LM4-N相比,LM4-S的总茎数由1 444×104·hm-2降至1 028×104·hm-2,降低了28.8%。4月10日,各品种总茎数均呈降低趋势,表现为YN24和JM22>LY502>LM4-N>AK58>LM4-S,LY502和LX99总茎数之间差异不显著;与LM4-N相比,LM4-S的总茎数由1 112×104·hm-2降至540×104·hm-2,降低了51.4%。表明小麦黄花叶病会导致感病植株分蘖大量死亡,后期将面临成穗数不足造成的减产风险。
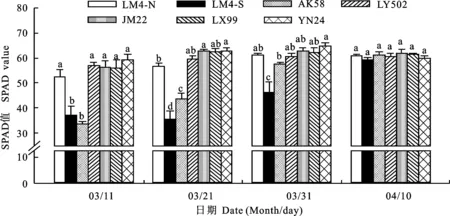
同一日期的图柱上无相同字母表示品种间差异显著(P<0.05)。下同。
Different letters on the columns indicate significant difference among the cultivars at same date at 0.05 level.The same below.
图1各品种不同时期的叶片SPAD值
Fig.1LeafSPADvalueofallcultivarsduringdifferentperiods
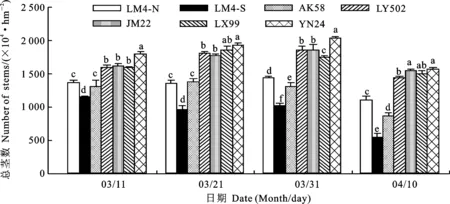
图2 各品种不同时期总茎数
2.3 小麦黄花叶病对不同品种植株干物质积累量的影响
由图3可知,随着小麦的生长,LM4-N、LY502、JM22、LX99和YN24的干物质积累量迅速增加,而LM4-S和AK58则增加缓慢。3月11日,干物质积累量表现为LY502>JM22和YN24>LM4-N、LM4-S和AK58,其中YN24与LX99以及LM4-N、LM4-S与AK58差异均不显著。LM4-N和LM4-S的干物质积累量差异不显著,说明此时小麦黄花叶病尚未对植株干物质积累量产生明显的影响。3月21日,干物质积累量表现为LY502、LX99和YN24>JM22和LM4-N> LM4-S和AK58;与LM4-N相比,LM4-S的干物质积累量由5.5 t·hm-2降至3.7 t·hm-2,降低了32.2%。3月31日,干物质积累量表现为LY502 > JM22和LX99 > YN24和LM4-N> AK58 > LM4-S;与LM4-N相比,LM4-S的干物质积累量由9.1 t·hm-2降至4.5 t·hm-2,降低了50.9%。从3月11日至3月31日,LM4-S和AK58的干物质积累量几乎保持不变,说明小麦黄花叶病严重抑制了感病植株干物质积累量的增加。与3月31日相比,4月10日,各品种植株干物质积累量迅速增加,表现为LY502>JM22>YN24和LM4-N>AK58>LM4-S,其中LX99与JM22差异不显著;与LM4-N相比,LM4-S的干物质积累量由14.5 t·hm-2降至8.4 t·hm-2,降低了42.2%,表明小麦黄花叶病造成感病植株后期干物质积累量大幅度降低。
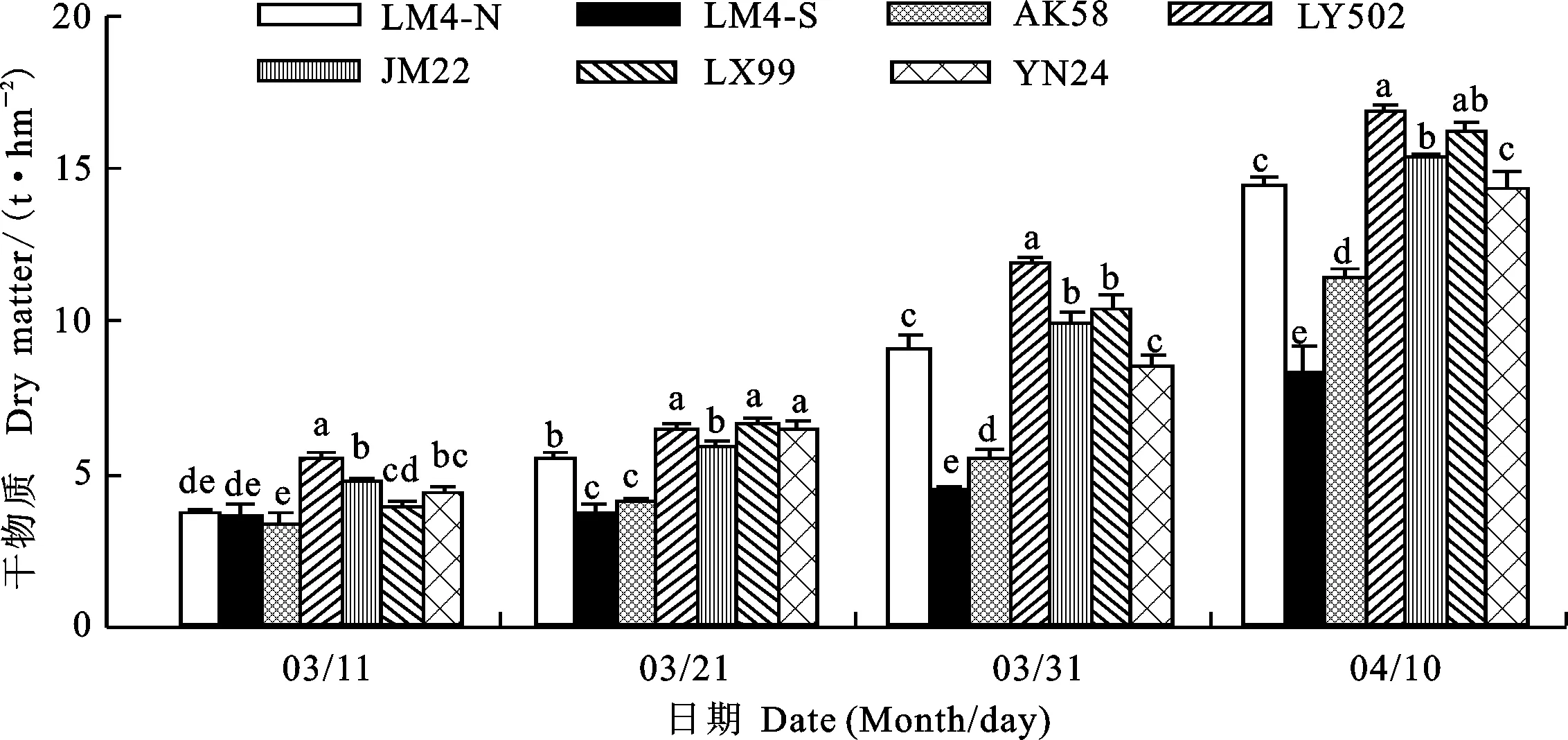
图3 各品种不同时期干物质积累量
2.4 小麦黄花叶病对不同小麦品种成熟期产量性状的影响
由表1可知,成熟期小麦单位面积穗数表现为LX99和JM22>LY502>LM4-N> AK58和LM4-S,其中YN24与LY502差异不显著。与LM4-N相比,感病后LM4-S单位面积穗数由553个·m-2降至436个·m-2,降低了21.2%。就穗粒数而言,LM4-N穗粒数为44.1个,显著高于其余处理,除LY502和AK58穗粒数显著高于LM4-S外,其余处理之间差异不显著。与LM4-N相比,LM4-S穗粒数降至33.3个,降低了24.5%,表明黄花叶病会导致小麦穗粒数显著降低。千粒重以LY502的36.8 g为最高,JM22、LM4-N和LX99的千粒重显著高于AK58,而YN24、LM4-S和AK58的千粒重之间无显著差异。与LM4-N相比,LM4-S的千粒重由34.9 g降至33.5 g,差异不显著,表明黄花叶病对小麦千粒重影响较小。成熟期小麦产量表现为,LY502>YN24和LM4-N> AK58和LM4-S,LY502与JM22和LX99差异不显著。与LM4-N相比,LM4-S的产量减少了2 944.3 kg·hm-2,降低了38.3%,表明黄花叶病会造成小麦产量显著降低。
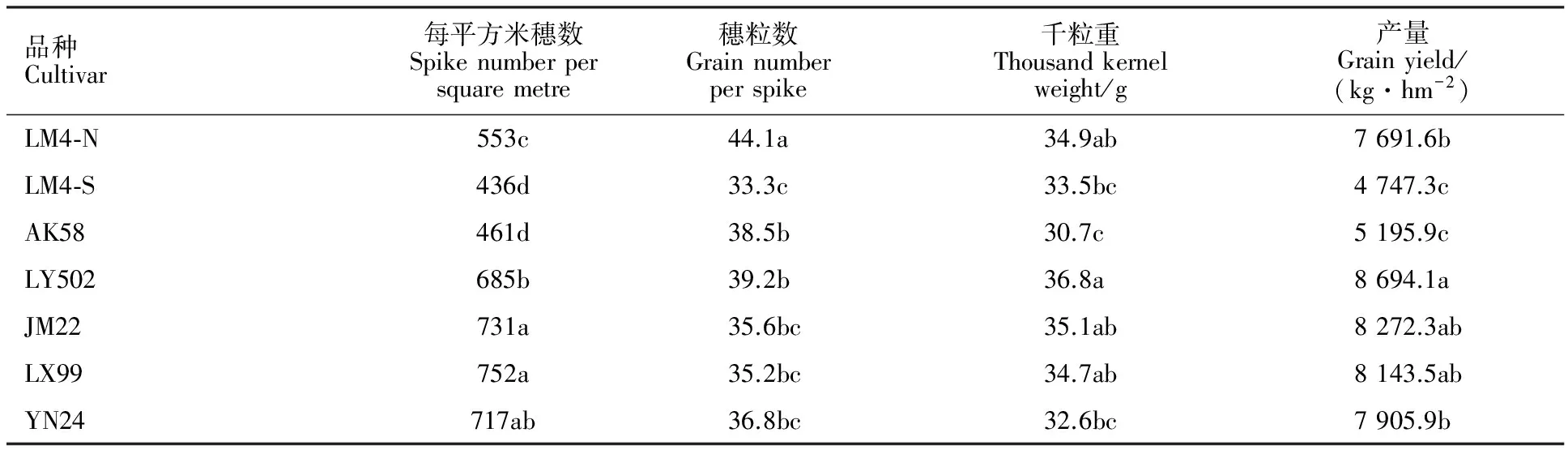
表1 成熟期小麦的产量性状Table 1 Grain yield components of tested cultivars at maturity
3 讨 论
小麦黄花叶病的感病品种被病原侵染以后,一般越冬前不表现发病症状,返青期病株新生叶片开始出现褪绿、黄化现象,抽穗前后叶片症状消退,植株恢复生长[4]。本研究利用叶片SPAD值来反映感病小麦的发病状态,显症以后,LM4-S和AK58的叶片SPAD值均显著低于其余处理,表明小麦黄花叶病毒侵染造成叶绿素破坏,致使叶片叶绿素含量降低,进而导致叶片出现黄化甚至枯死现象。随着气温上升,拔节后期所有品种的叶片SPAD值之间均无显著差异,表明高温对小麦黄花叶病具有抑制作用,叶片的功能逐渐恢复正常。由此可见,感病小麦植株叶片SPAD值的变化趋势与小麦黄花叶病的发病规律相吻合。可以进一步设计试验研究SPAD值与小麦黄花叶病发生程度的相关性,建立应用SPAD值评价小麦黄花叶病的发病程度的体系,并预测小麦黄花叶病的发病动态。
合理的群体结构是小麦取得高产的必要条件,单位面积总茎数以及干物质积累量的多寡直接决定成熟期小麦的穗数、穗粒数和千粒重。缪倩等[5]研究表明,小麦黄花叶病致使感病品种分蘖减少、植株矮缩。本研究中,LM4-S自显症后总茎数逐渐开始下降,始终低于LM4-N,且未出现春季分蘖高峰期。同时,感病植株的干物质积累量显著低于其他处理,表明小麦黄花叶病导致感病植株出现大量分蘖死亡的现象,同时病株的光合生产能力减弱。干物质积累量的降低是由叶绿素含量下降后光合生产力减弱以及单位面积总茎数减少两方面造成的。尽管后期叶片恢复正常功能,但是该病已经对小麦产量造成不可逆的损失。与LM4-N相比,LM4-S的单位面积穗数和穗粒数显著降低,千粒重略有下降。感病品种显症以后分蘖大量死亡导致成熟期穗数降低,而干物质供应不足则是穗粒数和千粒重降低的主要原因。LM4-S和AK58产量显著低于其余处理,说明小麦黄花叶病造成感病小麦品种大幅度减产。
[1] 孙炳剑,羊 健,孙丽英,等.禾谷多黏菌传小麦病毒病的分布及变化动态[J].麦类作物学报,2011,31(5):969.
SUN B J,YANG J,SUN L Y,etal.Distribution and dynamics ofPolymyxagraministransmitted wheat viruses in China [J].JournalofTriticeaeCrops,2011,31(5):969.
[2] HAN C G,LI D W,XING Y M,etal.Wheat yellow mosaic virus widely occurring in wheat(Triticumaestivum) in China.[J].PlantDisease,2000,84(6):627.
[3] 陈剑平,陈 炯,郑 滔,等.禾谷多粘菌传麦类病毒研究进展[J].植物保护,2004,30(2):14.
CHEN J P,CHEN J,ZHENG T,etal.Advance in cereal viruses transmitted byPolymyxagraminisLed [J].PlantProtection,2004,30(2):14.
[4] 赵玖华,徐德坤,尚佑芬,等.山东省小麦黄花叶病的突发与防控措施[J].山东农业科学,2012,44(10):95.
ZHAO J H,XU D K,SHANG Y F,etal.Occurrence and control measures of wheat yellow mosaic viral disease in Shandong [J].ShandongAgriculturalSciences,2012,44(10):95.
[5] 缪 倩,季英华,任春梅,等.一种快速同步检测小麦黄花叶病毒和中国小麦花叶病毒的方法[J].麦类作物学报,2013,33(3):595.
MIAO Q,JI Y H,REN C M,etal.A simplified method for quick detection of wheat yellow mosaic virus and Chinese wheat mosaic virus [J].JournalofTriticeaeCrops,2013,33(3):595.
[6] 岳绪国,景德道,陈爱大.小麦抗梭条花叶病品种的田间筛选及抗性遗传研究初报[J].麦类作物学报,2001,21(3):23.
YUE X G,JING D D,CHEN A D.Primary study on WSSM resistance and field screening of wheat [J].JournalofTriticeaeCrops,2001,21(3):23.
[7] 李大伟,韩成贵.中国小麦黄花叶病毒(WYMV)分布的RT-PCR鉴定[J].植物病理学报,1997,27(4):303.
LI D W,HAN C G.Identification of the wheat yellow mosaic virus occurring in China by RT-PCT [J].ActaPhytopathologicaSinica,1997,27(4):303.
[8] 陈剑平.中国禾谷多黏菌传麦类病毒研究现状与展望[J].自然科学进展,2005,15(5):524.
CHEN J P.Research status and prospect cereal viruses transmitted by plymyxa graminis led in China [J].ProgressinNaturalScience,2005,15(5):524.
[9] 吴 斌,姜珊珊,张 眉,等.山东省小麦生产品种对小麦黄花叶病毒病的抗性[J].麦类作物学报,2017,37(3):332.
WU B,JIANG S S,ZHANG M,etal.Resistance of wheat cultivars to wheat yellow mosaic virus in Shandong [J].JournalofTriticeaeCrops,2017,37(3):332.
[10] 刘伟华,何震天,耿 波,等.小麦对黄花叶病的抗性鉴定及典型品种的遗传分析[J].植物病理学报,2004,34(6):542.
LIU W H,HE Z T,GENG B,etal.Identification of resistance to yellow mosaic disease of wheat and analysis for its inheritance of some varieties [J].ActaPhytopathologicaSinica,2004,34(6):542.
[11] 孙炳剑,李洪连,杨新志,等.河南省主要推广品种对小麦黄花叶病毒抗性的评价[J].植物保护学报,2011,38(2):102.
SUN B J,LI H L,YANG X Z,etal.Evaluation of commercial wheat cultivars for resistance to wheat yellow mosaic virus in Henan [J].JournalofPlantProtection,2011,38(2):102.
[12] 周益军,程兆榜,侯庆树,等.小麦品种对梭条花叶病的抗性研究[J].植物保护学报,2000,27(2):102.
ZHOU Y J,CHENG Z B,HOU Q S,etal.Resistance of wheat varieties to wheat spindle streak mosaic disease [J].JournalofPlantProtection,2000,27(2):102.
[13] 何震天,陈秀兰,张 容,等.高抗黄花叶病新品种扬辐麦4号的选育[J].核农学报,2011,25(1):75.
HE Z T,CHEN X L,ZHANG R,etal.Breeding of new variety Yangfumai 4 with high resistance to wheat yellow mosaic disease [J].JournalofNuclearAgriculturalSciences,2011,25(1):75.
[14] 朱新开,盛海君,顾 晶,等.应用SPAD值预测小麦叶片叶绿素和氮含量的初步研究[J].麦类作物学报,2005,25(2):46.
ZHU X K,SHENG H J,GU J,etal.Primary study on application of SPAD value to estimate chlorophyll and nitrogen content in wheat leaves [J].JournalofTriticeaeCrops,2005,25(2):46.
[15] 赵 犇,姚 霞,田永超,等.基于上部叶片SPAD值估算小麦氮营养指数[J].生态学报,2013,33(3):916.
ZHAO B,YAO X,TIAN Y C,etal.Estimation of nitrogen nutrient index on SPAD value of top leaves in wheat [J].ActaEcologicaSinica,2013,33(3):916.
EffectofWheatYellowMosaicViralDiseaseonBiologicalTraitsandGrainYieldofDifferentWheatCultivars
CUIZhengyong1,LIPeng1,GAOGuoqiang1,KANHaili2,DUZhencui2,ZHANGFengyun1,SUNMingzhu1,LIXinhua1
(1.Institute for Application of Atomic Energy,Shandong Academy of Agricultural Science,Jinan,Shandong 250100,China; 2.Plant Protection Station of Junan County,Linyi,Shandong 276600,China)
时间:2017-09-13
网络出版地址:http://kns.cnki.net/kcms/detail/61.1359.S.20170913.1139.016.html
S512.1;S311
A
1009-1041(2017)09-1175-06
2017-01-10
2017-07-12
山东省农业科学院重大科技成果培育计划项目(2014CGPY03);“十三五”国家重点研发计划项目(2016YFD0102101);山东省自主创新重大关键技术项目(2014GJJS0201); 国家科技支撑计划项目(2014BAA03B04;2013BAD01B02);国家公益性行业(农业)科研专项(201303007-1)。
E-mail:qlwheat@163.com(崔正勇);E-mail:lipengwwt@163.com(李 鹏,与作第一作者同等贡献)
李新华(E-mail:lixinhuaf@163.com)
