聚乙烯吡咯烷酮保护的纳米银可视化检测三聚氰胺
2017-10-15李春娟龙云飞
唐 建, 陈 述, 李春娟, 龙云飞
(湖南科技大学化学化工学院,理论化学与分子模拟省部共建教育部重点实验室, 湖南湘潭 411201)
三聚氰胺是一种三嗪类含氮杂环有机化合物,其氮含量高达66%,将其添加到食品及饲料中可以提高蛋白质的虚高含量[1]。因此,食品中三聚氰胺的检测具有现实意义。目前,常用的三聚氰胺检测方法有高效液相色谱法[2]、气相色谱-质谱法[3]、电化学方法[4]以及同位素法[5]等。这些方法中大多操作比较繁琐,有些需要昂贵的仪器,不适于现场检测。因此,开发简单并能应用于现场分析的三聚氰胺检测方法,是该领域的重要发展方向。基于金属纳米粒子聚集而导致颜色变化的比色分析法引起了人们越来越多的关注[6],该方法已广泛用于检测金属离子[7]、小分子[8]和蛋白质[9]。其中,金纳米粒子(AuNPs)由于具有容易制备、稳定、生物相容性好、尺寸可调及高的消光系数等特性而被广泛应用于比色分析[10]。银纳米粒子(AgNPs)和AuNPs相比,拥有更高的吸光系数,因而在比色分析中也具有自身的优势。但是由于银表面容易氧化[11],使其在比色分析中存在稳定性相对较差的缺点,界面功能化和选择合适的稳定剂对提高AgNPs比色分析结果稳定性具有很好的效果。比如用适当配体稳定的功能化AgNPs已成功的用于氨基酸[12]、DNA[13]的比色分析。
利用目标分析物与纳米粒子表面分子之间的相互作用,引起纳米粒子聚集并导致颜色变化已用于检测2,4,6-三硝基甲苯[14]、含巯基的氨基酸和肽[15]。Han等[16]用对硝基苯胺稳定的纳米银,可视化检测出0.1 mg/kg含量的三聚氰胺。本文采用低毒的聚乙烯吡咯烷酮(PVP)稳定的AgNPs为探针,通过富电子的三聚氰胺和AgNPs表面上的缺电子PVP发生相互作用后,引起AgNPs团聚,导致吸收光谱的变化和溶液颜色的变化,从而建立了可视化检测三聚氰胺的方法,该方法具有更好的应用前景。
1 实验部分
1.1 仪器与试剂
Lambda35型紫外-可见分光光度计(美国,铂金埃尔默仪器公司);Tecnai G20型透射电子显微镜(美国,FEI公司);KQ2200DE型超声波清洗器(昆山市超声仪器有限公司);DF-101B型集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司)。
PVP(平均分子量:58000,Aladdin Chemistry Co.),三聚氰胺、NaBH4(国药集团化学试剂有限公司),硼酸(长沙分路口塑料化工厂),H3PO4(湖南汇虹试剂有限公司),HCl(湖南省株洲市化学工业研究所),NaOH、AgNO3、柠檬酸钠(汕头市西陇化工厂),所有试剂均为分析纯,在使用前均没有进一步纯化。实验用水为二次蒸馏水。
1.2 实验过程
1.2.1PVP保护的AgNPs的制备AgNPs的制备参照Sun等的实验[17],具体做法为:将47.5 mL二次蒸馏水加入到锥形瓶中,通氮气除氧30 min后,将锥形瓶置于磁力搅拌器中,依次加入0.5 mL柠檬酸三钠(30 mmol/L)、1.0 mL AgNO3(5.0 mmol/L)、0.5 mL新制的NaBH4(50.0 mmol/L),此时溶液由无色变为微黄,30 s后加入0.5 mL PVP(0.5 mg/mL),反应30 min后将锥形瓶取出,此时溶液为深黄色。
1.2.2三聚氰胺合成样品的制备向含5.0×10-6mol/L三聚氰胺的1.4 mL溶液中分别加入200 μL Fe3+(5.0×10-5mol/L)、Cu2+(5.0×10-5mol/L)、半胱氨酸(5.0×10-5mol/L),混匀后制得合成样品1;向含5.0×10-6mol/L三聚氰胺的1.4 mL溶液中分别加入200 μL Al3+(5.0×10-5mol/L)、Co2+(5.0×10-5mol/L)、L-组氨酸(5.0×10-5mol/L),混匀后制得合成样品2。
1.2.3牛奶样品前处理提取液的配制和牛奶样品中三聚氰胺的提取参考文献方法[5],对溶剂用量进行了适当调整,具体方法如下:(1)提取液的配制:取750 mL 0.1%三氯乙酸溶液与750 mL乙腈混溶,避光保存。(2)牛奶样品中三聚氰胺的提取:准确移取0.40 mL牛奶样品于5.0 mL具塞塑料离心管中加入3.2 mL提取液和20.0 μmol/L的三聚氰胺内标溶液0.4 mL(相当于提取液中加入的三聚氰胺的浓度为2.00 μmol/L),超声提取10 min,振荡提取10 min,于10 000 r/min离心10 min,过滤,取上清液备用。
1.2.4紫外-可见光谱研究和三聚氰胺的检测紫外-可见光谱通过Lambda35型紫外-可见分光光度计检测。将200 μL不同浓度的三聚氰胺加入1.7 mL AgNPs中,摇匀后再加入100 μL的B-R缓冲溶液(pH=8.69),摇匀,避光放置6 h 后进行测试。
2 结果与讨论

图1 检测三聚氰胺的原理Fig.1 Mechanism for detection of melamine
2.1 三聚氰胺的检测原理
AgNPs的合成及对三聚氰胺检测的原理如图1所示。由于三聚氰胺中的氮原子含有孤对电子,因此三聚氰胺可以作为电子供体,可以向作为受体的缺电子的PVP提供电子,这种相互作用可引起AgNPs的聚集,最终导致溶液的紫外-可见光谱和溶液颜色的变化,这种变化与三聚氰胺浓度之间存在内在联系,从而可实现三聚氰胺的定量检测。
2.2 AgNPs的紫外-可见吸收光谱
用PVP做保护剂制备的AgNPs呈深黄色,其局域表面等离子体特征峰位于396 nm处(图2中曲线a),将此纳米粒子避光放置半个月后颜色和吸收峰位置都无明显变化。当往制得的AgNPs中加入pH值为8.69的B-R缓冲溶液后,AgNPs的黄色变浅,其局域表面等离子体特征峰会蓝移至392 nm处(图2中曲线 b)且吸收峰的强度增大、吸收峰变窄。这可能是由于B-R缓冲溶液将大粒径的AgNPs溶解成小粒径的AgNPs所致。当往AgNPs中加入2.0 μmol/L的三聚氰胺后(图2中曲线c),AgNPs的吸光度降低、吸收波长红移,并在530 nm附近出现一新的吸收峰,AgNPs颜色由黄色变为灰色。这些变化是由于AgNPs的团聚引起的。

图2 不同条件下AgNPs的紫外-可见吸收光谱Fig.2 UV-Vis absorption spectra of AgNPs under different conditions(a) AgNPs;(b) AgNPs+ B-R buffer;(c) AgNPs+ melamine+B-R buffer.
2.3 AgNPs与三聚氰胺反应后的形貌表征
将制备的AgNPs和分别与0.5 μmol/L、2.0 μmol/L 三聚氰胺反应后的AgNPs进行透射电镜(TEM)表征得到的形貌如图3所示,单独的AgNPs粒径较小,且分散均匀(图3a),当往AgNPs中加入0.5 μmol/L的三聚氰胺后,AgNPs 发生轻微团聚并且粒径有所增大(图3b);加入2.0 μmol/L 三聚氰胺后,AgNPs 发生明显团聚并且粒径变得更大。这是由于三聚氰胺可以与AgNPs表面上的PVP发生相互作用,引起AgNPs的聚集,甚至发生颗粒间的融合,出现大量的大颗粒。
2.4 检测三聚氰胺实验条件的优化
2.4.1pH值的优化图4是pH对检测三聚氰胺的影响,结果表明在pH为8.69的B-R缓冲溶液中,AgNPs与三聚氰胺作用后的吸光度改变值最大,在其它pH条件下,AgNPs的吸光度改变较小,因此实验选择pH值为8.69的B-R缓冲溶液作为工作条件。

图3 AgNPs与不同浓度三聚氰胺反应后的透射电镜(TEM)图 Fig.3 TEM images of AgNPs reacting with different concentrations of melamine(a) 0 μmol/L;(b) 0.5 μmol/L AgNPs;(c) 2.0 μmol/L.
2.4.2AgNPs浓度的优化在三聚氰胺浓度不变的条件下,改变AgNPs的浓度,当AgNPs浓度为0.4 mmol/L(以银原子的浓度计算)时,AgNPs和三聚氰胺反应后吸光度降低得最大,见图5。这是因为作为电子供体的三聚氰胺的浓度一定时,AgNPs浓度越大,作为电子受体的PVP浓度也越大,电子供体和受体之间的相互作用就会减弱,从而不利于AgNPs团聚。AgNPs的浓度降低时,虽然电子供体和受体之间的相互作用会增加,但是由于AgNPs间的间距增大也不利于AgNPs团聚。因此,只有当AgNPs浓度适当,电子供体和受体间的相互作用较强时才能很好的引起AgNPs团聚。

图4 pH对检测三聚氰胺的影响Fig.4 The influence of the pH on the melamine detection
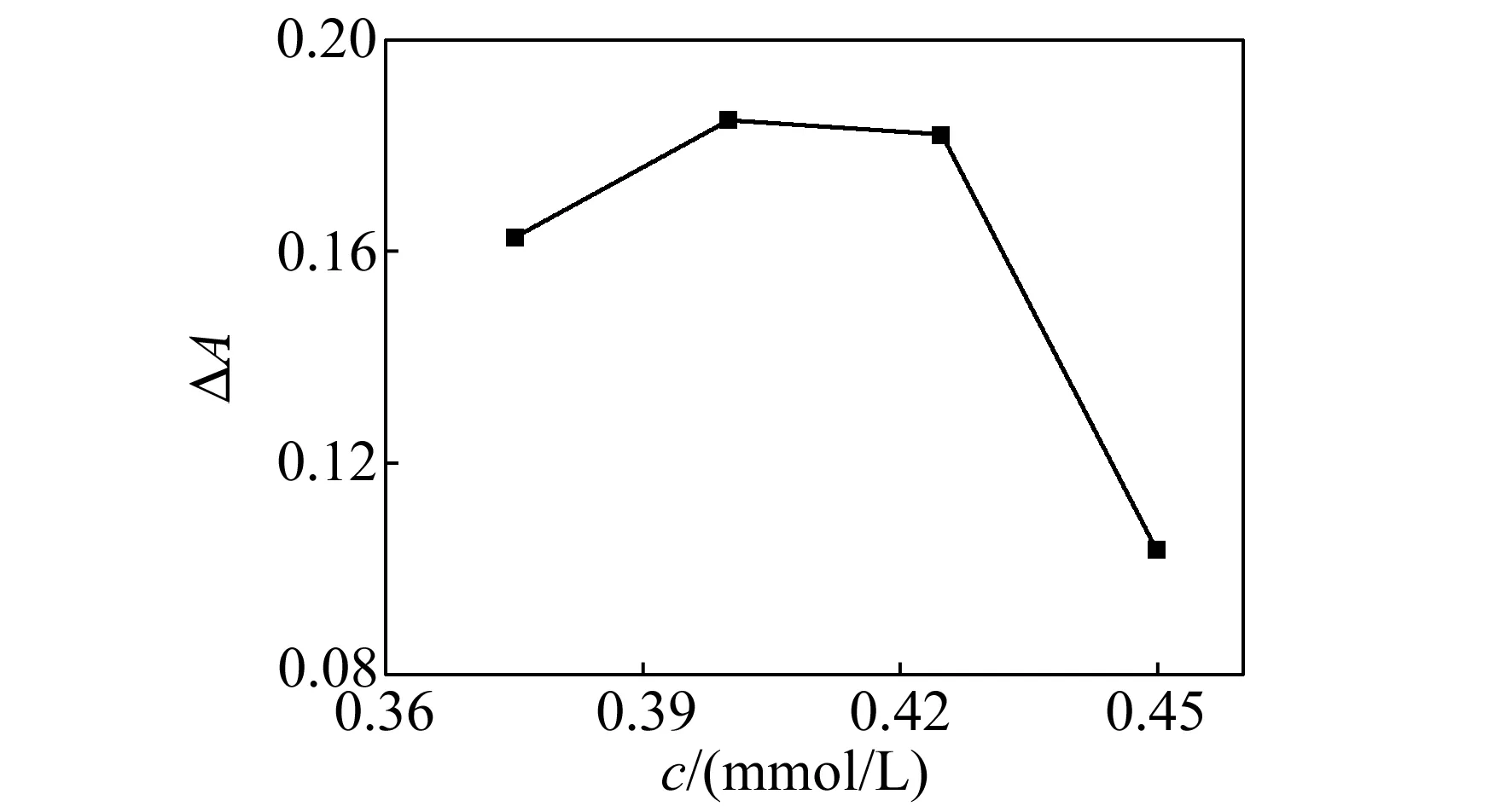
图5 AgNPs浓度对三聚氰胺检测的影响Fig.5 The influence of the concentration of AgNPs on the melamine detection
2.4.3反应时间优化实验发现制备的AgNPs与三聚氰胺要反应一定时间后才能使AgNPs的吸光度降到最低。结果表明,随着反应时间的延长,AgNPs的吸光度逐渐下降,反应时间为6 h时,AgNPs的吸光度降到最低。因此,我们确定实验的反应时间为6 h。
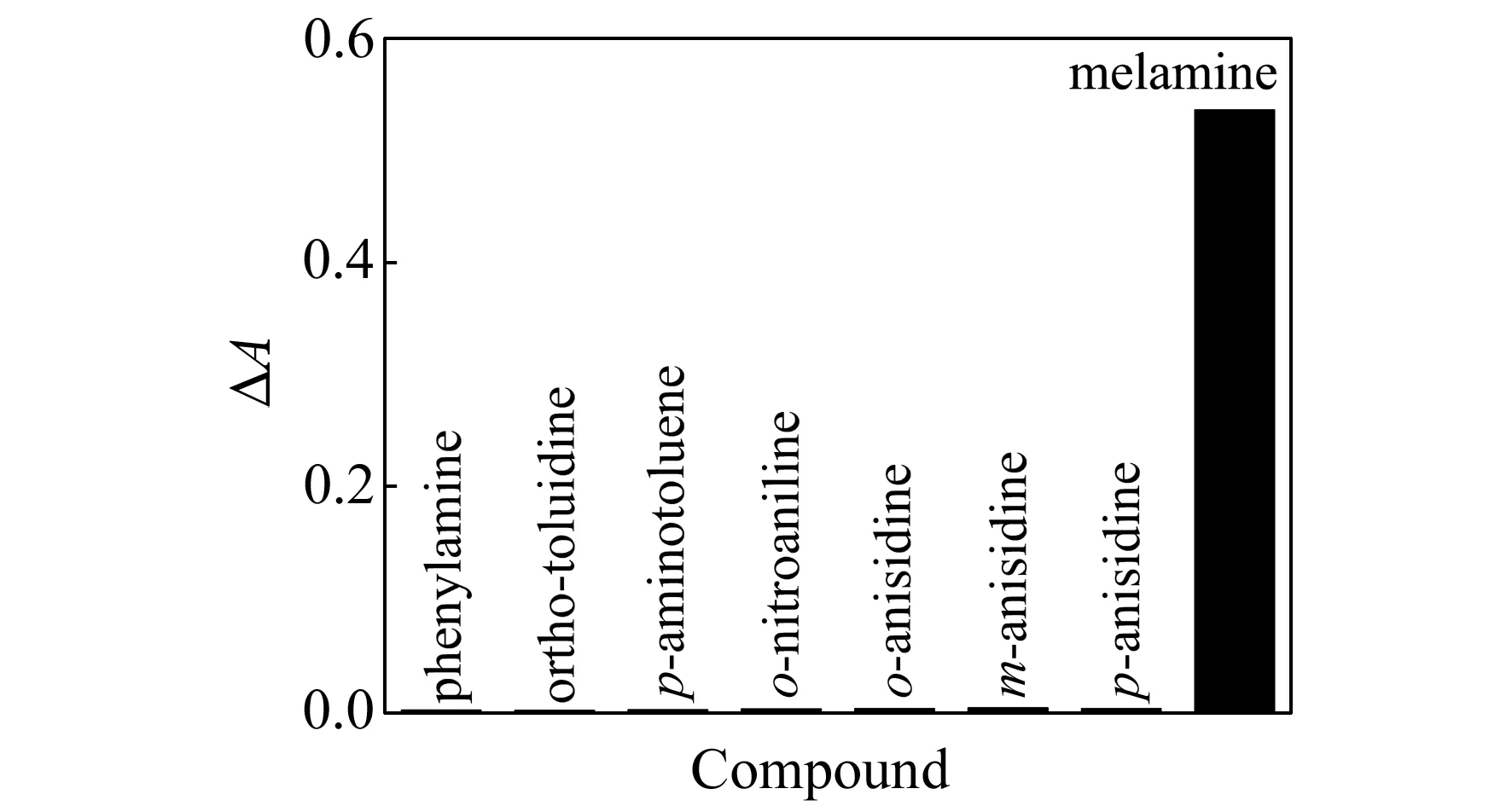
图6 与三聚氰胺具有相似结构的物质对三聚氰胺检测的影响Fig.6 The influence of the melamine analogues on the melamine detection
2.5 结构相似物质对AgNPs吸光度的影响
为了考察该检测方法对三聚氰胺的选择性,在相同测试条件下,在与三聚氰胺浓度(2.0×10-6mol/L)相同的情况下,探讨了几种与三聚氰胺具有相似结构的物质与AgNPs反应后引起的吸光度的变化情况。结果如图6所示,在实验选定的条件下,三聚氰胺与AgNPs反应后使AgNPs吸光度下降得最多,其它物质的信号响应值均小于三聚氰胺信号响应值的5.0%。说明在该实验条件下,AgNPs对三聚氰胺的识别具有良好的选择性。
2.6 三聚氰胺的检测参数
在最佳实验条件下,按照实验方法,在300~600 nm波长范围内扫描紫外-可见吸收光谱(图7a)。从图中可以看出,随着加入的三聚氰胺浓度的增大,AgNPs在392 nm处的吸光度降低,吸收峰位置红移,并在530 nm处出现一个新吸收峰,AgNPs的颜色由浅黄变成深黄最后变成灰色,这些变化都是由于AgNPs的聚集引起的。浓度在5.0×10-8~2.0×10-6mol/L范围内,在392 nm处的吸光度降低值与三聚氰胺的浓度之间存在较好的线性关系(图7b),线性方程为:△A=0.01574+0.2266c,相关系数r为0.9951。另一方面,当浓度在0.1~2.0×10-6mol/L范围内,颜色变化可以直接用肉眼分辨,由此可以建立一种三聚氰胺的半定量检测方法。和同位素法[5]相比较,本方法更为简单且灵敏度更高。

图7 AgNPs与不同浓度三聚氰胺反应的紫外-可见吸收光谱(a)和线性曲线(b)Fig.7 UV-Vis absorption spectra(a) and linear curve(b) of AgNPs reacting with different concentrations of melamine The concentration of melamine from line 1 to 7(μmol/L):0,0.05,0.1,0.5,1.0,1.5,2.0.
2.7 合成样品中三聚氰胺含量的检测
根据标准曲线,对1.2.2节中2个合成样品中的三聚氰胺进行检测,结果如表1所示。由表1可知,合成样品的回收率在91.43%~105.70%之间,牛奶样品中的加标回收率在91.00%~97.50%范围,说明选择的牛奶样品中不含有三聚氰胺,同时说明方法有一定的实际应用价值。

表1 样品的测定结果
3 结论
本文利用富电子的三聚氰胺和缺电子的PVP在AgNPs界面上进行电子相互转换,从而引起AgNPs团聚,团聚前后AgNPs的颜色和吸光度都会发生明显变化,且AgNPs在392 nm处的吸光度随三聚氰胺浓度的增大呈梯度降低。据此,建立了一种定量检测三聚氰胺的方法,当三聚氰胺浓度在0.1×10-6~2.0×10-6mol/L范围,溶液的颜色变化与三聚氰胺浓度关系可以直接用肉眼分辨,由此可以建立一种简单的可视化检测三聚氰胺方法。
