模拟干旱对亚热带森林土壤微生物生物量及群落结构的影响
2017-10-13聂园园周贵尧邵钧炯周灵燕刘瑞强翟德苹周旭辉
聂园园,周贵尧,邵钧炯,周灵燕,刘瑞强,翟德苹,周旭辉
(1. 复旦大学 生物多样性科学研究所, 教育部生物多样性与生态工程重点实验室, 上海 200438;2. 华东师范大学 生态与环境科学学院,上海 200062;3. 安徽农业大学 生命科学学院,合肥 230036)
模拟干旱对亚热带森林土壤微生物生物量及群落结构的影响
聂园园1,周贵尧2,邵钧炯2,周灵燕3,刘瑞强2,翟德苹2,周旭辉1
(1. 复旦大学 生物多样性科学研究所, 教育部生物多样性与生态工程重点实验室, 上海 200438;2. 华东师范大学 生态与环境科学学院,上海 200062;3. 安徽农业大学 生命科学学院,合肥 230036)
土壤微生物作为生态系统的重要组成部分,在生态系统的物质转化和能量流动等生物地球化学循环过程中起着重要作用.本文以亚热带典型森林为研究对象,通过设置隔离穿透水的干旱处理、样地建设影响的干扰处理,以及自然状态下的空白对照处理,利用磷脂脂肪酸(Phospholipid Fatty Acid, PLFA)分析法,研究了干旱环境对森林生态系统土壤微生物生物量及群落结构的影响.结果表明: 不同处理方式对土壤温度影响差异不显著,但干旱显著降低了土壤湿度.与对照组相比,干扰处理下土壤微生物生物量与群落结构没有显著变化,干旱处理轻微显著降低了3个土层土壤微生物总PLFAs、细菌和真菌PLFAs含量(P<0.1).干旱对i15:0和16:0两种表征细菌的脂肪酸含量没有显著影响,但对a15:0,i16:0,16:12OH和18:1ω7c等4种表征细菌的脂肪酸含量影响明显.土壤微生物总PLFAs含量与土壤含水量在干旱处理下显著正相关,而在干扰和对照处理下呈现负相关关系.这些结果表明,干旱影响了森林生态系统土壤微生物生物量及群落结构,并且土壤水分是引起干旱条件下微生物生物量变化的关键因素.
干旱环境; 土壤微生物; 磷脂脂肪酸; 亚热带森林
土壤微生物作为分解者,在陆地生态系统生物地球化学循环过程中发挥着重要作用[1],是指示和反映土壤肥力特性的一个重要指标[2].土壤微生物群落结构和生物量是土壤生态系统功能的基础,同时也是综合影响土壤物理、化学和生物学过程的重要因子[3].微生物对外界环境反应敏感,温度、湿度、盐分和酸碱度等因子均可显著改变其群落结构[4].干旱由于能显著降低土壤含水量、减少根系分泌物和凋落物,同时对土壤理化性质,如酸碱度、通气性、颗粒组成、团聚体含量和营养状况等产生重要影响,成为驱动地下生态系统微生物变化的重要因素[5].据IPCC报道,在过去的一个世纪,由于温室气体的排放,全球温度平均升高约0.78℃,到本世纪末,大气温度将会持续增加约1.1~4.8℃[6].近半个世纪以来,全球气候变化显著增加了干旱事件发生的频率和强度,不仅严重威胁到生态系统的稳定性和多样性,同时对生态系统的服务功能也造成巨大影响[5].因此,开展微生物对未来气候变化,特别是对干旱的反馈研究,为进一步理解和探讨气候变化背景下生态系统结构和功能的响应特征具有重要意义.
模拟干旱是目前研究气候变化对土壤微生物结构和群落影响的有效方法.近年来,国内外陆续开展了大量关于干旱对微生物生物量和群落结构影响的研究.例如,Uhlirova等[7]研究发现,干旱条件下,真菌相对细菌而言具有较强的耐旱性,同时革兰氏阳性菌耐旱性显著高于阴性菌;Schimel等[8]进一步揭示出革兰氏阳性菌细胞壁较厚是其耐旱性强的主要原因;Fierer等[9]研究表明,干旱发生时,土壤中细菌通过水分流动和有机质扩散获取养分的途径受到抑制,生长繁殖所需的有效资源减少,但真菌能够通过菌丝穿过透气土壤颗粒获取未溶解的养分,并将这些养分输送到需要水分和养分的细胞中,从而提升适应干旱的能力.国内,李国斌等人通过模拟干旱实验发现,随着干旱程度的加剧,细菌生物量出现先升后降的变化趋势,同时根际菌类生物量与地上植物生物量存在显著正相关关系[10];刘方春等人发现干旱能够显著改变微生物的群落结构和生物量,适度干旱有利于提高细菌和放线菌生物量,同时促进细菌群落结构的多样性[4].以上研究多集中于湿地[11- 12]、草原[13- 14]以及农田生态系统[15- 16],且不同生态系统微生物群落结构和生物量对干旱的响应特征也存在显著差异.虽然森林生态系统,特别是亚热带森林生态系统,由于其特殊的生境,在陆地生态系统中具有重要的生态与服务功能价值[17],但到目前为止,关于森林生态系统中土壤微生物对干旱环境响应的研究还鲜有报道.
磷脂脂肪酸(Phospholipid Fatty Acid, PLFA)是活体微生物细胞结构的重要组成成分,其含量在自然生理条件下较稳定,且不同菌群具有独特的PLFA特征谱图(包括PLFA含量、组成),因此磷脂脂肪酸构成的变化可以指示土壤微生物群落结构的改变,从而对微生物群落进行识别和定量描述[18- 19].此分析方法与分子生物学方法相比,具有实验条件要求低、操作难度小、成本适中、实验结果客观可靠、并在获取微生物群落信息时更加简便、快捷、高效等特点,从而得到了较广泛的应用.如牛佳等[11]利用该分析方法定量统计了若尔盖高寒湿地干湿土壤微生物群落结构、总生物量、各菌群生物量;林生等[20]采用磷脂脂肪酸(PLFAs)标记法对不同年限茶树根际土壤微生物多样性进行了研究,结果表明20年茶树根际土壤的真菌PLFAs含量高于其他土壤样品,细菌PLFAs含量与1年土壤相近;李永山等[21]利用PLFA方法研究转基因棉花对土壤微生物群落结构变化的影响,研究发现转基因棉花降低了棉田土壤革兰氏阳性细菌比例,提高真菌和放线菌比例.基于上述原因,本研究以浙江天童亚热带常绿阔叶林为实验对象,通过PLFA法分析探讨不同干旱条件下土壤微生物生物量和群落结构的变化特征,以期为森林生态系统管理提供一定理论依据.
1 材料和方法
1.1样地概况
实验地位于浙江省宁波市鄞州区天童国家森林公园(29°48′N,121°47′E).该地区平均海拔约300m,最高峰太白山顶653.3m,是典型的亚热带季风气候区,全年气候温暖湿润,雨量充沛,四季分明,年平均气温是16.2℃,月平均最高和最低气温出现在7月和1月,温度分别为28.1℃、4.2℃.区域年平均降雨量约1551mm,年蒸发量为1320.1mm,因该地区常常受到梅雨锋系以及台风影响,降雨高峰通常出现在每年的5—8月,年相对空气湿度高达85%.全年日照时间高达2010h,无霜期237.8d.此外,天童山国家森林保护区属于典型的浙江东部的低山丘陵,土壤性质为黄红壤,成土母质是中生代的沉积岩、部分呈酸性的火成岩以及石英砂岩和花岗岩的残积风化物,土壤的厚薄度不一致,一般在1m左右[22- 24].
实验地点自然条件和地理位置优越,具有发育良好的森林植被,属于我国东部典型的中亚热带北缘常绿阔叶林,林冠郁闭度高,植被盖度在80%~90%.木荷(Schimasuperba)、栲树(Castanopsisfargesii)、米槠(Castanopsiscarlesii)、石栎(Lithocarpusglaber)等是该区域的优势树种.草本层则主要以里白(Hicriopterisglauca)为优势物种,乔木、灌木、草本植物的垂直分层明显[23- 24].
1.2样地设置
2012年9月,在高于野外研究站海拔约120m处,选择了一片树龄约50~70年的次生林,在其中选取9块立地状况和植被组成相类似的25m×25m的样地,编号为1~9.随机选择1、2、4号为干旱处理组,沿样地边缘挖掘1.2~2m深沟渠并放置焊接PVC板,后将土壤回填并压实,以此隔绝地表径流.在样地中搭建钢架,每隔10cm放置一个宽40cm开口向上的V形透明PVC板,遮挡约80%样地面积,隔离穿透水.随机选择7、8、9号样地为空白对照组,不做任何处理.3、5、6号样地为测定干旱样地建设过程中人为干扰影响而设置的干扰处理组,每隔20cm左右放置一个宽30cm开口向下的V形透明PVC板,除没有隔离降水外,其余设施均与干旱处理相同.2013年6月所有处理样地建设完毕.
在9个样地周围放置3个气象数据采集器,其中1号采集器位于1,8和9号样地之间,2号采集器位于2~5号样地之间,3号采集器位于6号和7号样地之间.在每个样地分5,15,30,50cm和75cm 5个土层深度布设温度和湿度探头,每隔30s采集一次温度和湿度数据,并换算成24h均值.
1.3土壤样品采集与微生物群落测定
2013年9月,在9块样地中随机选取3个取样点,用直径5cm土钻分别采取0~10cm,10~20cm和20~30cm 3个土层土壤.在采样时尽量避免人为干扰,采取的土壤样品去除凋落物、细根、砾石等杂质,过2mm筛后进行PLFAs分析,同时用烘干法测定土壤含水量以用于计算相当于8g干土的鲜土重.
PLFA分析主要参照Bossio和Scow[25]描述的实验方法,具体步骤如下: (1) 称取相当于8g干重的新鲜土壤,倒入离心管中,加入23mL提取液(氯仿/甲醇/磷酸体积比为1∶2∶0.8)后,放置于摇床上中速振荡2h.(2) 把离心管转移至3000r/min的离心机离心10min,将上清液倒入加有12mL氯仿和12mL磷酸缓冲溶液的分液漏斗中;下层土壤沉淀再用23mL提取液重复提取1次.将第二次离心获得的上层清液倒入分液漏斗中,摇匀,在避光条件下,静置过夜.(3) 次日,将分液漏斗中下层氯仿层接入试管中,在30~32℃水浴中用高纯氮气吹干.用1mL氯仿分5次将浓缩的脂肪酸转移到活性硅胶柱中,分别用3mL氯仿、3mL丙酮和甲醇洗提,弃去氯仿和丙酮洗提液,收集甲醇洗提液,在32℃水浴中用高纯氮气吹干后,依次加入1mL甲醇与甲苯混合液(体积比1∶1)与1mL 0.2mol/L KOH甲醇溶液,振荡混匀,在37℃水浴中加热15min.(4) 加入0.3mL 1mol/L的醋酸、2mL正己烷和2mL纯水,低速振荡10min,提取上层溶液;剩余溶液用2mL正己烷重新提取1次,两次提取的上层溶液混合后,用高纯氮气吹干,得到甲酯化的磷脂脂肪酸样品.
该样品用200μL正己烷溶解,以19∶0甲酯作为内标物.在气相色谱仪(Hewlett- Packard 6890 series GC, FID)上采用MIDI系统软件(MIDI,Inc.,Newark,DE)测定峰值,每个峰值代表每种PLFA含量[18].
1.4PLFA命名原则与表征
PLFA的命名是碳原子总数: 双键数和双键距离分子末端的位置来命名,后缀c(cis)和t(trans)表示顺式和反式的异构体;a(anteiso)和i(iso)分别表示支链的反异构和异构,cy(Cyclopropyl)表示环丙烷脂肪酸;10Me表示一个甲基侧链在距离分子末端第10个碳原子上,br表示甲基支链的位置未知;OH前的数字表示羟基的位置[26].
根据已有的报道,PLFAs i14:0,i15:0,a15:0,i16:0,i17:0,a17:0可用来表征革兰氏阳性细菌(G+)[27];15:03OH,16:12OH,16:1ω7c,cy17:0,18:1ω7c,cy19:0可用来表征革兰氏阴性细菌(G-)[27];i14:0,i15:0,a15:0,i16:0,i17:0,a17:0,15:03OH,16:12OH,16:1ω7c,cy17:0,18:1ω7c,cy19:0,16:0表征细菌[28];18:1ω9,18:2ω6,9c,16:1ω5c可用来表征真菌[29].
1.5数据统计分析
数据统计分析采用SPSS 16.0软件,用t- test分析不同处理之间土壤微生物PLFAs含量(ω)差异,显著水平采用P≤0.05.用SPSS 16.0的主成分分析法(Principal Components Analysis, PCA)分析处理间土壤微生物PLFAs含量的差异与变异性.PLFAs含量用SigmaPlot 10.0软件绘制成图.
2 结果与分析
2.1干旱对土壤温度和含水量影响
图1(见第100页)为不同处理方式下不同土层土壤温度和湿度(土壤体积含水量,φ)的变化情况.从图中可以看到,不同处理方式对土壤温度无显著影响,同时不同土层之间温度差异也不明显.与之相反,不同处理下土壤湿度差异明显.在3个土层深度,干旱处理下土壤湿度均显著低于干扰和对照处理,但在不同土层,干扰和对照处理间的差异并不一致.在0~10cm和20~30cm两个土层,干扰和对照处理下土壤湿度差异不明显,而在10~20cm土层深度上,对照处理下土壤湿度总体趋势高于干扰处理.
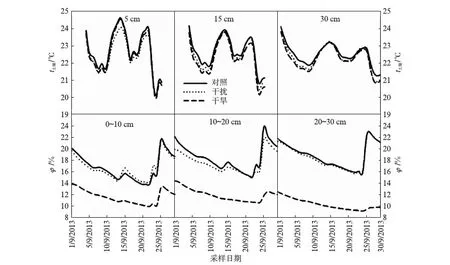
图1 土壤温度与体积含水量Fig.1 Soil temperature and volume water content
2.2干旱对土壤微生物生物量及群落结构的影响
干旱处理与对照组相比,土壤微生物总PLFAs、细菌和真菌PLFAs含量在3个土层上有轻微显著差异.在同一土层水平上,干旱和干扰处理之间土壤微生物总PLFAs、细菌和真菌PLFAs含量存在差异.在0~10cm和10~20cm两个土层上,干扰处理下土壤微生物总PLFAs、细菌和真菌PLFAs含量均显著高于干旱处理,但在20~30cm上,两种处理方式下3个变量之间没有显著差异.综合土层深度来看,与对照组相比,0~10cm干旱处理下土壤微生物总PLFAs、细菌和真菌PLFAs含量分别显著降低了23.87%,24.33%和21.58%,而在10~20cm下分别显著降低了32.07%,32.16%和31.57%(图2,图3,见第100页).

图2 不同土层及处理中细菌、真菌PLFAs含量Fig.2 Bacterial PLFAs and fungal PLFAs in different soil depths under different treatments以干土计重,n=9.不同字母表示差异显著(P≤0.05),其中A,B表示处理间差异,a,b表示土层间差异.
对土壤总PLFAs的主成分分析(PCA)结果表明,在总的土层空间尺度上,前两个主成分(PCA1、PCA2)解释了处理之间微生物PLFAs含量变异的91.03%,第一主成分和第二主成分的贡献值分别为67.56%和23.47%.在0~10cm、10~20cm、20~30cm以及总的土层深度上,3个处理方式下,土壤微生物PLFAs含量没有显著差异,但在干旱处理下,土壤微生物PLFAs含量存在较大的变异性.
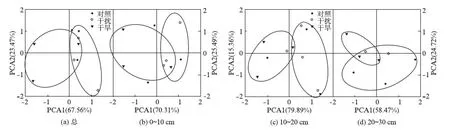
图3 不同处理磷脂脂肪酸的主成分分析Fig.3 Principal components analysis of PLFAs in different treatments
图4为不同土层及不同处理革兰氏阳性细菌、革兰氏阴性细菌特征脂肪酸含量.从图中可以看到,在3个土层上,干旱和对照处理下革兰氏阳性细菌和阴性细菌PLFAs含量之间没有显著差异,但干扰处理下,0~10cm和10~20cm两个土层上革兰氏阳性细菌及阴性细菌的含量均显著高于干旱处理.同时,干旱处理对i15:0和16:0两种表征细菌的脂肪酸含量没有显著影响,但对a15:0,i16:0,16:12OH和18:1ω7c等4种表征细菌的脂肪酸含量影响明显.
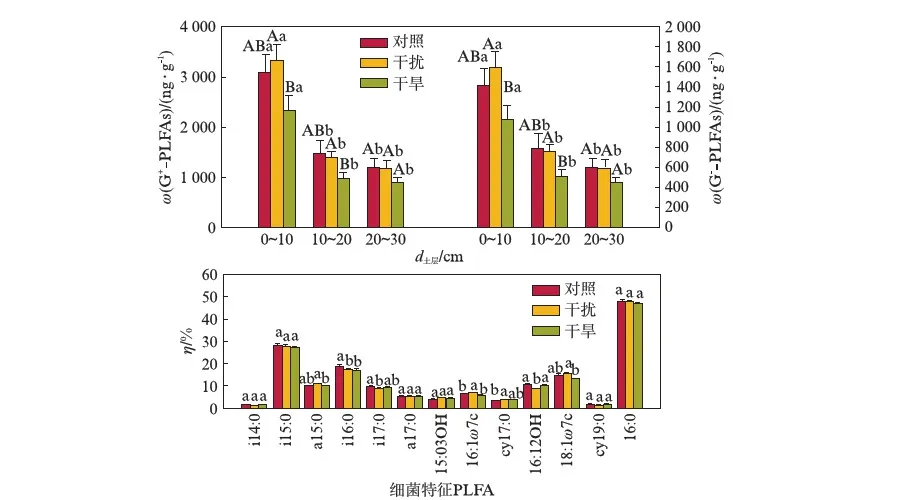
图4 不同土层和处理下革兰氏阳性细菌、革兰氏阴性细菌特征脂肪酸含量及所有细菌特征脂肪酸的比例(η)Fig.4 Contents of G+- or G-- PLFAs in different soil depths under different treatments and the ratio of bacterial PLFAs以干土计重,n=9.不同字母表示差异显著(P≤0.05),其中A,B表示处理间差异,a,b表示土层间差异.
2.3干旱对土壤微生物垂直分布的影响
图5为不同处理方式下不同土层之间革兰氏阳性细菌与阴性细菌比和真菌细菌比,从图中可以看出,在相同的土层水平上,3种处理之间革兰氏阳性细菌与阴性细菌比和真菌细菌比没有显著差异,表明干旱在空间格局上对革兰氏阳性细菌与阴性细菌比和真菌细菌比没有显著影响.
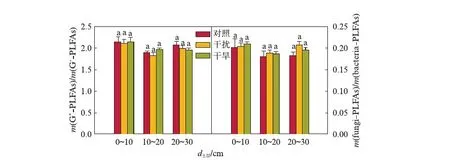
图5 不同土层及不同处理革兰氏阳性细菌与阴性细菌PLFAs质量比、真菌细菌PLFAs质量比Fig.5 Mass ratio of G+- PLFAs/G-- PLFAs, fungi- PLFAs/bacteria- PLFAs in different soil depths under different treatmentsn=9.不同字母表示差异显著(P≤0.05).
2.4土壤含水量与微生物生物量关系
通过相关性分析(图6,见第102页),我们发现干旱处理下土壤微生物总PLFAs含量与土壤含水量表现为显著正相关关系,而对照组和干扰处理土壤微生物总PLFAs含量与土壤含水量呈现显著负相关关系(图6(a)).另外,在10~20cm土层上,土壤微生物总PLFAs含量与土壤含水量表现为显著正相关关系(图6(b)).

图6 土壤体积含水量与微生物PLFAs含量相关性Fig.6 Correlation of soil microbial PLFAs with soil volume water content
3 讨 论
3.1干旱对微生物生物量的影响
干旱处理下,0~10cm土壤微生物总PLFAs、细菌和真菌PLFAs含量分别降低了23.87%,24.33%和21.58%,10~20cm土层分别降低了32.07%,32.16%和31.57%,统计结果显示为轻微显著差异(P<0.1)(图2,图3).此实验结果可能与以下原因有关: 第一,采样时间为9月份,阔叶树种开始相继落叶,增加了土壤碳输入,平衡了因为干旱而造成的养分缺乏,使得微生物生物量没有出现极显著或显著下降[30].第二,实验干旱处理时间较短,水分降低未对微生物生物量造成严重影响[31],随着干旱处理时间持续,土壤微生物的响应会逐渐表现出来,这与以往诸多研究结果相一致.如魏天凤等[32]研究表明,干旱没有对樟子松人工林生态系统内土壤微生物生物量产生显著影响;Hector[33]和Chen[34]的研究结果也同样表明,干旱虽然降低了细菌和真菌生物量,但差异不显著.然而,我们的研究与其他研究存在一定差异,Hueso等[35]通过6个月的室内干旱实验发现,干旱显著降低了土壤微生物生物量,同时,在干旱条件下,细菌通过累积低分子量物质、调节细胞质的渗透势来适应外界环境变化,从而导致生理过程,如胞外多糖的合成[36]、孢子的形成[37]、内部水势调整[37]等发生改变,最终使生物量显著减少.不同生态系统中土壤微生物生物量对干旱的响应规律不一致,是因为干旱对土壤环境的影响较为复杂,同时会通过对植被的影响(如改变植物群落组成,改变凋落物输入的数量和质量等)间接作用于土壤微生物,从而导致响应的差异性.刘爽等[38]研究结果表明,土壤微生物生物量改变是生态系统特性和环境因子共同作用的结果,这种作用受到干旱强度、持续时间和实验控制模式等因素的影响[39].
3.2干旱对微生物群落结构的影响
土壤性质与土壤资源有效性的改变会影响土壤微生物群落结构与组成[40- 41].本研究结果显示,干旱显著改变了微生物群落结构中部分表征细菌的脂肪酸含量,但对土壤真菌细菌比、革兰氏阳性细菌与阴性细菌比没有显著影响(图2,图3),这与William[42]和Hueso[35]的研究结果相一致.分析其中原因,可能与以下几点有关: 第一,微生物群落组成主要依赖于土壤资源可利用性,森林生态系统资源相对丰富,短暂的干旱不会降低土壤资源有效性[18],因此对真菌细菌比和革兰氏阳性细菌与阴性细菌比没有显著影响.第二,相关研究表明,干旱对细菌及真菌、革兰氏阳性细菌和阴性细菌带来的生理特征上的改变可能是相同的[37,42],因此两者在数量上的变化是同步的,从而使相对比例不变.第三,相关研究结果表明,土壤中真菌细菌比、革兰氏阳性细菌与阴性细菌比例与土壤有机碳、全氮含量密切相关[37],因此对土壤碳氮起主导作用的植被组成是影响微生物群落结构的主要因素[43],植物输入到土壤中的碳氮数量及质量(如凋落物、死根、根际分泌物等),会影响土壤微生物的生存资源,从而使土壤微生物群落组成发生改变[44].而本研究样地中,植被组成基本一致,短期的干旱处理未引起植物输入到土壤中碳量的改变.16:0和i15:0是表征细菌中含量偏高的两种PLFAs,但均未受到干旱影响(图4),而含量次高的a15:0,i16:0,16:12OH 和18:1ω7c 4种表征细菌的脂肪酸含量影响明显.这与田倩等[18]研究结果相一致,较丰富的PLFAs表征受外界环境影响较小,而微生物生物量的变化主要由中等含量PLFAs表征变化引起,这可能与不同种属的微生物抵抗外界环境胁迫能力存在差异有关,但其中具体的内在机制尚待进一步研究.
3.3干旱条件下土壤水分对微生物的调控
分析结果显示,干旱处理下,土壤微生物生物量与土壤含水量呈显著正相关关系,且两者的相关性在10~20cm土层表现得最明显(图6),这与Zeglin等[29]研究结果一致.另外,牛佳等[11]在研究高寒湿地土壤水分条件对土壤微生物生物量影响时发现,土壤含水量较低的无淹水样地,土壤微生物总生物量、细菌、革兰氏阳性菌和阴性菌生物量均显著低于土壤水分高的淹水样地.同时,也有研究表明,土壤微生物量在雨季较高,干季相对较低,主要因为土壤含水量高时,森林植物生长茂盛,向地下部分输送的有机物较多,土壤微生物活动和数量增加;而土壤含水量较低时,植物生长较弱,凋落物减少,微生物可获取的水分及养分资源不足,因此活性及生物量均降低[37].此外,微生物生物量与土壤含水量的正相关关系在中层(10~20cm)土层表现尤为明显,主要是因为森林生态系统中表层土壤凋落物较多,微生物生物量更多与土壤透气性、酸碱度、有机质含量等理化性质密切相关,受水分条件限制较低;深层土壤相对稳定,受干旱胁迫的影响较小,土壤微生物群落变化相应较小;而实验样地中层土壤中植物根系较多,受土壤含水量变化明显,进而对土壤微生物的影响也较大.由于本实验在土壤采样时干旱处理刚建成不久,干旱对生态系统造成的影响可能未完全呈现出来,而随着干旱处理时间延长,土壤微生物生物量和群落结构可能对干旱的响应可能会更加明显.
[1] KENNEDY A C, SMITH K L. Soil microbial diversity index and the sustainability of agricultural soils[J].PlantandSoil, 1995,170(5): 75- 86.
[2] WEYENS N, LELIE D V D, TAGHAVI S,etal. Exploiting plant- microbe partnerships to improve biomass production and remediation[J].TrendsBiotechnol, 2009,27(2): 591- 598.
[3] FRATERRIGO J M, BALSER T C, TURNER M G. Microbial community variation and its relationship with nitrogen mineralization in historically altered forest[J].Ecology, 2006,87(3): 570- 579.
[4] 刘方春,邢尚军,马海林,等.持续干旱对樱桃根际土壤细菌数量及结构多样性影响[J].生态学报,2014,34(3): 642- 649.
[5] 程 曼.干旱对自然生态系统的影响及评估[D].南京: 南京信息工程大学,2012.
[6] IPCC. Climate change 2013: The physical science basis[M]. Cambridge, UK: Cambridge University Press,2013.
[7] UHLIROVA E, ELHOTTOVA D, TRISKA J,etal. Physiology and microbial community structure in soil at extreme water content[J].FoliaMicrobiol, 2005,50(2): 161- 166.
[8] SCHIMEL J P, GULLEDGE J M, CLEIN- CURLEY J S,etal. Moisture effects on microbial activity and community structure in decomposing birch litter in theAlaskantaiga[J].SoilBiolBiochem, 1999,31(6): 831- 838.
[9] FIERER N, CARNEY K M, HORNER- DEVINE M C,etal. The biogeography of ammonia- oxidizing bacterial communities in soil[J].MicrobialEcology, 2009,58(2): 435- 445.
[10] 李国斌,李光跃,孙窗舒,等.干旱胁迫对蒙古黄氏生物量及其根际微生物种群数量的影响[J].西北植物学报,2015,35(9): 1868- 1874.
[11] 牛 佳,周小奇,蒋 娜,等.若尔盖高寒湿地干湿土壤条件下微生物群落结构特征[J].生态学报,2011,31(2): 0474- 0482.
[12] 杨桂生,宋长春,王 丽,等.水位梯度对小叶章湿地土壤微生物活性的影响[J].环境科学,2010,31(2): 444- 449.
[13] 王晓凌,陈明灿,张 雷.不同耕作方式对土壤微生物量和土壤酶活性的影响[J].安徽农学通报,2007,13(12): 28- 30.
[14] 郑慧芬.水分、氮和磷添加对内蒙古半干旱草原土壤微生物的影响[D].北京: 中国科学院研究生院,2012.
[15] 杜社妮,梁银丽,张成娥.施肥对西红柿土壤微生物和土壤呼吸的影响[J].干旱地区农业研究,2011,29(5): 178- 181.
[16] 单鸿宾,梁 智,王纯利,等.连作及灌溉方式对棉田土壤微生物量碳氮的影响[J].干旱地区农业研究,2010,28(4): 202- 205.
[17] 杨万勤,张 健,胡庭兴,等.森林土壤生态学[M].成都: 四川科学技术出版社,2006.
[18] 田 倩,夏汉平,周丽霞.磷脂脂肪酸法分析鹤山针叶林和荷木林的土壤微生物多样性[J].热带亚热带植物学报,2011,19(2): 97- 104.
[19] 李冬梅,施雪华,孙丽欣,等.磷脂脂肪酸谱图分析方法及其在环境微生物学领域的应用[J].科技导报,2012,30(2): 65- 69.
[20] 林 生,庄家强,陈 婷,等.不同年限茶树根际土壤微生物群落PLFA生物标记多样性分析[J].生态学杂志,2013,32(1): 64- 71.
[21] 李永山,范巧兰,陈 耕,等.利用PLFA方法研究转Bt基因棉花对土壤微生物群落结构变化的影响[J].棉花学报,2009,21(6): 503- 507.
[22] 达良俊,杨永川,宋永昌.浙江天童国家森林公园常绿阔叶林主要组成种的种群结构及更新类型[J].植物生态学报,2004,28(3): 376- 384.
[23] 于雪珍,路 葵,李秀艳.天童常绿阔叶林退化过程中土壤微生物主要类群变化特性研究[J].安全与环境学报,2005,5(4): 61- 64.
[24] 高 杰,邵钧炯,何杨辉,等.天童山常绿阔叶林土壤呼吸的空间异质性研究: 取样数量的估算和取样方法的优化[J].复旦学报(自然科学版),2015,54(1): 58- 66.
[25] BOSSIO D A, SCOW K M. Impacts of carbon and flooding on soil microbial communities: Phospholipid fatty acid profiles and substrate utilization patterns[J].MicrobialEcology, 1998,35(3): 265- 278.
[26] PONDER F, TADROS M, LOEWENSTEIN E F. Microbial properties and litter and soil nutrients after two prescribed fires in developing savanas in an upland Missouri Ozark Forest[J].ForestEcology&Management, 2009,257(2): 755- 763.
[27] SAMPEDRO L, JEANNOTTE R, WHALEN JOANN K. Trophic transfer of fatty acids from gut microbiota to the earthwormLumbricusterrestrisL[J].SoilBiologyandBiochemistry, 2006,38(8): 2188- 2198.
[28] MARHAN S, KANDELER E, SCHEU S. Phospholipid fatty acid profiles and xylanase activity in particle size fractions of forest soil and casts ofLumbricusterrestrisL. (Oligochaeta, Lumbricidae)[J].AppliedSoilEcology, 2007,35(2): 412- 422.
[29] ZEGLIN L H, BOTTOMLEY P J, JUMPPONEN A,etal. Altered precipitation regime affects the function and composition of soil microbial communities on multiple time scales[J].Ecology, 2013,94(10): 2334- 2345.
[30] OLSSON- PAL A. Signature fatty acids provide tools for determination of the distribution and interactions of mycorrhizal fungi in soil[J].FemsMicrobiologyEcology, 1999,29(4): 303- 310.
[31] CASTRO H F, CLASSEN A T, AUSTIN E,etal. Soil microbial community responses to multiple experimental climate change drivers[J].Applied&EnvironmentalMicrobiology, 2010,76(4): 999- 1007.
[32] 魏天凤,任艳林,曾 辉,等.降水改变对樟子松人工林土壤微生物量碳及微生物商动态变化的影响[J].北京大学学报,2008,45(3): 15- 20.
[33] HECTOR M, SERNA- CHAVE Z, NOAH F,etal. Global drivers and patterns of microbial abundance in soil[J].GlobalEcologyandBiogeography, 2013,22(6): 1162- 1172.
[34] CHEN M M, ZHU Y G, SU Y H,etal. Effects of soil moisture and plant interactions on the soil microbial community structure[J].EurJSoilBiol, 2007,43(1): 31- 38.
[35] HUESO S, GARCIA C, HERNANDEZ T. Severe drought conditions modify the microbial community structure, size and activity in amended and unamended soils[J].SoilBiology&Biochemistry, 2012,50(1): 167- 173.
[36] KOHLER J, CARAVACA F, ROLDAN A. Effect of drought on the stability of rhizosphere soil aggregates ofLactucasativagrown in a degraded soil inoculated with PGPR and AM fungi[J].AppliedSoilEcology, 2009,42(2): 160- 165.
[37] LANDESMAN W J, DIGHTON J. Response of soil microbial communities and the production of plant- available nitrogen to a two- year rainfall manipulation in the New Jersey Pinelands[J].SoilBiology&Biochemistry, 2010,42(10): 1751- 1758.
[38] 刘 爽,王传宽.五种温带森林土壤微生物生物量碳氮的时空格局[J].生态学报,2010,30(12): 3135- 3143.
[39] 王 宁,王美菊,李世兰,等,降水变化对红松阔叶林土壤微生物生物量生长季动态的影响[J].应用生态学报,2015,26(5): 1297- 1305.
[40] FIERER N, JACKSON R B. The diversity and biogeography of soil bacterial communities[J].ProcNatlAcadSciUSA, 2005,103(7): 626- 631.
[41] CHEN F L, ZHENG H, ZHANG K,etal. Changes in soil microbial community structure and metabolic activity following conversion from nativePinusmassonianaplantations to exoticEucalyptusplantations[J].ForestEcologyandManagement, 2013,291(15): 65- 72.
[42] WILLIAMS M A, RICE C W. Seven years of enhanced water availability influences the physiological, structural, and functional attributes of a soil microbial community[J].AppliedSoilEcology, 2007,35(3): 535- 545.
[43] MCINTOSH A C S, MACDONALD S E, QUIDEAU S A,etal. Linkages between the forest floor microbial community and resource heterogeneity within mature lodge pole pine forests[J].SoilBiology&Biochemistry, 2013,63(4): 61- 72.
[44] DERMODY O, WELTZIN J F, ENGEL E C,etal. How do elevated CO2, warming, and reduced precipitation interact to affect soil moisture and LAI in an old field ecosystem?[J].PlantSoil, 2007,301(1): 255- 266.
Abstract: Soil microbes are essential components in terrestrial ecosystem, which play crucial roles in biogeochemical cycling, such as material transformation and energy flow. Our study focused on effects of drought on soil microbial biomass and community structure by throughfall displacement experiment(TDE) treatment with drought, disturbance, and control treaatments in a subtropical evergreen broadleaf forest, Ningbo, Zhejiang. Results showed that soil temperature did not change with drought and disturbance treatments, while drought significantly decreased soil moisture. Compared with control treatment, disturbance had no significant effects on soil microbial biomass and community structure, but drought reduced total microbial biomass, bacteria and fungi biomass with marginal significance(P<0.1). In addition, although drought did not significantly affect bacteria biomass with markers of i15:0 and 16:0, it significantly decreased those with markers of a15:0, i16:0, 16:12OH and 18:1ω7c. Furthermore, total soil microbial biomass exhibited the positive correlation with soil water content under drought, but negative ones occurred in control and disturbance treatments. Therefore, drought affected soil microbial biomass and community structure in the subtropical forest, and soil water content is the key factor in regulating these changes under drought.
Keywords: drought; soil microbe; PLFA; subtropical forest
EffectsofSimulatingDroughtonSoilMicrobialBiomassandCommunityStructureinSubtropicalForest
NIE Yuanyuan1, ZHOU Guiyao2, SHAO Junjiong2, ZHOU Lingyan3, LIU Ruiqiang2, ZHAI Deping2, ZHOU Xuhui1
(1.MinistryofEducationKeyLaboratoryforBiodiversityScienceandEcologicalEngineering,InstituteofBiodiversityScience,FudanUniversity,Shanghai200438,China; 2.SchoolofEcologicalandEnvironmentalSciences,EastChinaNormalUniversity,Shanghai200062,China; 3.SchoolofLifeSciences,AnhuiAgriculturalUniversity,Hefei,AnhuiProvince, 230036,China)
Q938.1
A
0427- 7104(2017)01- 0097- 09
2016- 04- 19
国家自然科学基金(31370489)
聂园园(1991—),女,硕士研究生;周旭辉,男,教授,通信联系人,E- mail: xhzhou@des.ecnu.edu.cn.
