大米蛋白的复合酶解及酶解物的体外抗氧化活性
2017-10-13彭斓兰陈季旺丁文平吴永宁
彭斓兰,陈季旺,2,蔡 俊,丁文平,2,吴永宁,2
(1. 武汉轻工大学 食品科学与工程学院,湖北 武汉 430023;2.农产品加工湖北省协同创新中心,湖北 武汉 430023)
大米蛋白的复合酶解及酶解物的体外抗氧化活性
彭斓兰1,陈季旺1,2,蔡 俊1,丁文平1,2,吴永宁1,2
(1. 武汉轻工大学 食品科学与工程学院,湖北 武汉 430023;2.农产品加工湖北省协同创新中心,湖北 武汉 430023)
为测定大米蛋白复合酶水解物的体外抗氧化活性,优化酶解工艺,分别采用胰蛋白酶(Trypsin)、复合蛋白酶(Protamex)及中性蛋白酶(Neutrase)复合酶解大米蛋白的碱性蛋白酶(Alcalase)水解液,测定水解度(DH)、肽浓度、ABTS+·清除活性及Fe2+螯合活性,明确较佳的复合酶种类及酶解条件。结果显示:随着时间的增加,碱性蛋白酶水解的DH和肽浓度增大,酶解物的ABTS+·清除活性及Fe2+螯合活性增强。较佳复合酶种类及酶解条件为大米蛋白浓度7.5%(w/v)、pH9、50℃、碱性蛋白酶添加量48 AU/Kg、90 min;胰蛋白酶添加量31.25 usp/mg、pH8.5、37℃、30 min。该条件下大米蛋白的DH为15.9%,酶解物Fe2+螯合活性及ABTS+·清除活性分别为78.6%、75.0%,表明大米蛋白的胰蛋白酶和碱性蛋白酶复合酶解物具有较高的抗氧化活性,可用于功能性食品。
大米蛋白;碱性蛋白酶;复合酶水解;体外抗氧化活性
Abstract:In order to investigate antioxidant activity of the hydrolysatesinvitroand optimize the process, rice protein was firstly hydrolyzed using Alcalase, then combined proteases hydrolysis was performed using Neutrase, Protamex, and Trypsin, respectively. Optimization of combined proteases types and conditions were obtained through analysis of hydrolysis degree (DH), peptide concentration, Fe2+chelating activity, and ABTS+·scavenging activity. The results showed that DH and peptide concentration, ABTS+·scavenging activity, and Fe2+chelating activity of the hydrolysates using Alcalase increased with an increase of hydrolysis times.The hydrolysate of rice protein with 15.9% of DH, 78.6% of Fe2+chelating activity, and 75.0% of ABTS+· scavenging activity was prepared with the optimized hydrolysis conditions (7.5% of rice protein, pH9, 50℃, 48AU/kg of the ratio to Alacalase and rice protein, and 90 min; 31.25 usp/mg of the ratio to Trypsin and rice protein, pH8.5, 37℃, 30 min). The findings indicated that the hydrolysate of rice protein through combined hydrolysis of Alcalase and Trypsin has higher antioxidant activityinvitroand allow for the application of functional foods.
Key words:rice protein; Alacalase; combined proteases hydrolysis; antioxidant activityinvitro
1 引言
近年来,有关大米安全问题的报道越来越多,例如湖南镉超标的“镉大米”和黑龙江普通稻米中添加香精加工成香米的“五常香米”等。这些大米由于不符合我国食品安全法对食品加工原料的要求而被废弃,造成稻米资源的极大浪费。大米蛋白不仅营养价值高,而且具有良好的消化性和低的过敏性[1]。如果酶解这些“问题大米”制备大米肽,不仅保留了大米蛋白的优良特性,而且大米肽具有良好的溶解性、酸热稳定性,用于药品、化妆品等非食品工业[2-3],可为妥善处置这些“问题大米”提供新途径,避免资源浪费。
测定抗氧化肽体外活性的方法较多,ABTS+·清除活性是使用最广泛的间接测定方法,具有快速、简便、与抗氧化肽的生物活性相关性强等特点[4-6]。该方法的原理是抗氧化肽与强氧化剂氧化2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(2,2’-azino-bis (3-ethyl benzothiazoline-6-sulfonic acid) diammonium salt,ABTS)生成的阳离子自由基(相对稳定的蓝绿色溶液)反应后,溶液颜色变浅,甚至无色[7]。Fe2+螯合活性的原理是在某些特定吸收波长下,Fe2+与螯合剂发生显色反应的产物具有吸收峰;加入的抗氧化肽螯合Fe2+,降低了显色产物的浓度,吸光值减小[5-8]。因此,本文以ABTS+·清除活性及Fe2+螯合活性方法测定大米蛋白酶解物的体外抗氧化活性。
目前采用优化单一蛋白酶的水解条件制备大米抗氧化肽,或从几种蛋白酶中优选一种酶制备具有抗氧化活性大米肽的报道较多[9-15],但是采用复合酶分步水解大米蛋白制备抗氧化肽的研究较少。Chanput等采用胃蛋白酶(Pepsin)和胰蛋白酶(Trypsin)复合水解米糠蛋白,发现酶解物的体外抗氧化活性显著高于米糠蛋白[16]。本文采用碱性蛋白酶(Alcalase)水解大米蛋白后,分别添加胰蛋白酶、复合蛋白酶(Protamex)及中性蛋白酶(Neutrase)复合水解,分析水解度(Degree of Hydrolysis, DH)及酶解物的肽浓度、Fe2+螯合活性及ABTS+·清除活性,确定较佳的复合酶种类及酶解条件,以为大米蛋白酶法制备抗氧化肽的规模化生产提供技术支撑,及重金属污染稻米的合理利用提供新的思路。
2 材料与方法
2.1 材料与设备
大米蛋白(蛋白含量88.5%,水分含量4.07%,灰分含量2.6%;干基)金农生物科技有限公司提供;碱性蛋白酶、中性蛋白酶、胰蛋白酶和复合蛋白酶 诺维信(中国)生物技术有限公司提供;ABTS(产自加拿大)、菲啰嗪(Ferrozine,产自印度)购于Sigma-Aldrich(上海)贸易有限公司;BSA(牛血清蛋白)、氯仿(CHCl3)、过硫酸钾(K2S208)、氯化亚铁(FeCl2)、盐酸(HCl,优级纯)等购于国药集团化学试剂有限公司。
WFJ720型可见分光光度计 尤尼柯(上海)仪器有限公司;JK-MSH-Pro-40WL电动搅拌机 上海精学科学仪器有限公司;HH-2数显恒温水浴锅 江苏荣华仪器制造有限公司;WHY-2(SHA-B)往返水浴恒温振荡器 金坛梅香仪器有限公司;TGL-16C高速离心机 上海安亭科学仪器厂;DELTA 320 pH计 梅特勒-托利多仪器(上海)有限公司。
2.2 方法
2.2.1 酶解条件
(1)碱性蛋白酶水解
参照蔡广霞等[17]的方法。浓度为7.5%(w/v)的大米蛋白,在pH值为9,酶解温度为50℃,碱性蛋白酶与大米蛋白比(E/S)为48AU/Kg的条件下,测定酶解15~180 min(15、30、60、90、120、180 min)的DH、肽浓度、螯合Fe2+活性及清除ABTS+·活性。
(2)复合酶水解
在碱性蛋白酶较佳酶解条件下,按照表1中三种蛋白酶的较佳条件调节温度、pH值,分别添加复合酶(0.5、2.5、4.5,w/w),测定酶解15~180 min(15、30、60、90、120、180 min)的DH、肽浓度、螯合Fe2+能力及清除ABTS+·活性。
表1 三种蛋白酶的酶解条件及底物特异性
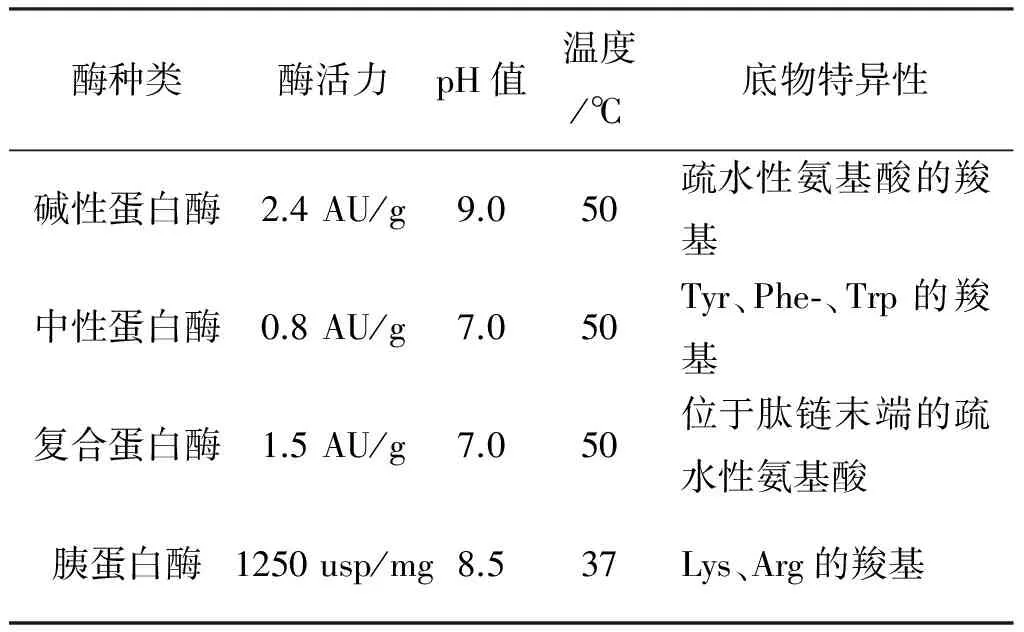
酶种类酶活力pH值温度/℃底物特异性碱性蛋白酶2.4AU/g9.050疏水性氨基酸的羧基中性蛋白酶0.8AU/g7.050Tyr、Phe⁃、Trp的羧基复合蛋白酶1.5AU/g7.050位于肽链末端的疏水性氨基酸胰蛋白酶1250usp/mg8.537Lys、Arg的羧基
(3)取样处理
酶解过程中,吸取酶解液5 mL至10 mL离心管中,分别滴加3滴HCl灭酶(1 mol/L),以8000 r/min的速度离心10 min,将上清液置于冰箱冷臧室中贮藏(12 h),备用。
2.2.2 DH的测定
参照Jens 的方法[18-19]稍做修改,采用式(1)计算DH。
DH(%)=B·Nb·1/α·1/Mp·1/Htot×100
(1)
式中:
B—NaOH溶液体积,mL;
Nb—NaOH溶液的当量浓度,mol/L;
Mp—大米蛋白的含量,g;
Htot—大米蛋白中的肽键总数,mmol/L;
α—α-氨基的解离度。
α-氨基的解离度参照式(2)计算。
α =(10pH-pK)/(1+10pH-pK)
(2)
式中:
pH—水解溶液的pH值;
pK-氨基的解离度常数,pK7.0。
2.2.3 肽浓度的测定
采用双缩脲法测定肽浓度[20]。以牛血清白蛋白(BSA)浓度(mg/mL)为横坐标、吸光度(波长540 nm)为纵坐标绘制标准曲线,曲线方程为y=0.0221x+0.0074(R2=0.9974)。
2.2.4 螯合Fe2+能力
参照Taheri等[8]的方法。在0.5 mL样品中先后加入3.2 mL蒸馏水和0.1 mL的FeCl2溶液(2 mmol/L),混匀并静置3 min。再加入0.2 mL的菲啰嗪溶液(5 mmol/L),混匀并反应10 min后,于562 nm波长处测定吸光度(以去离子水为空白组)。重复测定3次,取其平均值。采用式(3)计算Fe2+螯合率。
Fe2+螯合率/%=(1-A样品/A空白)×100
(3)
2.2.5 清除ABTS+·自由基活性
参照蔡俊等[7]的方法。ABTS+·储备液:取10 mL ABTS+·溶液(7 mmol/L)和5 mL K2S2O8溶液(7.35 mmol/L)混合,室温下避光放置12~16 h,备用。ABTS+·工作液:无水乙醇稀释ABTS+·储备液至734 nm波长处的吸光度为0.70。测定时吸取50 μL样品,加入3 mL ABTS+·工作液混合均匀,室温下反应10 min后测定其吸光度(A样品),空白组以水代替样品(A空白)。采用式(4)计算ABTS+·清除率。
ABTS+·清除率/%=(1-A样品/A空白)×100
(4)
3 结果与分析
3.1 碱性蛋白酶水解
碱性蛋白酶水解大米蛋白的结果见图1。由图1-a可知,随着酶解的进行,DH一直增大(6.3%、12.6%、15.5%)。酶解过程中,酶解液肽浓度增加了55.9%,从23.6 mg/mL(15 min)增加到36.8 mg/mL(180 min)。可能是碱性蛋白酶破坏了大米蛋白的肽键,将不溶性的大米蛋白水解成可溶性的多肽和游离氨基酸[19, 21]。
由图1-b可以看出,随着酶解的进行,酶解液的Fe2+螯合活性及ABTS+·清除活性逐渐增强。15 min时,酶解液Fe2+螯合活性为3.2%, 90 min(29.8%)时增加了8.31倍,180 min(55.7%)时增加了16.4倍;酶解液ABTS+·清除活性为44.0%(15 min),90 min(68.9%)时增加了56.6%,180 min(76.9%)时增加了74.8%。
碱性蛋白酶酶解液肽浓度的增加幅度均低于ABTS+·清除活性及Fe2+螯合活性,说明肽浓度的增加是大米蛋白酶解物抗氧化活性增强的主要原因,而ABTS+·清除活性和Fe2+螯合活性增强可能是生成的多肽种类及数量造成的[22-25]。酶解初期,大米蛋白酶解液的ABTS+·清除活性及Fe2+螯合活性随着酶解时间的增加而增强,可能是大米蛋白被水解,多肽暴露或产生具有抗氧化活性的氨基酸侧链和序列,因此表现出显著的ABTS+·清除活性;酶解后期, ABTS+·清除活性增幅较缓的原因可能是大米蛋白的肽键数量减少,多肽含量增幅变缓。此外,碱性蛋白酶的进一步水解影响了多肽中具有抗氧化活性的氨基酸基团。由于具有Fe2+螯合活性的多肽、氨基酸浓度较低或结构未暴露出来,因此酶解液Fe2+螯合活性在酶解初期较低;随着酶解时间增加,Fe2+螯合活性明显增强,可能是大米蛋白的空间结构、肽键被破坏,具有Fe2+螯合活性的多肽、游离氨基酸(例如组氨酸)浓度增大,或含有COO-的侧链氨基酸从大米蛋白结构中暴露出来。
水解过程中,虽然酶解液的抗氧化活性一直增强,但90 min后增加趋势变平缓。考虑后续复合酶解,选择90 min为碱性蛋白酶的较佳酶解时间。

图1 碱性蛋白酶水解大米蛋白的DH、肽浓度及酶解物的体外抗氧化活性
3.2 中性蛋白酶水解
3.2.1 DH
从图2-a可知,酶解初期,DH随时间的延长快速增加,30~120 min时,DH平稳增大,120~180 min时,DH增幅很小,几乎不变。可能是中性蛋白酶水解了大米蛋白的肽键,酶解液中多肽和游离氨基酸含量增加,DH增大。酶解初期,大米蛋白中的酶切位点较多,水解速度快,多肽和游离氨基酸含量迅速增加,DH增幅明显;随着时间的延长,大米蛋白中酶切位点减少以及酶开始失活,120 min后DH的增幅变缓[19,24]。
添加中性蛋白酶后,虽然整个酶解过程中DH一直增加,且三组酶添加量的增幅差异不显著(分别为10.96%、10.63%、10.90%),但是酶添加量为4 AU/mg时,相同时间的DH均最小。此外,酶解中期酶添加量为20 AU/mg时的DH略大于36 AU/mg,而酶解后期差异不显著。可能是酶添加量较低时,酶与充足的大米蛋白肽键接触,使DH增大,但是当酶添加量过高时,部分酶不能与大米蛋白肽键充分接触,因此DH增幅不显著。酶解过程结束时DH为13.87%~14.26%,与未添加中性蛋白酶相比,增幅为10.08%~13.17%。
3.2.2 肽浓度
由图2-b可知,在碱性蛋白酶的水解液中添加中性蛋白酶后,不同酶添加量(4 AU/mg、20 AU/mg、36 AU/mg)条件下,肽浓度均有不同程度的增加。酶解初期,肽浓度缓慢上升,直到120 min后,肽浓度增大明显并趋于稳定。中性蛋白添加量为4 AU/mg时,整个酶解过程中肽浓度变化不明显。酶添加量增至20 AU/mg时,初期肽浓度与酶添加量4 AU/mg时相差不大,中后期肽浓度明显增加。酶添加量增大至36 AU/mg时,后期虽然肽浓度明显增加,但始终低于酶添加量为4或20 AU/mg组。酶解结束时肽浓度为28.8~30.2 mg/mL,与未添加中性蛋白酶相比略有降低。
3.2.3 ABTS+·清除活性
图2-c可知,添加中性蛋白酶后,酶添加量为4 AU/mg 和36 AU/mg的大米蛋白酶解液ABTS+·清除活性差异不显著,且明显小于20 AU/mg组。而酶添加量为20 AU/mg时,酶解液的ABTS+·清除活性从69.3%(15 min)增强到77.9%(18 min),增幅为12.41%。酶解过程结束时ABTS+·清除活性为65.4%~77.9%。与未添加中性蛋白酶相比,增幅为-5.08%~13.06%。
3.2.4 Fe2+螯合活性
从图2-d可知,添加中性蛋白酶后,大米蛋白酶解液的Fe2+螯合活性虽整体增强,但不同酶添加量的增强幅度差异明显。当酶添加量为20 AU/mg时,Fe2+螯合活性从20.6%(15 min)增强到29.5%(90 min),增幅为43.20%,反应结束时Fe2+螯合活性为30.0%。整个酶解过程中,与酶添加量为4或36 AU/mg 组的Fe2+螯合活性相比,20 AU/mg组的明显增大,且逐步增强。酶解过程结束时Fe2+螯合活性为22.2~30.0%,略低于未添加中性蛋白酶时。
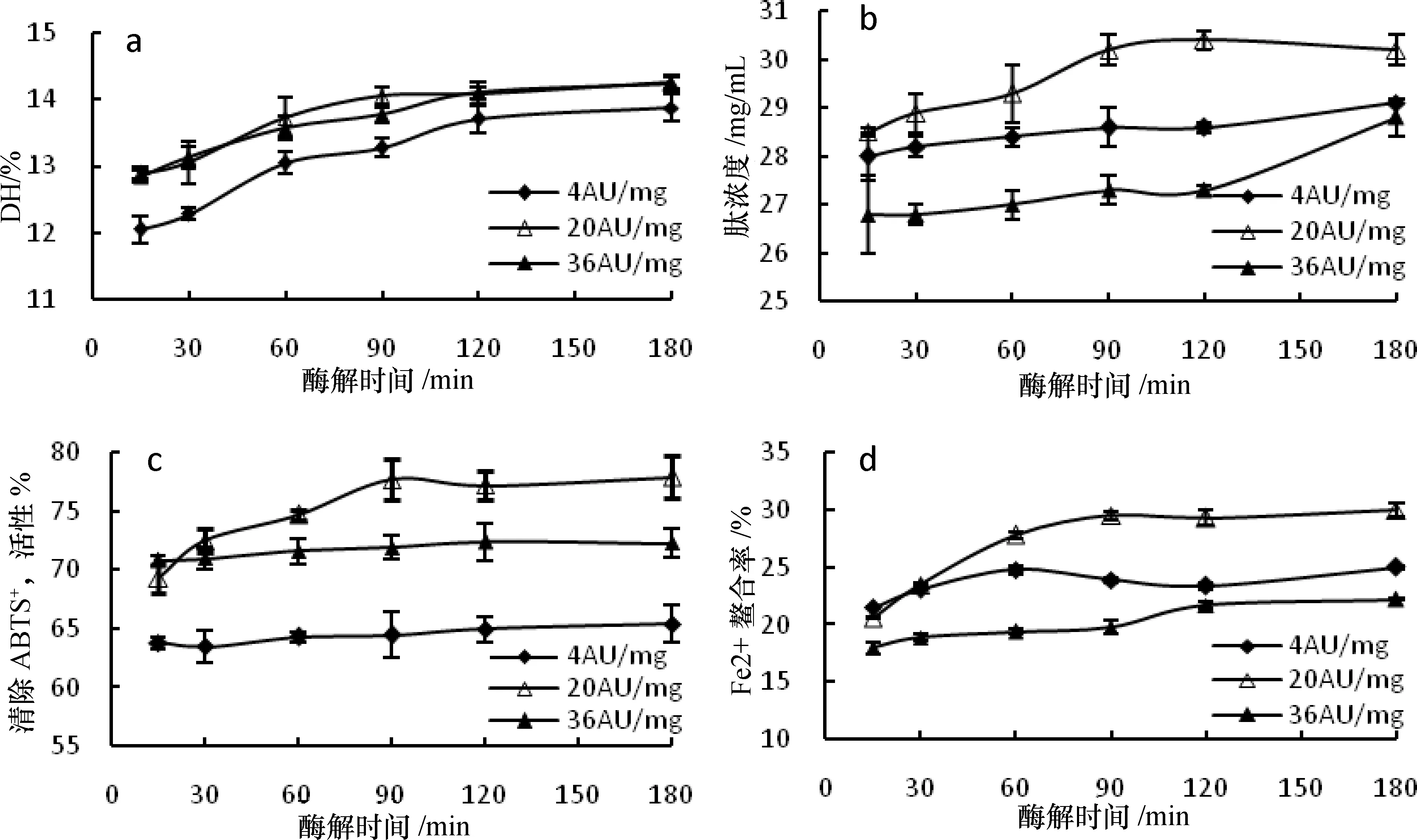
图2 中性蛋白酶复合水解大米蛋白的DH、肽浓度及酶解物的体外抗氧化活性
3.3 复合蛋白酶水解
3.3.1 DH
由图3-a可知,添加复合蛋白酶后,DH随反应时间的增加而上升。当酶添加量为7.5 AU/mg时DH始终最小,但与酶添加量为37.5 AU/mg时的DH增大幅度基本一致。当酶添加量增至67.5 AU/mg时,水解速率和DH增大幅度均与7.5 AU/mg时相差不大,酶解结束时的DH分别为14.48%(67.5 AU/mg)和14.34%(37.5 AU/mg)。酶解过程结束时DH为13.17%~14.48%,与未添加复合蛋白酶相比增幅为4.5%~14.9%。
3.3.2 肽浓度
由图3-b可知,添加复合蛋白酶后,三组酶添加量的肽浓度在酶解过程都略有增加,但增幅差异明显。复合蛋白酶添加量为7.5 AU/mg时,随着反应时间的增加肽浓度基本保持不变,反应结束时增幅仅为0.7%;酶添加量为37.5 AU/mg时,酶解初期肽浓度明显增大,30 min后保持平稳,酶解结束时增幅为3.3%;继续增大酶添加量至67.5 AU/mg,酶解初期的肽浓度轻微增大,90~120 min时肽浓度快速增加,120 min后缓慢增加,最终增幅为6%。180 min时肽浓度达到最高值28.4%(67.5AU/mg),但与未添加复合蛋白酶相比,略有降低。
3.3.3 ABTS+·清除活性
从图3-c可知,添加复合蛋白酶后, ABTS+·清除活性逐渐增强。15~30 min时ABTS+·清除活性明显增大,30~120 min时ABTS+·清除活性均不同程度地增强且有波动,120 min到酶解结束时, ABTS+·清除活性逐渐增强。
三组酶添加量的大米蛋白酶解液的ABTS+·清除活性增幅分别为11.4%(7.5 AU/mg)、11.0%(37.5 AU/mg)和8.8%(67.5 AU/mg)。虽然7.5 AU/mg和37.5 AU/mg时增幅相差不大,但是整个酶解过程中37.5 AU/mg组的ABTS+·清除活性始终强于另两组。酶解过程结束时ABTS+·清除活性最高,为75.5%(37.5 AU/mg)。与未添加复合蛋白酶相比,最终增幅为9.58%。
3.3.4 Fe2+螯合活性
从图3-d可知,在碱性蛋白酶酶解液中添加复合蛋白酶,整个酶解过程中大米蛋白酶解液的Fe2+螯合活性随反应时间的增加有不同程度的增强,但是三组酶添加量时,Fe2+螯合活性及其增强幅度差异比较明显。
三组酶添加量的Fe2+螯合活性增幅分别为21.7%(7.5 AU/mg)、32.1%(37.5 AU/mg)和18.5%(67.5 AU/mg),其中酶添加量为7.5 AU/mg时,酶解初期Fe2+螯合活性几乎不变,90 min后虽然增强,但始终低于另外两组酶添加量的Fe2+螯合活性。酶添加量增至37.5 AU/mg时,Fe2+螯合活性明显增强,120 min后基本保持不变。酶添加量增加至67.5 AU/mg时,Fe2+螯合活性与37.5 AU/mg时变化不大且比较稳定。酶解过程结束时酶解液Fe2+螯合活性最强,为42.3%,增幅为41.95%。
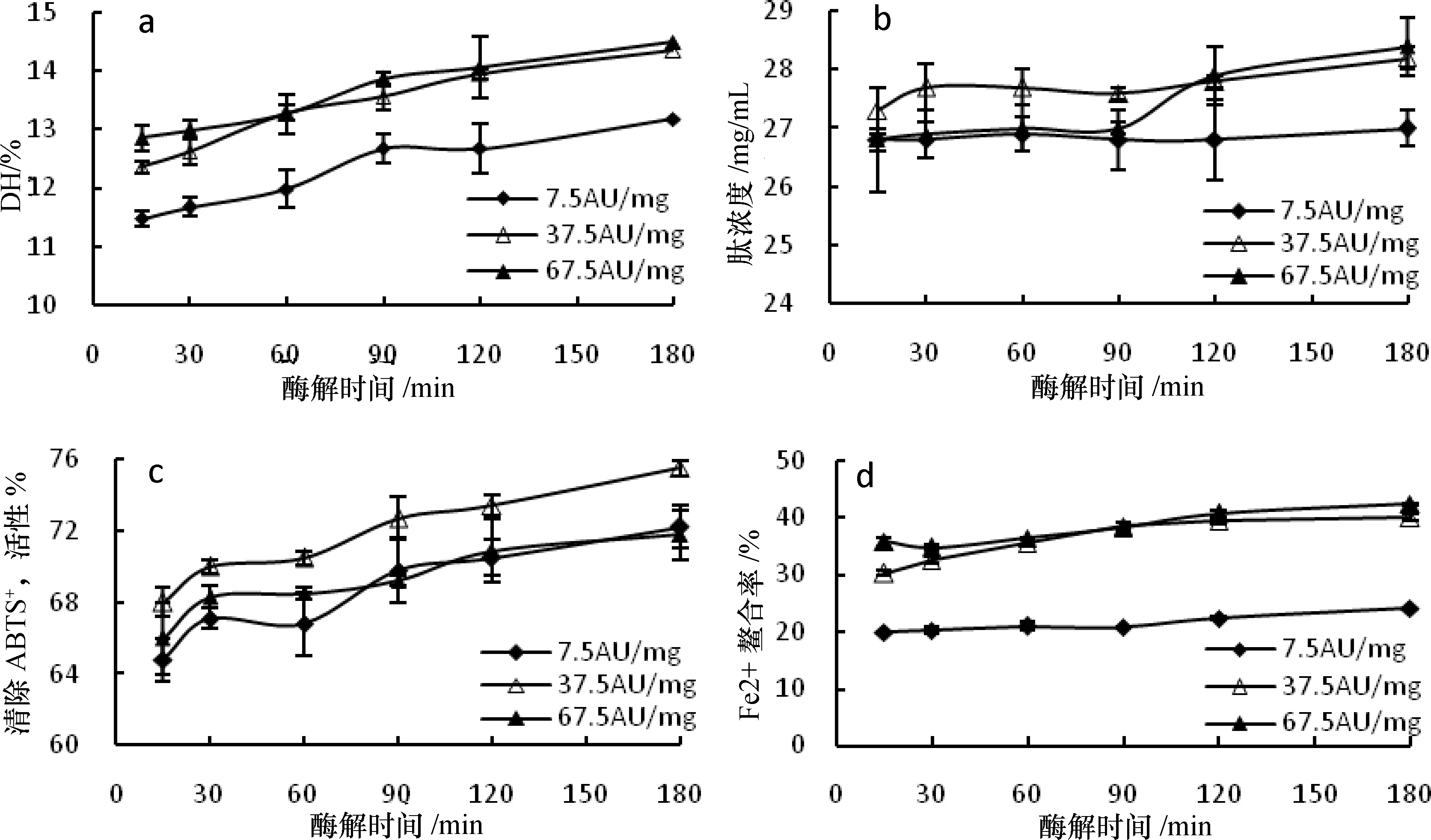
图3 复合蛋白酶复合水解大米蛋白的DH、肽浓度及酶解物的体外抗氧化活性
添加复合蛋白酶后,酶解15 min时肽浓度增大缓慢,说明生成了更多的寡肽、氨基酸等物质,而酶解初期ABTS+·清除活性保持稳定,之后略微增强,说明被酶解的多肽产生的寡肽、氨基酸等增强了该活性。酶添加量为37.5 AU/mg、67.5 AU/mg的复合蛋白酶解液Fe2+螯合活性增大,可能是新生成的寡肽、氨基酸等物质的含量增加,使该活性增强。随着酶解进行,酶解液Fe2+螯合活性增幅变缓,可能原因是不断有多肽被进一步水解成寡肽、游离氨基酸。
3.4 胰蛋白酶水解
3.4.1 DH
由图4-a可知,添加胰蛋白酶后,三组酶添加量的DH均随时间的增加而上升,且增幅基本保持一致。当水解时间为15~30 min时,DH增加较快,随后增速变缓。相同水解时间,DH随着酶添加量的增加显著上升,酶解结束时DH最低为16.69%(6.25 usp/mg),最高为18.65%(56.25 usp/mg),均高于相同酶添加量的中性蛋白酶和复合蛋白酶。
3.4.2 肽浓度
由图4-b可知,添加胰蛋白酶后,肽浓度均有一定程度的增大,30~180 min时,肽浓度缓慢增加。胰蛋白酶添加量为6.25 usp/mg时,肽浓度在15~30 min明显增大,之后几乎保持不变;酶添加量增至31.25 usp/mg时,15~30 min肽浓度迅速增加,且30 min后肽浓度均比6.25 usp/mg组的高;酶添加量增至56.25 usp/mg时,增幅虽然低于6.25 usp/mg组和31.25 usp/mg组的肽浓度,但是肽浓度在三组酶添加量中始终最高。酶解过程结束时肽浓度为30.9~33.6 mg/mL,高于相同酶添加量的中性蛋白酶和复合蛋白酶。
3.4.3 ABTS+·清除活性
从图4-c可知,不同胰蛋白酶酶添加量条件下ABTS+·清除活性均有所增强,且不同酶添加量的清除活性差别不显著,可见酶添加量对ABTS+·清除活性的影响不大。15~90 min时, ABTS+·清除活性略有增强,90~180 min增长放缓且出现波动。酶添加量为56.25 usp/mg时,ABTS+·清除活性始终低于另两组,酶解初期酶添加量为31.25 usp/mg组的ABTS+·清除活性略低于56.25 usp/mg组,后期则相反。酶解结束时ABTS+·清除活性最高为81.6%,与未添加胰蛋白酶的ABTS+·清除活性相比,增幅为18.43%,且高于相同酶添加量的中性蛋白酶和复合蛋白酶。
3.4.4 Fe2+螯合活性
从图4-d可知,添加胰蛋白酶后,Fe2+螯合活性随反应时间的增长逐渐增强。并且60~180 min时,Fe2+螯合活性增幅减缓,且具有波动性。酶添加量为6.25 usp/mg时,Fe2+螯合活性增强明显,尤其是15~60 min时Fe2+螯合活性迅速增强,之后增幅减小。虽然反应结束时6.25 usp/mg增幅为36.7%,明显大于另外两组(31.25 usp/mg时26.6%,56.25 usp/mg时24%),但是Fe2+螯合活性始终低于另外两组。酶添加量增至31.25 usp/mg时,Fe2+螯合活性不断增强,且与另外两组酶添加量相比,酶解液Fe2+螯合活性虽然增幅不是最大,但各反应阶段Fe2+螯合活性都最强。继续增大酶添加量,Fe2+螯合活性虽缓慢增强,但仍略低于31.25 usp/mg组,直至反应结束。酶解结束时Fe2+螯合活性为82.0%~93.3%,增加了1.75~2.13倍,高于相同酶添加量的中性蛋白酶和复合蛋白酶。
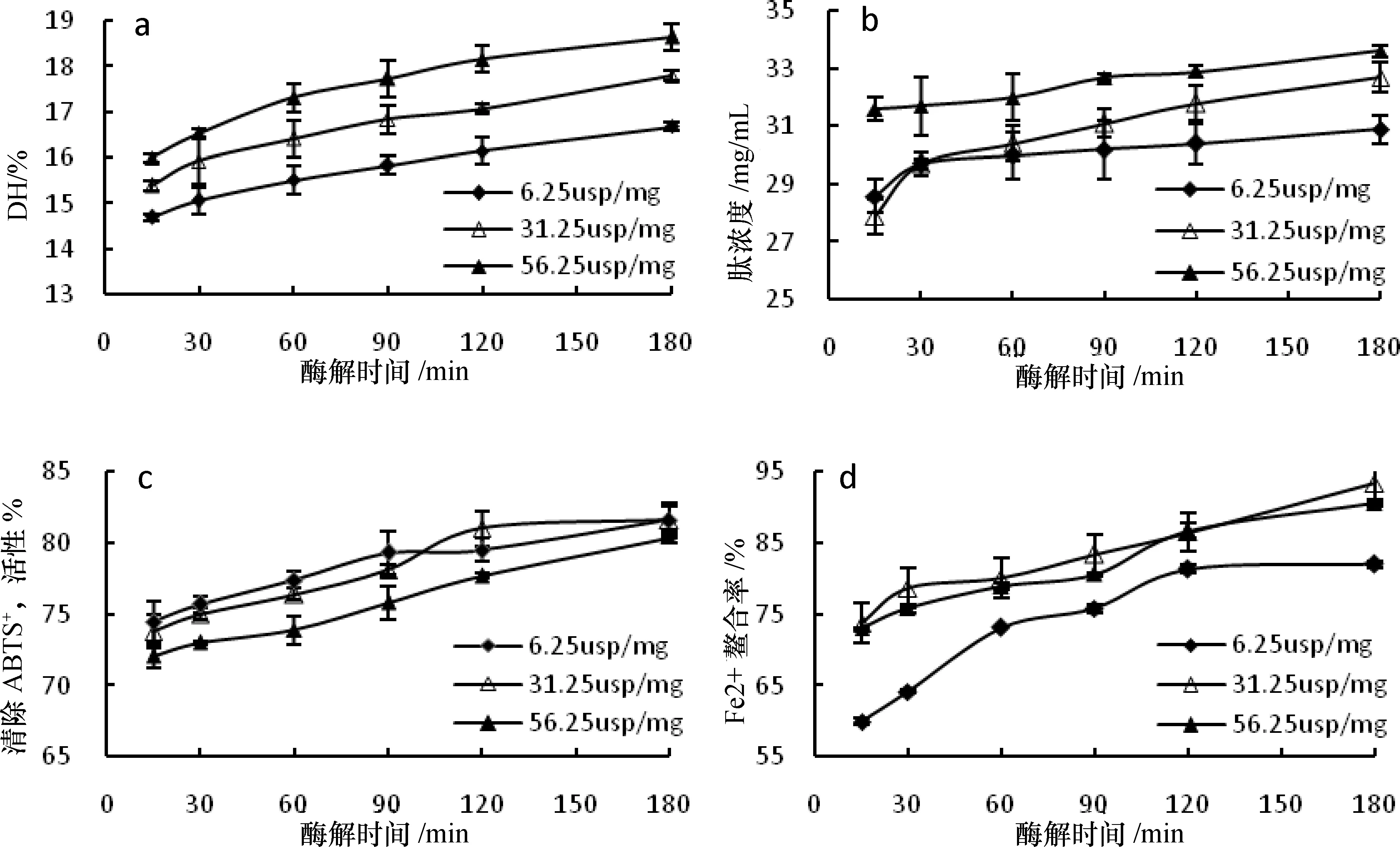
图4 胰蛋白酶复合水解大米蛋白的DH、肽浓度及酶解物的体外抗氧化活性
胰蛋白酶复合水解大米蛋白的DH、肽浓度均比只用碱性蛋白酶高,可能是由于碱性蛋白酶水解大米蛋白时的作用位点主要是羧基端为疏水性氨基酸形成的肽键,而疏水性氨基酸主要在蛋白质内部,利用其疏水相互作用,保持蛋白质三级结构的稳定[26]。碱性蛋白酶水解液再用胰蛋白酶复合水解,使得赖氨酸、精氨酸组成的肽键进一步水解。由于中性蛋白酶作用的结合位点主要有色氨酸、苯丙氨酸、丙氨酸等疏水性氨基酸的羧基;复合蛋白酶的作用位点主要是位于肽链末端的疏水性氨基酸,二种蛋白酶与碱性蛋白酶的作用位点类似,随着碱性蛋白酶水解的时间延长,大米蛋白的肽键逐渐被消耗,酶解位点减少,因此,用中性蛋白酶和复合蛋白酶水解时,DH、肽浓度的增加不明显,导致胰蛋白酶复合水解的酶解物的DH、肽浓度高于中性蛋白酶、复合蛋白酶。
胰蛋白酶复合水解的酶解物的Fe2+螯合活性均高于中性蛋白酶、复合蛋白酶,可能是酶解物中较高浓度的寡肽和游离氨基酸含有更多的配位原子,能螯合更多的Fe2+。此外,胰蛋白酶复合水解的酶解物中含有较多的天冬氨酸、谷氨酸、组氨酸、半胱氨酸等,高Fe2+螯合活性可能与这些特定的氨基酸有关[27, 28]。胰蛋白酶复合水解的酶解物的ABTS+清除活性明显高于中性蛋白酶、复合蛋白酶,可能是由于该酶解物较高的寡肽和游离氨基酸浓度,能释放出更多的抗氧化性基团,这些基团与ABTS+·发生反应使反应体系褪色,即ABTS+·清除活性较强[24]。
综合上述试验结果,确定大米蛋白复合酶解制备高活性抗氧化肽的较佳条件为:7.5%(w/v)的大米蛋白,碱性蛋白酶水解的pH值为9、50℃、酶添加量为48 AU/Kg,90 min;胰蛋白酶水解的pH值为8.5、37℃、酶添加量为31.25 usp/mg、30 min。
4 结论
胰蛋白酶、复合蛋白酶、中性蛋白酶三种蛋白酶中,胰蛋白酶与碱性蛋白酶复合水解大米蛋白的酶解液抗氧化活性最强,并且Fe2+螯合活性及ABTS+·清除活性明显高于碱性蛋白酶单独水解的酶解液。
复合酶解反应的较佳条件为:7.5%(w/v)的大米蛋白、碱性蛋白酶水解的pH值为9、50℃、酶添加量为48AU/Kg、90 min;胰蛋白酶水解的pH值为8.5、37℃、酶添加量为31.25 usp/mg、30 min。在该条件下制备的大米蛋白酶解物具有较高的ABTS+·清除活性及Fe2+螯合活性,可以用于指导大米蛋白酶法制备抗氧化肽的规模化生产。
[1] 陈季旺, 孙庆杰, 夏文水, 等. 碱酶两步法制备大米蛋白的研究[J]. 农业工程学报, 2006, 5: 169-172.
[2] Takahashi M, Moriguchi S, Yoshilawa, M, et al. Isolation and characterization of oryzatensiu: a novel bioactive peptide with ileum-contracting and immunomodulating activities derived from rice albumin[J]. Biochemistry and Molecular Biology International, 1994, 33(6): 115l-1158.
[3] 杨兰花. 80%大米多肽应用于化妆品安全性研究[J].香料香精化妆品, 2011, 10(5):27-28.
[4] Tironi V A, Aón M C. Amaranth proteins as a source of antioxidant peptides: Effect of proteolysis[J].Food Research International,2010,43: 315-322.
[5] Wang L L, Xiong Y L L. Inhibition of lipid oxidation in cooked beef patties by hydrolyzed potato protein is related to its reducing and radical scavenging ability[J]. Journal of Agricultural and Food Chemistry, 2005, 53, 9186-9192.
[6] Kong B H, Xiong Y L L. Antioxidant activity of zein hydrolysates in a liposome system and the possible mode of action[J].Journal of Agricultural and Food Chemistry, 2006, 54, 6059-6068.
[7] 蔡俊,陈季旺,王茹,等.多肽体外抗氧化活性测定方法的比较[J].食品科学, 2016, 37(11): 52-57.
[8] Taheri A, Farvin K H S, Jacobsen C, et al. Antioxidant activities and functional properties of protein and peptidefractions isolated from salted herring brine[J].Food Chemistry, 2014, 142: 318-326.
[9] 顿新鹏, 陈正望. 酶法水解米渣蛋白制备大米小分子肽[J]. 食品科学, 2004, 6: 113-116.
[10] 曹辉. 大米蛋白酶法制备抗氧化肽的研究[D]. 镇江:江苏大学, 2008.
[11] 马海乐, 刘斌, 李树君, 等. 酶法制备大米抗氧化肽的蛋白酶筛选[J]. 农业机械学报,2010, 4(11): 119-123.
[12] 蒋艳. 碎米酶法制备抗氧化肽和ACE抑制肽的研究[D].合肥:合肥工业大学, 2012.
[13] Zhang J H, Zhang H, Wang L, et al. Isolation and identification of antioxidative peptides from rice endospermprotein enzymatic hydrolysate by consecutive chromatographyand MALDI-TOF/TOF MS/MS[J].Food Chemistry, 2010, 119: 226-234.
[14] Yan QJ, Huang LH, Sun Q,et al.Isolation, identification and synthesis of four novel antioxidant peptidesfrom rice residue protein hydrolyzed by multiple proteases[J].Food Chemistry, 2015, 179: 290-295.
[15] Wattanasiritham L, Theerakulkait C, Wickramasekara S, et al. Isolation and identification of antioxidant peptides from enzymatically hydrolyzed rice bran protein[J]. Food Chemistry, 2016, 192: 156-162.
[16] Chanput W, Theerakulkait C, Nakai S, Antioxidative properties of partially purified barley hordein, rice bran protein fractions and their hydrolysates[J].Journal of Cereal Science, 2009, 49: 422-428.
[17] 蔡广霞. 大米源血管紧张素转化酶抑制肽的复合酶法制备、纯化及构效关系研究[D].武汉:武汉工业学院, 2012.
[18] Jens A N. Determination of the degree of hydrolysis of food protein hydrolysates by trinilrobenzen sulfonic acid [J]. Journal of Agricultural and Food Chemistry, 1979, 27(6): 1256-1262.
[19] Jens A N .Enzymatic hydrolysis of food protein[M]. Essex. Elsevier applied science publisher s LTD, 1986.
[20] 余瑞元, 袁明秀, 陈丽蓉, 等. 生物化学实验原理和方法(第二版)[M]. 北京: 北京大学出版社, 2005.
[21] 崔诚, 陈悦, 陈季旺, 等. 基于混合床离子交换树脂脱盐的草鱼肽及其理化性质[J]. 食品科学, 2013, 34(18): 23-27.
[22] Chen H M, Koji M, Fumio Y. Structural analysis of anti-oxidative peptides from soybean β-conglycinin[J]. Journal of Agriculture and Food Chemistry, 1995, 43: 574-578.
[23] Rajapakse N, Mendis E, Jung W K, et al. Purification of a radical scavenging peptide from fermented mussel sauce and its antioxidant properties[J]. Food Research International, 2005, 38: 175-182.
[24] Sarmadi B H, Ismail A. Antioxidative peptides from food proteins: A review[J]. Peptides, 2010, 31:1949-1956.
[25] Farvin K H S, Andersen L L, Otte J, et al. Antioxidant activity of cod (Gadusmorhua) protein hydrolysates: Fractionation and characterisation of peptide fractions[J]. Food Chemistry, 2016, 204: 409-419.
[26] 王镜岩, 朱圣庚, 徐长法. 生物化学(第三版,下册)[M].北京:高等教育出版社, 2002.
[27] Janet C C, Alan J H, Cristian J M, et al. Antioxidant and metal chelating activities of peptide fractions from phaseolin and bean protein hydrolysate[J].Food Chemistry, 2012, 135: 1789-1795.
[28] Storcksdieck S, Bonsmann G, Hurrell R F. Iron-binding properties, amino acid composition, and structure of muscle tissue peptides from in vitro digestionof different meat sources[J]. Journal of Food Science, 2007, 72(1): S19-S28.
Combined proteases hydrolysis of rice protein and antioxidant activity of the hydrolysatesinvitro
PENGLan-lan1,CHENJi-wang1,2,CAIJun1,DINGWen-ping1,2,WUYong-ning1,2
(1.College of Food Science and Engineering, Wuhan Polytechnic University , Wuhan 430023, China; 2.Hubei Collaborative Innovation Center for Processing of Agricultural Products, Wuhan 430023, China)
2017-07-08.
彭斓兰(1991-),女,硕士,E-mail:Peng-lanlan @outlook.com.
陈季旺(1970-),男,教授,博士,E-mail:jiwangchen1970@126.com.
粮食公益性行业科研专项(201513006-3);湖北省自然科学基金面上项目(2014CFB888);武汉市国际合作项目(201231234466);武汉轻工大学研究生创新基金项目(2014cx013).
2095-7386(2017)03-0014-09
10.3969/j.issn.2095-7386.2017.03.003
TS 103.84+3
B
