化学还原法制备钒电池电解液中还原剂选择及性能
2017-10-13杨亚东张一敏黄晶刘涛郑秋实
杨亚东,张一敏,黄晶,刘涛,郑秋实
化学还原法制备钒电池电解液中还原剂选择及性能
杨亚东1,2,张一敏1,2,3,黄晶1,2,3,刘涛1,2,3,郑秋实1,2
(1武汉科技大学资源与环境工程学院,湖北武汉430081;2钒资源高效利用湖北省协同创新中心,湖北武汉430081;3湖北省页岩钒资源高效清洁利用工程技术研究中心,湖北武汉430081)
以V2O5为原料,采用化学还原法制备钒电池电解液。对比草酸、抗坏血酸、酒石酸、柠檬酸、双氧水、甲酸、乙酸制备所得钒电池电解液的转化率、还原率及电化学性能,发现草酸制得的电解液转化率及还原率较高,且其电化学活性明显优于其他还原剂。对草酸制备电解液的反应动力学进行分析,发现该反应为放热反应且在常温下能自发进行。对制备过程中的各项参数进行优化,在(H2C2O4)∶(V2O5)=1∶1、反应温度90℃、反应时间100min、(H2SO4)∶(V2O5)=5∶1的条件下,电解液的转化率与还原率达到了94.80%和93.55%。草酸和VOSO4制备的电解液电化学分析结果表明草酸制备的电解液能够抑制析氧副反应的发生,具有较大的扩散系数、交换电流密度、电极反应标准速率常数和较小的极化电阻,对电极反应的传质过程和传荷过程有促进作用,提高了电极反应速率。以草酸为还原剂能够在较低温度下高效地制备具有良好的电化学性能及稳定性的钒电池电解液。
全钒液流电池;电解液;电化学
近年来,大规模储能技术逐渐成为可再生能源开发利用的重点[1-2]。全钒液流电池储能技术由于其具有储能规模大、安全性高、循环寿命长、环境友好等优点[3-5],成为规模储能的首选技术之一。
电解液作为全钒液流电池的一个重要部分,不仅决定了电池的储能容量,还直接影响储能系统的性能及成本[6-8]。SKYLLAS-KAZACOS等[9]最早采用VOSO4直接溶解于H2SO4溶液的方式制备V(Ⅳ)电解液,但VOSO4的成本较高,不利于大规模应用。因此,有学者[10-11]开展了以成本较低的V2O5为原料制备电解液的研究。由于V2O5在硫酸中溶解度很低,而V(Ⅳ)易溶于水和硫酸,有人提出了电解法[12-13]和化学还原法[14-15]两种制备电解液的方法。刘然等[16]采用流动型电解槽电解制备出了高浓度且具有较好电化学活性的V(Ⅲ)电解液,但存在制备效率过低、能耗较高、对设备要求高等问题。吴雄伟等[17]用双氧水还原V2O5制备出了具有较好活性的钒电池电解液,但制备的电解液钒浓度较低、反应温度高且制备效率过低。有学者利用草酸、柠檬酸、锌粉、酒石酸、抗坏血酸、SO2、甲酸和乙酸作化学还原法的还原剂,并做了相关的研究[18-19],但未对各还原剂的制备效果和制得的电解液的电化学性能进行对比,选出最佳的还原剂。此外,没有对化学还原法制备的电解液的电化学动力学和稳定性进行比较详细的研究。
本文通过对比草酸、抗坏血酸、酒石酸、柠檬酸、双氧水、甲酸、乙酸制备电解液的转化率、还原率和电化学性能,选出了最佳的还原剂草酸。对草酸还原的反应动力学进行了研究,优化了制备过程中的各项工艺参数。对草酸制备的电解液和VOSO4制备的电解液进行了电化学动力学和稳定性分析,探究了草酸还原制备的电解液电极反应过程和稳定性的变化。
1 实验部分
1.1 仪器及试剂
五氧化二钒(V2O5,99.5%),购于三浦化工有限公司;草酸(H2C2O4,分析纯)、98%浓硫酸(分析纯)购于国药集团化学试剂有限公司;水浴恒温磁力搅拌器、ZDJ-4A自动电位滴定仪,上海雷磁精密仪器有限公司;CHI660E电化学工作站,上海辰华仪器有限公司。
1.2 电解液制备
化学还原制备电解液:在一定量的浓硫酸中加入同体积的水,加入V2O5进行溶解活化,放入一定温度的恒温水浴锅中搅拌,按还原剂与V2O5的摩尔比逐量加入还原剂,反应一段时间后过滤。
VOSO4制备电解液:在浓硫酸中加同体积的水,将定量的VOSO4(无结晶水)加入其中,搅拌至完全溶解,制得钒浓度为1.9mol/L、硫酸浓度为3mol/L的V(Ⅳ)电解液。
1.3电解液浓度测定及转化率、还原率计算
钒总浓度测定[20]:将电解液稀释100倍,取稀释液依次加入硫磷混酸、硫酸亚铁铵溶液,高锰酸钾溶液至溶液为紫红色,加入尿素,滴加亚硝酸钠溶液至溶液变为无色,以-苯代邻氨基苯甲酸为指示剂,用硫酸亚铁铵标准液滴定至溶液由红色变为黄绿色。记录滴定体积计算总钒浓度。
V(Ⅳ)浓度测定:取一定量电解液,加入硫磷混酸,采用高锰酸钾溶液进行氧化还原电位滴定,记录滴定体积计算V(Ⅳ)浓度[21]。
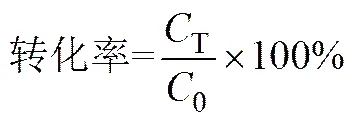
(2)
式中,T为钒的总浓度,mol/L;Ⅳ为V(Ⅳ)的浓度,mol/L;0为钒的理论浓度,本文中为2mol/L。
1.4 电解液电化学测试
循环伏安测试:测试采用三电极系统,工作电极为10mm×10mm的石墨板电极,对电极为10mm×10mm的铂片电极,参比电极为饱和甘汞电极,测试温度为25℃,扫描初始电压0.2V,正向扫描,扫描电压范围0.2~1.7V,扫描速率20mV/s。
稳态极化曲线测试:测试采用上述的三电极系统,测试温度为25℃,扫描初始电压0.7V,正向扫描,扫描电压范围0.7~1.2V,扫描速率1mV/s。
1.5 电解液稳定性测试
将制得的V(Ⅳ)电解液电解成V(Ⅴ),取10mL V(Ⅴ)电解液装入密封玻璃瓶中,然后静置于40℃和50℃的恒温水浴锅中进行稳定性测试。间隔一定时间观察玻璃瓶中沉淀的形成情况,记录玻璃瓶中沉淀出现的时间。将出现沉淀的电解液过滤,测试过滤后的电解液中钒的浓度。
2 结果与讨论
2.1 不同还原剂制备电解液转化率及还原率对比
在还原剂与V2O5摩尔比为各还原反应的化学计量比,反应温度、反应时间和(H2SO4)∶(V2O5)分别为90℃、120min和5∶1的条件下,将不同还原剂制得的电解液钒浓度、转化率及还原率进行对比,结果如表1。
从表1可见,草酸、抗坏血酸和酒石酸具有较高的还原率及转化率且钒的浓度均达到了1.85mol/L,而柠檬酸与双氧水的转化效果较差,无法用于制备高浓度的电解液。甲酸和乙酸对V2O5的转化基本无促进作用。这说明在较低的反应温度下,草酸、抗坏血酸、酒石酸有较高的还原效率,而其他的还原剂可能由于还原能力不足或反应温度较低使得转化率与还原率较低。
由于草酸、抗坏血酸和酒石酸的转化率与还原率均较高且制得的电解液钒浓度相近,对3种电解液进行循环伏安测试,测得循环伏安曲线如图1 所示。
由图1可知,草酸、抗坏血酸、酒石酸制得的电解液的峰电位差依次为433mV、433mV、443mV且氧化还原峰的对称性较好,说明这3种还原剂制备的电解液的VO2+/VO2+电对电极反应的可逆性相差不大。草酸制备的电解液的氧化峰电流为119.3mA明显大于抗坏血酸和酒石酸的84.69mA、96.74mA,表明草酸制备的电解液的电化学活性最佳。这可能是由于少量的未反应的酒石酸和抗坏血酸残留在溶液中,其基团分子结构较大与钒离子结合阻碍了电极反应的传质过程使得电化学活性降低。草酸则由于其基团较小使电解液具有较好的电化学活 性[22],适合用作制备电解液的还原剂。

表1 不同还原剂制备电解液的还原率及转化率
图1 不同还原剂制备的电解液的循环伏安曲线
2.2 五氧化二钒与草酸反应的热力学分析
V2O5在硫酸中的溶解度较低,通过草酸的还原,生成溶解度较大的VOSO4,从而制得V(Ⅳ)电解液。其反应式如式(3)。
V2O5(s)+H2C2O4(s)+2H2SO4(l)—→2VOSO4(l)+2CO2(g)+3H2O(l)(3)
根据表2中的热力学数据进行计算得出,该反应的rmθ=–262.632kJ/mol、rmθ=–352.128kJ/mol。因此,反应(3)为放热反应,能促进还原反应的进行,且该反应在常温下能自发进行。
2.3 草酸制备电解液的参数优化
2.3.1(H2C2O4)∶(V2O5)对电解液制备的影响
在反应温度为90℃、反应时间120min和(H2SO4)∶(V2O5)=5∶1的条件下,考察了(H2C2O4)∶(V2O5)对电解液的转化率及还原率的影响,结果如图2。
由图2可见,(H2C2O4)∶(V2O5)在0.8到1之间电解液的转化率及还原率均呈现快速上升的趋势。当(H2C2O4)∶(V2O5)>1之后,电解液的转化率与还原率基本不变。在(H2C2O4)∶(V2O5)=1时,转化率与还原率分别为95.15%和93.55%且钒浓度达到了1.903mol/L。这说明在(H2C2O4)∶(V2O5)<1时,草酸量不足以还原五氧化二钒使其完全溶解,而当(H2C2O4)∶(V2O5)>1后草酸已经足量,继续增加草酸用量转化率和还原率不会出现明显变化反而会引入草酸杂质,过多的草酸进入电解液会影响其电化学性[22]。因此,确定最佳的(H2C2O4)∶(V2O5)=1,这与反应(3)的化学计量比相吻合。

表2 反应方程式(3)中物质的热力学数据[23]
2.3.2 反应温度对电解液制备的影响
在(H2C2O4)∶(V2O5)=1∶1、反应时间120min、(H2SO4)∶(V2O5)=5∶1的条件下,考察了不同反应温度下电解液转化率及还原率的变化,结果如图3。
由图3可知,转化率及还原率均随反应温度的升高而增大,当反应温度>90℃后温度升高还原率有小幅提升而转化率变化不大,这是因为温度升高促进了还原反应的进行,从而将溶液中的VO2+还原成VO2+使还原率升高。在保证电解液转化率的前提下,应尽量降低反应温度,因此选择反应温度为90℃。
2.3.3 反应时间对电解液制备的影响
在(H2C2O4)∶(V2O5)=1∶1、反应温度为90℃和(H2SO4)∶(V2O5)=5∶1的条件下,考察了反应时间对电解液制备过程的影响,结果如图4。
从图4可见,在较短的时间内电解液的转化率和还原率就能达到较高的水平,这说明草酸还原效率较高。电解液的转化率及还原率在40min到100min上升较快,在100min到120min基本没有提升,这说明当固体溶解完全后,转化率与还原率并不会随反应时间的延长而增大。为提高效率降低能耗,选取的反应时间为100min。
2.3.4(H2SO4)∶(V2O5)对电解液制备的影响
在(H2C2O4)∶(V2O5)=1∶1、反应温度为90℃和反应时间为100min的条件下,考察了(H2SO4)∶(V2O5)对电解液制备效果的影响,结果如图5。
从图5可见,当(H2SO4)∶(V2O5)<5时,电解液的转化率及还原率随着硫酸用量的增加而增大。(H2SO4)∶(V2O5)>5后电解液的转化率及还原率虽有一定程度提升,但幅度较小。这说明硫酸用量的增加会促进V2O5的溶解和还原,钒浓度达到一定程度后反应进行较为完全而不会有较大提升。考虑到电池运行过程中硫酸浓度对电解液稳定性和电池设备腐蚀的影响,选择的(H2SO4)∶(V2O5)=5∶1,在此条件下,制得的电解液钒浓度为1.9mol/L,硫酸浓度为3mol/L。
2.4 电解液的电化学分析
对草酸还原制备的1.9mol/L V(Ⅳ)电解液和同浓度的VOSO4制备的电解液进行循环伏安测试。
对比图6(a)和(b)可以发现,VOSO4制备电解液的循环伏安曲线出现了除VO2+/VO2+氧化还原峰以外的峰,将1.5~1.7V范围内的循环伏安曲线放大如图7所示,结合电位判断此处发生了析氧副反应[24],而草酸制备电解液的循环伏安曲线中没有出现有类似的情况,这说明草酸制备的电解液能抑制析氧副反应的发生,有利于钒电池的稳定运行。随着扫描速率的增大,草酸与VOSO4制备的电解液的氧化峰电流ipa和还原峰电流ipc均不断增大,同时氧化还原峰电位差∆φ也逐渐增大且均大于59mV,但氧化还原峰的峰形较对称且ipa/ipc均保持在1左右,说明在电解液中VO2+/VO2+电对在石墨板电极上的电极反应属于准可逆体系。钒离子在电极反应过程中的扩散系数可以通过Randles-Sevcik方程[25]计算。对于准可逆体系,其扩散系数介于可逆体系和不可逆体系之间。
可逆体系

不可逆体系
(5)
式中,p为氧化峰电流,A;为电极反应转移电子数;为电荷传递系数(≈0.5);为电极面积,cm2;为反应活性物质浓度,mol/cm3;0为反应活性物质的扩散系数,cm2/s;为扫描速率,V/s。
对草酸和VOSO4制备的电解液氧化峰电流与扫描速率的方根进行线性拟合,根据Randles-Sevcik方程计算得到草酸和VOSO4制备的电解液中VO2+的扩散系数分别为9.767×10–7~1.581×10–6cm2/s、8.524×10–7~1.380×10–6cm2/s[22]。说明采用草酸制备电解液对VO2+/VO2+电对的电极反应传质过程有促进作用,这可能是由于草酸制备的电解液中存在的有机基团与钒离子络合,抑制了钒离子自身的缔合使得扩散系数增大[26]。
由草酸和VOSO4制备的电解液的性能见图8~图10。由图8可以看出,草酸制备的电解液的电流峰值要高于VOSO4制备的电解液。扣除各自峰电流的基线值可以得到草酸和VOSO4制备的电解液的极限扩散电流密度d分别为34.78mA/cm2和30.83mA/cm2。这同样证明了通过草酸制备电解液会VO2+/VO2+电对的电极反应传质过程有促进作用。
由图9可看出,草酸和VOSO4制备的电解液的电极反应平衡电位分别为0.817V和0.803V,对于稳态极化曲线,过电位<10mV时,与电流密度具有很好的线性关系。由图10可看出,对过电位为–10~10mV的与进行线性拟合,再通过以下公式计算可以得到电解液的电化学动力学参数[27]:

式中,p为极化电阻,Ω·cm2;为过电位,V;为电流密度,A/cm2;0为交换电流密度,A/cm2;为通用气体常数,=8.314J/(mol·K);为热力学温度,取298.15K;为电极反应过程中电子转移数(=1);为法拉第常数,=96485C/mol;0为电极反应标准速率常数,cm/s;0为钒离子浓度,mol/cm3。
对电流密度与过电位的线性关系进行拟合,得到草酸和VOSO4制备的电解液的线性关系式分别为=0.07472+3.44×10–5和=0.04674+6.08×10–5。由上述公式计算得到各自的电化学动力学参数[28],如表3。

表3 草酸和VOSO4制备的电解液电化学动力学参数
由表3的参数可见,草酸制备的电解液VO2+/VO2+电对的电极反应具有更小的极化电阻,更大的交换电流密度和标准速率常数。表明通过草酸制备电解液可以减少电化学极化,提高电极反应速率。这可能是由于草酸制备的电解液存在的有机基团结合到电极表面为电极反应增加了活性位点,使得电极表面的电子转移过程加快从而促进了电极反应的传荷过程[29]。
2.5 电解液稳定性
钒电池电解液的稳定性主要体现在V(Ⅴ)电解液的热稳定性,将草酸和VOSO4制备的1.9mol/L V(Ⅳ)电解液电解成V(Ⅴ)电解液,对V(Ⅴ)电解液进行热稳定性测试,结果如表4。

表4 草酸和VOSO4制备的V(V)电解液的稳定性
由表4可见,草酸制备的电解液在40℃和50℃的沉淀出现时间均大于VOSO4制备的电解液,且40℃电解液沉淀出现时间远大于50℃。过滤后,草酸和VOSO4制备的电解液在40℃和50℃测试条件下的钒浓度相差不大,40℃的电解液钒浓度大于50℃。这说明温度越高电解液稳定性越差,钒浓度下降越快,草酸制备的电解液的稳定性优于VOSO4制备的电解液。
3 结论
(1)对比草酸、抗坏血酸、酒石酸、柠檬酸、双氧水、甲酸、乙酸制备所得的钒电池电解液的转化率、还原率及电化学性能,发现草酸还原制备的电解液具有较高的制备效率及较好的电化学性能。
(2)热力学计算表明,草酸与V2O5的反应为放热反应能促进还原反应的进行且该反应在常温下能自发进行。草酸还原制备电解液的最佳制备条件为(H2C2O4)∶(V2O5)=1:1、反应温度90℃、反应时间100min和(H2SO4)∶(V2O5)=5∶1,此条件下转化率与还原率分别为94.8%和93.55%。
(3)对比VOSO4制备的电解液,草酸制备的电解液中VO2+/VO2+电对具有较大的扩散系数,电极反应的极化电阻更小,交换电流密度和标准速率常数更大,能够抑制析氧副反应的发生,对电极反应的传质、传荷过程有促进作用。V(Ⅴ)电解液的热稳定性测试表明,草酸制备的电解液在40℃和50℃具有较好的稳定性。
[1] 刘大凡,李晓磊,郭西凤,等. 全钒氧化还原液流电池的发展现状[J]. 无机盐工业,2010,42(8):4-6.
LIU D F,LI X L,GUO X F,et al. Current development status of all vanadium redox flow battery[J]. Inorganic Chemicals Industry,2012,42(8):4-6.
[2] MANI U,VANCHIAPPAN A,YAN Q Y,et al. Recent advancements in all vanadium redox flow batteries[J]. Advanced Materials Interfaces,2016,3(1):2-3.
[3] ZENG Y K,ZHAO T S,AN L,ZHOU X L,WEI L. A comparative study of all vanadium and iron-chromium redox flow batteries for large-scale energy storage[J]. Journal of Power Sources,2015,300:438-439.
[4] DAVID R,EDWIN T,LI B,et al. Performance of a low cost interdigitated flow design on a 1 kW class all vanadium mixed acid redox flow battery[J]. Journal of Power Sources,2016,306:24-25.
[5] KI J K,MIN S P,YOUNG J K,et al. A technology review of electrodes and reaction mechanisms in vanadium redox flow batteries[J]. Journal of Materials Chemistry,2015,3(33):16913-16914.
[6] 王刚,陈金伟,汪雪芹,等. 全钒氧化还原液流电池电解液[J]. 化学进展,2013,25(7):1103-1104.
WANG G,CHEN J W,WANG X Q,et al. Electrolyte of all vanadium redox flow battery[J]. Progress in Chemistry,2013,25(7):1103-1104.
[7] 徐波,齐亮,姚克俭,等. 全钒液流电池电解液分布的数值模拟[J]. 化工进展,2013,32(2):313-314.
XU B,QI L,YAO K J,et al. Investigation and simulation on electrolyte distribution for all vanadium redox flow battery[J]. Chemical Industry and Engineering Progress,2013,32(2):313-314.
[8] 尹跃龙,李小山,王树博,等. 复合添加剂对全钒液流电池正极电解液的影响[J]. 化工进展,2011,30:767-769.
YIN Y L,LI X S,WANG S B,et al. Effect of complex additives on the positive electrolyte for all vanadium redox flow battery[J]. Chemical Industry and Engineering Progress,2013,30:767-769.
[9] SKYLLAS-KAZACOS M,RYCHCIK M,ROBINS R G,et al. New all vanadium redox flow cell[J]. Journal of the Electrochemical Society,1986,133(5):1057-1058.
[10] 彭声谦,许国镇,杨华栓,等. 用从石煤中提取的V2O5制备钒电池用VOSO4的研究[J]. 无机盐工业,1997,1:3-5.
PENG S Q,XU G Z,YANG H S,et al. Study on preparation of vanadyl sulfate for all vanadium redox flow battery with vanadium pentoxide extracted from stone coal[J]. Inorganic Chemicals Industry,1997,1:3-5.
[11] 毛凤娇. 钒电池用硫酸氧钒的制备研究[J]. 四川化工,2015,18(1):1-4.
MAO F J. Study on preparation of vanadyl sulfate for all vanadium redox flow battery[J]. Sichuan Chemical Industry,2015,18(1):1-4.
[12] 向小绢,吴雄伟,邓奇,等. V2(SO4)3的制备及其在固体钒电池中的应用[J]. 广州化学,2014,39(3):17-21.
XIANG X J,WU X W,DENG Q,et al. Preparation of V2(SO4)3and its application in vanadium-solid battery[J]. Guangzhou Chemistry,2014,39(3):17-21.
[13] KAZACOS M,CHENG M,SKYLLAS K M. Vanadium redox cell electrolyte optimization studies[J]. App. Electrochem.,1990,20:463-466.
[14] 陈孝娥,崔旭梅,王军. V(Ⅲ)-V(Ⅳ)电解液的化学合成及性能[J]. 化工进展,2012,31(6):1330-1332.
CHEN X E,CUI X M,WANG J. Study on the chemical synthesis and the performance of V(Ⅲ)-V(Ⅳ)electrolyte[J]. Chemical Industry and Engineering Progress,2012,31(6):1330-1332.
[15] 彭声谦,许国镇,杨华栓,等. 用从石煤中提取的V2O5研制全钒氧化还原流体电池[J]. 矿产综合利用,1998(2):42-46.
PENG S Q,XU G Z,YANG H S,et al. A Study on degree of structural order of Kaolinite from Shange,Maoming[J]. Multipurpose Utilization of Mineral Resources,1998(2):42-46.
[16] 刘然,潘建欣,谢晓峰,等. 五氧化二钒电解制备全钒液流电池V3+电解液[J]. 高校化学工程学报,2014,28(6):1275-1278.
LIU R,PAN J X,XIE X F,et al. Synthesis of V3+electrolyte by electrochemical reducing vanadium pentoxide[J]. Journal of Chemical Engineering of Chinese Universities,2014,28(6):1275-1278.
[17] 吴雄伟,彭穗,冯必钧,等. 钒电解液的绿色制备及其热力学分析[J]. 无机材料学报,2011,26(5):535-538.
WU X W,PENG S,FENG B J,et al. Preparation,thermodynamic and electrochemical properties of vanadium solution[J]. Journal of Inorganic Materials,2014,26(5):535-538.
[18] 孙琦. 一种钒电池活性物质硫酸氧钒的制备方法:201310218693.7[P]. 2013-09-18.
SUN Q. A method of preparation of active substances vanadium sulfate for all vanadium redox flow battery:201310218693.7[P]. 2013-09-18.
[19] 许伟琦. 一种高纯度钒电池电解液的配制方法:201310289611.8[P]. 2013-10-09.
XU W Q. A preparation method of high purity electrolyte for all vanadium redox flow battery:201310289611.8[P]. 2013-10-09.
[20] 中华人民共和国国家质量监督检验检疫总局. 中国国家标准:GB/T 8704.5—2007[S]. 北京:中国标准出版社,2007.
General Administration of Quality Supervision,Inspection and Quarantine of the People’s Republic of China,Standardization Administration of the People’s Republic of China. Information and documentation——rules for bibliographic references and citations to information resources:GB/T 8704.5—2007[S]. Beijing:Standards Press of China,2007.
[21] 国家能源局. 中国能源行业标准:NB/T 42006—2013[S],北京:中国标准出版社,2013:3-4.
National Energy Administration. China’s energy industry standards:NB/T 42006—2013[S],Beijing:Standards Press of China,2013:3-4.
[22] WANG G,CHEN J W,WANG X Q,et al. Study on stabilities and electrochemical behavior of V(Ⅴ) electrolyte with acid additives for vanadium redox flow battery[J]. Journal of Energy Chemistry,2014,23:73-81.
[23] DEAN J A. 兰氏化学手册[M]. 魏俊发,译. 北京:科学出版社,2003:1458-1556.
DEAN J A. Lang chemical manual[M]. WEI J F,trans. Beijing:Science Press,2003:1458-1556.
[24] 张华民. 液流电池技术[M]. 北京:化学工业出版社,2015:78-80.
ZHANG H M. Technology of flow battery[M]. Beijing:Chemical Industry Press,2015:78-80.
[25] LIANG X X,PENG S,LEI Y,et al. Effect of L-glutamic acid on the positive electrolyte for all-vanadium redox flow battery[J]. Electrochimica Acta,2013,95:81-83.
[26] HAN H G,HE Z X,LIU J L,et al. Effects of pyridine carboxylic acid on the positive electrolyte for vanadium redox flow battery[J]. Ionics,2015,21:167-174.
[27] BARD A J,FAULKNER L R. Electrochemical methods,fundamental and applications[M]. New York:John Wiley & Sons,2001:99.
[28] WU X J,LIU S Q,WANG N F,et al. Influence of organic additives on electrochemical properties of the positive electrolyte for all-vanadium redox flow battery[J]. Electrochimica Acta,2012,78:479-480.
[29] 刘素琴,史小虎,黄可龙,等. 钒液流电池用碳纸电极改性的研究[J]. 无机化学学报,2008,24(7):1081-1082.
LIU S Q,SHI X H,HUANG K L,et al. Characteristics of carbon paper as electrode for vanadium redox flow battery[J]. Chinese Journal of Inorganic Chemistry,2008,24(7):1081-1082.
Reducing agent selection and performance study of electrolyte for vanadium redox battery prepared by chemical reduction method
YANG Yadong1,2,ZHANG Yimin1,2,3,HUANG Jing1,2,3,LIU Tao1,2,3,ZHENG Qiushi1,2
(1College of Resource and Environment Engineering,Wuhan University of Science and Technology,Wuhan 430081,Hubei,China;2Hubei Collaborative Innovation Center of High Efficient Utilization for Vanadium Resources,Wuhan 430081,Hubei,China;3Hubei Provincial Engineering Technology Research Center of High Efficient Cleaning Utilization for Shale Vanadium Resource,Wuhan 430081,Hubei,China)
The electrolyte for vanadium redox batterywas prepared using chemical reduction method with vanadium pentoxide as raw materials. The conversion rate,reducing rate and electrochemical properties of electrolyte prepared by oxalic acid,ascorbic acid,tartaric acid,citric acid,hydrogen peroxide,formic acid,and acetic acid were compared. It was found that oxalic acid had higher conversion rate,higher reducing rate,and better electrochemical activity. The reaction kinetics analysis indicated that the reaction of oxalic acid reduction is exothermic reaction,and could proceed spontaneously at room temperature. The parameters of preparation process was optimized,under the conditions of(H2C2O4):(V2O5)=1∶1,reaction temperature 90℃,reaction time 100min and(H2SO4)∶(V2O5)=5∶1,the conversion rate and reducing rate reached 94.8% and 93.55%,respectively. The electrochemical analysis of electrolyte showed that the electrolyte prepared by oxalicacid could inhibit the oxygen evolution reaction. It also showed that the mass transfer and charge transfer process and reaction rate were improved. Using oxalic acid as reducing agent could prepare electrolyte efficiently in lower temperature,and the prepared electrolyte has good electrochemical properties and stability.
vanadium redox battery;electrolyte;electrochemical
O 642
A
1000–6613(2017)01–0274–08
10.16085/j.issn.1000-6613.2017.01.034
2016-06-07;修改稿日期:2016-08-03。
国家自然科学基金(51474162),51404174)及教育部科学技术研究项目(213025A)。
杨亚东(1992—),男,硕士研究生。E-mail:yangyadong1016@sina.com。联系人:张一敏,教授,研究方向为高效洁净矿物加工理论与工艺、湿法冶金、二次资源利用。E-mail:zym126135@126.com。
