种衣剂对低温处理下棉花胚根及幼苗外部形态和超微结构的影响*
2017-10-13段留生张鹏忠谭伟明
雷 斌,李 进,段留生,张鹏忠,李 杰,谭伟明
种衣剂对低温处理下棉花胚根及幼苗外部形态和超微结构的影响*
雷 斌1,2,李 进2,3,段留生1**,张鹏忠4,李 杰3,谭伟明1
(1.中国农业大学农学与生物技术学院,北京 100083;2.新疆农业科学院核技术生物技术研究所,乌鲁木齐 830091;3.新疆绿洲兴源农业科技有限责任公司,乌鲁木齐 830091;4.国家棉花工程技术研究中心,乌鲁木齐 830091)
以棉种‘新陆中54号’为材料,用3种种衣剂(棉1、棉2、棉3)包衣棉种后播种于塑料营养盒内,25℃恒温培养,分别在第4天(棉种长出胚根)和第7天(棉株幼苗)均进行5、10、15、20℃共4个低温处理,与各低温下未包衣种子(对照,CK)进行比较,低温处理24h后,观察各处理棉花胚根、幼苗外部形态和超微结构的变化,以期通过模拟新疆早春“倒春寒”发生特点,考察种衣剂对提高棉花耐寒性的功效。结果表明:20℃下种衣剂处理与CK无差异,种子萌发正常,发芽率在92.24%~95.51%,3种种衣剂包衣处理胚根生长量为3.66~3.81cm,幼苗叶色浓绿,茎杆直立,胚根细胞中线粒体结构完整,叶肉细胞中线粒体、叶绿体结构规则;15℃低温下种衣剂处理棉种发芽率较CK提高4.45~6.98个百分点,胚根生长速度下降,但包衣处理生长量较CK提高25.27%~36.05%,幼苗叶色浓绿,棉苗直立,胚根细胞中线粒体内脊清晰,叶肉细胞中叶绿体、线粒体结构清晰,细胞器结构和数量明显优于CK;10℃低温下棉种发芽受到抑制,但包衣处理较CK发芽率提高0.73~4.25个百分点,19.15%~42.55%的幼苗叶片下垂萎蔫,保持正常温度后种衣剂处理棉苗很快恢复到正常形态,胚根细胞中线粒体、内质网数目多于CK,叶肉细胞中叶绿体轮廓清晰,内含物较少;5℃低温下各处理棉种发芽率均低于50.00%,CK幼苗叶色脱水失绿,萎蔫下垂,萎蔫率达74.47%,叶绿体膨胀成圆球形、轮廓模糊,包衣处理幼苗萎蔫率在60.42%~67.45%,叶肉细胞中叶绿体结构完整,呈椭球型,线粒体结构较规则、内含物浑浊。研究表明种衣剂能促进低温处理下种子萌发、提高发芽率和胚根生长速度、保护棉苗外部形态和细胞超微结构稳定,维持正常生长,增强幼苗抵御低温的危害能力。
种衣剂;棉花;低温处理;外部形态;超微结构
棉花(L.)是重要的经济作物,是新疆经济发展的支柱,2015年新疆种植面积达242.13万hm2,总产量约451.00万t[1]。棉花是喜温作物,棉种发芽最适温度为28~30℃,播种期、苗期临界温度分别为12℃、15℃[2-3],低温是制约其生长发育的主要因素之一,种子露白期和幼苗期是感受低温最敏感的时期[4-6]。新疆北疆棉区由于早春“倒春寒”频繁发生,种子露白期和幼苗期经常发生低温冷害,造成烂种、烂芽和死苗。种衣剂是由杀虫剂、杀菌剂、植物生长调节剂、成膜剂、悬浮剂等成分经特定工艺流程加工制成的,可直接或经稀释后包覆于种子表面,形成具有一定强度和通透性保护层膜的农药制剂[7],具有抗逆、助长等功能,能促进棉种发芽和幼苗生长[8]。因此,分析种衣剂对低温处理下棉花胚根、幼苗外部形态和超微结构响应,探索种衣剂抗寒作用机制,为种衣剂推广提供科学依据,对提高棉花抵御低温胁迫能力、促进棉花产业持续健康发展具有重要意义。
关于低温对作物生长发育和超微结构也有相关研究,李进等[8]研究发现低温胁迫会延长发芽时间、降低发芽势、发芽率,限制下胚轴的生长,并且温度越低,抑制作用越强,但种衣剂处理能促进低温处理下棉花种子发芽和幼苗生长。武辉等[9]研究发现,棉花幼苗叶片在不同程度低温胁迫下所表现的冷害症状差异较明显,轻则叶片下垂萎蔫,重则叶片死亡。杨云珠等[10]研究发现,低温条件下PVA和PEG预处理吸胀的大豆种子,其胚根细胞内线粒体能继续发育,有明显的双层膜结构。Ma等[11]用透射电镜观察发现,4℃处理下低温敏感型绿豆叶肉细胞中叶绿体遭到破坏、淀粉粒积聚。杨凤仙等[12]研究发现低温锻炼过程中,棉花叶片叶绿体发生明显变形,液泡内出现大量膜性结构物质,而线粒体等其它细胞器表现较为稳定。Robert等[13]研究表明,棉花叶绿体在5℃下形成外围的网状结构,也证实了低温对膜产生不利影响。
目前,对棉花低温研究大多集中在生理生化指标上,对低温处理下棉花种子胚根、幼苗外部形态和超微结构关联研究相对较少,对外源物质提高耐低温能力的研究报道更少。因此,本研究通过自制种衣剂包衣棉种,模拟大田低温危害,考察种衣剂处理对不同低温下棉花胚根及幼苗外部形态和超微结构的影响,以期探索缓解低温冷害对新疆棉花危害的技术及产品,为种衣剂推广和棉花抗寒研究提供理论依据。
1 材料与方法
1.1 材料
试验于2015-2016年在新疆农业科学院核技术生物技术研究所进行。供试棉花品种为‘新陆中54号’。供试种衣剂共3种(棉1:18.6%拌·福·乙悬浮种衣剂;棉2:7.2%拌·福悬浮种衣剂;棉3:26%多·福·立枯磷悬浮种衣剂),棉1由新疆农业科学院核技术生物技术研究所研制,棉2、棉3为市购产品,分别由新疆当地公司生产。
1.2 方法
1.2.1 种子包衣处理
挑选健康饱满、大小均匀的棉花种子,按药种重量比1:50进行包衣,阴干后置于种子袋内保存备用。
1.2.2 棉花种子发芽、胚根生长试验、电镜样品取样
将种子播种在塑料营养盒中放入25℃培养箱中培养,基质为细砂,培养箱光照强度12000lx,光周期为12h/12h(昼/夜),相对湿度70%~75%。在培养箱中培养后第4天和第7天,对3种种衣剂包衣棉种或幼苗均进行5、10、15、20℃共4个低温处理,以各低温下未包衣处理为对照CK,分别与相应低温下包衣处理进行比较。每处理50粒,重复3次。培养4d后低温处理24h,记录各处理种子发芽数,计算发芽率,并从各处理随机选取10棵测定胚根长度,计算胚根生长速度。另取5棵用蒸馏水清洗干净,滤纸吸干水后拍照,然后快速用刀片将胚根切成厚度约0.5mm的薄片样品,真空抽气使完全下沉,放入4℃冰箱内用2.5%戊二醛固定液中固定24h作为后续电镜试验样品。培养7d后低温处理24h,随机定苗40株,统计各处理萎蔫幼苗数并拍照,计算萎蔫率,另从各处理棉花叶片中部主脉两侧无叶脉处切取宽为1~2mm的小长条样品,真空抽气使叶片完全下沉,放入4℃冰箱内用2.5%戊二醛固定液中固定24h作为后续电镜试验样品。

(2)
1.2.3 电镜样品制备与观察
取固定好的胚根、叶片电镜试验样品,用磷酸缓冲液(pH7.2)漂洗3~5次,转入1%锇酸液中固定1.5h。固定完成后用磷酸缓冲液(pH7.2)漂洗3~5次,再用30%、50%、60%、70%、80%、90%、95%、100%酒精逐级脱水,每次0.5h,用体积比1:1、4:1、1:0丙酮与酒精进行冲洗置换,Epon812渗透、包埋。把制好的样品在烘箱内烘干、超薄切片机切片、醋酸双氧铀和柠檬酸铅溶液双重染色,然后用透射电镜观察、拍照。
1.3 数据处理
用Microsoft Excel 2003进行数据处理,利用SPSS 17.0软件进行方差分析(P<0.05),邓肯氏法进行多重比较检验,数据均以“平均值±标准差”表示。
2 结果与分析
2.1 种衣剂对低温处理下棉花胚根及幼苗外部形态的影响
由图1和图2可见,包衣与未包衣棉花胚根和幼苗在不同低温处理下所表现的外部形态差异较明显。20℃低温处理时棉花种子萌发正常,发芽率为92.24%~95.51%,胚根乳白色,各处理胚根长在3.66~3.81cm,幼苗叶色浓绿,茎杆直立,棉花植株无萎蔫,统计分析发现包衣与未包衣差异不显著(表1、表2、表3)。15℃低温处理时棉花种子萌发受到轻微抑制,发芽率降低、胚根长度受阻,CK分别比包衣处理降低4.45~6.98个百分点、25.27%~36.05%,在外观形态方面,包衣与CK处理差异不显著,均表现出幼苗叶色浓绿、茎杆直立、植株无萎蔫。10℃低温处理时棉花种子萌发受到较大抑制,发芽率均下降,棉1处理发芽率最高,为62.72%,包衣处理较未包衣提高0.73~4.25个百分点,胚根生长受阻较大,生长量低,幼苗叶色呈暗绿色,19.15%~42.55%的幼苗叶片下垂萎蔫,种衣剂处理较CK萎蔫率下降12.76~23.40个百分点,包衣与未包衣处理差异显著。5℃低温处理严重抑制棉花种子萌发,发芽率均低于50.00%,胚根生长严重受阻,CK幼苗叶片脱水失绿,茎杆变软弯曲,萎蔫下垂,萎蔫率为74.47%,较包衣处理高7.02 ~14.05个百分点,差异显著。

表1 25℃培养第4天进行不同低温处理24h后棉种发芽率比较(平均值±均方差)
注:小写字母表示品种间在0.05水平上的差异显著性。下同。
Note:Lowercase indicates the difference significance among varieties at 0.05 level. The same as below.
2.2 种衣剂对低温处理下棉花胚根及棉苗细胞超微结构的影响
植物细胞的超微结构与其耐低温性密切相关。图3显示,20℃低温处理下棉花胚根细胞中线粒体结构完整,嵴清晰,呈椭球形,分布在细胞壁周围,数量较少,有内质网和高尔基体分布。叶片中叶绿体结构完整,呈长椭球状,紧贴细胞壁分布,基粒片层结构清晰,平行排列,多而整齐,叶绿体基质中未见淀粉粒,线粒体结构完整,呈椭球形,双层膜清晰,膜系统结构完整,细胞内含物少,包衣与CK(未包衣)无明显差异。
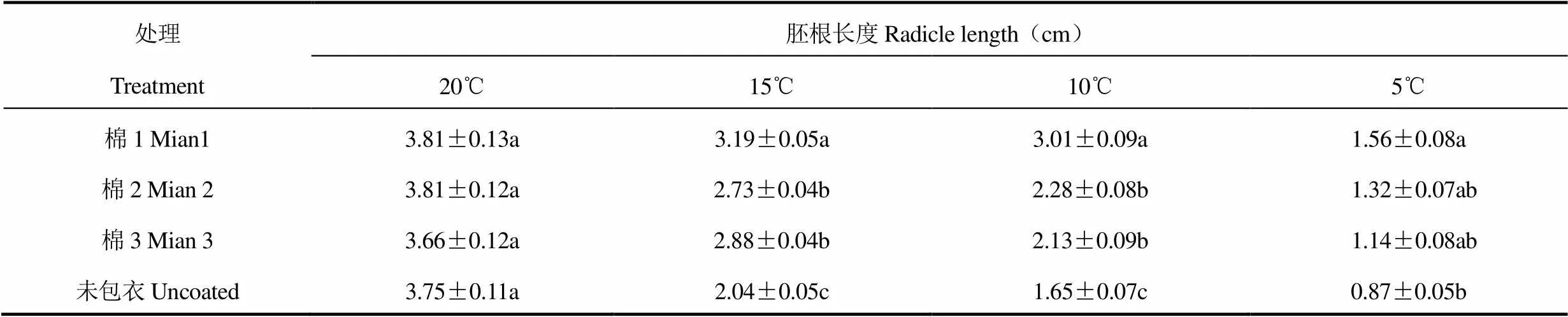
表2 25℃培养第4天进行不同低温处理24h后棉种胚根长度比较(平均值±均方差)
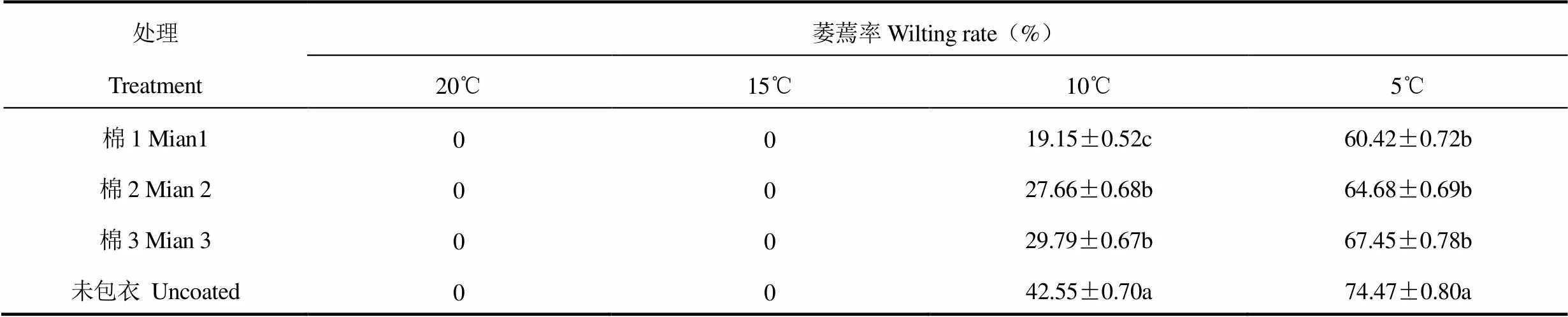
表3 25℃培养第7天进行不同低温处理24h后包衣与未包衣棉花幼苗萎蔫率比较
注:1、2、3、4为棉1、棉2、棉3、未包衣处理胚根细胞超微结构;5、6、7、8为棉1、棉2、棉3、未包衣处理叶肉细胞超微结构,下同。各图放大倍数:1(×30k);2(×20k);3(×17k);4(×5k);5(×17k);6(×17k);7(×20k);8(×15k)。CW:细胞壁;Ch:叶绿体;M:线粒体;SG:淀粉粒;G:基粒;O:嗜锇颗粒;ER:内质网;Ga:高尔基体
Note:1,2,3,4 represent the radicle cell ultrastructure of coated (Mian1,Mian2 and Mian3) and uncoated seed, respectively; 5, 6, 7, 8 represent the mesophyll cell ultrastructure of coated (Mian1, Mian2 and Mian3) and uncoated seed, respectively. The same as below. Direct magnification:1(×30k),2(×20k),3(×17k),4(×5k), 5(×17k), 6(×17k),7(×20k), 8(×15k). CW: cell wall; Ch: hloroplast; M: Mitochondria; SG: Starch grain; G: Grana; O: Osmiophilic material; ER: Endoplasmic reticulum; Ga: Golgi apparatus
图4表明,15℃低温处理下胚根细胞中线粒体结构完整,嵴清晰,呈椭球形,分布在细胞壁周围,种衣剂处理的线粒体、内质网数量多于CK,有高尔基体分布。种衣剂处理的叶绿体结构完整,呈长椭球状,紧贴细胞壁分布,基粒片层结构较清晰,CK的叶绿体略膨胀变形,叶绿体基质中有嗜锇颗粒,未见有淀粉粒,线粒体结构完整,呈椭球形,双层膜较清晰,细胞内含物少,包衣处理与CK差异不明显。可见,15℃低温条件下,种衣剂处理对棉花种子胚根和幼苗生长影响不大。
图5表明,10℃低温处理下棉花胚根细胞中线粒体结构完整,嵴清晰,呈椭球形,分布在细胞壁周围,种衣剂处理的线粒体、内质网数量略多于CK,有高尔基体分布。棉1、棉2处理的叶片叶绿体呈长椭球状,结构较完整,紧贴细胞壁分布,基粒片层结构较清晰,叶绿体基质中有嗜锇颗粒和淀粉粒,棉3和CK的叶绿体膨胀变形,呈卵圆形,淀粉粒较大,基粒弯曲松散,线粒体结构完整,呈椭球形,线粒体嵴清晰,细胞内含物较少,棉1和CK之间在细胞器数量、结构完整性和化合物数量方面差异较明显,可见,10℃低温处理24h时,种衣剂处理能保护细胞结构完整,较不包衣能促进棉花种子胚根和幼苗生长。
注:各图放大倍数:1(×17k);2(×17k);3(×10k);4(×15k);5(×17k);6(×10k);7(×12k);8(×17k)
Note: Direct magnification: 1(×17k); 2(×17k); 3(×10k); 4(×15k); 5(×17k); 6(×10k); 7(×12k); 8(×17k)
注:各图放大倍数:1(×20k);2(×12k);3(×15k);4(×17k);5(×15k);6(×12k);7(×20k);8(×12k)
Note: Direct magnification:1(×20k); 2(×12k); 3(×15k); 4(×17k); 5(×15k); 6(×12k); 7(×20k); 8(×12k)
图6显示,5℃低温处理下棉花胚根细胞中线粒体结构较完整,嵴清晰可见,呈椭球形,分布在细胞壁周围,棉1、棉3处理的线粒体、内质网、高尔基体数量略多于CK。棉1处理的棉花叶肉细胞中叶绿体结构模糊,略微变形,呈椭球状或圆球状,叶绿体少量解体,叶绿体基粒片层结构不清晰,基粒松散,叶绿体基质中有嗜锇颗粒和淀粉粒;棉2、棉3和CK棉花叶片叶肉细胞叶绿体轮廓模糊,大部分脱离细胞壁,呈随机分布,结构松散,膨胀成不规则形,基粒模糊弯曲,细胞内含物浑浊,大部分叶绿体已经解体,线粒体结构模糊,淀粉粒少。5℃低温处理24h下各处理棉花种子胚根细胞超微结构变化不明显,但叶片叶肉细胞超微结构遭到破坏,可见,5℃低温处理下,种衣剂处理尤其是棉1种衣剂处理较CK对保护细胞结构有一定作用,但不明显。
注:各图放大倍数:1(×35k);2(×20k);3(×6k);4(×1k);5(×10k);6(×10k);7(×8k);8(×17k)
Note: Direct magnification:1(×35k); 2(×20k); 3(×6k); 4(×1k); 5(×10k); 6(×10k); 7(×8k); 8(×17k)
3 结论与讨论
试验结果表明,20℃轻度低温处理时棉花种子发芽率均高于90.00%,随着处理温度的降低,发芽率急剧下降,5℃处理时发芽率均低于50.00%,表明发芽率受温度影响较大。但不同低温处理下包衣棉种较CK发芽率提高1.24~9.42个百分点,说明种衣剂能促进种子萌发,提高发芽率;在助长方面,20℃时各处理胚根长度在3.66~3.81cm,较5℃低温条件下增加2.4~4.3倍,表明低温能抑制胚根生长,温度越低,抑制程度越大,胚根生长越慢;在外部形态方面,20℃、15℃时各处理幼苗叶色浓绿,茎直立,无萎蔫症状,10℃时19.15%~ 42.55%的幼苗叶片下垂萎蔫,种衣剂处理较CK萎蔫率下降12.76~23.40个百分点,5℃处理时叶片萎蔫率高达74.47%,CK较包衣处理萎蔫更明显。5℃与10℃低温处理下茎、叶100%弯曲、萎蔫,表明在5℃和10℃低温处理下,种衣剂对棉花幼苗具有一定保护作用,降低萎蔫率,与王钰静等[5,9]等在棉花上研究结果基本一致,验证了种衣剂能缓解棉花遭受低温冷害的功能。
细胞器超微结构是近年来深入研究植物抗寒性的重要指标。本研究表明,随着处理温度的降低,包衣处理的棉花胚根细胞中线粒体在不同低温下结构均保持完整,呈椭球形,分布在细胞壁周围,内嵴清晰可见,线粒体、内质网数量略多于CK,温度越低细胞器结构完整性和丰富性越降,细胞中淀粉粒转化为糖类的能力下降,细胞活力减弱。棉花叶片叶肉细胞中叶绿体随着外界温度的降低结构遭到破坏,由长椭球状变为圆球状,大部分脱离细胞壁,呈随机分布,基粒片层结构松散,线粒体结构较完整,呈椭球形,双层膜清晰,膜系统结构完整,细胞内含物多,15℃和10℃时包衣处理的叶绿体、线粒体结构与CK相比较完整,说明低温不仅影响植物的外部形态,同时也影响植物细胞超微结构的变化,Ma等[11-15]在绿豆、棉花、小麦、玉米等作物上也得出类似结论。轻度低温20℃和重度低温5℃处理时种子包衣与不包衣差异不明显。在作物抗寒性超微结构方面,许多研究表明,低温胁迫能引起线粒体、叶绿体等细胞超微结构改变,液泡膜的破坏是冻害致死的临界线,进一步探索低温胁迫植物超微结构变化,对解析植物抗寒机理、鉴别作物品种抗寒性具有重要意义[16],而在棉花上的相关研究鲜有报道。有关种衣剂处理有助于保持低温条件下棉花叶肉细胞和胚根细胞结构完整、免遭低温危害的研究尚无报道。
本研究根据种衣剂能促进新疆棉田出苗、保苗、低温修复的生产实际,并将当地推广较好的种衣剂和自制产品进行相关抗寒机制探讨,从棉花外部形态到细胞内部结构均表现出一致性,表明种衣剂(尤其是棉1)能提高棉种及幼苗抗寒能力,这为指导棉花生产和抗寒基础理论研究提供了一定的借鉴作用。但是,种衣剂调控棉种体内激素、信号传导、耐寒基因表达等抗寒机制,以及种衣剂处理后棉苗耐受低温的范围、持续时长、频次等问题尚需进一步深入研究。
References
[1]新疆维吾尔自治区统计局.新疆统计年鉴[M].中国统计出版社,2015:363-369.
Statistic Burean of Xinjiang Uygur Autonomous Region.Xinjiang statistical yearbook[M].China Statistics Press, 2015:363-369.(in Chinese)
[2]严志丹.2012年阿拉尔市棉花生育期气象条件分析[J].新疆农垦科技,2014,(8):51-52.
Yan Z D.Analysis of cotton meteorological conditions in Alar in 2012[J].Xinjiang Farmland Reclamation Science and Technology,2014,(8):51-52.(in Chinese)
[3]刘玉涛,王瑾.低温天气对棉花播种出苗的影响及对策[J].中国种业,2011,(2):48.
Liu Y T,Wang J.Effects of low temperature weather on the seed emergence of cotton and measures[J].China Seed Industry,2011, (2):48.(in Chinese)
[4]Ruelland E,Vaultier M N,Zachowski A.Cold signalling and cold acclimation in plants[J].Advances in Botanical Research,2009, 49:35-150.
[5]王钰静,谢磊,李志博,等.低温胁迫对北疆棉花种子萌发的影响及其耐冷性差异评价[J].种子,2014,33(5):74-77.
Wang Y J,Xie L,Li Z B,et al.Effects of low temperature stress to germination of cotton seeds and evaluation of their cold resistance in northern Xinjiang[J].Seed,2014,33(5):74-77.(in Chinese)
[6]Zeinolabedin J,Rohola H,Saeed S.Chilling stress in plants[J]. International Journal of Agriculture and Crop Sciences,2013, 24(5):2961-2968.
[7]吴学宏,刘西莉,王红梅,等.我国种衣剂的研究进展[J].农药,2003,42(5):1-5.
Wu X H,Liu X L,Wang H M,et al.Progressing on the study of seed coating formulations in China[J].Pesticides,2003,42(5): 1-5.(in Chinese)
[8]李进,段俊杰,努尔买买提·努尔合加,等.种衣剂对棉花幼苗生长及抗寒能力的影响[J].新疆农业科学,2015,52(11):1997- 2003.
Li J,Duan J J,Nu E M M T,et al.Effect of seed coating agents on seedling growth and cold resistance of cotton[J].Xinjiang Agricultural Sciences,2015,52(11):1997-2003.(in Chinese)
[9]武辉,张巨松,石俊毅,等.棉花幼苗对不同程度低温逆境的生理响应[J].西北植物学报,2013,33(1):74-82.
Wu H,Zhang J S,Shi J Y,et al.Physiological response of cotton seedlings under low temperature stress[J].Acta Bot. Boreal.- Occident.Sin,2013,33(1):74-82.(in Chinese)
[10]杨云珠,陈文涛,郭金铨.PVA和PEG预处理对大豆种子在低温吸胀过程中胚根线粒体发育和超微结构的影响[J].植物学报,1992,31(6):432-436.
Yang Y Z,Chen W T,Guo J Q.Effects of PVA and PEG pretreatment on development and ultrastructure of plumular root mitochondria in soybean seed during low temperature imbibition process[J].Acta Botanica Sinica,1992,31(6): 432-436.(in Chinese)
[11]Ma S F,Lin C Y,Chen Y M.Comparative studies of chilling stress on alterations of chloroplast ultrastructure and protein synthesis in the leaves of chilling-sensitive(mungbean) and -insensitive(pea) seedlings[J].Bot.Bull.Academia Sinica,1990, 31:263-272.
[12]杨凤仙,董俊梅,杨晓霞.低温胁迫下棉叶叶绿体、液泡超微结构的变化[J].山西农业大学学报,2001,(2):116-117.
Yang F X,Dong J M,Yang X X.Varitions of the ultrastructure of the leaf cell of cotton under low temperature[J].Journal of Shanxi Agriculture University,2001,(2):116-117.(in Chinese)
[13]Robert R W,Mcwilliam J R,Naylor A W.A comparative study of low temperature-induced ultrastructural alterations of three species with differing chilling sensitivities[J].Plant,Cell and Environment,1983,6(7):525-535.
[14]彭倩,周青,叶亚新.La与UV-B辐射胁迫对大豆叶片细胞叶绿体超微结构的影响[J].中国农业气象,2008,29(1):33-36.
Peng Q,Zhou Q,Ye Y X.Influence of La and Ultraviolet-B stress on chloroplast ultrastructure of soybean leaves[J].Chinese Journal of Agrometeorology,2008,29(1):33-36.(in Chinese)
[15]付连双,王晓楠,王学东,等.低温驯化及封冻后不同抗寒性小麦品种细胞超微结构的比较[J].麦类作物学报, 2010,30(1):66-72.
Fu L S,Wang X N,Wang X D,et al.Comparison of cell ultrastructure between winter wheat cultivars during cold acclimation and freezing period[J].Journal of Triticeae Crops,2010,30(1):66-72.(in Chinese)
[16]吴凯,周晓阳.环境胁迫对植物超微结构的影响[J].山东林业科技,2007,(3):80-83.
Wu K,Zhou X Y.Effects of Environmental stresses on plant ultrastructure[J].Shandong Forestry Science and Technology, 2007,(3):80-83.(in Chinese)
Effect of Seed Coating Agents on External Morphology and Ultrastructure of Cotton Radicles and Seedlings under Low Temperature Treatments
LEI Bin1,2, LI Jin2,3, DUAN Liu-sheng1, ZHANG Peng-zhong4, LI Jie3, TAN Wei-ming1
(1.College of Agriculture and Biotechnology, China Agricultural University, Beijing 100083, China; 2.Research Institute of Nuclear Technology and Biotechnology, Xinjiang Academy of Agricultural Sciences, Urumqi 830091; 3.Xinjiang Oasis Agricultural Science and Technology Co., Ltd., Urumqi 830091; 4.Research Center of National Cotton Engineering and Technology, Urumqi 830091)
In this study, ‘Xinluzhong 54’ cotton seeds coated with three different homemade seed coating agents (Mian 1, Mian 2 and Mian 3) were sown in plastic nutrition boxes and cultured at 25℃. On the 4thand 7thdays when cotton seed radicles had grown into cotton seedlings, the coated cotton seeds were exposed to four low-temperature treatments at 5℃, 10℃, 15℃ and 20℃. The uncoated cotton seeds exposed to the same low-temperature treatments served as the control group (CK). The external morphologies and ultrastructures of the cotton radicles and seedlings were observed at 24 hours after low-temperature exposure to explore the effects of seed coating agents on improving the cold resistance of cotton by simulating the late spring cold climate in Xinjiang Province. The results showed that there was no significant difference between the coated and uncoated treatments at 20℃. Cotton seeds germinated normally at the germination rate of 92.24%-95.51%. The radicle growth lengths of the three different seed coating agents were 3.66-3.81cm, and the cotton seedlings grew well with dark green leaves and erect stems. The mitochondrial structure of radicle cells was complete, and the structures of mitochondria and chloroplasts in mesophyll cells were normal. Compared with the control, the seed germination rate of the coated seeds increased by 4.45-6.98 percentage points at 15℃. The radicle growth speed declined, but the growth amount increased by 25.27%-36.05%. The cotton seedlings grew well with dark green leaves and erect stems. Mitochondria cristae in radicle cells were clear. In addition, the structures of chloroplasts and mitochondria in mesophyll cells were clear, which were significantly better than after CK treatment. Cotton seed germination was inhibited at 10℃, but the germination rate of the coated seeds increased by 0.73-4.25 percentage points compared with that of the uncoated seeds. Radicle growth was limited, and the leaves were dark green. Approximately 19.15%-42.55% of the seedling leaves drooped and wilted. There were more mitochondria and endoplasmic reticula in the radicle cells of seedlings compared with that in seedlings from uncoated seeds. The outline of the chloroplast in mesophyll cells was clear with few inclusions. The Main 1 treatment was better than the other treatments. The cotton germination rate after different treatments was lower than 50.00% at 5℃. The seedling leaves in the uncoated group lost color and wilted with a wilting rate of 74.47%, whereas that of the coated treatment group was 60.42%-67.45%. The mitochondrial structure in the radicle cells was clear, and the mitochondrial structure in mesophyll cells was normal, while chloroplasts expanded into a spherical shape. The grana lamellar structure disintegrated, inclusions were turbid, and no significant difference was observed between coated and uncoated treatment groups. Our results show that seed coating agents can stimulate cotton seed germination, increase the seed germination rate and radicle growth speed under low-temperature treatments, protect the external morphology and cell ultrastructure stability of cotton radicles and seedlings, maintain normal growth, and enhance the ability of seedlings to resist damage from the low-temperature climate.
Seed coating agents; Cotton; Low temperature stress; External morphology; Ultrastructure
10.3969/j.issn.1000-6362.2017.04.006
2016-10-08
。E-mail:duanlsh@cau.edu.cn
新疆维吾尔自治区重点研发任务专项“机采棉苗期低温冷害保苗技术与产品开发”(2016B01001-2-2);国家科技支撑计划项目“棉花高产高效关键技术研究与示范”(2014BAD11B02-1-3);农业部荒漠绿洲作物生理生态与耕作重点实验室项目“低温胁迫下种衣剂对棉花抗寒性的影响及其作用机理研究”(25107020-201505)
雷斌(1973-),博士,研究员,研究方向为作物化控。E-mail:leib668@xaas.ac.cn
