SPG膜乳化法制备粒径均匀的布比卡因P(L)GA微球
2017-10-13于洪丹吴新霞王俊伟蔡晨辰
于洪丹,吴新霞,王俊伟,蔡晨辰,刘 力,徐 晖*
SPG膜乳化法制备粒径均匀的布比卡因P(L)GA微球
于洪丹1,吴新霞2,王俊伟3,蔡晨辰1,刘 力1,徐 晖1*
(1. 沈阳药科大学药学院,辽宁沈阳110016;2. 丰润区第二人民医院妇幼保健院,河北唐山 064000;3. 沈阳药科大学中药学院,辽宁沈阳 110016)
目的以酰胺类局部麻醉药布比卡因为模型药物,生物可降解的P(L)GA为骨架材料,采用SPG膜乳化法制备均一粒径、高载药量的缓释布比卡因微球。方法以微球粒径、表面形态、载药量和包封率为考察指标,筛选微球制剂处方,考察微球的体外释放行为并探讨药物释药机制。结果采用孔径40 μm的SPG膜所制备的布比卡因P(L)GA微球的粒径均在15~20 μm内,粒径分布均匀;偏光显微镜观察和XRPD分析结果表明,药物以晶体形态存在于微球内部;影响微球释放的主要因素为投药量、外水相体积及载体类型;当投药量的质量分数为75%、外水相体积100 mL时制备的布比卡因PLA微球具有相对理想的药物释放行为;Ritger-Peppas拟合结果表明,布比卡因以扩散方式从微球中释放。结论这种高载药量、粒径均匀的布比卡因缓释微球可望应用于临床的术后镇痛。
药剂学;缓释微球;SPG膜乳化法;布比卡因;聚乳酸;术后疼痛
布比卡因 (BUP) 属于酰胺类局麻药,化学结构式见图1。布比卡因起效快、作用强,被广泛用于局部麻醉和术后镇痛[1]。布比卡因在人体内消除半衰期为(2.7±1.3) h,局麻作用持续时间较短,为实现局麻效果往往需要多次给药,导致局部组织高浓度药物经吸收入血,产生不同程度的中枢神经和心血管毒性[2]。新型药物传递系统逐渐用于布比卡因的长效制剂,包括微球、植入剂、脂质体等,这些新型制剂对延长局麻药的作用时间、改善患者的顺应性等具有良好的效果[3],如布比卡因脂质体注射液EXPAREL®、布比卡因乙酸乙丁酸蔗糖酯(SABER)凝胶贮库型注射液Posidur®、布比卡因胶原蛋白植入剂XaraColl®[4-6],在临床应用中取得良好的术后镇痛效果。
聚乳酸(PLA)和乙酸-羟基乙酸共聚物(PLGA)为生物相容性、可生物降解的脂肪族聚酯,被广泛应用于微粒药物传递系统[7-8],也有研究报道P(L)GA包载局麻药缓释微球用作注射用植入剂,延长局麻药的作用时间[9-10]。微球的制备方法很多,其中乳化溶剂挥发法简单易行,方便控制,并被多数研究者采用,但是通过高速剪切分散或机械搅拌条件下制备的微球粒径大小不一,粒度范围宽,重现性差,这可能对微球的给药、释放行为和药效产生很大的影响[11]。Shirasu porous glass (SPG) 膜乳化技术在控制粒度分布方面具有不可替代的优越性,SPG膜是由亲水性材料Al2O3-SiO2制成的一种多孔玻璃膜,通过SPG膜制备的脂溶性载体P(L)GA微球,粒径均匀,不同孔径大小的SPG膜制备的微球平均粒径在1~100 μm内可控[12]。
本研究的目的是制备高载药量的布比卡因缓释微球,以不同型号PL(G)A为载体,采用SPG膜乳化法制备微球,并考察微球的粒径、载药量、形貌和体外释放等性质。
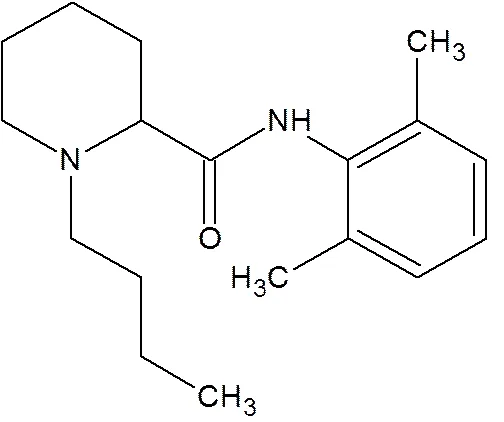
Fig. 1 Chemical structure of bupivacaine
1 仪器与材料
BSA124S电子天平(德国Sartorius公司),T18 basic高速分散机(德国IKA公司),SPG膜乳化器、SPG膜(40μm)(日本SPG Technology株式会社),RE52CS旋转蒸发器、B-220恒温水浴锅(上海亚荣生化仪器厂),SHB-Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司),BA300Pol偏光显微镜(麦克奥迪实业集团有限公司,中国),IS09001往返式水浴恒温摇床(上海智城分析仪器制造有限公司),UV5100紫外-可见分光光度计(安徽晥仪科技股份有限公司),S-3400扫描电镜(日本Hitachi公司),XRD-6000X射线衍射仪(日本Shimadzu公司)
盐酸布比卡因(上海三维制药有限公司),氨水(分析纯,沈阳经济技术开发区试剂厂),聚乙烯醇(PVA-217,日本KURARAY公司),聚乳酸(PLA,IV=2.0 dL∙g-1)、乙酸-羟基乙酸共聚物(PLGA, IV=1.6 dL∙g-1或2.0 dL∙g-1)(长春应用化学研究所),其他试剂(分析纯或色谱纯,市售)。
2 方法
2.1 布比卡因游离碱的制备和理化性质考察
O/W型乳化溶剂挥发法适用于水不溶性药物,需要将盐酸布比卡因原料药制备成脂溶性游离碱以提高包封率。称取适量盐酸布比卡因原料药,加水配成近饱和溶液,滴加过量氨水至完全沉淀,过滤,洗涤,干燥沉淀得布比卡因游离碱。取适量的布比卡因游离碱5份,分别加入水及pH值5.0、6.5、6.8、7.4的磷酸盐缓冲液,37 ℃恒温振摇24 h,过滤、适当稀释后于263 nm处测定吸光度,计算溶解度;用pH值7.4的磷酸盐缓冲液溶解并稀释成一定浓度的布比卡因溶液,37 ℃恒温振摇,于不同时间点取样测定吸光度,考察稳定性;测定布比卡因在正辛醇和水中的油水分配系数,用正辛醇饱和的蒸馏水溶解适量的布比卡因,测得吸光度为1,计算质量浓度为1,精密移取该溶液5 mL加至等体积的水饱和的正辛醇中,放入25 ℃恒温水浴摇床中,24 h后静置、分离出水相,测得吸光度为2,计算质量浓度为2,根据公式O/W=(1-2) /2,计算油水分配系数logO/W。
2.2 布比卡因微球的制备
通过SPG膜乳化技术制备布比卡因微球,制备方法如下:将P(G)LA和BUP溶于二氯甲烷中作为有机相,将含质量分数1%PVA和质量分数0.6%Tween80的水溶液作为水相,迅速将有机相加入到水相,8 000 r∙min-1高速剪切乳化,形成O/W型初乳,在液氮的压力下迅速将初乳经过膜乳化器(图2),形成粒径均一的乳剂,将乳剂加入至质量分数1%PVA水溶液中,40 ℃下旋蒸10 min,除去有机溶剂,得固化的微球经洗涤、离心、冷冻干燥。通过改变布比卡因投药量、外水相体积和载体PL(G)A型号,以微球粒径、表面形态、载药量及包封率为考察指标进行微球处方的筛选。
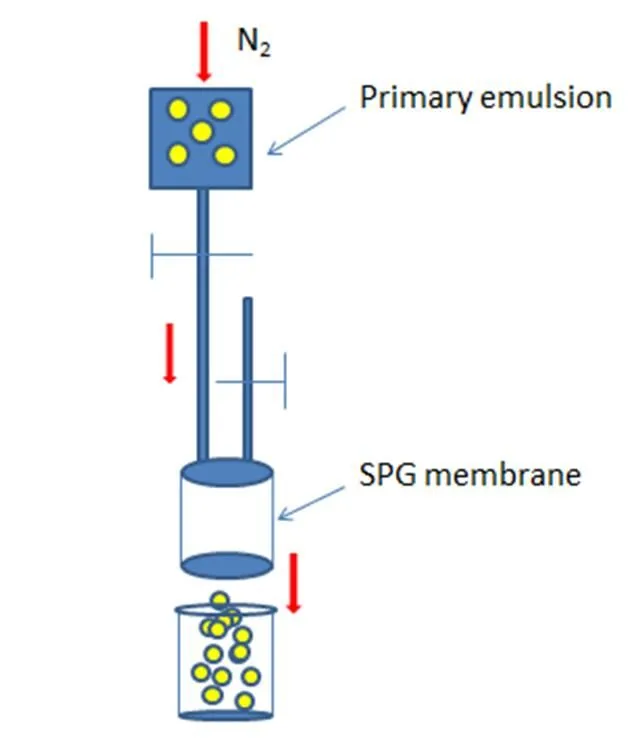
Fig. 2 Illustration of SPG membrane emulsification method
2.3 载药量和包封率的测定
建立载药量和包封率测定的紫外-可见分光光度法,符合方法学要求。精密称取布比卡因微球约10.0 mg,置于25 mL量瓶中,加入甲醇20 mL,超声30 min使微球破裂,释放药物,甲醇稀释至刻度,离心取上清液,于波长263 nm处测定吸光度,通过标准曲线方程计算溶液中药物含量,按照下述公式计算载药量(drug loading,DL)和包封率(entrapment efficiency,EE)。
DL=(微球包载药量)/(微球总质量)×100%;EE=(微球测定载药量)/(微球理论药量)×100%。
2.4 微球的表征
用偏光显微镜观察微球,利用软件测量微球平均粒径。取少量微球铺于导电胶上,喷金,用扫描电镜观察表面形态。分别对布比卡因游离碱、空白微球及PLA载药微球进行X射线衍射(XRD)分析,测试条件为:用Cu Kα作为衍射源,λ为1.540 6 nm,扫描范围为5°~60°(2),步长为0.016 7°。
2.5 微球体外释放
精密称取布比卡因微球约10.0 mg,加入pH值7.4的PBS溶液50 mL,置于37 ℃恒温水浴摇床中,100 r∙min-1振荡,分别于6、12、24、36、48、60、72、96和120 h(即5 d)取样,同时补加5 mL新鲜释放介质,反复摇匀使微球充分分散,再放回摇床中继续释放。所取样品经5 000 r∙min-1下离心6 min,保证微球完全沉淀,再用注射器吸取上清液5 mL过滤,于263 nm处测定吸光度,计算释放量,绘制累积释放曲线。
3 结果与讨论
3.1 布比卡因理化性质
布比卡因游离碱在水及pH值5.0、6.5、6.8和7.4的PBS溶液中的溶解度(37 ℃)见表1。结果表明,布比卡因在不同介质中,其饱和溶解度随pH值的降低而增加,在水中溶解度为(177.24±0.44) mg∙L-1,而在pH值7.4的PBS溶液中增加至(393.66±0.66) mg∙L-1。溶液中稳定性考察结果显示,布比卡因在pH值7.4的PBS溶液中(37 ℃)7 d内稳定(RSD=0.86%)。实验测定布比卡因的油水分配系数logO/W为3.14,表明布比卡因游离碱具有很强的脂溶性,适合用O/W型乳化溶剂挥发法制备微球。

Table 1 Solubility of bupivacaine in different media
3.2 微球的制备与表征
采用SPG膜乳化技术制备布比卡因微球,为了得到粒径适合注射给药的微球,选择孔隙为40 μm的SPG膜,P(L)GA为载体,其中制备初乳时水相体积为10 mL,通过改变布比卡因投药量、外水相体积和载体PL(G)A型号,进行微球处方的筛选,结果见表2和图3。由于前期的实验,对表面活性剂Tween80进行过考察,实验表明含质量分数0.6%的Tween80使微球的粒径、载药量略微降低,但是微球的表面更光滑,且对微球的体外释放影响不大,因此作者直接选取质量分数0.6%的Tween80作为辅助乳化剂,以改善微球外观。基于SPG膜乳化技术的目的,通过显微镜照片可知,不同处方微球粒径均一,均在15~20 μm内。当外水相体积为100 mL时,投药量质量分数分别为60%、65%、75%、80%(处方1、2、4、6),微球载药量和包封率依次增加。当投药量质量分数为80%(处方5、6、7)、外水相体积为150、100和50 mL时,其外水相为100 mL时载药量和包封率最高。外水相中加入质量分数5% NaCl(处方8),与处方6相比,微球的载药量和包封率略有降低。以PLGA为载体制备的微球(处方9、10),PLGA黏度(分子质量)越高,载药量和包封率越高。
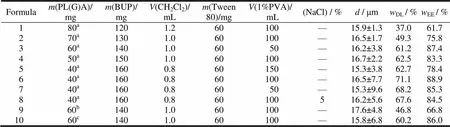
Table 2 Formulations and properties of the prepared microspheres
Notes: a—PLA, IV=2.0 dL∙g-1; b—PLGA75/25, IV=1.6 dL∙g-1; c—PLGA 85/15, IV=2.0 dL∙g-1

Fig.3 Polarizing microscope images of BUP-MSs.
对处方3、4、10进行扫描电镜观察(图4)。处方4为PLA微球,其表明光滑圆整,无药物晶体吸附,而处方10为PLGA微球,微球虽然圆整,但是表面存在少量药物晶体吸附;处方3为投药量质量分数为70%的PLA微球,但其外水相体积为50 mL,可观察到其表面粘附大量药物晶体。由此可知,外水相体积对微球包封率影响明显。通过XRPD曲线(图5)可知,微球中布比卡因以晶体形态存在。

Fig. 4 Typical SEM images of the prepared BUP-MSs
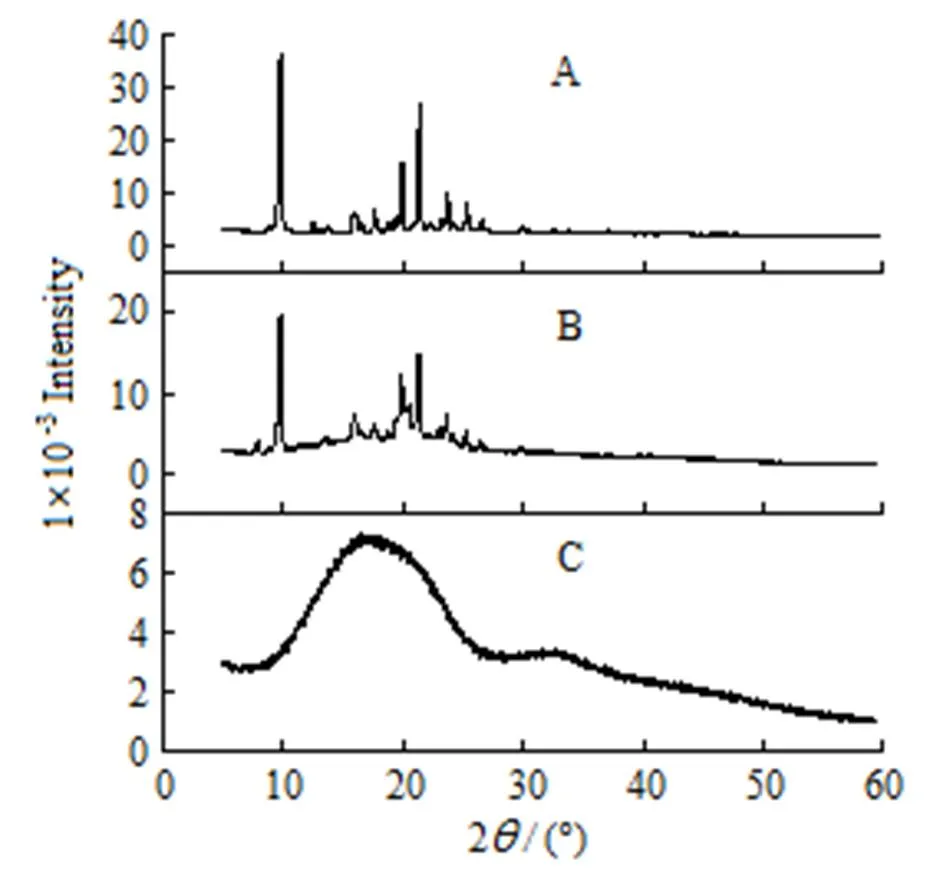
A—BUP; B—BUP-MS; C—Blank MS
3.3 微球的体外释放
布比卡因微球的体外释放行为见图6。不同载药量微球表现不同的释放速度。由释放曲线可知,随着投药量的增加,释放速度增加,投药量质量分数低于70%(处方1、2)时,微球释放速度很慢,5 d累积释放量低于20%。处方3由于外水相体积的减少而导致表面存在大量的药物晶体,其突释现象很严重;处方4为投药量质量分数75%的微球,能持续缓慢释放药物;而处方6由于过高的载药量而导致释放速度加快。外水相体积对微球释放速度存在一定的影响,当水相体积为50 mL时,由于微球表面粘附大量药物而导致严重的突释现象,外水相体积为100 mL与150 mL时的释放速度差别不大,为了提高产率,外水相体积为100 mL时更理想。处方8中由于NaCl的存在,其药物释放速度降低。载体材料的型号同样对微球的药物释放有明显影响,实验结果表明,PLGA微球的释放速度快,且突释严重;处方9采用PLGA (75/25, IV=1.6 dL∙g-1)为载体,与处方10 PLGA (85/15, IV = 2.0 dL∙g-1)相比,载体黏度降低或聚乳酸比例下降,药物释放速度加快,突释现象更明显。分析可能的原因为,与PLA相比,PLGA脂溶性相对较低,微球包封率下降,大量药物粘附于载体表面,导致突释现象严重。PLGA中聚乳酸比例下降,其亲脂性有所降低,同样导致类似的现象。
布比卡因用于术后镇痛,要求其5 d左右的镇痛效果,处方4的微球具有比较理想的释放特征,5 d内持续缓慢释放80%的布比卡因。对于球形颗粒,可以用Ritger-Peppas方程,即=n拟合释放数据。当≤0.43时,药物释放为Fick 扩散机理;当0.43﹤﹤0.89,药物释放机制为非Fick扩散,即扩散与骨架溶蚀机制相结合;当﹥0.89,药物释放制剂为骨架溶蚀作用[13]。处方4微球的释放曲线经Ritger-Peppas拟合得,=12.2640.384 1,2=0.998 8,拟合得到的=0.384,由此可以推断,布比卡因载药微球的药物释放机理为扩散控制机制。
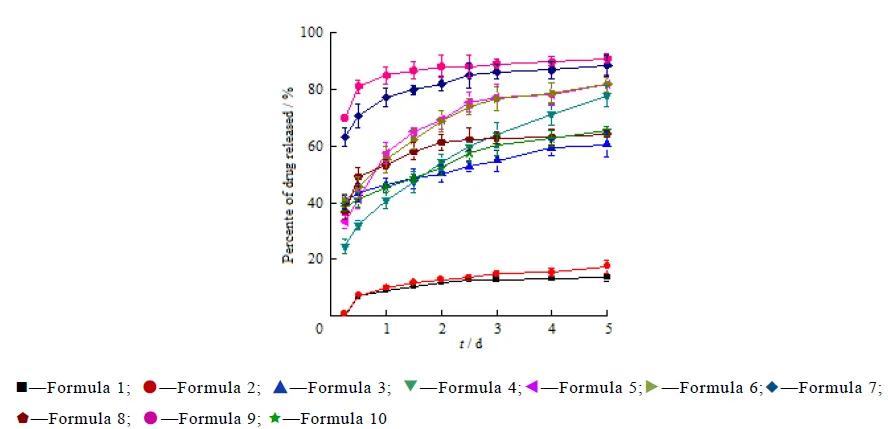
Fig. 6 In vitro drug release profiles of BUP-MSs
4 结论
以生物可降解的PLA为载体,采用SPG膜乳化技术制备的布比卡因微球,所制备的微球粒径均一,在15~20 μm内,载药量大于60%,微球具有明显的体外药物缓释作用。布比卡因PLA微球可望为术后镇痛和局部麻醉提供一种理想的给药途径。
致谢:本研究得到沈阳药科大学中青年教师事业发展支持计划资助。
[1] 刘晓睿, 丁平田, 张锦. 布比卡因缓释微球的制备及体外释药特性评价[J]. 沈阳药科大学学报, 2005, 22(6): 405-409.
[2] CORRE P L, ESTEBE J P, CLEMENT R, et al. Spray-dried bupivacaine-loaded microspheres:evaluation and biopharmaceutics of bupivacaine following brachial plexus administration in sheep[J]. International Journal Pharmaceutics, 2002, 238(1/2): 191–203.
[3] MCALVIN J B, PADERA R F, SHANKARAPPA S A, et al. Multivesicular liposomal bupivacaine at the sciatic nerve[J]. Biomaterials, 2014, 35(15): 4557-4564.
[4] JOHNSTON E. EXPAREL Prescribing Information[Z]. Psotsurgical Pain Congress. November 13, 2012.
[5] ELLIS D, VERITY N, LISSIN D. et al. Treatment of postoperative pain in shoulder surgery with SABER®- Bupivacaine. American Pain Society 32nd Annual Scientific Meeting[R]. New Oeleans, LA, USA: 2013.
[6] CUSACK S L, REGINALD P, HEMSEN L. The pharmacokinetics and safety of an intraoperative bupivacaine- collagen implant (XaraColl®) for postoperative analgesia in women following total abdominal hysterectomy[J]. Journal of Pain Research, 2013, 6(10): 151–159.
[7] ATHANASIOU K A, NIEDERAUER G G, AGRAWAL C M.Sterilization, toxicity, biocompatibility and clinical applications of poly lactic acid/poly glycolic acid copolymers[J]. Biomaterials, 1996, 17(2): 93–102.
[8] FU Yao, KAO W J. Drug release kinetics and transport mechanisms of non-degradable and degradable polymeric delivery systems[J]. Drug Delivery, 2010, 7(4): 429-444.
[9] ZHANG He, LU Ying, ZHANG Guoqing, et al. Bupivacaine-loaded biodegradable poly (lactic-co-glycolic) acid microspheres. I. Optimization of the drug incorporation into the polymer matrix and modelling of drug release[J]. International Journal of Pharmaceutics, 2008, 351(1/2): 244-249.
[10] CURLEY J, CASTILLO J, HOTZ J, et al. Prolonged regional nerve blockade, injectable biodegradable bupivacaine/ polyester microspheres[J]. Anesthesiology,1996, 84(6): 1401-1410.
[11] MA Guanghui, NAGAI M, OMI S. Preparation of uniform poly(lactide) microspheres by employing the Shirasu Porous Glass(SPG) emulsification technique[J]. Colloids Surfaces A: Physicochemical and Engineering. Aspects, 1999, 153(1/2/3): 383-394.
[12] QI Feng, WU Jie, YANG Tingyuan, et al. Mechanistic studies for monodisperse exenatide-loaded PLGA microspheres prepared by different methods based on SPG membrane emulsification[J]. Acta Biomaterialia, 2014, 10(10): 4247-4256.
[13] RITGER P L, PEPPAS N A. A simple equation for description of solute release I. Fickian and non-fickian release from non-swellable devices in the form of slabs, spheres, cylinders or discs[J]. Journal of Controlled Release, 1987, 5 (1): 23-36.
Uniform bupivacaine PL(G)A microspheres for sustained release prepared by SPG membrane emulsification method
YU Hongdan1, WU Xinxia2, WANG Junwei3, CAI Chenchen1, LIU Li1, XU Hui1*
(1.,,110016,; 2,064000; 3,,110016,)
Objective The aim of this study is to prepare biodegradable P(L)GA microspheres embedded with high content of bupivacaine, an amide type of local anesthetics by the Shirasu porous glass (SPG) membrane emulsification technique, for sustained drug release. Method The formulation was screened by evaluating particle size, surface morphology, drug loading and entrapment efficiency, and thedrug release behavior and the release mechanism were investigated. Result Polarizing microscope observation and XPRD analysis indicated that bupivacaine existed as crystal in the uniform microspheres (15-20 μm) prepared by the SPG membrane with pore size of 40 μm. The key factors which affect the release of drug in cludes feed ratio of drug to polymer, volume of aqueous phase and type of P(L)GA. When the feed ratio of drug to polymer was 75% and aqueous phase volume was 100 mL, the drug loaded PLA microspheres exhibited sustained drug release behavior. Ritger- Peppas equation was introduced to fit the release profiles, and the result suggested that the release of bupivacaine from microspheres followed a diffusion controlled mechanism. Conclusion Uniform-sized PLA microspheres of high drug loading was prepared for sustained drug release, which provides great potential for the treatment of postoperative pain.
pharmaceutics; sustained release microspheres; SPG membrane emulsification technique; bupivacaine; poly (lactic acid); postoperative pain
(本篇责任编辑:赵桂芝)
(2017)03–0058–09
10.14146/j.cnki.cjp.2017.03.002
R 94
A
2015-04-10
于洪丹(1989-), 女(汉族), 辽宁葫芦岛人, 硕士研究生, E-mailyuhongdan1116@126.com;
徐晖(1972-), 男(汉族), 辽宁法库人, 副教授, 博士, 主要从事药物制剂研究, Tel. 024-23986356, E-mailxuhui_lab@163.com。
