普瑞巴林胃漂浮缓释片的处方工艺研究
2017-06-15翟小春辜勇军
翟小春,辜勇军
普瑞巴林胃漂浮缓释片的处方工艺研究
翟小春1,2,辜勇军1*
(1. 四川大学生物治疗国家重点实验室,四川成都 610041;2. 四川科伦药业股份有限公司,四川成都 610071)
目的 优选制备普瑞巴林胃漂浮缓释片的最佳处方。方法采用粉末直接压片制备普瑞巴林胃漂浮缓释片,以释放度、漂浮性能为评价指标,采用L9(34) 正交试验设计对辅料羟丙基甲基纤维素、聚乙烯吡咯烷酮、微晶纤维素和碳酸氢钠的用量进行筛选。结果按优选处方制备的样品起漂时间小于1 min,持续漂浮时间大于24 h,达到了预期的设计目标。结论优选的普瑞巴林胃漂浮缓释片处方合理、工艺简单可行、质量可控。
药剂学;胃漂浮片;正交试验设计;普瑞巴林;制备工艺;含量测定
普瑞巴林是一种-氨基丁酸(GABA)受体拮抗剂,广泛应用于缓解多种疾病疼痛,包括癫痫发作的辅助治疗、糖尿病神经病变的神经痛、带状疱疹后遗神经痛、手术牙齿疼痛和其他疼痛综合征以及社会焦虑症等[1-3]。普瑞巴林在国内上市销售的剂型为胶囊剂,其国外已上市的胃漂浮缓释片可避免胃局部药物浓度过高引起的胃肠道刺激,同时可延长药物在胃肠道的吸收时间,提高生物利用度,从而降低用药频率,提高患者用药依从性[4]。本课题旨在研究普瑞巴林胃漂浮缓释片的处方工艺[5],为其商业化生产提供依据。
1 仪器与材料
Agilent 1260高效液相色谱仪(德国Agilent公司),UV-2600紫外分光光度计(岛津仪器苏州有限公司),RC8MD溶出试验仪(天津天大天发科技有限公司),DP30A单冲压片机(北京国药龙立仪器有限公司),MS-204S电子天平、PE20-K实验室pH计(梅特勒-托利多仪器<上海>有限公司),JP-C300超声波清洗机(广州吉普超声波电子设备有限公司),WH-3旋涡混合仪(上海沪西分析仪器厂有限公司)。
普瑞巴林对照品(四川科伦药物研究所,批号 20121102),普瑞巴林缓释片参比制剂(规格为每片含普瑞巴林165 mg,美国辉瑞公司,批号20130322),普瑞巴林(四川科伦药业股份有限公司简阳分公司,批号I130903),羟丙基甲基纤维素(HPMC K100M,美国陶氏化学公司,批号2B16012N12),聚乙烯吡咯烷酮(PVP K30,ISP国际特品,批号 000159822),微晶纤维素(pH101,安徽山河药用辅料股份有限公司,批号131105),碳酸氢钠(自贡鸿鹤制药有限责任公司,批号I130903),二氧化硅(批号 20140304)、硬脂酸镁(批号20140414)(湖州展望药业股份有限公司)。
2 方法与结果
2.1 含量测定
2.1.1 含量测定方法的建立
检测波长的选择:取普瑞巴林对照品适量,加纯化水溶解并稀释至150 mg∙L-1作为供试液,纯化水为空白溶剂对照,于波长200~400 nm内进行扫描。结果普瑞巴林在波长205 nm处有最大吸收,溶剂没有干扰,故检测波长确定为205 nm。
色谱条件及系统适用性试验:色谱柱为CAPCELL PAK C18柱(250 mm×4.6 mm,5 μm),流动相为磷酸盐缓冲溶液(取磷酸二氢钾0.15 g、磷酸二氢钠0.65 g,加水1 000 mL溶解,用磷酸调节pH=5.5)-乙腈(体积比60∶40),检测波长205 nm,柱温35 ℃。取普瑞巴林对照品及杂质A、杂质B、杂质C对照品各适量,加流动相溶解并稀释制成每1 mL中含普瑞巴林、杂质A、杂质B、杂质C各约5 μg的混合溶液,作为系统适用性试验溶液。精密量取上述混合溶液100 μL,注入液相色谱仪,杂质B、普瑞巴林、杂质A、杂质C依次出峰,两色谱峰之间的分离度应不得低于2.0,理论塔板数按普瑞巴林峰计不低于2 000。
测定法:取本品10片,研细,精密称取细粉适量(约相当于普瑞巴林75 mg),置于50 mL量瓶中,加甲醇45 mL,用涡旋混合器振荡5 min,加流动相稀释至刻度,摇匀。精密量取2 mL,置于10 mL量瓶中,用流动相稀释至刻度,摇匀,滤过,取续滤液作为供试溶液。精密量取供试溶液100 μL,注入液相色谱仪,记录色谱图。另取普瑞巴林对照品适量,精密称定,同法制成每1 mL中约含普瑞巴林300 μg的溶液,作为对照溶液,同法测定,按外标法以峰面积计算,即得。
2.1.2 方法学验证
供试溶液和对照溶液制备:按“2.1.1”条方法制备供试溶液和对照溶液。
阴性溶液制备:按处方比例称取各辅料,混合均匀。精密称取适量,按供试溶液制备方法制备阴性溶液。
专属性考察:按“2.1.1”条色谱条件,精密吸取上述3种溶液各100 μL,分别注入液相色谱仪进行测定。结果显示,供试溶液主峰的保留时间与对照溶液主峰的保留时间一致,保留时间相对偏差为0.22%,而阴性样品在此保留时间无干扰(图1),表明方法专属性良好。
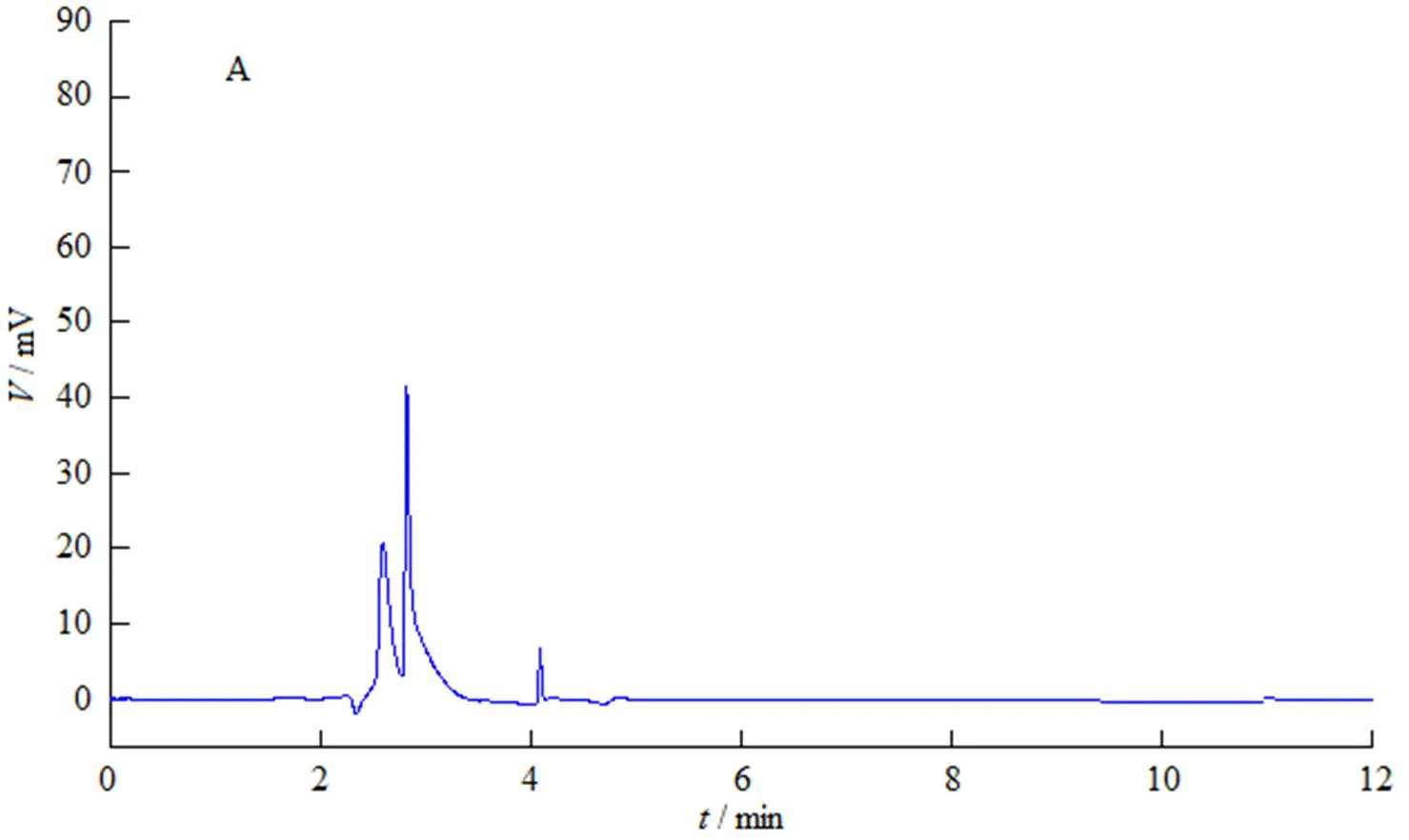
标准曲线制备:精密称取普瑞巴林对照品适量(约相当于普瑞巴林50 mg),用流动相配制成质量浓度为500 mg∙L-1溶液,再精密量取0.5、1、2、4、6、8和10 mL分别置于10 mL量瓶中,用流动相稀释至刻度制得质量浓度分别为25、50、100、200、300、400和500 mg∙L-1系列标准溶液,按“2.1.1”条色谱条件将上述7个溶液分别进样测定,以峰面积积分值()为纵坐标,样品质量浓度()为横坐标绘制标准曲线,线性方程为:=2.9×10-3+1.07×10-2,=0.999 9。结果表明,普瑞巴林质量浓度在25~500 mg∙L-1内线性关系良好。
精密度试验:平行制备6份供试溶液,分别按“2.1.1”条色谱条件进样检测,测定的6份供试溶液普瑞巴林峰面积RSD值为0.65%,表明精密度良好。
稳定性试验:取供试溶液,分别在0、2、4、8、16和24 h精密吸取100 μL注入液相色谱仪进行测定,记录峰面积,结果峰面积的RSD值为0.40%,表明样品稳定性良好。
空白回收试验:精密称定普瑞巴林原料12、15和18 mg,分别置于50 mL量瓶中,平行制备3份,分别加入76 mg空白辅料混合均匀,加流动相振摇溶解并稀释至刻度,作为供试溶液。精密量取供试溶液和对照溶液依法测定,计算含量,普瑞巴林回收率为98.8%~100.8%(=9),RSD值为1.31%。
2.2 释放曲线评价方法
取普瑞巴林胃漂浮缓释片,照《中华人民共和国药典》2015年版四部通则0931溶出度与释放度测定法第一法测定释放度,以人工胃液900 mL为释放介质,转速为50 r∙min-1,温度为(37.0±0.5)℃,依法操作,于1、2、4、8、12、18和24 h分别取溶液10 mL,同时补充相同温度的释放介质10 mL。所取溶液用0.45 μm微孔滤膜滤过,作为供试溶液。精密量取上述各供试溶液及普瑞巴林对照溶液各100 μL,按“2.1.1”条色谱条件测定,记录色谱图,采用外标法计算各点累计释放度,绘制释放曲线[6]。计算样品与参比制剂2、4、8、18 h累计释放度相似因子(2,要求>50),2计算公式如下:
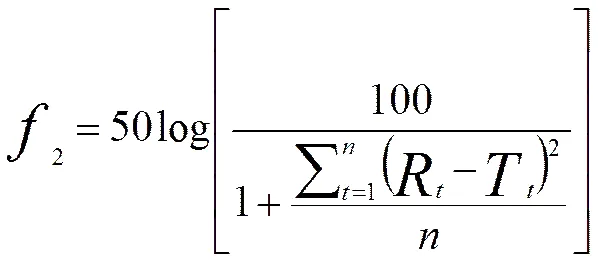
其中:R与T分别为参比和受试制剂在第时间点的平均累积释放度,为测试点数。
2.3 漂浮性能评价方法
将普瑞巴林胃漂浮缓释片置于(37.0±0.5) ℃的900 mL人工胃液中,转速为50 r∙min-1模拟胃蠕动条件下观察并记录起漂时间及持续漂浮时间。要求起漂时间<1 min,持续漂浮时间>24 h。
2.4 处方筛选和优化
采用正交试验筛选处方[7],以辅料HPMC()、PVP K30()、MCC pH101()和NaHCO3()的用量作为处方筛选因素,进行4因素3水平L9(34)正交设计(表1)。按正交试验表处方,将普瑞巴林依次与羟丙基甲基纤维素、聚乙烯吡咯烷酮、微晶纤维素、碳酸氢钠混合过0.3 mm 孔径筛。加入质量分数0.6%二氧化硅、质量分数0.6%硬脂酸镁混匀,粉末直接压片[8],以释放曲线(相似因子2)、漂浮性能作为评价指标,对最佳的制剂处方进行筛选。L9(34)试验结果见表2、3,处方4样品在人工胃液中原形及其体外漂浮24 h后的情况见图2。
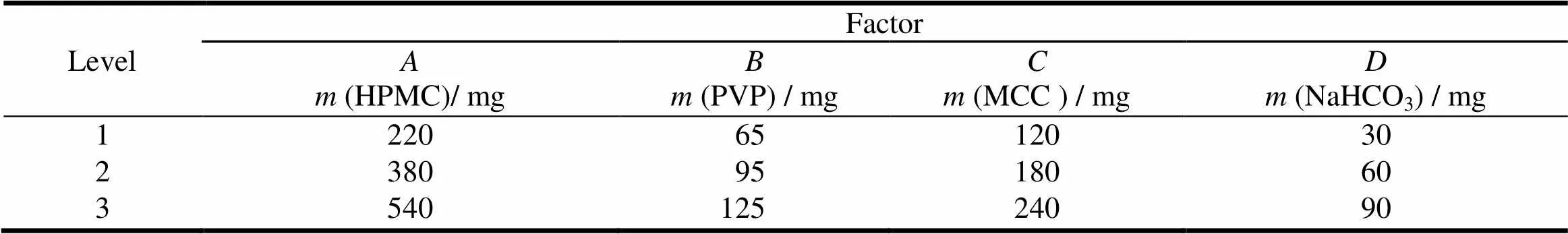
Table 1 The factor level table
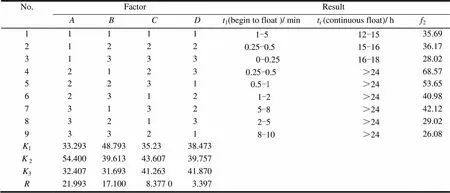
Table 2 The orthogonal experiment table
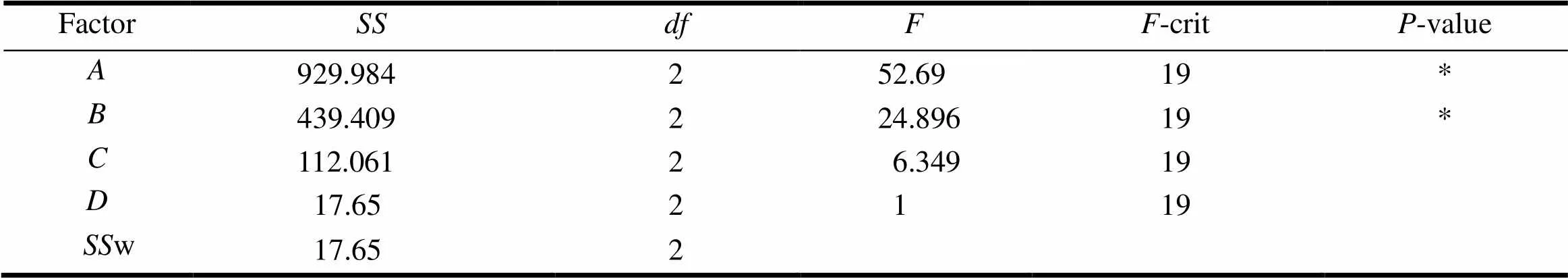
Table 3 Analysis of variance table

Fig. 2 Observation the swelling performance of tablets
由表2结果可知,各因素对普瑞巴林释放度的影响程度为>>>,因素、因素对普瑞巴林体外释放具有显著性影响,通过比较各因素的均值,选定普瑞巴林胃漂浮缓释片的最佳处方为2123。以该处方制备的胃滞留缓释片起漂时间小于1 min,持续漂浮时间大于24 h,2=68.57,符合预定试验目标。
2.5 制备工艺
按2123处方配比,将普瑞巴林依次与羟丙基甲基纤维素、聚乙烯吡咯烷酮、微晶纤维素、碳酸氢钠混合过0.3 mm孔径筛,加入质量分数0.6%二氧化硅、质量分数0.6%硬脂酸镁混匀,干粉直接压片,硬度控制在120~180 N,得表面光洁白色片剂,每片含普瑞巴林165 mg。
2.6 验证试验
为了进一步验证上述辅料配比和制备工艺的可行性和稳定性,按“2.5”条处方工艺制备3批样品,进行验证试验,对3批次样品进行质量分析。
2.6.1 漂浮性能确认
按“2.3”条漂浮性能评价方法测定样品漂浮性能。结果3批次样品起漂时间分别为22、25和22 s,持续漂浮时间均>24 h。表明优化处方制得的普瑞巴林胃漂浮缓释片漂浮性能良好。
2.6.2 含量测定
按“2.1.1”条含量测定法检测样品含量。结果3批次样品含量质量分数分别为101.2%、101.4%和99.7%,RSD为0.92%,参比制剂含量质量分数为98.9%。表明优化处方制得的普瑞巴林胃漂浮缓释片含量稳定、重现性好,且与参比制剂的含量相当。
2.6.3 有关物质测定
取“2.1.1”条下研细药粉,精密称定(约相当于普瑞巴林200 mg),置于50 mL量瓶中,加甲醇45 mL,用旋涡混合仪振荡5 min,加流动相稀释至刻度。精密量取6 mL,置于10 mL量瓶中,用流动相稀释至刻度,摇匀,滤过作为供试溶液。另取普瑞巴林对照品、杂质A对照品、杂质B对照品和杂质C对照品适量,用流动相溶解并稀释成每1 mL约含普瑞巴林、杂质A、杂质B、杂质C各5 μg的混合溶液,作为对照溶液。按“2.1.1”条色谱条件,精密量取供试溶液及对照溶液各100 μL,注入液相色谱仪测定峰面积,以外标法计算。自制样品杂质A、B未检出,杂质C的含量质量分数分别为0.014%、0.016%和0.010%,总杂质的质量分数分别为0.014%、0.016%和0.010%;参比制剂杂质A、B未检出,杂质C的含量质量分数为0.012%,总杂质的质量分数为0.012%。表明优化处方制得的普瑞巴林胃漂浮缓释片杂质含量稳定、重现性好,与参比制剂的杂质水平相当。
2.6.4 释放度测定
取3批验证试验样品,按“2.2”条释放曲线评价方法,测定各点累计释放度,计算2因子,绘制释放曲线。结果见表4,释放曲线见图3。

Table 4 The cumulative release rate of sample at different time

Fig. 3 The release profiles of pregabalin gastric floating sustained-release tablets
试验结果表明,研制样品与参比制剂2、4、8、18 h释放度2值均>50。普瑞巴林胃漂浮缓释片在24 h内缓慢释放,达到缓释长效的目的,优化处方制得的普瑞巴林胃漂浮缓释片与参比制剂释放度相似。
3 讨论
a. 胃内滞留型制剂主要根据流体动力学平衡原理,将药物与一种或多种亲水性凝胶及其他辅料混合制成亲水凝胶缓释片[9],并使密度<1 g∙cm-3,使制剂在胃内漂浮以延长药物在胃内滞留时间,从而提高药物的治疗效果,剂型制备成功的关键在于辅料的选择。
b. 本研究以HPMC为骨架材料[10],其黏度的选择对漂浮性能和药物的释放有很大影响;高黏度材料的水化速率低于低黏度材料,且密度小,膨胀体积松大,漂浮性能好。处方中的PVP K30为亲水凝胶骨架的致孔剂,可以在骨架中形成亲水孔道,在凝胶层体积逐渐增大的情况下,加快药物的释放速度,通过控制PVP K30用量可以起到协同控制药物释放速率的作用。单用亲水性凝胶材料有时达不到理想的漂浮效果,为提高药物的漂浮性能,通常可添加密度较小的微晶纤维素,在起到协助维持药片漂浮的同时,还可使药物缓释。处方中NaHCO3为发泡剂,遇酸性成分后,产生大量气泡,可加快药片起漂。
c. 压制片剂时的压力大小对片剂的外观、漂浮情况及释放度均有影响。压力大小可改变骨架片密度使孔隙率和孔道率发生变化,影响药物释放,压力越大片剂内部的孔隙率就越小,水分进入片剂的时间就越长。
d. 胃漂浮型缓释片在制备时,建议综合考虑影响制剂成型工艺的各个因素,通过优化辅料种类、辅料用量及制剂工艺参数,方能获得制剂学性质适宜的制剂。
[1] 耿向华. 硫辛酸联合普瑞巴林治疗痛性糖尿病神经病变的临床疗效观察[J]. 中国临床新医学, 2015, 8: 736-739.
[2] 王天笑, 李亚东. 普瑞巴林治疗慢性疼痛的研究进展[J]. 科技信息, 2014, 15: 372-396.
[3] 率红莉, 汪津洋. 糖尿病周围神经病变治疗药物研究进展[J]. 中国药房, 2014, 4: 377-382.
[4] 高庆让. 缓释、控释药物制剂的研究进展及临床应用[J]. 求医问药(下半月), 2013, 8: 29.
[5] 王志强, 王彬, 吴继禹, 等. 盐酸二甲双胍胃滞留缓释片的制备与质量考察[J].中国药业, 2010, 24: 51-53.
[6] 施能胜. 高效液相色谱法测定头孢克洛缓释胶囊的体外释放度[J]. 江苏医药, 2015, 7: 848-849.
[7] 宋信莉, 刘文, 王群, 等. 交试验法优选戊己胃漂浮缓释片处方工艺研究[J]. 李时珍国医国药, 2013, 10: 2420-2422.
[8] 高春生. 粉末直接压片工艺制药工业整体发展的助推剂[J]. 国际药学研究杂志, 2009, 1: 1-5.
[9] 沙莹, 王莉, 贾向群, 等. 盐酸普萘洛尔缓释片的处方工艺和释放度研究[J]. 中国药业, 2004, 3: 57-58.
[10] 张春燕, 王洪光, 周金辉, 等. 柠檬酸钾骨架缓释片的研制[J]. 中国药业, 2007, 20: 27-28.
Preparation of pregabalin gastric floating sustained-release tablets
ZHAI Xiaochun1, 2,GU Yongjun1*
(1.,610041,; 2..,.,610071,)
ObjectiveThe aim of this study is to optimize the formulation of pregabalin gastric floating sustained-release tablets. Methods Pregabalin gastric floating sustained-release tablets were prepared by direct compression technology. The orthogonal experimental design (L9(34)) was used to evaluate the effects of the excipients including hydroxypropylmethylcellose (HPMC), polyvinyl pyrrolidone (PVP), microcrystalline cellulose (MCC) and sodium bicarbonate on the floating behaviors and the release profiles of tablets, and to optimize the formula.Results The optimal pregabalin gastric floating sustained-release tablets began to float in less than 1 min and could keep floating for more than 24 h.Conclusion The pregabalin gastric floating sustained-release tablets with controllable quality are successfully prepared by the simple process.
Pharmaceutics;floating tablets; orthogonal experimental design; pregabalin; preparation process; concentration determination
(本篇责任编辑:赵桂芝)
(2017)03–0067–08
10.14146/j.cnki.cjp.2017.03.003
R94
A
2016-03-25
翟小春(1985-), 男(汉族), 江西宜春人,工程师,硕士研究生, E-mail zhaixiaochun112@163.com;
辜勇军(1984-), 男(汉族),四川眉山人,工程师,硕士, 主要从事新药研究与开发, Tel. 028-66537322, E-mail guyongjun119@sina.com。
