超声造影时间-强度曲线在肝癌射频消融的应用研究
2017-10-12李小晶彭红艳曾金凤沈伶俐
何 雁,李 蕾,李小晶,彭红艳,张 玲,曾金凤,王 丹,沈伶俐
(1.武汉大学中南医院超声影像科,武汉 430071;2.武汉科技大学附属天佑医院超声介入科,武汉 430064)
论著·临床研究
超声造影时间-强度曲线在肝癌射频消融的应用研究
何 雁1,李 蕾2△,李小晶1,彭红艳1,张 玲1,曾金凤1,王 丹1,沈伶俐1
(1.武汉大学中南医院超声影像科,武汉 430071;2.武汉科技大学附属天佑医院超声介入科,武汉 430064)
目的探讨超声造影时间-强度曲线在肝癌射频消融治疗效果的应用价值。方法对76例肝癌患者共118个肿瘤病灶行超声引导下射频消融治疗,消融术后1个月使用声学定量分析软件对残余消融灶行动态分析,并与同期增强磁共振成像(MRI)检查结果进行比较,以病理为金标准,对肿瘤残余消融病灶良恶性进行统计对比分析。结果肝脏射频消融治疗后超声造影疗效的准确性为82.2%,增强MRI为83.9%;超声造影与增强MRI间比较差异无统计学意义(P>0.05),其检查结果一致性较高;消融术后良性残留消融灶与恶性残留灶血流灌注特点不同,时间强度曲线示峰值强度(IMAX)良性残留消融灶小于恶性残留灶(P<0.01),峰值强度上升时间(RT)及达峰时间(TTP)良性残留消融灶长于恶性残留灶(P<0.01);超声造影与增强MRI判断残余病灶良恶性比较差异无统计学意义(P>0.05)。结论超声造影结合时间强度曲线可以动态、直观、定量地反映灭活灶及良恶性残留灶与周围肝实质血流灌注的差异。
肝肿瘤;超声检查,多普勒,彩色;导管消融术;射频消融;时间-强度曲线
原发性肝癌是临床较为常见的肝脏恶性肿瘤,手术治疗虽然是目前较为有效的治疗方法,但仍因多中心性发生及肝炎、肝硬化背景等因素导致了手术治疗的局限性和低效性[1]。超声引导下经皮射频消融治疗肝内肿瘤被认为是一种安全有效的技术,已被临床广泛应用[2]。但治疗后仍有肿瘤未能完全灭活或短期内复发的情况发生,因此对消融后灭活灶和残余灶的评估有至关重要的作用。近年来,随着超声影像技术的发展,超声造影在肝脏肿瘤的探测,发现微小病灶及定性方面有明显优势,但因主观性影响容易造成判断差异。超声造影结合时间-强度曲线通过设置参数精确的量化分析肿瘤病灶血管灌注情况,在射频消融术前肿瘤性质的判断及术后灭活灶和残留灶的良恶性评估中有重要的临床应用价值。
1 资料与方法
1.1一般资料 选择2010年7月至2014年11月在本院感染科就诊并临床确诊为肝癌患者76例。其中,原发性肝癌55例,转移性肝癌21例(结直肠癌8例,乳腺癌2例,肺癌3例,胃癌3例,前列腺癌3例,宫颈癌2例)。其中男48例,女28例;年龄32~74岁,平均(53.5±11.7)岁;临床及二维超声高度怀疑恶性病灶118个,病灶最大直径8~60 mm,平均(25.1±6.3)mm。排除标准:(1)重度肝硬化及中量以上腹水者;(2)心功能不全或体质较弱者;(3)弥漫性肝癌患者;(4)晚期广泛转移及门脉癌栓者;(5)有食管胃底静脉曲张破裂出血史者;(6)有凝血功能障碍者。所有患者均签署知情同意书。
1.2方法
1.2.1仪器 百胜公司Mylab 90彩色多普勒超声诊断仪,配有造影技术,探头频率2~5 MHz,机械指数(MI) 0.06~0.11。动态造影数据自动存盘。意大利Bracco公司生产的超声造影剂SonoVue。射频仪为美国RITA公司产RITA MODEL 1500型RFA系统,射频电极针为RITA公司产15G的星形XL电极针。巴德穿刺活检枪,型号MC1816。
1.2.2治疗方法 常规二维超声检查病灶位置、形态、大小、边界、内部回声及血供情况,初步判断肿瘤性质并设计布针方案。射频消融:超声引导下在预定的肝表面进针点进针,边进针边调整方向到达瘤体,连接RITA射频消融系统.逐步打开星形XL电极针进行消融。超声全程监控消融过程,直到每个瘤体完全固化。射频消融后1个月行超声造影检查,5.0 mL生理盐水配制超声造影剂,抽取2.5 mL经肘部浅静脉快速推注,然后推注5.0 mL生理盐水,同时记录病灶动态增强过程。应用超声造影时间-强度曲线分析软件对造影图像分析,记录时间强度曲线的峰值强度(IMAX)、峰值强度上升时间(RT)、达峰时间(TTP)。
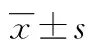
2 结 果
2.1射频消融术后1个月超声造影及增强磁共振成像(MRI)检查 超声造影显示肿瘤病灶射频消融后完全灭活97个,可疑残留21个。判断肝脏射频消融治疗后的疗效准确性为82.2%;增强MRI显示肿瘤病灶射频消融后完全灭活99个,可疑残留19个,判断肝脏射频消融治疗后的疗效准确性为83.9%。超声造影与增强MRI比较差异无统计学意义(P>0.05),其检查结果一致性较高(Kappa=0.901)。
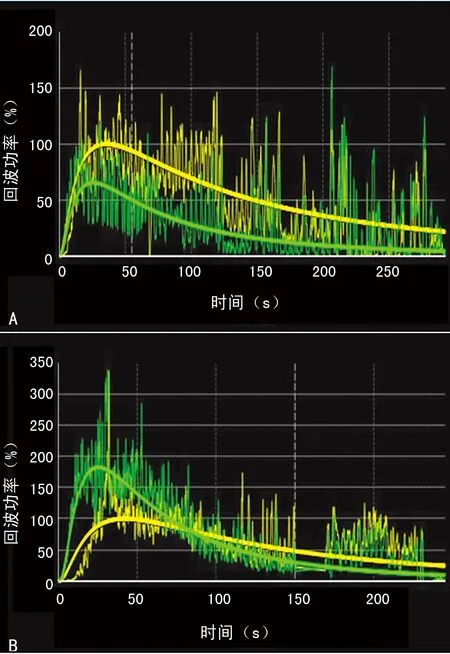
A:良性残留灶时间强度曲线;B:恶性残留灶时间强度曲线。黄色曲线为正常肝组织
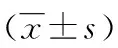
图1 良恶性残留灶时间强度曲线图
2.2超声造影发现可疑残留病灶穿刺活检 超声造影发现残留病灶21个(良性8个,恶性13个);增强MRI发现残留病灶19个(良性7个,恶性12个);以穿刺活检为标准,良性7个,恶性14个。超声造影与增强MRI判断残留病灶良恶性比较差异无统计学意义(P>0.05),其检查结果一致性也较高,超声造影Kappa=0.897,MRI检查Kappa=0.800。
2.3超声造影时间-强调曲线 (1)良性残留灶曲线平滑,恶性残留灶曲线较陡直(图1);(2)IMAX良性残留灶小于恶性残留灶(P<0.01),RT及TTP良性残留灶长于恶性残留灶(P<0.01),见表1。
3 讨 论
原发性肝癌是我国常见恶性肿瘤,恶性肿瘤血供丰富,内新生血管排列紊乱。二维彩超不能充分显示肿瘤内血流情况,尤其是对肝脏肿瘤微血管的显示较差。据报道,超声发现肝细胞肝癌的敏感度为50%~85%,特异度仅70%~90%[3-4]。超声造影可最大限度地发现肿瘤新生血管在管径大小、分支及分布异常,客观真实地反映肿瘤的血流灌注信息[5]。注射造影剂后绘制出的时间-强度曲线可以定量评价组织结构微循环血流灌注[6]。由于它结合了造影的动态过程和造影强度变化过程,以量化的方式反映组织器官的血流特点和血管特性,对血流动力学改变作出评价,客观而准确地反映组织中血流灌注的改变,是一种功能成像[7]。
超声造影时间-强度曲线是把超声造影表现进行量化分析的过程,IMAX为100%,是相对值,可反映病灶内的整体血供状况,即造影剂进入感兴趣区内达到最高浓度时与参照区的强度比; RT、TTP均是以灌注曲线开始上升前的起点开始计算,可以客观反映真实的时间参数,使超声造影更为直观[8]。从肉眼观察上升到量化分析,超声造影诊断有据可依,并且可以准确地观察病灶内微小的血流变化,分析时间强度曲线上的一些具体指标,对于肉眼无法鉴别良恶性的占位有较好的临床意义[9]。
原发性肝癌局部消融治疗的专家共识指出,肝癌射频消融治疗疗效评估方法为增强影像学(增强CT、增强MRI、超声造影)于治疗后1个月进行评估[10]。本组病例选取肝癌患者临床及二维超声高度怀疑恶性病灶118个,射频消融1个月后复查,118个消融病灶中,超声造影发现有97个病灶完全消融,与增强MRI检查一致性较高。超声造影及增强MRI发现7个良性残留病灶,病理穿刺活检,证实为肝硬化结节6个,炎性假瘤1个;二者检查与病理一致性较高。超声造影怀疑良性残留灶1例,病理证实为恶性,考虑为患者呼吸影响,病灶脱离靶区域,超声造影时间强度曲线未能捕捉到强化时间及方式导致误诊。1个残余消融病灶超声造影时间-强度曲线捕捉到周边残余肿瘤呈恶性肿瘤超声造影表现,但增强MRI未见异常增强信号,考虑为扫描厚度等因素。1个复发小病灶二者均未检出导致漏诊。本研究超声造影结合时间强度曲线与增强MRI在对肝癌患者肝内肿瘤完全灭活、残留病灶的良恶性总体判断准确性方面有很高一致性,和国内学者报道一致,避免了良性残留灶的二次射频消融,减轻患者身体及经济压力,对指导临床治疗有很好的应用价值。
肝脏超声造影能够实时监测,指导穿刺,提高微波消融治疗肝癌的疗效。肝癌消融治疗的彻底性是影响疗效的主要原因[11]。超声造影结合时间-强度曲线通过设置参数精确的量化分析肿瘤血管及微血管血流灌注情况,为消融提供较好的视野和精确的定位,提高射频消融的效率,在射频消融术前肿瘤性质的判断及术后灭活灶和残留灶的良恶性的评估有较大的应用前景[12]。
[1]高军喜,王颖鑫,杨磊,等.超声造影与增强CT对肝癌射频消融效果的一致性评价[J].中国肿瘤临床,2013,40(19):1179-1183.
[2]Rhim H.Complications of radiofrequency ablation in hepatocellular carcinoma[J].Abdom Imaging,2005,30(4):409-418.
[3]Masia SD,Tostib ME,Meleb A.Screening for hepatocellular carcinoma[J].Dig Liver Dis,2005,37(4):260-268.
[4]季正标,王文平,俞清,等.肝癌微波消融术前超声造影对肝脏肿瘤再定性的应用价值[J].中国介入影像与治疗学,2010,7(1):19-22.
[5]赵志华,廖锦堂,唐宏伟.超声造影在肝脏局灶性病变定性诊断中的价值[J].临床超声医学杂志,2014,9(16):637-640.
[6]Badea AF,Tamas-Szora A,Clichici S,et al.Contrast enhanced ultrasonography(CEUS) in the characterization of tumor microcirculation.Validation of the procedure in the animal experimental model[J].Med Uhrason,2013,15(2):85-94.
[7]Bex A,Fournier L,Lassau N.et al.Assessing the response to targeted therapies in renal cell carcinoma:technical insights and practical considerations[J].Eur Urol,2014,65(4):766-77.
[8]裴小青,刘隆忠,刘敏,等.肝硬化背景对肝细胞癌超声造影灌注曲线的影响[J].中华超声影像学杂志,2010,19(7):576-579.
[9]刘艳,陈文卫,李珏颖,等.SonoLiver时间强度曲线在肝脏局灶性占位病变超声造影中的应用价值[J/CD].中华医学超声杂志(电子版),2011,8(5):1023-1032.
[10]陈敏山,陈敏华,叶胜龙,等.原发性肝癌局部消融治疗的专家共识[J].临床肿瘤学杂志,2011,16(1):70-73.
[11]秦建民,顾新刚,张敏,等.肝脏实时超声造影在肝癌微波消融治疗中的应用[J].肝胆胰外科杂志,2013,23(1):27-30.
[12]Maruyama H,Yoshikawa M,Yokosuka O.Current role of ultrasound for the management of hepatocellular carcinoma[J].World J Gastroenterol,2008,14(11):1710-1719.
Applicationstudyofcontrast-enhancedultrasoundtime-intensitycurveinhepatocellularcarcinomaradiofrequencyablation
HeYan1,LiLei2△,LiXiaojing1,PengHongyan1,ZhangLing1,ZengJinfeng1,WangDan1,ShenLingli1
(1.DepartmentofUltrasoundImage,ZhongnanHospitalAffiliatedtoWuhanUniversity,Wuhan,Hubei430071,China;2.DepartmentofInterventionalUltrasound,AffiliatedTianyouHospital,WuhanUniversityofSciencesandTechnology,Wuhan,Hubei430064,China)
ObjectiveTo investigate the application value of contrast-enhanced ultrasound(CEUS) time-intensity curve in the radiofrequency ablation treatment of hepatocellular carcinoma.MethodsSeventy-six patients with hepatocellular carcinoma (118 tumor lesions) conducted the ultrasound-guided radiofrequency ablation therapy.The acoustic quantitative analysis software was employed to dynamically analyze the residual ablation lesions,which were compared with the examination results of synchronous enhanced MRI,with the pathology as the gold standard,the benign and malignant tumor residual ablation lesions were performed the statistically comparative analysis.ResultsThe accuracy of CEUS effect after liver radiofrequency ablation therapy was 82.2%,which of enhanced MRI was 83.9%;the difference between CEUS and enhanced MRI had no statistical significance(P>0.05),their examination results had higher consistency;the benign residual ablation lesions after radiofrequency ablation had blood perfusion characteristics different from malignant residual lesions,the time-intensity curve showed that IMAX benign residual lesions were smaller than malignant residual lesions(P<0.01).The benign residual lesions of RT and TTP were longer than the malignant residual lesions(P<0.01);diagnosing benign and malignant had no statistical difference between CEUS and enhanced MRI (P>0.05).ConclusionCEUS combined with the time-intensity curve can dynamically,intuitively and quantitatively reflect the blood perfusion differences among inactivated focus,benign and malignant residual lesions,and the surrounding liver parenchyma.
liver neoplasms;ultrasonography,doppler,color;catheter ablation;radiofrequency ablation;time-intensity curve
R445.1
A
1671-8348(2017)26-3649-02
2017-02-18
2017-06-09)
何雁(1983-),主治医师,硕士,主要从事超声造影方面研究。△
,E-mail:lsq521125@126.com。
10.3969/j.issn.1671-8348.2017.26.017
