TLS9a核酸适配体对小鼠肝癌细胞的靶向作用研究
2017-10-12魏莉平王镀津邹甜甜费安兴
魏莉平,王镀津,邹甜甜,费安兴△
(1.湖北省黄石市妇幼保健院团城山院区检验科 435000;2.湖北省黄石市中心医院检验科 435000)
论著·基础研究
TLS9a核酸适配体对小鼠肝癌细胞的靶向作用研究
魏莉平1,王镀津2,邹甜甜1,费安兴1△
(1.湖北省黄石市妇幼保健院团城山院区检验科 435000;2.湖北省黄石市中心医院检验科 435000)
目的探讨TLS9a核酸适配体对小鼠肝癌细胞的靶向作用。方法制备马来酰亚胺修饰的装载阿霉素的脂质体(liposome),合成FITC荧光及巯基修饰的TLS9a核酸适配体,并将其耦联到脂质体表面。紫外分光光度法检测阿霉素包封率。动态光散射法(DLS)测纳米粒子粒径大小及电位分布,倒置荧光显微镜观察小鼠肝癌细胞对阿霉素摄入及用流式细胞技术检测平均荧光强度,评估小鼠肝癌细胞对药物摄入量。四甲基偶氮唑蓝(MTT)法检测细胞活性。结果流式细胞术检测TLS9a核酸适配体与BNL.1ME.A.7R.1小鼠肝癌细胞结合率为54.1%,TLS9a耦联的脂质体平均粒径分布在(116.0±5.0)nm。TLS9a-liposome/DOX在pH 5.0的环境中可以快速释放化疗药物DOX,72 h药物释放量超过70%。TLS9a-liposome/DOX在体外能够有效抑制小鼠肝癌细胞BNL.1ME.A.7R.1生长。结论TLS9a核酸适配体可以特异性与小鼠肝癌细胞BNL.1ME.A.7R.1结合,可用于检测小鼠肝癌细胞。
肝肿瘤;核酸适配体;TLS9a;靶向治疗;小鼠肝癌细胞
尽管化疗药物广泛应用于癌症治疗,但由于他们不具备肿瘤特异性,而在临床的应用中受到限制。因此,发展有效且具有主动靶向功能的化疗药物运输平台成为纳米医药领域研究的热点。寡核苷酸适配体不仅能提供与抗体类似的结合效率,同时具备低免疫原、高稳定、合成简单和易改等优点,是应用于靶向药物释放的一种较好的选择。TLS9a适配体是由Shangguan等[1]于2008年利用cell-SELEX技术筛选出的一种核酸适配体,其序列为5′-AGT CCA TTT TAT TCC TGA ATA TTT GTT AAC CTC ATG GAC-3′,能够特异性地与小鼠肝癌细胞系BNL.1ME.A.7R.1结合,而与小鼠胚胎肝细胞BNL.CL.2结合能力弱,是一种具有潜在应用价值的靶向分子。本研究将荧光标记的TLS9a核酸适配体应用于流式细胞技术来检测游离单个小鼠肝癌细胞,为小鼠肝癌细胞的检测和诊断提供了新的思路。同时,本课题组利用TLS9a核酸适配体作为主动靶向分子,成功构建TLS9a核酸适配体耦联的脂质体,并在体外考察其药物释放及抗小鼠肝癌细胞效应。
1 材料与方法
1.1材料
1.1.1主要试剂 棕榈酰油酰磷脂酰胆碱(POPC)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000 (PEG2000-DSPE)、α-生育酚(α-tocopherol)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000-马来酰亚胺(MAL-PEG2000-DSPE)购自美国Avanti公司;FITC与巯基双标的TLS9a核酸适配体购自上海生物工程股份有限公司;阿霉素(DOX)购自美国Sigma公司;四甲基偶氮唑蓝(MTT)试剂盒购自北京索莱宝科技有限公司。其他试剂为实验室常用分析纯级。
1.1.2细胞 BNL.1ME.A.7R.1小鼠肝癌细胞系,BNL.CL.2小鼠胚胎肝细胞系购自ATCC中国代理公司。
1.2方法
1.2.1流式细胞技术检测核酸适配体与小鼠肝癌细胞结合率 收集对数期生长的BNL.1ME.A.7R.1 和BNL.CL.2细胞(1×106),重悬在50 μL清洗缓冲液中[4.5 g/L葡萄糖和5 mmol/L MgCl2的磷酸盐缓冲液(PBS)],同时加入40 μL黏附缓冲液[0.2 mg/mL转移核糖核酸酵母(yeast tRNA)和2.0 mg/mL牛血清清蛋白(BSA)的清洗缓冲液]和10 μL胎牛血清。加入FITC标记的TLS9a适配体,使其终浓度为25 nmol/L。4 ℃孵育30 min。用清洗缓冲液清洗3次,最后细胞重悬在500 μL清洗缓冲液中上流式细胞仪检测。
1.2.2马来酰亚胺修饰的脂质体(TSL9a-liposome)制备 10 μmol脂质体(POPC∶PEG2000-DSPE∶α-tocopherol∶MAL-PEG2000-DSPE 物质量比例为1.0∶1.0∶0.1∶0.1)溶解在1 mL氯仿中。加到圆底烧瓶中,在旋转蒸发仪上抽真空10 min使氯仿完全挥发。室温真空干燥4 h,取出加入1 mL的D-Hank′s缓冲液(pH 6.5)超声波恒温水浴5 min,使其形成脂质体悬液,将上述溶液加入挤推器中的玻璃注射器中,分别过孔径为200 nm及100 nm的聚碳酸酯膜各20次以上,即得到马来酰亚胺修饰的脂质体。
1.2.3TLS9a核酸适配体耦联的脂质体制备 将TLS9a和MAL-PEG2000-DSPE(1∶10)加入到上述制备的马来酰亚胺修饰的从脂质体中,混匀,氮气保护下4 ℃孵育24 h,最后产物用超滤浓缩管(3 500 MWCO)清洗3次,去除未结合的小分子物质,产物4 ℃保存备用。
1.2.4TLS9a-liposome包封DOX 将脂质体pH值调整到7.5,与脂质体按照物质量比例为1∶10加入,37 ℃振荡孵育4 h,透析去除未包封的DOX,终产物4 ℃保存备用。紫外分光光度法检测上清液中DOX水平,计算包封率。
1.2.5适配体修饰的脂质体粒径电位检测 利用动态光散射法(DLS)测量纳米材料的粒径和电位分布图。取适量脂质体溶于1 mL去离子水,25 ℃环境下检测纳米材料粒径和电位分布,重复3次。
1.2.6纳米材料体外药物释放考察 分别配置pH 7.4和pH 5.0的PBS,将载药脂质体浓度调整到1 mg DOX/mL浓度,加入到透析袋中(截留相对分子质量为3 500),分别置于30 mL pH 7.4和pH 5.0的PBS中。在避光条件下,37 ℃ 100 r/min水浴振荡。在预定的时间取500 μL透析液用荧光光度计测算药物释放量。重复3次计算平均值。
1.2.7评估DOX摄入量 在6孔板内接种BNL.1ME.A.7R.1(3×105/孔)细胞,培养24 h,分别加入终浓度为10 μg/mL的liposome/DOX、TLS9a-liposome/DOX,37 ℃、5%CO2培养1 h,收集细胞,PBS洗3次,500 μL重悬,流式细胞仪检测每组收集的10 000细胞,得到DOX荧光强度。分别收集上述细胞1×106,PBS清洗3次,4%多聚甲醛固定30 min,0.2 mg/mL 4′,6-二脒基-2-苯基吲哚(DAPI)染色15 min,PBS重悬,1 000 r/min离心6 min,清洗3次,倒置荧光显微镜下观察小鼠肝癌细胞对DOX的摄入量。
1.2.8MTT法评估靶向药物体外杀伤效果 BNL.1ME.A.7R.1细胞(1×104/孔)接种于96孔板,每组重复8孔,37 ℃ 5%CO2培养24 h,分别加入不同浓度的DOX、liposome/DOX、TLS9a -liposome/DOX,再培养24 h,移除培养液,加入100 μL不含血清的DMEM细胞培养液,20 μL MTT液,培养4 h,吸弃上清液,每孔加入100 μL DMSO,100 r/min室温摇床振荡10 min。酶标仪上490 nm波长处检测吸光度值。计算细胞活力。
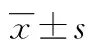
2 结 果
2.1TLS9a用于检测小鼠肝癌细胞 TLS9a核酸适配体可以特异性地与BNL.1ME.A.7R.1小鼠肝癌细胞结合,25 nmol/L时的结合率为54.1%,而与正常的小鼠胚胎肝细胞BNL.CL.2的结合率只有6.4%,见图1。
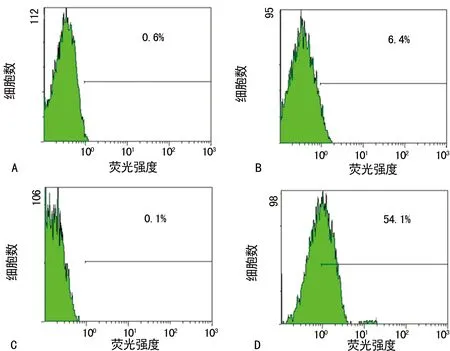
A:BNL.CL.2细胞(对照);B:BNL.CL.2细胞与25 nmol/L FITC标记的TLS9a核酸适配体;C:BNL.1ME.A.7R.1细胞(对照);D:BNL.1ME.A.7R.1细胞与25 nmol/L FITC标记的TLS9a核酸适配体
图1流式细胞仪检测TLS9a与小鼠肝癌细胞的结合率
2.2TLS9a核酸适配体耦联的脂质体表征 本实验中制备的TLS9a-liposome粒径和电位分布如图2所示。liposome纳米材料粒径分布在(109.0±3.1)nm,TLS9a -liposome纳米材料粒径分布在(116.0±5.0)nm;liposome电位分布在+30 mV左右,TLS9a-liposome电位分布在-23 mV左右,见图2。
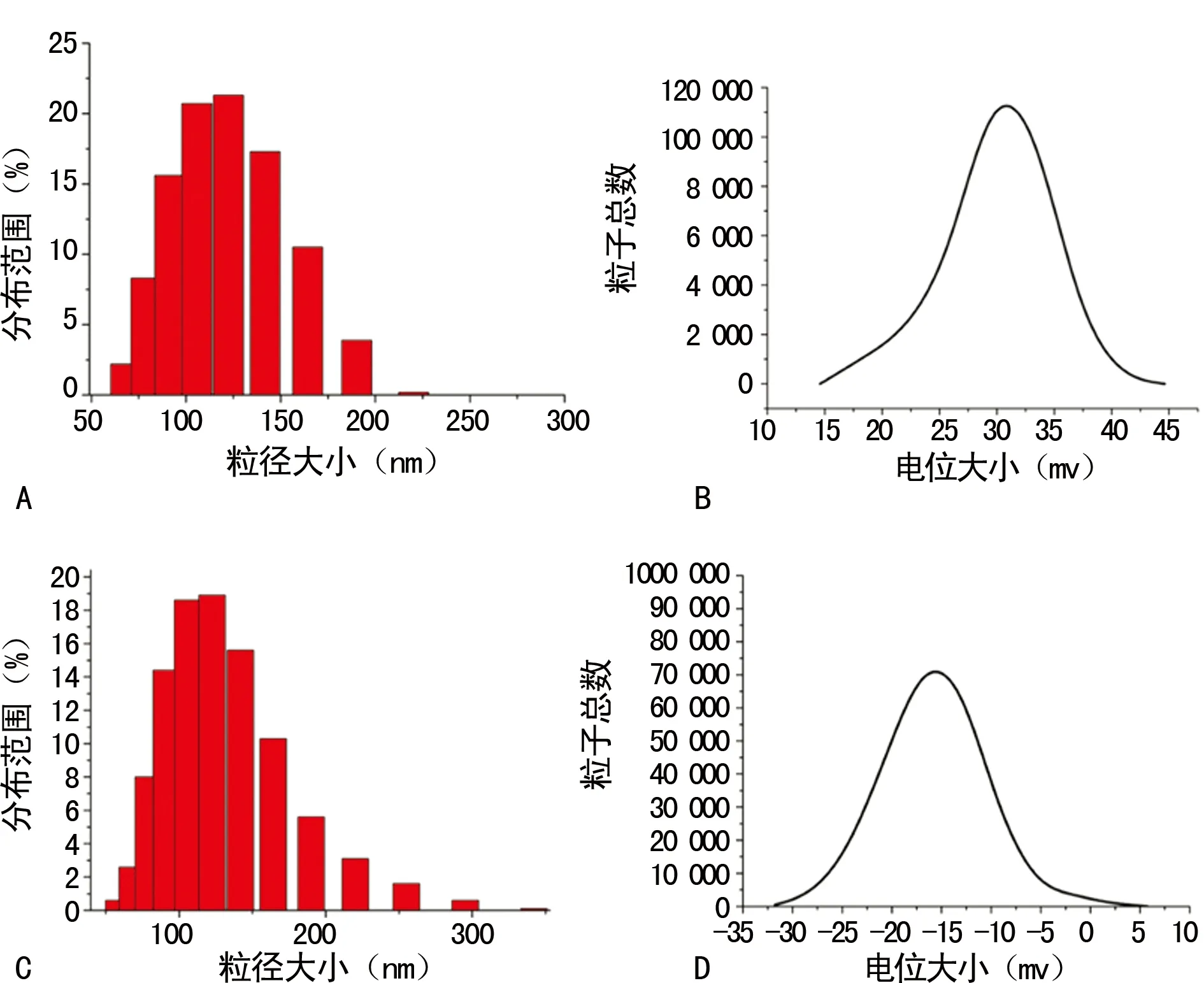
A:liposome粒径分布图;B:liposome电位分布图;C:TLS9a-liposome粒径分布图;D:TLS9a-liposome电位分布图
图2 DLS检测liposome及TLS9a-liposome纳米粒子粒径和电位分布图
2.3TLS9a-liposome体外药物释放测定 TLS9a-liposome在pH 7.4的环境中72 h内药物释放不超过20%,而在pH 5.0的环境中累积释放超过70%,人体体液循环中的pH值接近7.4,肿瘤微环境中pH值处于酸性环境,见图3。
2.4TLS9a-liposome靶向释放药物测定 修饰后TLS9a-liposome能明显提高小鼠肝癌细胞对DOX的摄入量。图4A中蓝色为细胞核,红色为DOX,可见耦联TLS9a-liposome组红色荧光明显强于未修饰靶向分子组;TLS9a-liposome组细胞内DOX荧光曲线明显右移,见图4B。
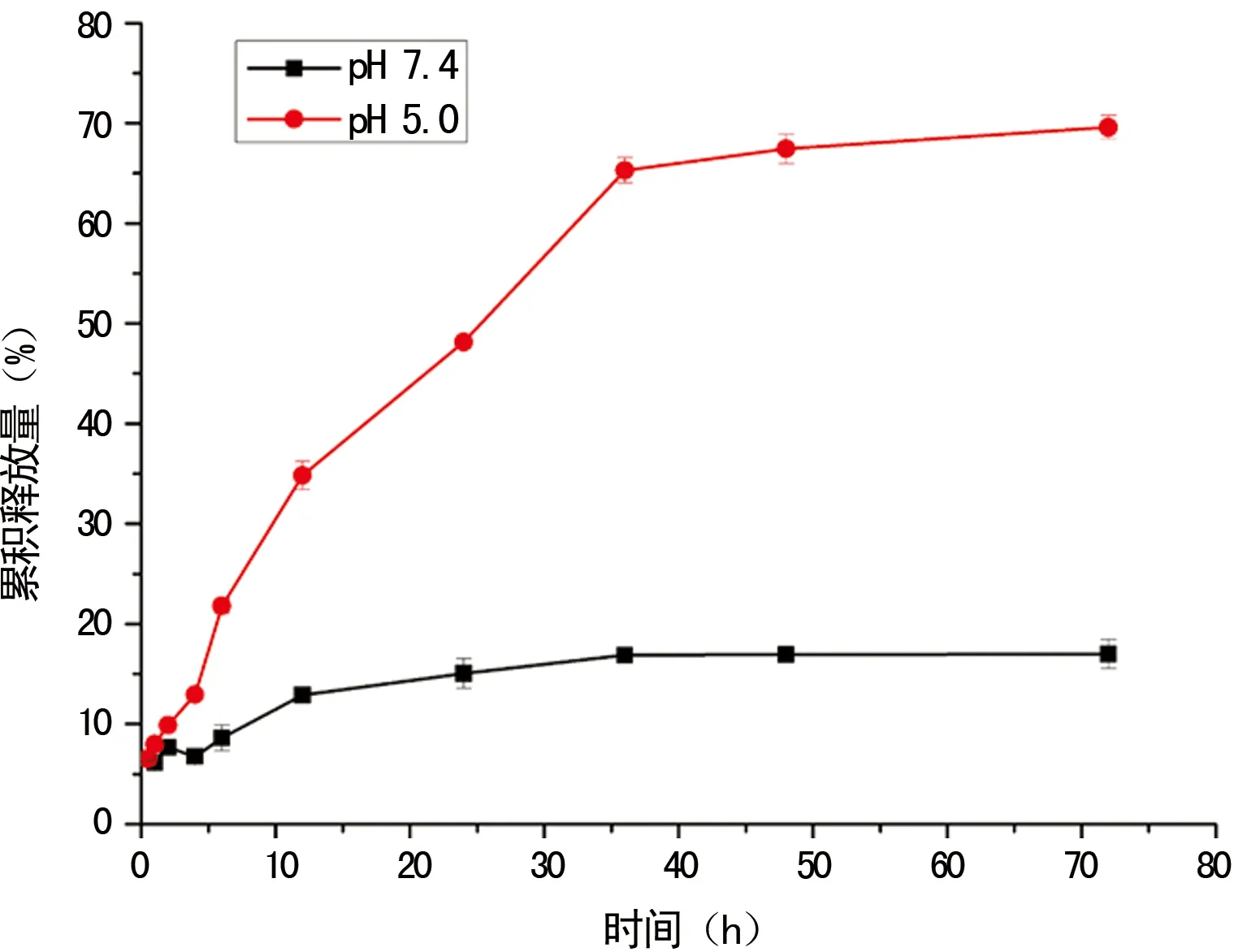
图3 TLS9a -liposome/DOX纳米材料在不同pH值下药物释放结果
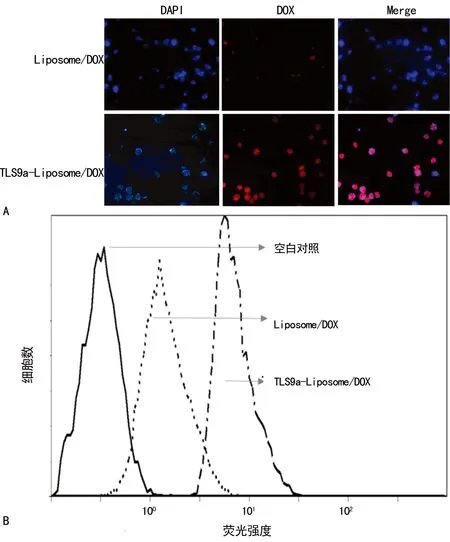
A:荧光显微镜检测DOX摄入量;B:流式细胞术检测药物摄入量
图4 BNL.1ME.A.7R.1小鼠肝癌细胞DOX摄入效果评估
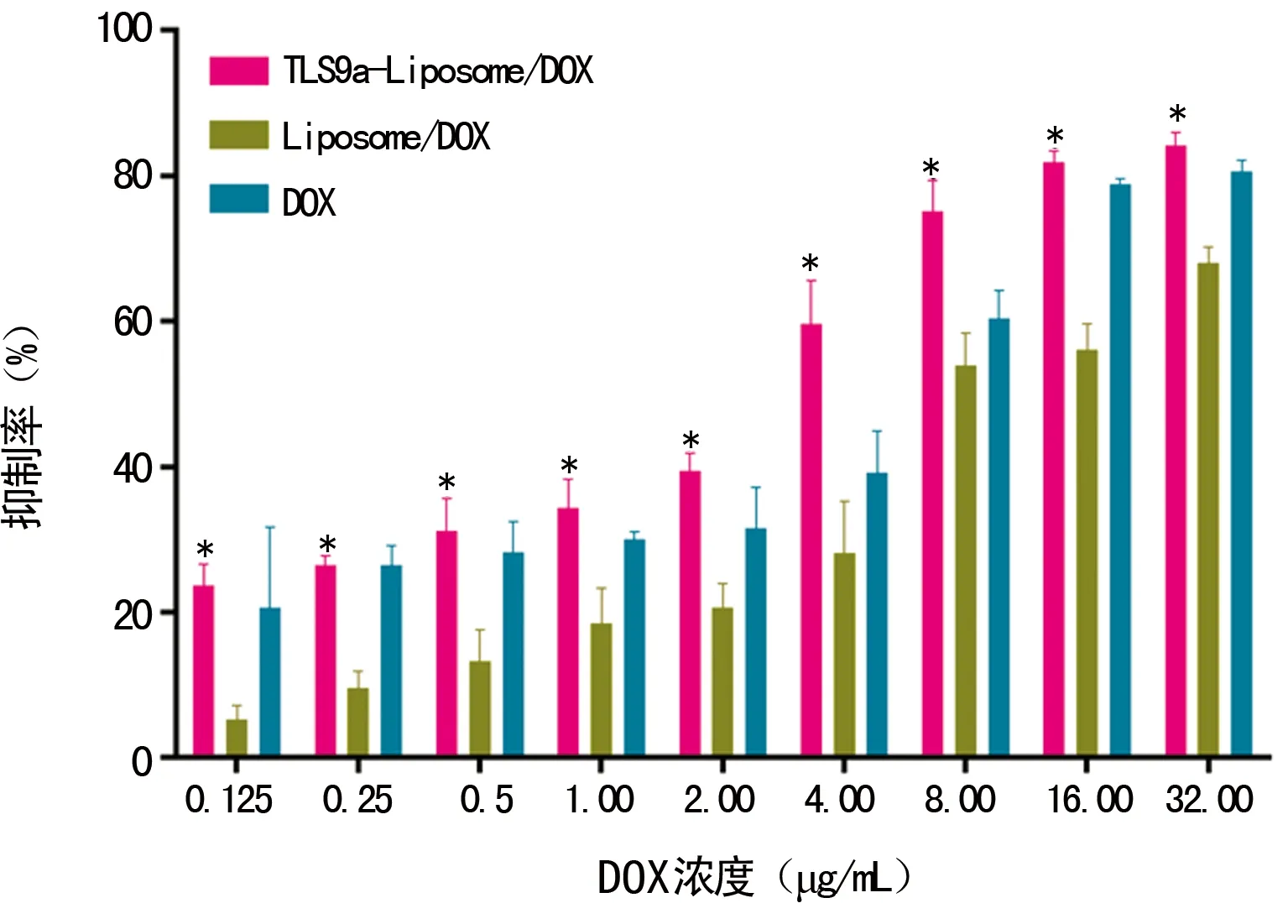
*:P<0.05,与liposome/DOX比较
图5 MTT法检测结果
2.5MTT法检测不同浓度的TLS9a-liposome/DOX对小鼠肝癌细胞抑制率 TLS9a-liposome/DOX比liposome/DOX对小鼠肝癌细胞抑制能力更强,见图5。
3 讨 论
核酸适配体在生物传感、生物检测和生物靶向治疗方面受到越来越多的重视[2-6]。适配体是小的DNA或RNA链,免疫原性极低,对人体无毒副作用。现今的技术可以筛选得到很多针对人肝癌的特异性适配体,将其应用到生物医药靶向诊治领域前景极其广阔,必将产生极大的社会和经济效应。利用核酸适配体构建各种新型的生物传感器用于肿瘤检测的研究也给临床诊断带来了新的希望[7-8]。
本研究在核酸适配体TLS9a上修饰FITC荧光基团,通过流式细胞术可以用于检测BNL.1ME.A.7R.1小鼠肝癌细胞。相对于传统的检测方法,核酸适配体价格低廉、合成简单、易于修饰,为肿瘤的临床诊断与检测方法提供了新的思路[9]。脂质体是一种已经应用于临床的传统纳米材料,具有很好的生物相容性,被广泛应用于生物医药领域[10-11]。DOX因其极大的不良反应而在临床上受到极大限制[12-13]。本实验通过在脂质体表面修饰TLS9a核酸适配体,实现化疗药物的主动靶向释放,使小鼠肝癌细胞对化疗药物的摄入量增加,从而提高化疗药物对小鼠肝癌细胞的杀伤效果。同时本研究发现TLS9a-liposome/DOX在模拟体内pH7.4环境时药物释放量很低,而在肿瘤局部酸性环境下可以快速持久释放药物,这说明TLS9a-liposome纳米材料在体循环中能保持相对稳定状态,并能减少化疗药物在到达肿瘤部位前的泄露,从而避免化疗药物对人体产生较大的不良反应。伴随着生物靶向治疗的兴起,适配体修饰的各种靶向载体必将不断涌现[14-15],这为生物靶向治疗提供了很好的发展契机。
综上所述,标记荧光基团的TLS9a核酸适配体可以用于小鼠肝癌细胞的检测,并且TLS9a-liposome/DOX纳米载体可以有效靶向释放化疗药物,从而提高化疗药物对小鼠肝癌细胞的杀伤能力。随着筛选方法的不断创新,新型的适配体也将源源不断出现,这将给临床对肿瘤的诊断检测和纳米医药领域的发展提供新的机遇。
[1]Shangguan D,Meng L,Cao ZC,et al.Identification of liver cancer-specific aptamers using whole live cells[J].Anal Chem,2008,80(3):721-728.
[2]Yeom JH,Lee B,Kim D,et al.Gold nanoparticle-DNA aptamer conjugate-assisted delivery of antimicrobial peptide effectively eliminates intracellular Salmonella enterica serovar Typhimurium[J].Biomaterials,2016(104):43-51.
[3]Sefah K,Shangguan D,Xiong X,et al.Development of DNA aptamers using Cell-SELEX[J].Nat Protoc,2010,5(6):1169-1185.
[4]Lyu Y,Chen G,Shangguan D,et al.Generating cell targeting aptamers for nanotheranostics using Cell-SELEX[J].Theranostics,2016,6(9):1440-1452.
[5]Kashefi-Kheyrabadi L,Mehrgardi MA,Wiechec E,et al.Ultrasensitive detection of human liver hepatocellular carcinoma cells using a label-free aptasensor[J].Anal Chem,2014,86(10):4956-4960.
[6]Lee JH,Yigit MV,Mazumdar D,et al.Molecular diagnostic and drug delivery agents based on aptamer-nanomaterial conjugates[J].Adv Drug Deliv Rev,2010,62(6):592-605.
[7]Jiang F,Liu B,Lu J,et al.Progress and challenges in developing aptamer-functionalized targeted drug delivery systems[J].Int J Mol Sci,2015,16(10):23784-23822.
[8]Lee H,Lytton-Jean AK,Chen Y,et al.Molecularly self-assembled nucleic acid nanoparticles for targeted in vivo siRNA delivery[J].Nat Nanotechnol,2012,7(6):389-393.
[9]Lu B,Wang J,Zhang J,et al.Screening and verification of ssDNA aptamers targeting human hepatocellular carcinoma[J].Acta Biochim Biophys Sin(Shanghai),2014,46(2):128-135.
[10]Kaneda Y.Virosomes:evolution of the liposome as a targeted drug delivery system[J].Adv Drug Deliv Rev,2000,43(2/3):197-205.
[11]Wagner A,Platzgummol M,Kreismayr G,et al.GMP production of liposomes:a new industrial approach[J].J Liposome Res,2006,16(3):311-319.
[12]Batist G,Barton J,Chaikin P,et al.Myocet(liposome-encapsulated doxorubicin citrate):a new approach in breast cancer therapy[J].Expert Opin Pharmacother,2002,3(12):1739-1751.
[13]Straubinger RM,Arnold RD,Zhou R,et al.Antivascular and antitumor activities of liposome-associated drugs[J].Anticancer Res,2004,24(2):397-404.
[14]Meng L,Yang L,Zhao X,et al.Targeted delivery of chemotherapy agents using a liver cancer-specific aptamer[J].PLoS One,2012,7(4):e33434.
[15]Parashar A.Aptamers in therapeutics[J].J Clin Diagn Res,2016,10(6):BE01-06.
TargetingeffectofTLS9anucleicacidaptameronmicehepaticcancercells
WeiLiping1,WangDujin2,ZouTiantian1,FeiAnxing1△
(1.DepartmentofClinicalLaboratory,TuanchengshanBranchHospital,HuangshiMunicipalMaternalandChildHealthCareHospital,Huangshi,Hubei435000,China;2.DepartmentofClinicalLaboratory,HuangshiMunicipalCentralHospital,Huangshi,Hubei435000,China)
ObjectiveTo investigate the targeting effect of TLS9a nucleic acid aptamer on mice hepatic cancer cells.MethodsThe liposome modified with maleimide and loading doxorubicin(DOX) was prepared,then TLS9a nucleic acid aptamer modified by FITC fluorescence and sulfydryl was synthesized,which was coupled to the liposome surface.The entrapment efficiency of DOX was detected by UV spectrophotometry.The dynamic light scattering(DLS) was applied to measure the particle size of nanoparticles and the potential distribution.The uptake of DOX in mice hepatic cancer cells was detected by the Nikon inverted microscope and the mean fluorescence intensity of liposome/DOX and TLS9a -liposome/DOX was detected by flow cytometry.The cells activity was detected by MTT.ResultsFlow cytometry assay showed that the binding rate of TLS9a nucleic acid aptamer with BNL.1ME.A.7R.1 mice hepatic cancer cells was 54.1%.TLS9a-liposome particle size distribution was in (116.0±5.0)nm.TLS9a-liposome/DOX released DOX quickly at pH 5.0,and the release amount in 72 h was more than 70% of the total release amount.TLS9a-liposome/DOX effectively inhibited the growth of mice hepatic cancer cells BNL.1ME.A.7R.1.ConclusionTLS9a nucleic acid aptamer could specifically combined with mice hepatic cancer cells BNL.1ME.A.7R.1,which could be used to detect mice hepatic cancer cells.
liver neoplasms;nucleic acid aptamer;TLS9a;targeted therapy;mice hepatic cancer cells
R73-36
A
1671-8348(2017)26-3623-03
2017-02-18
2017-06-06)
魏莉平(1986-),住院医师,硕士,主要从事肿瘤生物靶向诊断方面研究。△
,E-mail:809427843@qq.com。
10.3969/j.issn.1671-8348.2017.26.008
