1,25(OH)2D3对溃疡性肠炎小鼠红细胞及脾脏免疫功能的影响
2017-10-12赵红伟和丽丽郎晓猛朱叶珊刘建平
赵红伟,张 建,和丽丽,郎晓猛,朱叶珊,刘建平△
(1.河北省人民医院消化内科,石家庄 050051;2.河北省人民医院老年病科,石家庄 050051;3.河北省中医院脾胃科,石家庄 050071;4.河北省唐山市中医院脾胃科 063000)
论著·基础研究
1,25(OH)2D3对溃疡性肠炎小鼠红细胞及脾脏免疫功能的影响
赵红伟1,张 建1,和丽丽2,郎晓猛3,朱叶珊4,刘建平3△
(1.河北省人民医院消化内科,石家庄 050051;2.河北省人民医院老年病科,石家庄 050051;3.河北省中医院脾胃科,石家庄 050071;4.河北省唐山市中医院脾胃科 063000)
目的探讨1,25-二羟基维生素D3[1,25(OH)2D3]对肠炎模型小鼠红细胞、脾脏免疫机制的作用。方法30只小鼠随机分为空白对照组、模型组、1,25(OH)2D3组,建立动物模型;观察小鼠一般情况、结肠病理变化,酵母菌花环法检测红细胞免疫复合物(RCIC)和红细胞表面C3b受体(RC3bR)花环变化,测量脾脏质量、长度,流式细胞术测脾脏免疫细胞阳性率。结果与模型组比较,1,25(OH)2D3组、空白对照组血中RBC-C3bR明显增高,红细胞免疫复合物花环(RBC-ICR)明显降低(P<0.01)。与空白对照组相比,模型组脾脏单个核细胞中CD3、CD4、CD8、CD45R细胞阳性率明显升高(P<0.01);经1,25(OH)2D3干预后,1,25(OH)2D3组脾脏单个核细胞中CD3、CD4、CD8、CD45R细胞阳性率与模型组比较明显下降(P<0.01)。结论1,25(OH)2D3对慢性肠炎的红细胞及外周脾脏淋巴细胞均有免疫调节作用。
1,25(OH)2D3;红细胞免疫;脾脏淋巴细胞;溃疡性结肠炎;慢性动物模型
溃疡性结肠炎(ulcerative colitis,UC)是一种病因尚不明确的慢性非特异性炎症性结肠病变。根据流行病学资料提示,本病的发病率在国内外均有逐年上升的趋势。此病迁延数月,反复发作,严重影响患者的正常生活和工作。目前关于其发病机制的基本共识是:易感个体在特定的环境因素作用下,有害物质触发了机体的免疫系统发生并产生过度的级联免疫反应,使炎症反复发生[1-2];1,25-二羟维生素D3[1,25(OH)2D3]是维生素D的活性代谢产物,具有免疫调节作用,有研究显示其可缓解UC症状[3-5],本研究旨在探索1,25(OH)2D3对慢性UC模型小鼠的治疗作用是否通过红细胞免疫和脾脏淋巴细胞免疫机制进行调节,现报道如下。
1 材料与方法
1.1材料 30只雄性C57BL/6小鼠(7~12周,体质量18~22 g,北京维通利华实验动物技术有限公司);1,25(OH)2D3(瑞士罗氏有限公司);右旋葡聚糖硫酸钠(dextran sodium sulfate,DSS,相对分子质量36 000~50 000,美国Sigma公司);酵母多糖试剂;2%DSS配制:10 g DSS 溶于500 mL蒸馏水中,配成2%浓度的液体,放入4 ℃冰箱保存且备用。
1.2方法
1.2.1造模方法 动物造模与实验分组慢性期造模及1,25(OH)2D3干预:30只雄性C57BL/6小鼠按随机数字表随机分入空白对照组、模型组和1,25(OH)2D3组,每组10只。第1~28天空白对照组一直饮用蒸馏水;模型组和1,25(OH)2D3组小鼠饮用2%DSS的时间段分别为第1~5天、第8~12天、第15~19 天、第22~28天,其他时间段均饮用蒸馏水。各组在造模第14天时给予干预,空白对照组与模型组均给予等体积花生油灌胃以做对照,1,25(OH)2D3组给予1,25(OH)2D3(0.005 μg/d,溶于花生油中)灌胃干预,每天1次,共干预14 d;所有的动物均在第29天处死。
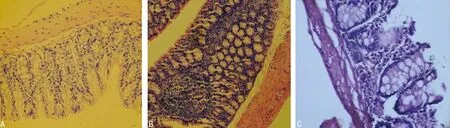
A:空白对照组;B:模型组;C:1,25(OH)2D3组
图1各组小鼠结肠黏膜组织光镜下病理学表现(HE,×200)
1.2.2一般情况及结肠病理组织染色 从实验第1天开始每天观察小鼠体质量变化、便血情况、大便性状、精神状态、饮食等。在第29天实验结束时处死动物,同时截取部分结肠段置于多聚甲醛内固定,进行包埋和切片,苏木精-伊红(HE)染色,行组织病理学观察。
1.2.3红细胞免疫的检测 红细胞C3b受体酵母菌花环(RBC-C3bR):实验结束时迅速从小鼠眼球取血1 mL,注入枸橼酸钠抗凝管中离心,从上层取出血浆备用,从下层取出50 μL红细胞加450 μL生理盐水混匀,检测红细胞浓度,加生理盐水稀释,终浓度1.25×107/mL。将冷冻致敏酵母菌充分吹打混匀,50 μL配好红细胞+50 μL血浆+50 μL酵母菌,50 μL配好红细胞+50 μL酵母菌,混匀37 ℃水浴,加入0.25%戊二醛25 μL,分别取1/2的量以毛细吸管涂片,吹干,加2滴甲醇固定,瑞士染液与缓冲液(1∶3)染色30 s,自来水冲洗去染液,湿片镜检计数红细胞花环形成率(与红细胞结合2个以上酵母菌)。同法检测红细胞表面C3b受体(RC3bR)。
1.2.4脾脏长度和脾脏质量的测量 第29天实验结束处死动物后留取各组小鼠的脾脏,分别称取、测量脾脏量长度和质量,并记录,统计各组脾脏质量、脾脏长度的变化。
1.2.5脾脏中免疫细胞阳性率的检测 分离脾脏中单个核细胞,用生理盐水漂洗2~3次,最终将其浓度调整为2×105/50 μL,第1管加入FITC标记的免疫球蛋白G(IgG) 5.0 μL和PE-Cy5标记的IgG2b 12.5 μL;第2管加入FITC标记抗小鼠CD4+2.5 μL,PE-Cy5标记的抗小鼠CD3+2.5 μL 和PE标记的抗小鼠CD8+抗体2.5 μL;第3管加入FITC标记CD45R 2.5 μL和IgG Cy5标记CD3+2.5 μL;避光作用30 min后,生理盐水洗1~3次,1 000 r/min离心5 min,弃上清液,100 μL生理盐水重悬,用流式细胞仪荧光法检测。
2 结 果
2.1各组实验动物的一般情况 从实验研究第1天开始,各组动物的体质量均增加,进食及饮食均较多;从第3天开始模型组、1,25(OH)2D3组实验动物的体质量开始逐渐下降,进食量及饮水明显减少,精神状态差、大便松散,但无稀便,无黏液及脓血便;第13~15天时实验动物的体质量下降较明显,精神萎靡,进食量及饮水量均明显减少,少动并出现稀便,肛周可见黏液及脓血便;1,25(OH)2D3组从第14天起给予1,25(OH)2D3灌胃干预,干预后动物的体质量仍继续下降,精神状态差,并出现稀便及血便;自第17天起1,25(OH)2D3组中的动物体质量下降不明显,基本平稳,精神症状均有好转,活动增多;从第18天起,1,25(OH)2D3组动物的体质量逐渐增加,但不太明显,大便稀且量多,便血不明显,精神可,进食及饮水增加;第29天,动物的体质量基本回到初始体质量的水平,大便量多,稀松但无脓血,精神状态良好,进食及饮水量较正常。
2.2各组实验动物结肠组织病理学变化 空白对照组动物的结肠病理光镜下观察可见黏膜光滑、完整,无缺损,无糜烂、水肿、充血等表现;模型组动物的结肠病理光镜下观察可见结肠黏膜不完整、紊乱、缺损,可见黏膜、黏膜下层大量炎性细胞浸润,隐窝增生,炎症细胞广泛浸润,呈典型慢性炎症改变。1,25(OH)2D3组结肠病理光镜下观察可见结肠黏膜稍完整,缺损不明显,黏膜层及黏膜下层炎症细胞浸润较模型组减少,炎症程度较模型组明显减轻,见图1。
2.3红细胞免疫的检测 与模型组比较,1,25(OH)2D3组、空白对照组血中RBC-C3bR明显增高,红细胞免疫复合物花环(RBC-ICR)明显降低(P<0.01),见表1。
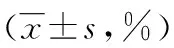
表1 红细胞免疫的比较
a:P<0.01,与模型组比较
2.4脾脏长度、质量的变化 3组小鼠脾脏长度和质量比较差异无统计学意义(P>0.05),见表2。
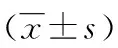
表2 两组脾脏长度和质量比较
2.5脾脏CD3、CD4、CD8、CD45R细胞阳性率的改变 与空白对照组相比,模型组脾脏单个核细胞中CD3、CD4、CD8、CD45R细胞阳性率明显升高(P<0.01);经1,25(OH)2D3干预后,1,25(OH)2D3组脾脏单个核细胞中CD3、CD4、CD8、CD45R细胞阳性率与模型组比较明显下降(P<0.01),见表3。
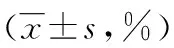
表3 脾脏CD3、CD4、CD8、CD45R细胞阳性率的改变
a:P<0.01,与模型组比较
3 讨 论
UC发病机制目前认为是有害物质引起宿主反应,使免疫失衡作用的结果,故免疫调节在本病的发病中起重要作用。1,25(OH)2D3是机体内活性的维生素D,维生素D3受体在淋巴细胞中诱导表达,从而在免疫调节中发挥重要作用。研究表明,IL-10敲除小鼠,当维生素D缺乏时,小鼠很快自发便血、消耗等结肠炎症状并伴随很高的病死率。给予足量的维生素D或1,25(OH)2D3会缓解症状[6-10]。
脾脏是重要的免疫器官,富含大量淋巴细胞,在免疫应答中起调节CD4+T细胞,传递抗原信息,CD8+T细胞为抑制性和杀伤性T细胞,具有抑制CD4+T细胞的功能,也有免疫抑制作用,CD4+/CD8+T细胞比值是反映T淋巴细胞活性的重要指标。研究表明,人类红细胞膜含有免疫黏附作用的C3b受体,它能清除血液循环中的免疫复合物。UC患者红细胞免疫黏附功能降低,清除免疫复合物(CIC)的能力减退,使体内CIC增高,即RBC-ICR增高,CIC可通过多种途径引起免疫损伤,最终导致UC的发生[11-13]。
实验结果显示2%DSS予小鼠饮用,可造成腹泻、血便,体质量下降等,结肠病理可见炎性细胞浸润和水肿,说明模型复制成功。给予1,25(OH)2D3干预后黏膜组织水肿情况有明显改善,增加血清中RC3bR水平,降低了免疫复合物在肠道黏膜上的大量沉积;使外周脾脏细胞中CD3+T细胞、CD4+T细胞、CD8+T细胞降低,从而调节了免疫系统反应,其机制可能是通过减少免疫细胞数量,降低免疫性细胞活性,从而降低炎性细胞因子对结肠黏膜的损伤。
[1]Dupont A,Kaconis Y,Yang I,et al.Intestinal mucus affinity and biological activity of an orally administered antibacterial and anti-inflammatory peptide[J].Gut,2015,64(2):222-232.
[2]Long TM,Nisa S,Donnenberg MS,et al.Enteropathogenic Escherichia coli inhibits type Ⅰ interferon-and RNase L-mediated host defense to disrupt intestinal epithelial cell barrier function[J].Infect Immun,2014,82(7):2802-2814.
[3]Mohammadi M,Zahedi MJ,Nikpoor AR,et al.Determination of vitamin D serum levels and status of the C3435T polymorphism of multidrug resistance 1 gene in southeastern iranian patients with ulcerative colitis[J].Middle East J Dig Dis,2015,7(4):245-252.
[4]Lima CA,Lyra AC,Rocha R,et al.Risk factors for osteoporosis in inflammatory bowel disease patients[J].World J Gastrointest Pathophysiol,2015,6(4):210-218.
[5]Amiriani T,Besharat S,Pourramezan Z,et al.Correlation between low bone density and disease activity in patients with ulcerative colitis[J].Middle East J Dig Dis,2015,7(1):25-30.
[6]Del PR,Pietropaoli D,Chandar AK,et al.Association between inflammatory bowel disease and vitamin D deficiency:a systematic review and meta-analysis[J].Inflamm Bowel Dis,2015,21(11):2708-2717.
[7]Krela-Kaömierczak I,Szymczak A,Lykowska-Szuber L,et al.The importance of vitamin D in the pathology of bone metabolism in inflammatory bowel diseases[J].Arch Med Sci,2015,11(5):1028-1032.
[8]Piodi LP,Poloni A,Ulivieri FM.Managing osteoporosis in ulcerative colitis:something new[J].World J Gastroenterol,2014,20(39):14087-14098.
[9]Mouli VP,Ananthakrishnan AN.Review article:vitamin D and inflammatory bowel diseases[J].Aliment Pharmacol Ther,2014,39(2):125-136.
[10]Ananthakrishnan AN,Cheng SC,Cai T,et al.Association between reduced plasma 25-hydroxy vitamin D and increased risk of cancer in patients with inflammatory bowel diseases[J].Clin Gastroenterol Hepatol,2014,12(5):821-827.
[11]Singh D,Srivastava S,Pradhan M,et al.Inflammatory bowel disease:pathogenesis,causative factors,issues,drug treatment strategies,and delivery approaches[J].Crit Rev Ther Drug Carrier Syst,2015,32(3):181-214.
[12]Stocco G,Cuzzoni E,De Iudicibus S,et al.Thiopurine metabolites variations during co-treatment with aminosalicylates for inflammatory bowel disease:effect of N-acetyl transferase polymorphisms[J].World J Gastroenterol,2015,21(12):3571-3578.
[13]Ricanek P,Lunde LK,Frye SA,et al.Reduced expression of aquaporins in human intestinal mucosa in early stage inflammatory bowel disease[J].Clin Exp Gastroenterol,2015(8):49-67.
Effectsof1,25-dihydroxyvitaminD3onimmunefunctionofRBCandspleeninulcerativecolitismice
ZhaoHongwei1,ZhangJian1,HeLili2,LangXiaomeng3,ZhuYeshan4,LiuJianping3△
(1.DepartmentofGastroenterology,HebeiProvincialPeople′sHospital,Shijiazhuang,Hebei050051,China;2.DepartmentofGerontology,HebeiProvincialPeople′sHospital,Shijiazhuang,Hebei050051,China;3.DepartmentofSpleenandStomach,HebeiProvincialHospitalofTraditionalChineseMedicine,Shijiazhuang,Hebei050071,China;4.DepartmentofSpleenandStomach,TangshanMunicipalHospitalofTraditionalChineseMedicine,Tanghan,Hebei063000,China)
ObjectiveTo investigate the effects of 1,25-dihydroxy vitamin D3[1,25(OH)2D3] on immune mechanism of RBC and spleen in colitis model mice.MethodsThirty mice were randomly grouped as follows:blank control group,model group and 1,25(OH)2D3group.The animal models were established.Then the general condition and colon pathological changes in mice were observed,the changes of the RBC immune compound(RCIC) and RBC surface C3b receptor(RC3bR) wreath were detected by the yeast wreath method,the weight and length of spleen were measured,the positive rates of spleen immune cells were detected by flow cytometry.ResultsCompared with the model group,RBC-C3bR in the 1,25(OH)2D3group and blank control group was significantly increased and RBC-ICR was significantly decreased (P<0.01).Compared with the blank control group,the positive rates of CD3,CD4,CD8 and CD45R in spleen mononuclear cell were significantly increased (P<0.01);after the 1,25(OH)2D3intervention,the positive rates of CD3,CD4,CD8 and CD56R in spleen mononuclear cells were significantly decreased compared with the model group(P<0.01).Conclusion1,25(OH)2D3has the immune regulatory effect on RBC and peripheral spleen lymphocytes in chronic colitis mice.
1,25(OH)2D3;RBC immune;spleen lymphocytes;ulcerative colitis;chronic animal model
R974
A
1671-8348(2017)26-3617-03
2017-02-18
2017-06-06)
赵红伟(1979-),主治医师,博士,主要从事胃肠疾病方面研究。△
,E-mail:13603396653@163.com。
10.3969/j.issn.1671-8348.2017.26.006
