色素上皮衍生因子对缺氧条件下H9C2心肌细胞保护作用*
2017-10-12周中新关秋华刘志伟董红燕张中明
王 柱,周中新,关秋华,张 昊,刘志伟,董红燕,张中明△
(1.徐州医科大学附属医院心胸外科,江苏徐州 221006;2.徐州医科大学生物化学与分子生物学研究中心,江苏徐州 221004;3.徐州医科大学形态学科研实验中心,江苏徐州 221004)
论著·基础研究
色素上皮衍生因子对缺氧条件下H9C2心肌细胞保护作用*
王 柱1,周中新1,关秋华2,张 昊1,刘志伟3,董红燕3,张中明1△
(1.徐州医科大学附属医院心胸外科,江苏徐州 221006;2.徐州医科大学生物化学与分子生物学研究中心,江苏徐州 221004;3.徐州医科大学形态学科研实验中心,江苏徐州 221004)
目的探讨色素上皮衍生因子(PEDF)对H9C2心肌细胞在低氧无血清条件下的保护作用及其可能的机制。方法体外培养H9C2细胞进行低氧无血清处理,将细胞分为对照组(H9C2)、缺氧组(缺氧+H9C2)、PEDF组(缺氧+H9C2+PEDF)、残粒体分裂抑制剂(Medivi-1)组(缺氧+H9C2+Mdivi-1)。TUNEL染色检测H9C2心肌细胞凋亡率;Western blot检测动力相关蛋白1(Drp1)、活化半胱天冬酶-3 (Cleaved-Caspase3)的蛋白水平;电镜及MitoTracker Red检测线粒体形态;采用线粒体膜电位检测试剂盒(JC-1)检测线粒体膜电位,MitoSOXTM检测线粒体活性氧簇(ROS)水平。结果缺氧诱导H9C2细胞线粒体分裂,缺氧组(6 h)与对照组比较差异有统计学意义(P<0.05),PEDF减少缺氧条件下线粒体分裂,PEDF组与缺氧组(6 h)比较差异有统计学意义(P<0.05),PEDF和Mdivi-1可以减少缺氧条件下(24 h)细胞凋亡,与缺氧组(24 h)比较差异有统计学意义(P<0.05)。结论PEDF通过抑制缺氧条件下H9C2细胞线粒体分裂减少细胞凋亡。
细胞凋亡;缺氧;心脏;H9C2细胞;色素上皮衍生因子;动力相关蛋白1;线粒体分裂
急性心肌梗死(acute myocardium infarction,AMI)是一种较常见的心血管疾病,对其的有效防治是医学界关注的热点[1-2]。AMI是持续而严重的心肌缺血所致的急性心肌细胞坏死[3],抑制缺血心肌细胞的凋亡与坏死及提高AMI预后是治疗的关键。色素上皮衍生因子(pigment epithelium derived factor,PEDF)作为重要的内源性血管抑制因子,在多个组织中均有表达,并具有多种生物活性[4-6]。本课题组的前期研究也提示PEDF具有抗血管渗透,保护缺血后心肌细胞凋亡,改善心肌梗死后心脏功能等作用[7-9]。本实验旨在通过构建H9C2细胞缺氧模型模拟心肌梗死,研究PEDF对细胞内线粒体分裂的调控,明确PEDF改善缺氧条件下H9C2细胞存活相关机制,为进一步完善缺血性心脏病的治疗提供理论基础及实验依据。
1 材料与方法
1.1材料 大鼠心肌细胞 H9C2购自北京北纳创联公司,DMEM培养基、D-Hanks 培养基购自美国Gibco公司;动力相关蛋白1(Drp1,#8570),活化半胱天冬酶-3 (Cleaved Caspase-3,#9664),β肌动蛋白(β-actin,#13E5) 抗体购自美国Cell Signaling Technology公司;线粒体荧光探针Mito-Tracker®Red购自英国Invitrogen公司;线粒体膜电位检测试剂盒(JC-1)购自南京凯基公司;大鼠重组PEDF购自武汉华美生物科技公司;MitoSOXTMRed线粒体活性氧簇(ROS)检测试剂盒购自美国Life Technologies公司。
1.2方法
1.2.1细胞培养 H9C2心肌细胞株来源于大鼠胚胎期心脏组织,在37 ℃、5%CO2条件下培养于含有10%胎牛血清的DMEM-F12培养基中。大鼠心肌细胞选取生长密度相似,生长状况良好的对数期心肌细胞进行分组:(1)对照组(H9C2):未经缺氧处理,在含10%胎牛血清的培养基中培养;(2)缺氧组(缺氧+H9C2):心肌细胞用无糖 D-Hanks 培养液替代正常培养基,在经过1%O2+5%CO2混合气平衡的单向气流缺氧装置中,于37 ℃培养; 缺氧时间分别为3、6、12、24 h。(3)PEDF组(缺氧+H9C2+PEDF):预处理的D-Hanks培养液中加入终浓度为10 nmol/L PEDF后缺氧处理,作为加药组;(4)Mdivi-1组(缺氧+H9C2+Mdivi-1):预处理的 D-Hanks 培养液中加入终浓度为1 μmol/L的Mdivi-1做同样的缺氧处理。
1.2.2Western blot检测蛋白表达 将各组心肌细胞培养皿置于冰上,磷酸盐缓冲液(PBS)漂洗2次,加入 4 ℃预冷的RIPA细胞蛋白裂解液,线粒体及胞质蛋白的提取方法如前所述[9],蛋白定量检测采用二喹啉甲酸法(BCA)。蛋白经十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳后用恒流湿法转膜。加入5%脱脂奶粉-TBST 封闭液于室温封闭 1 h,再分别加入稀释的Drp1、Cleaved Caspase-3和β-actin一抗,4 ℃轻摇过夜;随后加入相应的二抗(1∶100稀释),37 ℃恒温摇床孵育1 h。蛋白的相对表达量用待测蛋白与β-actin的灰度值比值计算。
1.2.3荧光显微镜观察线粒体形态 细胞培养于48孔板中,经分别处理后,使用 MitoTracker Red(200 nmol/L)标记心肌细胞线粒体,予室温孵育20 min后,PBS冲洗3遍,即可采用荧光显微镜观察线粒体形态。
1.2.4电镜观察线粒体分裂 细胞培养于6孔板中待细胞生长约4×105/孔,分别加入药物处理,作用20 min后弃去培养基上清液,用0.25%胰酶消化收集各组细胞,洗涤后加2.50%戊二醛浸没细胞团块。经过一系列脱水、染色并切片后观察线粒体分裂情况。
1.2.5线粒体膜电位检测试剂盒JC-1检测细胞线粒体膜电位 细胞培养于48孔板中,经分别处理后,使用JC-1(10 μg/mL)标记线粒体膜电位,避光孵育15 min,PBS洗3遍,即可采用荧光显微镜观察。
1.2.6线粒体ROS的测定 取对数生长期的H9C2细胞予48孔板常规培养,分别处理后,每孔加入200 μL MitoSOXTM试剂(将1 mmol/L的MitoSOX Red储存液按照1∶1 000 的比例加入到无血清培养基中,充分混匀即为MitoSOX Red工作液) 与细胞培养箱内37 ℃共孵育10 min。之后用PBS清洗细胞3次,hoechst3342染色细胞核15 min,荧光显微镜下观察。以红色荧光强度代表各组细胞线粒体ROS水平。
1.2.7TUNEL 荧光染色检测细胞凋亡 取对数生长期的H9C2细胞予48孔板常规培养,缺氧24 h后,经分别加药处理,使用4 ℃预冷的多聚甲醛固定细胞10 min,PBS冲洗3遍,加入10%驴血清(0.3%trition稀释)封闭,PBS冲洗3遍,避光条件下加入事先准备好的TUNEL反应液,37 ℃水浴1 h。PBS冲洗后,加入DAPI染色5 min,PBS洗孔板内细胞后荧光显微镜下观察。
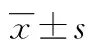
2 结 果
2.1PEDF对缺氧H9C2细胞线粒体分裂的影响 荧光和电镜的结果显示,对照组H9C2细胞线粒体成网格状分布,呈条索状,分裂比例少。缺氧组(6 h)线粒体呈现为不规则,大小不一,球型,分裂比例占大部分。PEDF处理后,H9C2细胞线粒体分裂状态明显减少,部分呈现网状分布,见图1。
A:线粒体荧光探针检测H9C2细胞内线粒体分裂情况(Scale bar,20 μm),局部放大5倍;B:电镜检测H9C2细胞内线粒体分裂情况(Scale bar,1 μm)
图1 3组缺氧H9C2细胞线粒体分裂情况
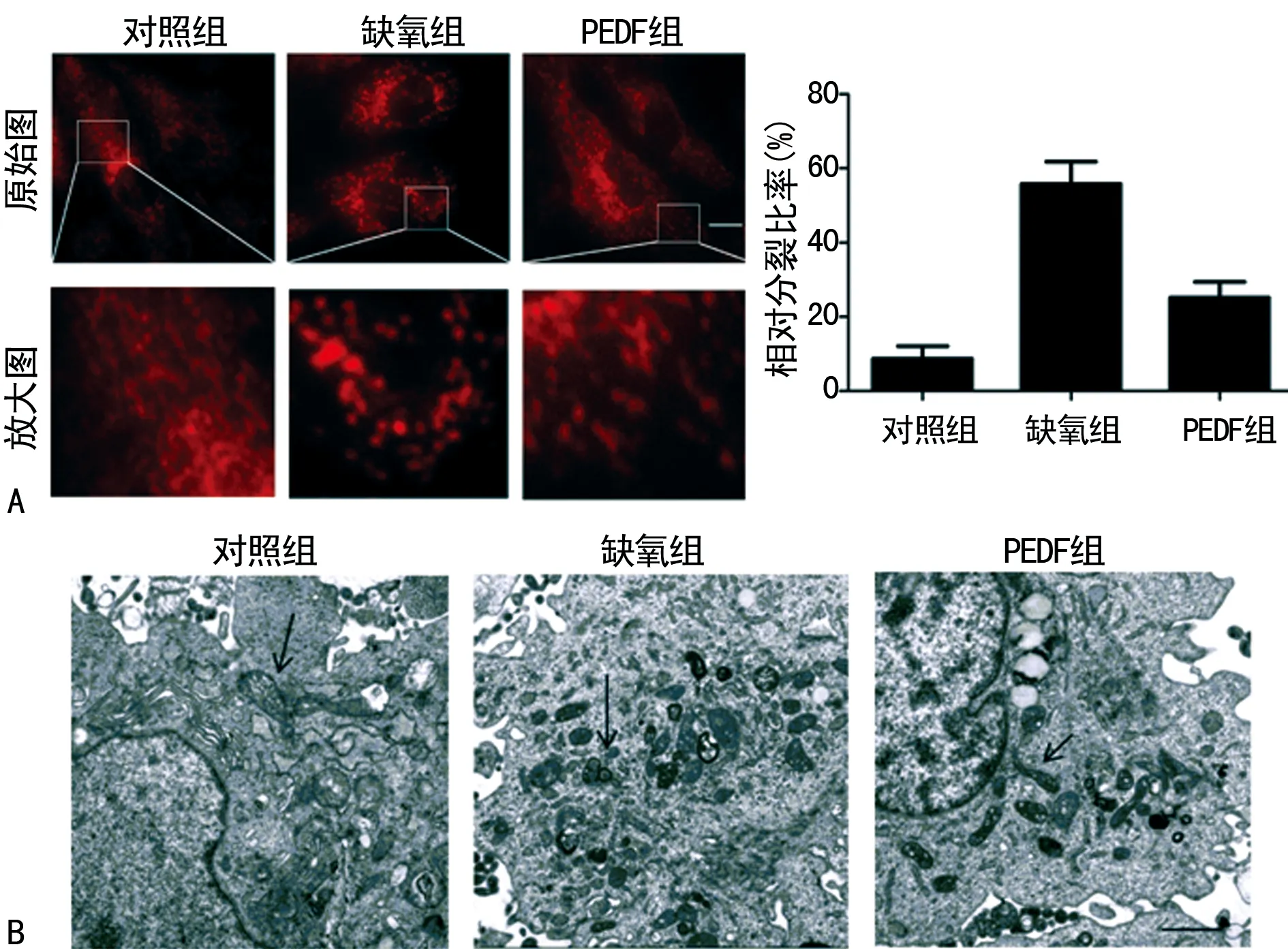
A:对照组与缺氧组线粒体及细胞质Drp1蛋白水平;B:3组Drp1蛋白在线粒体及细胞质中的水平
图2 3组Drp1蛋白Western blot图
2.2缺氧对Drp1蛋白线粒体转位的影响及PEDF对Drp1的作用 Western blot结果显示,与对照组相比,线粒体Drp1的蛋白水平随着缺氧时间(3、6、12、24 h)的延长而不断增加。胞质Drp1的蛋白水平随着缺氧时间的延长而不断减少(P<0.05),见图2A。与缺氧组(6 h)相比,PEDF组线粒体Drp1的蛋白水平明显下降,而胞质Drp1的蛋白水平明显上升(P<0.05),见图2B。
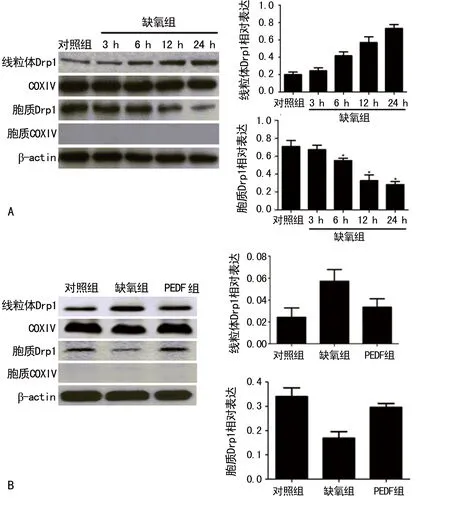
2.3PEDF对缺氧条件下H9C2细胞内线粒体ROS及线粒体膜电位的影响 线粒体ROS荧光结果显示,与对照组相比,缺氧组(6 h),线粒体ROS红色荧光明显增加(P<0.05);与缺氧组(6 h)相比,Mdivi-1组和PEDF组线粒体ROS水平下降(P<0.05),见图3A。与对照组相比,缺氧组(6 h)线粒体膜电位降低(P<0.05),而PEDF组及Mdivi-1组可以抑制缺氧条件下线粒体膜电位下降(P<0.05),见图3B。
A:线粒体ROS荧光探针(红色)检测H9C2细胞线粒体ROS水平(Scale bar,20 μm),B:JC-1检测线粒体膜电位情况(Scale bar,20 μm)
图3 4组H9C2细胞线粒体ROS水平及线粒体膜电位比较
2.4PEDF及Mdivi-1对细胞存活的影响 TUNEL和Western blot结果显示,与对照组相比,缺氧组(24 h)细胞凋亡率明显上升(P<0.05),与缺氧组(24 h)相比,PEDF组及Mdivi-1组凋亡率下降(P<0.05),见图4。
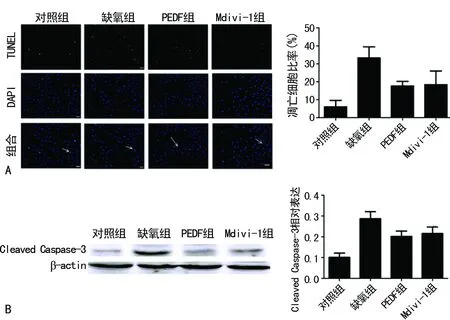
A:TUNEL染色检测(Scale bar,50μm),B:Western blot检测
图4 4组细胞凋亡TUNEL和Western blot检测图
3 讨 论
近年来PEDF对缺血性心脏的保护作用成为研究的热点。本课题组前期的研究亦表明,PEDF在保护缺血心脏发挥重要的作用。本实验认为PEDF可通过抑制缺氧心肌细胞内线粒体分裂而抑制心肌细胞凋亡和坏死,为缺血性心脏病的治疗提供了新的方向。
线粒体是高度动态的细胞器,在细胞内彼此连接,呈现立体的管网状结构,并且发生频繁地融合与分裂。线粒体连接成网络有利于能量在其中的传递,也有利于信息沟通,包括膜电位快速传递及线粒体内容物的交换[10-11]。大量研究显示,线粒体的融合或分裂与细胞凋亡密切相关,线粒体融合不足、过度分裂导致线粒体的片断化是细胞凋亡的前提[12]。在凋亡过程中,线粒体从连续网状的结构变成颗粒状的结构[13]。不平衡的线粒体分裂在许多疾病中都存在,比如癌症,心血管疾病,神经系统疾病及糖尿病等[14]。然而,少有研究证实PEDF与线粒体分裂的相关性。本研究发现,在缺氧的H9C2细胞中,线粒体分裂增加,PEDF可以明显地抑制线粒体分裂之后的片段化,改善线粒体功能,抑制细胞凋亡。
线粒体分裂是一种动态平衡的过程,这种状态有相关的蛋白调控[15]。Drp1是一种重要的分裂蛋白,主要存在与细胞的胞质中,当分裂开始时,Drp1从胞质转移到线粒体膜上,在潜在分裂位点处多个 Drp1 分子形成多聚体,围绕线粒体外膜形成指环结构,并通过 GTP 水解改变分子间的距离或角度,逐渐压缩直至线粒体分裂。线粒体分裂完成后,Drp1 重新回到胞质,如此循环往复,这种线粒体分裂复合物介导线粒体膜电位的下降和线粒体内容物的释放促进凋亡的发生[16]。在本研究发现,在缺氧条件下,H9C2细胞线粒体Drp1增加,胞质中Drp1减少,同时细胞内线粒体ROS上升,膜电位下降,这些结果表明缺氧可以诱导线粒体分裂增加和线粒体功能的下降,进而可导致细胞凋亡。然而,PEDF可减少缺氧导致的DRP1的线粒体转位,线粒体膜电位下降,以及线粒体ROS的释放。因此,本研究认为PEDF是通过抑制线粒体的分裂改善了线粒体功能。
本课题组前期均已经表明,PEDF可以明显的提高心肌细胞的生存率,改善心脏功能,但其保护作用的机制却是各不相同。Gao等[8]的研究发现,PEDF及其相关肽段通过抗氧化作用减少心肌细胞凋亡。而Wang等[9]的研究发现,在缺氧的条件下,PEDF可以通过PEDFR抑制P53的线粒体膜转位,减少线粒体膜通透性的开放,改善心肌细胞的存活。本研究发现PEDF是通过抑制细胞内Drp1线粒体转位,减少线粒体的分裂,改善线粒体的功能。然而抑制线粒体分裂可以改善缺氧条件下心肌细胞的凋亡,因此,本研究认为PEDF可以通过抑制线粒体的分裂减少缺氧条件下心肌细胞的凋亡。此实验结果既验证了PEDF对心肌细胞的保护作用,又提出了本实验的另一条心肌保护的分子机制,为治疗缺血性心脏病提供了新的治疗方案。
[1]Boersma E,Mercado N,Poldermans D,et al.Acute myocardial infarction[J].Lancet,2003,361(9360):847-858.
[2]White HD,Chew DP.Acute myocardial infarction[J].Lancet,2008,372(9638):570-584.
[3]Edinger AL,Thompson CB.Death by design:apoptosis,necrosis and autophagy[J].Curr Opin Cell Biol,2004,16(6):663-669.
[4]Filleur S,Nelius T,De Riese W,et al.Characterization of PEDF:a multi-functional serpin family protein[J].J Cell Biochem,2009,106(5):769-775.
[5]Wang YJ,Subramanian P,Shen DF,et al.Pigment epithelium-derived factor reduces apoptosis and pro-inflammatory cytokine gene expression in a murine model of focal retinal degeneration[J].ASN Neuro,2013,5(5):e00126.
[6]Subramanian P,Locatelli-Hoops S,Kenealey J,et al.Pigment epithelium-derived factor(PEDF)prevents retinal cell death via PEDF Receptor(PEDF-R):identification of a functional ligand binding site[J].J Biol Chem,2013,288(33):23928-23942.
[7]Zhang H,Wang Z,Feng SJ,et al.PEDF improves cardiac function in rats with acute myocardial infarction via inhibiting vascular permeability and cardiomyocyte apoptosis[J].Int J Mol Sci,2015,16(3):5618-5634.
[8]Gao X,Zhang H,Zhuang W,et al.PEDF and PEDF-derived peptide 44mer protect cardiomyocytes against hypoxia-induced apoptosis and necroptosis via anti-oxidative effect[J].Cardiology,2014,129(1):41-42.
[9]Wang X,Zhang Y,Lu P,et al.PEDF attenuates hypoxia-induced apoptosis and necrosis in H9c2 cells by inhibiting p53 mitochondrial translocation via PEDF-R[J].Biochem Biophys Res Commun,2015,465(3):394-401.
[10]Skulachev VP.Mitochondrial filaments and clusters as intracellular power-transmitting cables[J].Trends Biochem Sci,2001,26(1):23-29.
[11]Ono T,Isobe K,Nakada K,et al.Human cells are protected from mitochondrial dysfunction by complementation of DNA products in fused mitochondria[J].Nat Genet,2001,28(3):272-275.
[12]Ugarte-Uribe B,Garcia-Saez AJ.Membranes in motion:mitochondrial dynamics and their role in apoptosis[J].Biol Chem,2014,395(3):297-311.
[13]Ong SB,Hall AR,Hausenloy DJ.Mitochondrial dynamics in cardiovascular health and disease[J].Antioxid Redox Signal,2013,19(4):400-414.
[14]Mao CP,Zhang JJ,Lin SC,et al.MiRNA-30a inhibits AECs-Ⅱ apoptosis by blocking mitochondrial fission dependent on Drp1[J].J Cell Mol Med,2014,18(12):2404-2416.
[15]Liesa M,Palacin M,Zorzano A.Mitochondrial dynamics in mammalian health and disease[J].Physiol Rev,2009,89(3):799-845.
[16]Youle RJ,van der Bliek AM.mitochondrial fission,fusion,and stress[J].Science,2012,337(6098):1062-1065.
ProtectiveeffectofPEDFonH9C2myocardialcellsunderhypoxiacondition*
WangZhu1,ZhouZhongxin1,GuanQiuhua2,Zhanghao1,LiuZhiwei3,DongHongyan3,ZhangZhongming1△
(1.DepartmentofCardiothoracicSurgery,AffiliatedHospitalofXuzhouMedicalUniversity,Xuzhou,Jiangsu221006,China;2.ResearchCenterforBiochemistryandMolecularBiology,XuzhouMedicalUniversity,Xuzhou,Jiangsu221004,China;3.MorphologyScientificResearchandExperimentCenter,XuzhouMedicalUniversity,Xuzhou,Jiangsu221004,China)
ObjectiveTo investigate the protective effects and possible mechanism of pigment epithelium derived faetor (PEDF) on myocardial cells H9C2 under hypoxia and serum-free condition.MethodsH9C2 cells were culture in vitro and performed the hypoxia and serum-free processing.The cells were divided into the control group(H9C2),hypoxia group(hypoxia+ H9C2),PEDF group(hypoxia+H9C2 +PEDF) and mitochondrial fission inhibitor(Mdivi-1) group(hypoxia+h9C2+Mivi-1).The apoptotic rate was detected by TUNNEL staining.The proteins levels of dynamin related peptide1(Drp1) and cleaved-caspase 3 were measured by Western blot.Electron Microscopy and MitoTracker Red were used to detect the mitochondria morphology,the mitochondrial membrane potential was evaluated by cationic dye JC-1.MitoSOXTMwas used to detect mitochondrial reactive oxygen species (ROS).ResultsHypoxia induced mitochondrial fission(P<0.05).The hypoxia group (6 h) and control group had statistical difference(P<0.05).PEDF reduces mitochondrial fission under hypoxia condition(P<0.05),which had statistical difference between the PEDF group and hypoxia group (6 h)(P<0.05).PEDF and Mdivi-1 could decrease cell apoptosis under hypoxia condition(24 h),compared with the hypoxia group,the difference was statistically significant(P<0.05).ConclusionPEDF decrease cell apoptosis by inhibiting H9C2 cells mitochondrial fission under hypoxia condition.
apoptosis;anoxia;cardiac;H9C2 cells;pigment epithelium derived factor;dynamin related peptide1;mitochondrial fission
R654.2
A
1671-8348(2017)26-3605-03
2017-02-11
2017-06-03)
10.3969/j.issn.1671-8348.2017.26.002
国家自然科学基金资助项目(81270173);江苏省卫生厅科技计划项目青年基金(Q201407)。
王柱 (1984-),住院医师,硕士,主要从事PEDF对缺血性心脏病的保护作用方面研究。△
,E-mail:zhang_zhongming@xzmc.edu.cn。
