3种生物源物质对黄瓜的促生与防病作用
2017-10-12张孝然陈夕军陈孝仁魏利辉黄奔立
张 云,张孝然,陈夕军,陈孝仁,张 青,魏利辉,黄奔立
(1.扬州大学园艺与植物保护学院,江苏 扬州 225009;2.苏州市农业科学院,江苏 苏州 215155;3.江苏省农业科学院植物保护研究所,江苏 南京 210014)
3种生物源物质对黄瓜的促生与防病作用
张 云1,张孝然1,陈夕军1,陈孝仁1,张 青2,魏利辉3,黄奔立1
(1.扬州大学园艺与植物保护学院,江苏 扬州 225009;2.苏州市农业科学院,江苏 苏州 215155;3.江苏省农业科学院植物保护研究所,江苏 南京 210014)
研究生物源物质S-诱抗素(S-ABA)、有机肥和寡聚糖对黄瓜的促生与防病作用,用其不同浓度稀释液浸种、催芽与喷施处理黄瓜植株。结果表明,不同浓度的3种生物源物质对黄瓜种子发芽率均无显著影响;除高浓度S-诱抗素(稀释倍数≤2 500倍)对黄瓜胚根、胚芽的伸长有明显抑制作用外,其他浓度生物源物质对其均有一定促进作用。叶面喷施生物源物质,可有效提高黄瓜植株的株高、根长、鲜重和干重,促进其体内苯丙氨酸解氨酶、过氧化物酶和多酚氧化酶等活性增加,并导致抗性相关物质含量发生变化。qRT-PCR结果表明,生物源物质喷施黄瓜植株表面48 h后,其体内抗性相关基因PAL和β-1,3-葡聚糖酶基因的表达量均明显上调。防效测定结果表明,间隔24 h,连续喷施两次生物源物质,可有效减轻黄瓜白粉病发生,S-诱抗素、有机肥和寡聚糖的防效分别达54.9%、68.4%和47.8%;与生防菌配合使用,防治效果更佳,将有机肥与拮抗放线菌5X4配合使用,对黄瓜白粉病的防效高达81.6%。
防病作用;促生;生物源物质;白粉病;黄瓜
Abstract:Biogenic materials,coming from living organisms and safety for environment and human,can be used as fungicide to control plant disease and plant growth regulators to promote plant growth. To determine the effects of biogenic materials on growth promoting and disease controlling of cucumber,different concentrations of three kinds of biogenic materials were used to soak seeds,accelerate germination and spray on the leaves of cucumber. Results showed that all concentration of biogenic materials had no effect on the germination rate of cucumber seeds,but could promote elongation of the radicle and germ except for the high concentration of trans-abscisic acid. The plant height,root length,fresh weight,dry weight and defence enzymes activities,such as phenylalanine ammonialyase (PAL),peroxidase (POD) and polyphenol oxidase (PPO),increased after the cucumber plants sprayed with biogenic materials a certain time. Quantitative real-time polymerase chain reaction indicated that the expression levels of PAL and β-1,3-glucanase gene of cucumber sprayed with biogenic materials were up-regulated. Spraying twice interval for 24 h,the biogenic materials could reduce thedisease severity of cucumber powdery mildew,and the control effects of trans-abscisic acid,organic fertilizer and oligosaccharide were 54.9%,68.4 and 47.8% respectively. The better control effect was found when biogenic materials combined with the bio-control agents,and the best control effect could reach 81.6%.
Key words:disease controlling;growth promoting;biogenic material;powdery mildew;cucumber
近年来黄瓜种植范围不断扩大,产量逐年升高,2014年全球黄瓜年产量已达7 330万t,其中84.3%源于亚洲。我国作为最大的黄瓜种植国之一,年播种面积达400万hm2以上,占全国蔬菜面积的10%左右[1]。白粉病是黄瓜最严重的病害之一,导致年均损失在20%以上,严重制约黄瓜的产量和品质[2]。由于设施栽培黄瓜地长期处于高温高湿状态,且黄瓜白粉病菌分生孢子在适宜条件下可反复侵染为害,潜育期短,因此该病极具暴发性[3]。
随着人们生活水平的提高和对健康的关注,长期大量使用化学农药造成的“3R”问题,已越来越引起人们重视[4]。研究者们将目光投向了高效无害化防控手段,如物理防治[5-6]和生物防治[7-8],特别是应用来源于植物的提取物[9-13]、天然油脂[14]和拮抗菌培养滤液[15]等生物源物质。生物源物质主要来源于动物、植物、微生物及其次生代谢物,以及经过结构改造的仿生合成的高活性、强特异性物质。由于其来源于自然界,无毒副作用,且对环境友好,是目前乃至未来研究的热点。作为影响植物生长发育的内源激素S-ABA,其不仅可以调节植物的衰老与叶片脱落,还对植物的颜色、花青素含量和抗氧化活性具有一定影响[16]。外源施用S-ABA不仅提高盐胁迫条件下水稻幼苗的成活率、地上部鲜重和含水量,还可提高水稻植株叶绿素总量、根系发根力、分蘖数及产量[17]。寡聚糖则可通过影响植物的组织生物化学,提高植物对病害的抗性,如诱导超敏反应、木质素沉积、胼胝质形成和防御酶活性等[18-19]。不同生物源的有机肥,其作用机制多样,生产中主要用来调节植物生长与改善土壤[20-21]。
由于生物源物质种类繁多、作用机理不明、适用的施用浓度与方法不同,且防效易受环境条件影响等原因,生物源物质的田间防效目前并不理想。基于此,本试验拟通过明确几种生物源物质的施用浓度、促生与诱抗机制,并结合生防菌的施用,探索其在黄瓜白粉病无害化控制上的应用前景,为病害防控提供理论依据。
1 材料与方法
1.1 试验材料
生物源物质:S-诱抗素(0.1%福生褔施壮水剂,主要成分为脱落酸),四川龙蟒福生科技有限责任公司;寡聚糖(50 g/L奇善宝海洋寡糖复合制剂),大连中科格莱克生物科技有限公司;有机肥(健丽壮有机肥可溶性粉剂,有机质≥30%),上海帅丰生物科技发展有限公司。
黄瓜品种:唐秋一号秋瓜,青岛胶州市九龙育苗繁育场。白粉病菌:采自扬州大学园艺与植物保护学院温室发病黄瓜叶片。
1.2 3种生物源物质对黄瓜的促生作用测定
1.2.1 发芽率与胚根、胚芽长测定 分别以50 mL各浓度生物源物质(S-诱抗素:1 000、2 500、5 000、10 000、20 000倍液;有机肥 500、1 000、2 000、4 000、8 000倍液;寡聚糖:400、800、1 600、3 200、6 400倍液)浸泡黄瓜种子8 h,洗净、沥干,整齐排列于以2 mL相同浓度液体浸润的滤纸上,滤纸置于培养皿中,25℃催芽。待对照发芽率达70%左右时,计算发芽率。以清水作对照,每个处理3次重复,每个重复50粒种子。
以清水浸种催芽后,选取芽长一致的种子置于浸润不同浓度生物源物质的滤纸上,分别于3~5 d后测量胚根、胚芽长。每个处理3次重复,每个重复30粒种子。
1.2.2 生长量测定 将培养基质与珍珠岩以2∶1均匀混合,填充于50穴的育苗盘中。每穴1粒种子,待2叶1心后将小苗移入110 mm×100 mm营养钵中,日夜光暗交替培养(25℃/20℃、12 h/12 h。4~5叶期时,选取长势较为一致的黄瓜苗,以推荐使用浓度(S-诱抗素1 000倍液、有机肥3 000倍液、寡聚糖1 000倍液)喷施生物源物质,连续2次,间隔24 h,并于第2次喷施7 d后测量各生长量指标。每个处理3次重复,每个重复10株。生长量指标包括黄瓜苗株高、根长、鲜重、干重和叶绿素含量。
1.3 防御酶活性测定
以推荐浓度(S-诱抗素1 000倍液、有机肥3 000倍液和寡聚糖1 000倍液,下同)生物源物质喷施4~5叶期黄瓜苗,于喷施后0、12、24、48、72和96 h时取样。将1.0 g黄瓜叶片放入预冷的研钵中,向其中加入5 mL预冷的磷酸缓冲液(pH 6.8)、0.1 g聚乙烯吡咯烷酮和少量石英砂,冰浴研磨成匀浆。4℃、8 000 r/min离心40 min,取上清定容至25 mL,即得粗酶液。以喷施清水的叶片作对照,每个处理3次重复。过氧化物酶(POD)、多酚氧化酶(PPO)和苯丙氨酸解氨酶(PAL)活性测定参照文献[22-23],超氧化物歧化酶(SOD)活性测定参照邹琦等[24]的方法进行。
1.4 抗性相关物质含量测定
以物质推荐使用浓度喷施4~5叶期黄瓜苗,并分别于喷施前和喷施后1、3、5、7、9 d取样,取样后立即置于液氮中,-70℃冰箱保存备用。可溶性糖、可溶性蛋白、丙二醛(MDA)和木质素含量测定分别参照文献[25-27]。
1.5 抗性相关基因表达水平检测
以推荐使用浓度生物源物质喷施4~5叶期黄瓜苗,48 h后取样。总RNA的提取按TaKaRa公司RNAiso Plus试剂盒说明书进行,总RNA经DNA酶I处理后用于cDNA第一条链的合成。qRT-PCR分析采用Takara公司的SYBR®Premix Ex TaqTMⅡ(Tli RNaseH Plus)试剂盒,操作按说明书进行。PAL基因和葡聚糖酶β-1,3-glu基因的qRT-PCR检测引物分别为:PAL-For/F-PAL-Rev(5′-TGCTAACTGGCGAA AGGGTA-3′/5′- TTGGTGTTCCATCCCACTCT-3′)和 G l u-F o r/G l u-R e v(5′-GGACTATGCCCTCTTCACAGC -3′/5′-TTCCTC CACCGACCTTCTC-3′),内参基因UBI-1扩增引物为:5′- CCAAA GCACAAGCAAGAGAC -3′和 5′- AGTAG GTTGTCTTATGGCGC -3′[28]。采用25 μL反应体系,反应程序为:95℃ 30 s,95℃ 5 s,55℃ 30 s,39 个循环。
1.6 生物源物质对黄瓜白粉病的防效
以推荐浓度生物源物质喷施1叶1心期黄瓜苗,连续2次,间隔24 h。3 d后,加生防菌处理喷施放线菌或细菌培养滤液,单独生物源物质处理喷施清水,均至叶片滴水。24 h后,接种白粉病菌孢子液(106个孢子/mL),28℃生化培养箱保湿培养,每天观察发病情况,以全清水喷施作对照,待对照叶片枯黄时开始调查。每个处理3次重复,每个重复12株。
黄瓜白粉病分级标准:0级,无病斑;1级,病斑占叶面积的1/5以下,白粉模糊不清;2级,病斑占叶面积的 1/5~1/3,白粉较为明显;3级,病斑占叶面积的1/3~1/2,白粉层较厚、连片;4级,病斑占叶面积的 1/2~2/3,白粉层浓厚,叶片开始变黄、坏死;5级,病斑占叶面积的 2/3 以上,叶片枯黄[29]。
试验数据采用DPS V6.55分析。
2 结果与分析
2.1 不同浓度生物源物质对黄瓜发芽率以及胚根、胚芽伸长的影响
从表1可以看出,不同浓度生物源物质浸种均对黄瓜种子的发芽率无明显影响。高浓度S-诱抗素(稀释倍数≤2 500倍)可抑制黄瓜胚根、胚芽的伸长;当稀释度≥5 000倍时,抑制作用消失;稀释度达20 000倍时,对胚芽的伸长有一定促进作用。有机肥和寡聚糖在各稀释度下,均可对黄瓜的胚根、胚芽伸长具促进作用。可见,生产上进行浸种催芽时,宜选用有机肥和寡聚糖,不宜选用S-诱抗素。
2.2 生物源物质对黄瓜生长量的影响
推荐浓度施用3种生物源物质,除对黄瓜叶片叶绿素含量无显著影响外,黄瓜植株的株高、根长、鲜重和干重均有所增加,增量分别处于19.38%~25.55%、23.94%~33.00%、13.32%~25.84%和13.54%~30.21%之间,说明这些生物源物质对黄瓜有很好的促生长作用(表2)。
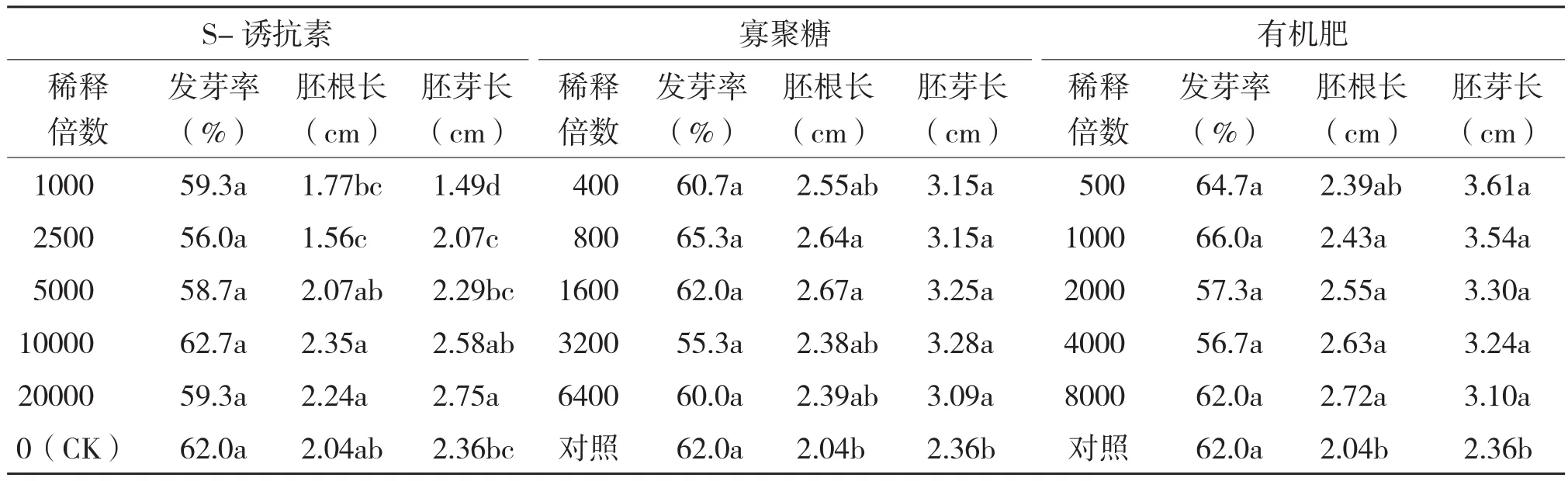
表1 不同浓度生物源物质对黄瓜种子发芽率及胚根、胚芽伸长的影响

表2 推荐浓度施用生物源物质对黄瓜生长量的影响
2.3 生物源物质对黄瓜抗性相关酶的诱导作用
以3种生物源物质喷施黄瓜叶片,在0~96 h范围内,植株体内SOD活性变化与对照无显著差异。POD在寡聚糖作用下,活性稍许降低;而在S-诱抗素和有机肥作用下,分别于喷施后24、72 h达最大值,为对照的2.85、1.76倍。叶面喷施后不同时间内,PPO和PAL活性较对照均有显著提高,特别是在寡聚糖作用下,提升效果更加明显(图1)。
2.4 生物源物质对黄瓜抗性相关物质的影响

图1 生物源物质处理对黄瓜植株体内防御酶活性的诱导作用
施用生物源物质后,黄瓜植株体内可溶性糖和木质素含量显著上升,而丙二醛含量显著下降;可溶性蛋白含量的变化并无规律,但在喷施后1 d,所有处理的可溶性蛋白都达到最小值。说明生物源物质处理对黄瓜植株的营养生长与抗逆具有促进作用(图2)。

图2 生物源物质处理对黄瓜植株体内抗性相关物质含量的影响
2.5 施用生物源物质对黄瓜PAL基因和β-1,3-葡聚糖酶基因表达量的影响
施用生物源物质48 h后,黄瓜植株体内PAL基因和β-1,3-葡聚糖酶基因的表达量显著上调。施用S-诱抗素、有机肥和寡聚糖后,黄瓜体内PAL基因的表达量分别是对照的1.32、1.88、2.06倍,而β-1,3-葡聚糖酶基因的表达量是对照的2.16、4.27、2.72倍。说明生物源物质可以诱导黄瓜植株体内抗性相关基因的表达,从而提高植株对病原物的抗性(图3)。
2.6 生物源物质对黄瓜白粉病的防治作用
从表3(图4,封三)可以看出,3种生物源物质对黄瓜白粉病均有一定的防效。连续施用2次,有机肥对黄瓜白粉病的防效达68.4%,即使防效稍差的寡聚糖也达到47.8%。若将生物源物质与生防菌结合使用,则防效可得到极大提高。其中,有机肥与放线菌5X4复合使用的防效更是高达81.6%。
3 结论与讨论
生物源农药[30]、有机肥料[31]、生长调节剂[32]和生物诱抗剂[33]等生物源物质,因其来源广、活性高和对环境友好,已逐渐被广泛应用作物生长调节与病虫害防治。在这些生物源物质中,植源性物质如大蒜鳞茎粗提物[34]、杜仲抗真菌蛋白[35]、石榴皮正丁醇萃取物[36]、丁香甲醇提取物[37]和一些生物菌肥[38]应用更加广泛。但不同生物源物质,其对不同作物的促生与防病作用、控病机制等并不完全相同[39-42]。作为脱落酸的一种,S-诱抗素可通过促进辣椒幼苗根系的生长、增加内源ABA合成、调节防御酶活性和减少氧自由基等来降低逆境对植株的伤害[43]。实时荧光定量PCR结果表明,水稻植株在条纹病毒胁迫下,6个与ABA合成相关的基因均有不同程度表达,说明ABA参与了植物体内的防卫反应[44]。有机肥可代替部分化肥施用,提高作物的品质和产量,还能促进土壤有益微生物量的增加,提高植株对氮、磷、钾的吸收[45]。寡聚糖是发现最早、研究最为深入的植物植保素合成的激发子。寡聚糖不仅可以促进植物种子的发芽率、种子活力和生长量,还能促进植物体内抗性相关酶发生变化[46]。
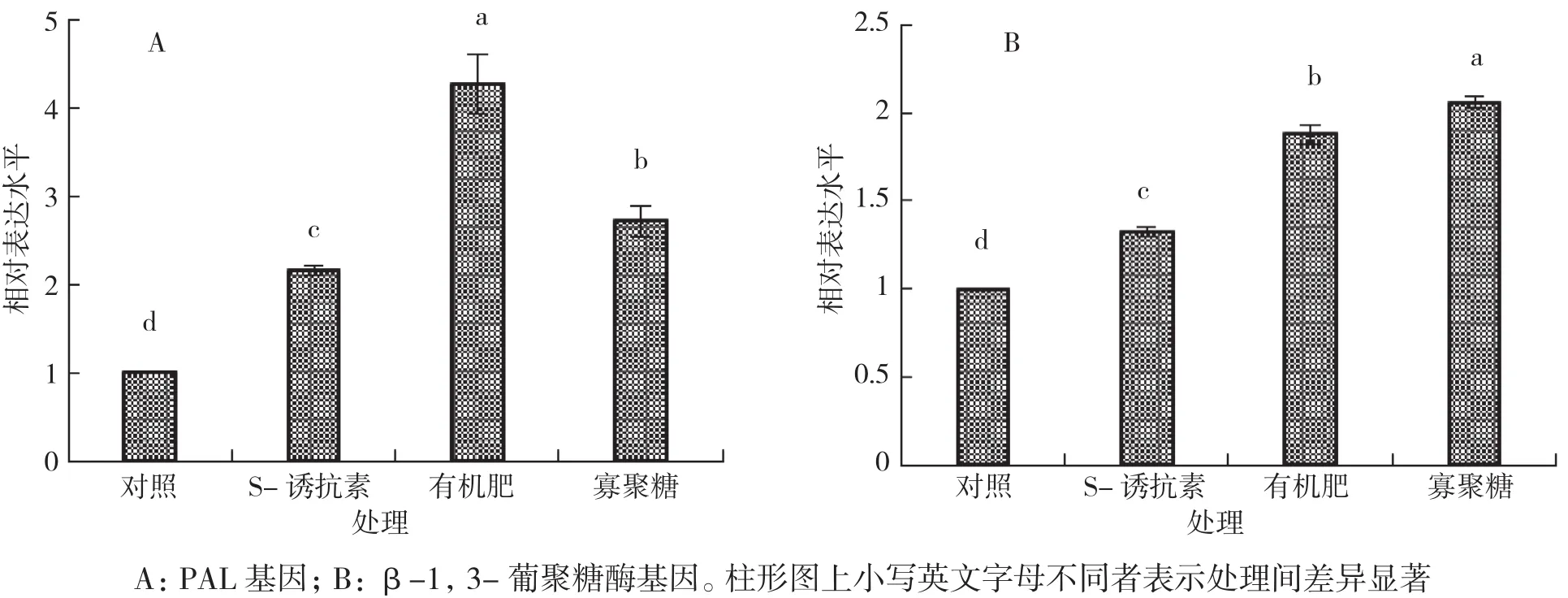
图3 生物物质处理后黄瓜体内PAL基因和β-1,3-葡聚糖酶基因的相对表达量

表3 生物源物质与生防菌复合使用对黄瓜白粉病的防治效果
本研究发现,S-诱抗素虽然可以促进黄瓜植株的营养生长,但不可用于浸种催芽,因为高浓度S-诱抗素浸种侵芽后易产生药害。而供试的3种生物源物质均能促进黄瓜体内抗性相关酶活性的提高,并诱使抗性相关物质含量发生变化,对一些抗性相关基因的表达亦有促进作用。其中,PAL酶是苯丙烷类代谢途径的关键酶与限速酶,POD更是在由酚类聚合为木质素的过程中起重要作用,这些酶活性的增加提高了寄主体内木质素的含量[47]。说明这些生物源物质通过促进黄瓜植株的营养生长,上调其相关抗性基因表达量,改变黄瓜体内抗性物质含量,从而达到控制病害的目的。
[1] 王田利. 我国黄瓜生产的发展变化历程[J]. 西北园艺,2015(6):4-7.
[2] EI-Naggar M A,EI-Deeb H M,Seham R S.Applied approach for controlling powdery mildew disease of cucumber under plastic houses[J].Pakistan Journal of Agriculture Agricultural Engineering and Veterinary Sciences,2012,28(1):54-64.
[3] Cerkauskas R F,Ferguson G. Management of powdery mildew(Podosphaera xanthii)on greenhouse cucumber in Ontario [J]. Canadian Journal of Plant Pathology,2014,36(1):22-37.
[4] 王文桥,张小风,韩秀英,等. 我国北方蔬菜病害抗药性问题及治理对策[J]. 中国蔬菜,2010(23):20-23.
[5] Suthaparan A,Stensvand A,Solhaug K A,et al. Suppression of cucumber powdery mildew by supplemental UV-B radiation in greenhouses canbe augmented or reduced by background radiation quality[J]. Plant Disease,2014,98(4):1349-1357.
[6] 王平,张红梅,金海军,等. 高温闷棚防治黄瓜白粉病及其对黄瓜生长和生理代谢的影响[J]. 上海农业学报,2016,32(2):7-13.
[7] Hamza A M,Essa T A,Derbalah A S,et al.Performance of some fundicide alternatives for controlling powdery mildew on cucumber under greenhouse conditions[J]. Egyptian Journal of Pest Control,2015,25(3):647-654.
[8] Almqvist A C. Biological control of powdery mildew in greenhouse produced cucumber[D]. Uppsala Swedish,Swedish University of Agricultural Sciences,2012.
[9] Zhang Z,Dai G,Zhu G Y,et al. Protective effect of Robinia pseudoacacia Linn1 extracts against cucumber powdery mildew fungus,Sphaerotheca fuliginea[J]. Crop Protection,2008,27(6):920-925.
[10] Masheva S,Lazarova T,Velkov N,et al. Botanical products against powdery mildew on cucumber in greenhouse[J]. Turkish Journal of Agricultural and Natural Sciences,2014,2(SI):1707-1712.
[11] Hamza A M,Essa T A,Derbalah A S,et al.Performance of some fungicide alternatives for controlling powdery mildew on cucumber under greenhouse conditions[J]. Egyptian Journal of Biological Pest Control,2015,25(3):631-637.
[12] Li Y P,Tian S L,Yang X J,et al. Transcriptomic analysis reveals distinct resistant response by physcion and chrysophanol against cucumber powdery mildew[J]. PeerJ,2016,4(5):e1991.
[13] Chen J,Dai G H. Effect of d-Pinitol isolated and identified from Robinia pseudoacacia against cucumber powdery mildew[J]. Scientia Horticultruae,2014,176(2):38-44.
[14] Haggag W M,EI-Gamal N G. Efficiency of the antagonist Tilletiopsis pallescens formulated with some natural oils for biocontrol of the powdery mildew in greenhouse cucumber[J]. Pakistan Journal of Biological Sciences,2015,51(3):252-260.
[15] Lee S Y,Weon H W,Kim J J,et al. Biological control of cucumber powdery mildew by Bacillus amyloliquefaciens M27[J]. The Korean Journal of Mycology,2013,41(4):268-273.
[16] Ferrara G,Mazzeo A,Matarrese A M S,et al.Use of abscisic acid(S-ABA) and sucrose for improving color,anthocyanin content and antioxidant activity of‘Crimsom Seedless’ grape berries[J]. Australian Journal of Grape and Wine Research,2015,21:18-29.
[17] 冯钟慧. S-ABA提高苏打盐碱地水稻抗逆性的研究[D]. 长春:中国科学院研究生院(东北地理与农业生态研究所),2016.
[18] Jia X C,Meng Q S,Zeng H H,et al. Chitosan oligosaccharide induces resistance to Tobacco mosaic virus in Arabidopsis via the salicylic acid mediated signaling pathway[J]. Scientific Reports,2016,6:26144.
[19] Abhayashree M S,Murali M,Thriveni M C,et al. Crude oligosaccharides mediated resistance and histo-chemical changes in Capsicum annuum against anthracnose disease caused by Colletotrichum capsici[J]. Plant Biosystems,2017,151(2):221-233.
[20] 李想,张宝娟,李继泉,等. 保水剂与有机肥配施对铁尾矿理化性质的改良作用[J]. 应用生态学报,2017,28(2):554-562.
[21] 刘红江,陈虞雯,孙国锋,等. 有机肥-无机肥不同配施比例对水稻产量和农田养分流失的影响[J]. 生态学杂志,2017,36(2):405-412.
[22] 孔凡明,许志刚. 水稻不育系抗白枯病与体内酶活性变化的关系[J]. 安徽农业大学学报,1998,25(3):217-223.
[23] 李靖,利容千,袁文静. 黄瓜感染霜霉病菌叶片中一些酶活性的变化[J]. 植物病理学报,1991,21(4):277-283.
[24] 邹琦. 植物生理学实验指导[M]. 北京:中国农业出版社,2000.
[25] 张妙霞,孔祥生,郭秀璞,等. 蒽酮法测定可溶性糖显色条件的研究[J]. 洛阳农专学报,1997,17(4):24-28.
[26] 陈建勋,王晓峰. 植物生理学实验指导[M]. 广州:华南理工大学出版社,2006.
[27] 波钦诺克XH. 邢家海等译. 植物生物化学分析法[M]. 北京:北京科学出版社,1981.
[36] Wan H J,Zhao Z H,Qian C T,et al. Selection of appropriate reference genes for gene expression studies by quantitative real-time polymerase chain reaction in cucumber[J]. Analytical Biochemistry,2010,399(2):257-261.
[29] 陈夕军,沈世炜,陈银凤,等. 氯化胆碱诱导黄瓜抗白粉病机理研究[J]. 中国蔬菜,2013,18:81-87.
[30] Hubert J,Unzbergov Z,Santino A. Plant volatile aldehydes as natural insecticides against storedproduct beetles[J]. Pest Management Science,2008,64(3):57-64.
[31] Singh J S,Strong P J. Biologically derived fertilizer:A multifaceted bio-tool in methane mitigation[J]. Ecotoxicology & Environmental Safety,2016,124:267-276.
[32] 汤日圣,唐现洪,钟雨,等. 生物源脱落酸(ABA)提高茄苗抗旱能力的效果及机理[J].江苏农业学报,2006,22(1):10-13.
[33] 郭默然. 牛蒡低聚果糖诱导烟草系统抗性的表达谱分析及信号转导机制的研究[D]. 济南:山东大学,2014.
[34] 尉婷婷,程智慧,冯武焕. 大蒜鳞茎粗提物对番茄灰霉病的抑菌和防治效果[J]. 西北农业学报,2010,19(6):176-180.
[35] 刘世会,赵德刚,宋宝安. 杜仲抗菌蛋白对番茄灰霉病菌的抑制作用[J]. 农药,2008,47(11):836-838.
[36] 乔树华,蒋红云,张燕宁,等. 石榴皮萃取物对番茄灰霉病菌的抑制作用及防病效果[J]. 植物保护,2010,36(1):148-150.
[37] 王树桐,曹克强,张凤巧,等. 中药丁香提取物对番茄灰霉病菌抑制作用及生防效果[J]. 植物病理学报,2005,35(6):91-94.
[38] Zhao S,Chen X,Deng S P,et al. The effects of fungicide,soil fumigant,bio-organic fertilizer and their combined application on chrysanthemum Fusarium wilt controlling,soil enzyme activites and microbial properties[J].Melecules,2016,21:526-540.
[39] Xu L,Ren L,Chen K R,et al. Putative role of IAA during the early response of Brassica napus L. to Plasmodiophora brassicae[J]. European Journal of Plant Pathology,2016,145(3):601-613.
[40] 吴焜玥,张燕. S-诱抗素和新奥霉素在日光温室黄瓜栽培中的应用研究[J]. 农业科学研究,2013,34(4):39-42.
[41] 钟书堂,沈宗专. 生物有机肥对连作蕉园香蕉生产和土壤可培养微生物区系的影响[J]. 应用生态学报,2015,26(2):481-489.
[42] Rizk F A,Shaheen A M,Abd EI-Samad E H,et al. Response of onion plants to organic fertilizer and foliar spraying of some micronutrients under sandy soil conditions[J]. Journal of Applied Sciences Research,2014,10(5):383-392.
[43] 罗立津,徐福乐,翁华钦,等. 脱落酸对甜椒幼苗抗寒性的诱导效应及其机理研究[J]. 西北植物学报,2011,31(1):94-100.
[44] 丁新伦,张孟倩,谢荔岩,等. 实时荧光定量PCR检测RSV胁迫下抗病、感病水稻中与脱落酸相关基因的差异表达[J]. 激光生物学报,2008,17(4):464-469.
[45] Jannoura R,Joergensen R G,Bruns C. Organic fertilizer effects on growth,crop yield,and soil microbial biomass indices in sole and intercropped peas and oats under organic farming conditions[J]. European Journal of Agronomy,2014,52(1):259-270.
[46] Elsayed A L,Rafudeen M S,Golldack D.Physiological aspects of raffinose family oligosaccharides in plants:protection against abiotic stress[J]. Plant Biology,2014,16(1):1-8.
[47] Javad N D M,Ahmad K,Mostafa A,et al. Effect of postharvest pulse treatment of salicylic acid on phenylalanine ammonia-lyase activity(PAL),lignin formation and stem bending disorder of gerbera cut flowers[J]. Iranian Journal of Horticultural Sciences,2015,46(2):279-290.
(责任编辑 白雪娜)
Effects of three kinds of biogenic materials on growth promoting and disease controlling of cucumber
ZHANG Yun1,ZHANG Xiao-ran1,CHEN Xi-jun1,CHEN Xiao-ren1,ZHANG Qing2,WEI Li-hui3,HUANG Ben-li1
(1. Horticulture and Plant Protection College,Yangzhou University,Yangzhou 225009,China;2. Suzhou Academy of Agricultural Sciences,Suzhou 215155,China;3. Institute of Plant Protection,Jiangsu Academy of Agricultural Sciences,Nanjing 210014,China)
S436.5
A
1004-874X(2017)06-0096-08
张云,张孝然,陈夕军,等.3种生物源物质对黄瓜的促生与防病作用[J].广东农业科学,2017,44(6):96-103.
2017-04-21
国家公益性行业(农业)科研专项(201403032);江苏省农业科技自主创新资金(CX(15)1037);江苏省“三新”工程项目(SXGC2016087)
张云(1992-),女,在读硕士生,E-mail:1209959001@qq.com
陈夕军(1974-),男,博士,副教授,E-mail:xjchen@yzu.edu.cn
