茉莉酸甲酯对甘草根次生代谢的调控
2017-10-12梁晓薇程轩轩唐晓敏潘利明张春荣
梁晓薇,杨 全,李 丹,程轩轩,唐晓敏,潘利明,张春荣
(广东药科大学中药学院/国家中医药管理局岭南药材生产与开发重点研究室,广东 广州 510006)
茉莉酸甲酯对甘草根次生代谢的调控
梁晓薇,杨 全,李 丹,程轩轩,唐晓敏,潘利明,张春荣
(广东药科大学中药学院/国家中医药管理局岭南药材生产与开发重点研究室,广东 广州 510006)
为探讨茉莉酸甲酯(MeJA)对甘草根次生代谢的调控及其机制,分别用20、50、100 μmol/L的MeJA喷施甘草叶片,高效液相色谱法测定甘草根中甘草酸和甘草苷等有效成分含量,实时荧光定量PCR法分析甘草根次生代谢途径重要酶β-香树脂醇合酶(GubAS)、β-香树脂醇-11-氧化酶(GubAO)、6-脱氧查尔酮合酶(GuDOCS)基因的相对表达水平。结果表明,20、50 μmol/L MeJA溶液处理的甘草酸含量得到极显著提高,100 μmol/L MeJA溶液处理的甘草酸含量与对照无显著差异;20、50 μmol/L MeJA溶液对甘草苷的积累没有显著影响,而100 μmol/L MeJA溶液处理的甘草苷含量降低。20 μmol/L MeJA溶液处理甘草0~6 h对GubAS、GuDOCS基因的表达均有促进作用,处理2~6 h对GubAO的表达也有促进作用;50 μmol/L MeJA溶液处理0~2 h对GubAS、GubAO、GuDOCS基因的表达水平都有提高作用,但随着处理时间延长,3个基因表达均恢复处理前水平;100 μmol/L MeJA溶液对GubAS和GubAO表达均无显著影响,GuDOCS表达量在100 μmol/L MeJA溶液处理2 h时得到提高,随后逐渐下降,并在处理24 h后出现降低现象。推断中低浓度MeJA在处理初期对甘草有效成分生物合成水平有上调的作用,随着处理浓度提高与时间延长,MeJA的促进作用逐渐减弱,甚至出现抑制现象。
甘草;茉莉酸甲酯;基因表达;次生代谢
Abstract:To investigate the regulation mechanism of methyl jasmonate (MeJA) on secondary metabolism of Glycyrrhiza uralensis root,the G. uralensis seedlings were treated by 20,50,100 μmol/L MeJA. After 9 d,the contents of active ingredients in G. uralensis roots were detected by high performance liquid chromatography(HPLC). And the expression patterns of key enzymes on biosynthetic pathway in G. uralensis roots treated by MeJA for 0,2,6,12,24,36,72 h were analyzed by real-time PCR. The results showed that the contents of glycyrrhizic acid in G. uralensis roots improved in both middle and low concentrations of MeJA,whereas the contents of liquiritin reduced in high concentrations of MeJA. The expression of GubAS,GubAO in G. uralensis roots were promoted by 20 and 50 μmol/L MeJA,and the expression of GuDOCS was promoted by 20 μmol/L MeJA. However,100 μmol/LMeJA suppressed GubAS and GuDOCS expression. All three genes expression reached the highest level at 6 h under the induction of 20 μmol/L MeJA. It can be concluded that MeJA in middle and low concentrations have the upregulation effect on biosynthesis of glycyrrhizic acid. However only low concentration can promote the biosynthesis of liquiritin.
Key words:Glycyrrhiza uralensis Fisch;methyl jasmonate;gene expression level;secondary metabolism
甘草(Glycyrrhiza uralensis Fisch.)为豆科多年生草本植物,其根及根茎为常用中药,具有补脾益气、清热解毒、祛痰止咳、缓急止痛、调和诸药的功效[1],被广泛用于食品、化妆品等领域。市场对甘草的大量需求导致野生资源枯竭,同时人工栽培的商品甘草良莠不齐,有的甚至低于《中国药典》要求[2],如何提高栽培甘草的品质成为目前甘草行业亟需解决的关键问题。
甘草有效成分主要是甘草苷为主的黄酮类化合物和甘草酸为主的三萜皂苷类化合物,二者也是《中国药典》评价甘草品质的主要指标[1]。甘草苷和甘草酸具有抗氧化[3]、抗病毒[4]、抗炎[5]等生物活性,是甘草适应生存环境的物质基础。甘草为阳生旱生植物,适度干旱胁迫能够促进甘草根中甘草苷和甘草酸的积累[6-7]。我们对适度干旱胁迫下甘草根的转录组进行测序和分析发现,适度干旱胁迫能够促进茉莉酸生物合成和信号转导途径关键因子的基因表达,暗示茉莉酸参与甘草的次生代谢和抗旱适应[8]。
茉莉酸及茉莉酸甲酯(methy jasmonate,MeJA)是参与植物抗逆特别是抗虫胁迫的植物激素,外施到植物体可以调控植物次生代谢产物的积累[9-10]。我们在前期研究基础上研究不同浓度MeJA处理对甘草根有效成分甘草酸和甘草苷的积累,以及MeJA对甘草有效成分生物合成途径关键酶β-香树脂醇合酶(β-amyrin synthase,GubAS)[11]、β- 香树脂醇 -11- 氧化酶(β-amyrin 11-oxidase,GubAO)[12]和 6-脱氧查尔酮合酶(6' -deoxychalcone synthase,GuDOCS)[13]基因表达的影响,探讨MeJA对甘草根次生代谢的调控及其分子机制。研究结果有助于揭示甘草在干旱环境中通过茉莉酸调控有效成分积累的机制,同时为应用化学调控提高甘草品质提供科学依据。
1 材料与方法
1.1 试验材料
甘草种子采自内蒙古杭锦旗4年生甘草,经北京中医药大学魏胜利老师鉴定为甘草(Glycyrrhiza uralensis Fisch.)的种子。种子萌发后,将幼苗移栽至营养土∶沙子∶土壤=2∶2∶1(体积比)的花盆中,按常规方法栽培。
茉莉酸甲酯(美国Sigma公司);RNAprep Pure多糖多酚植物总RNA提取试剂盒(天根公司);PrimeScript RT Master Mix (Perfect Real Time)、SYBR Premix Ex Taq II (Tli RNaseH Plus,大连宝生物工程有限公司);CFX96荧光定量PCR仪(美国Bio-Rad公司)。
1.2 试验方法
1.2.1 MeJA处理甘草 甘草栽培6个月后,用20、50、100 μmol/L的MeJA溶液喷施叶片,0、2、6、12、24、36、72 h后取部分甘草根快速洗净后用液氮速冻,-80℃保存,用于基因表达水平测定。剩余甘草每3 d喷施一次MeJA溶液,连续处理3次,药后9 d取根和根茎阴干,用于甘草根有效成分含量测定。每个处理3次重复。
1.2.2 甘草酸和甘草苷含量测定 取甘草干燥样品,粉碎后过三号筛,精密称定0.2 g加入100 mL 70 %乙醇,称定重量,超声提取30 min后补足重量,过滤取滤液作为供试品溶液。参照《中国药典》采用高效液相色谱法测定甘草酸和甘草苷含量[1]。
1.2.3 基因表达量测定 (1)甘草根总RNA提取和反转录 将MeJA溶液处理0、2、6、12、24、36、72 h的甘草根使用多糖多酚植物总RNA提取试剂盒提取总RNA,琼脂糖凝胶电泳检测RNA质量。采用PrimeScript RT Master Mix试剂盒,参照说明书的方法进行反转录,获得第一链cDNA。
(2)实时荧光定量PCR(qPCR) 根据本课题组甘草根转录组测序得到的GubAS、GubAO、GuDOCS基因序列[10]设计引物(表1)。采用 SYBR Premix Ex TaqII(Tli RNaseH Plus)试剂盒和CFX96荧光定量PCR仪进行qPCR。PCR 扩增程序:95℃,30 s;95℃,5s;58℃,30 s;39个循环。以管家基因β-Tubulin的表达量作参照,采用2﹣△△Ct法计算基因相对表达量。

表1 实时荧光定量PCR引物序列
2 结果与分析
2.1 MeJA对甘草根中甘草酸和甘草苷积累的调控
由图1可知,MeJA溶液处理甘草根对其有效成分甘草酸含量有显著效果,特别是浓度为20、50 μmol/L MeJA溶液处理的甘草酸浓度与对照相比有极显著提高。20 μmol/L MeJA溶液对甘草苷的含量没有显著影响,高浓度MeJA溶液处理下甘草苷含量显著降低。

图1 MeJA浓度对甘草根有效成分积累的影响
2.2 MeJA对甘草根次生代谢关键酶基因表达水平的调控
2.2.1 荧光定量PCR标准曲线的建立 图2为目的基因GubAS、GubAO、GuDOCS和内参基因β-Tubulin标准曲线,其中扩增效率与相关系数见表2。在检测样品5个浓度梯度中,扩增效率结果表明内参基因和目的基因的扩增效率都在90%~105%范围。相关系数大于0.98表明Ct值与起始模板稀释倍数的相关性良好,目的基因和内参基因扩增效率符合2-△△Ct法计算相对表达量的条件。

表2 目的基因与内参基因的扩增效率和相关系数
2.2.2 甘草根次生代谢关键酶基因表达水平 从GubAS基因表达量的变化(图3 A)可知,20 μmol/L MeJA溶液处理0~6 h与50 μmol/L MeJA溶液处理0~2 h均对甘草根GubAS基因表达有不同程度的促进作用,其中20 μmol/L MeJA溶液处理6 h的甘草中,GubAS基因表达量与起始表达量相比有极显著提高,且随处理时间的延长,中低浓度的MeJA处理组中GubAS基因表达逐渐恢复处理前水平;100 μmol/L MeJA溶液对GubAS基因表达没有显著作用。
对于GubAO基因(图3B),20 μmol/L MeJA溶液处理0~6 h与50 μmol/L MeJA溶液处理0~2 h均促进其表达,在20 μmol/L MeJA溶液处理6 h的甘草根中GubAO基因表达量得到极显著提高,随后逐渐恢复至处理前水平;100 μmol/L MeJA溶液处理下GubAO基因与起始表达量相比无显著性差异。

图2 目的基因GubAS(A)、GubAO(B)、GuDOCS(C)与内参基因β-Tubulin(D)的qPCR标准曲线
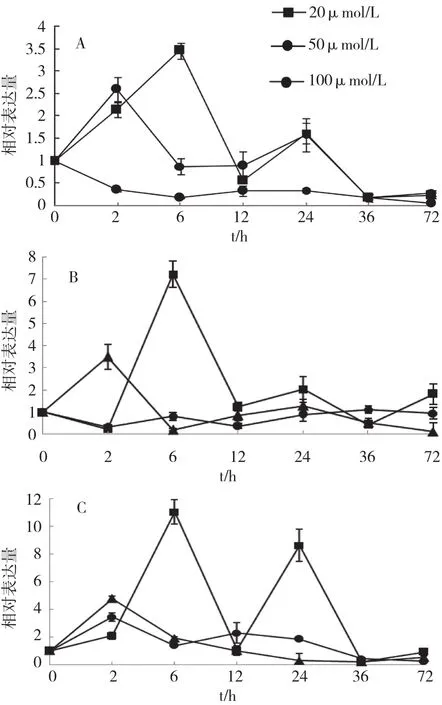
图3 MeJA处理浓度和时间对甘草根GubAS(A)、GubAO(B)、GuDOCS(C)基因表达的调控
由图3C可知,20 μmol/L的MeJA溶液处理0~6 h促进GuDOCS基因表达,其中20 μmol/L MeJA溶液诱导6 h的GuDOCS基因表达量得到极显著提高;50 μmol/L MeJA溶液处理对GuDOCS基因表达没有明显的促进作用,100 μmol/L MeJA溶液处理2 h后促进甘草根中GuDOCS基因表达,24 h后出现抑制GuDOCS基因表达的现象。
3 结论与讨论
已有研究表明,施用MeJA等植物生长调节剂能有效提高栽培药用植物的品质[14-16]。外施MeJA能对植物产生与逆境胁迫相似的作用:激活植物体内茉莉酸信号途径,诱发防御基因表达,引起系统诱导型抗性[17]。在此过程中,MeJA可调节植物次生代谢相关基因的表达从而促进某些产物的合成和积累:Mangas[18]研究发现,MeJA能促进积雪草三萜类化合物的合成,但抑制植物甾醇的合成;行玉冰等[19]发现MeJA调节丹参代谢相关酶的表达,促进迷迭香酸的合成;Dai等[20]研究发现,MeJA能提高猴头菌的生物量及麦角甾醇的含量;Liu等[21]通过对何首乌转录组分析表明,MeJA能显著影响何首乌有效成分生物合成多个基因的表达。
本试验研究了外源MeJA对甘草根中甘草酸和甘草苷的含量及其对应的生物合成途径相关酶基因表达的调控作用,结果表明20、50 μmol/L MeJA溶液处理后的甘草根中甘草酸含量得到极显著提高;同时GubAS和GubAO作为甘草酸等三萜类化合物生物合成途径的关键基因,在20 μmol/L MeJA溶液诱导中表达量存在不同程度提高,其中在该浓度下诱导6 h后的表达量达到极显著提高。推断中低浓度的MeJA溶液在处理初期对甘草酸的合成和积累具有促进作用,随着MeJA溶液浓度的提高与处理时间的延长,MeJA对甘草酸生物合成的上调作用逐渐减弱。同样,结合MeJA溶液对甘草苷含量及其生物合成途径中下游基因GuDOCS基因表达量的影响,分析发现低浓度MeJA溶液在处理初期对甘草根中GuDOCS基因的表达存在促进作用,但未体现甘草苷含量的提高,且随着MeJA浓度提高与处理时间延长,甘草苷的合成与积累受到抑制,因此可初步推断MeJA对甘草苷的作用不明显。
植物次生代谢途径及其调控网络十分复杂,本研究发现外源MeJA通过调控甘草有效成分生物合成途径相关基因的表达,对不同有效成分的合成和积累有不同的调控效果,更深入的调控机制仍需后续研究。本研究为化学调控提高栽培甘草的品质奠定了基础,也为甘草资源的保护与可持续利用提供可行的途径。
[1] 国家药典委员会. 中华人民共和国药典·一部[S]. 北京:中国医药科技出版社,2015:86.
[2] 魏胜利,王文全,王继永,等. 我国不同产区野生与栽培甘草的甘草酸含量及其影响因子的初步研究[J]. 中国中药杂志,2012,37(10):1341-1345.
[3] 崔誉蓉,陈朋,刘军花,等. 4种甘草黄酮类化合物抗氧化构效关系研究[J]. 时珍国医国药,2010,21(12):3041-3043.
[4] Song W,Si L,Ji S,et al. Uralsaponins M-Y,antiviral triterpenoid saponins from the roots of Glycyrrhiza uralensis[J]. J Nat Prod,2014,77(7):1632-1643.
[5] Kim K R,Jeong C K,Park K K,et al. Anti-Inflammatory Effects of Licorice and Roasted Licorice Extracts on TPA-Induced Acute Inflammation and Collagen-Induced Arthritis in Mice[J]. Journal of Biomedicine &Biotechnology,2014,2010(1110-7243):709378.
[6] 唐晓敏. 水分和盐分处理对甘草药材质量的影响[D]. 北京:北京中医药大学,2008.
[7] Li W D,Hou J L,Wang W Q,et al. Effect of water deficit on biomass production and accumulation of secondary metabolites in roots of Glycyrrhiza uralensis[J]. Russ J Plant Physiol,2011,58(3):538-542.
[8] 张春荣,桑雪雨,渠萌,等. 基于转录组测序揭示适度干旱胁迫对甘草根基因表达的调控[J]. 中国中药杂志,2015,40(24):4817-4823.
[9] Pastý ì Rová A,Repč ák M,Eliašová A. Salicylic acid induces changes of coumarin metabolites in Matricaria chamomilla L.[J]. Plant Science,2004,167(4):819-824.
[10] 宋西红,郝磊,吕晓玲,等. 紫苏肉桂酸4-羟基化酶基因的克隆与表达[J]. 广东农业科学,2015,42(11):124-129.
[11] Chen H,Liu Y,Zhang X,et al. Cloning and characterization of the gene encoding β-amyrin synthase in the glycyrrhizic acid biosynthetic pathway in Glycyrrhiza uralensis[J]. Acta Pharmaceutica Sinica B,2013,3(6):416-424.
[12] Seki H,Ohyama K,Sawai S,et al. Licorice β-amyrin 11-oxidase,a cytochrome P450 with a key role in the biosynthesis of the triterpene sweetener glycyrrhizin[J]. Proc Natl Acad Sci U S A,2008,105(37):14204-14209.
[13] Debashree S,Dhiraj N,Attipalli R. Plant aldoketo reductases(AKRs)as multi-tasking soldiers involved in diverse plant metabolic processes and stress defense:A structure-function update[J].J Plant Physiol,2015,179:40-55.
[14] 吴晓玲,杨小萍. 不同处理对甘草生长特性及甘草酸含量的影响[J]. 江苏农业科学,2013,41(10):219-221.
[15] 李丽,董银卯,姚霞,等. 茉莉酸甲酯对植物酚类成分代谢影响进展[J]. 中药材,2014,37(11):2109-2112.
[16] 田娇,刘园,房敏峰,等. 外源茉莉酸类激素对药用植物次生代谢的影响研究[J]. 天然产物研究与开发,2015,27:185-190.
[17] Mehari ZH,Elad Y,Rav-David D,et al.Induced systemic resistance in tomato(Solanum lycopersicum)against Botrytis cinerea by biochar amendment involves jasmonic acid signaling[J].Plant Soil,2015,395(1):31-44.
[18] Mangas S,Bonfill M,Osuna L,et al. The effect of methyl jasmonate on triterpene and sterol metabolisms of Centella asiatica,Ruscus aculeatus and Galphimia glauca cultured plants[J]. Phytochemistry,2006,67(18):2041-2049.
[19] 行冰玉,党小琳,张婧一,等. 茉莉酸甲酯对丹参培养细胞中迷迭香酸生物合成及相关酶活性的影响[J]. 植物生理学报,2013,49(12):1326-1332.
[20] Dai X,Zhan Y,Zhang J,et al. Regulatory effect of salicylic acid and methyl jasmonate supplementation on ergosterol production in Hericium erinaceus mycelia[J]. J For Res,2015,26(1):71-77.
[21] Liu H,Wu W,Hou K,et al,Transcriptome changes in Polygonum multiflorum Thunb. roots induced by methyl jasmonate[J]. J Zhejiang Univ Sci B,2015,16(12):1027-1041.
(责任编辑 白雪娜)
Regulation of methyl jasmonate on secondary metabolism of Glycyrrhiza uralensis root
LIANG Xiao-wei,YANG Quan,LI Dan,CHENG Xuan-xuan,TANG Xiao-min,PAN Li-ming,ZHANG Chun-rong
(School of Traditional Chinese Medicines,Guangdong Pharmaceutical University/Key Laboratory of State Administration of Traditional Chinese Medicine for Production& Development of Cantonese Medicinal Materials,Guangzhou 510006,China;
R932
A
1004-874X(2017)06-0057-06
梁晓薇,杨全,李丹,等.茉莉酸甲酯对甘草根次生代谢的调控[J].广东农业科学,2017,44(6):57-62.
2016-10-21
国家自然科学基金(811173488);中医药行业科研专项(201207002);中国中医科学院中药研究所项目(2011ZDXK-01);广东省中医药局建设中医药强省科研项目(20142090)
梁晓薇(1991-),女,硕士,E-mail:1329509951@qq.com
张春荣(1976-),男,博士,讲师,E-mail:zhangchunr@21cn.com
