基于ISSR标记的猕猴桃品种遗传多样性分析及指纹图谱构建
2017-10-12张安世韩臣鹏齐秀娟张中海
张安世, 韩臣鹏, 齐秀娟, 张中海
(1. 焦作师范高等专科学校理工学院, 河南 焦作 454000; 2. 郑州绿博园管理中心, 河南 郑州 451470;3. 中国农业科学院郑州果树研究所, 河南 郑州 450009)
基于ISSR标记的猕猴桃品种遗传多样性分析及指纹图谱构建
张安世1,①, 韩臣鹏2, 齐秀娟3, 张中海1
(1. 焦作师范高等专科学校理工学院, 河南 焦作 454000; 2. 郑州绿博园管理中心, 河南 郑州 451470;3. 中国农业科学院郑州果树研究所, 河南 郑州 450009)
采用ISSR标记对中华猕猴桃(ActinidiachinensisPlanch.)、美味猕猴桃〔A.chinensisvar.deliciosa(A. Chev.) A. Chev.〕、软枣猕猴桃〔A.arguta(Sieb. et Zucc.) Planch. ex Miq.〕和毛花猕猴桃(A.erianthaBenth.)的32个样本进行了遗传多样性分析,并以ISSR标记为基础构建了DNA指纹图谱。结果表明:筛选的10个多态性高且条带清晰的引物共扩增出200个条带(位点),其中,多态性位点195个,多态性位点百分率(PPL)达97.50%;各引物的多态性信息含量(PIC)以及供试样本的观测等位基因数(Na)、有效等位基因数(Ne)、Nei’s基因多样性指数(H)和Shannon’s多样性指数(I)的总均值分别为0.908 0、1.980 0、1.356 9、0.225 5和0.361 3,4个猕猴桃种间的遗传分化系数(Gst)为0.414 6,基因流(Nm)为0.705 9,且32个样本间的Na、Ne、H和I值差异极显著(P<0.001)。供试32个样本间的遗传相似系数(GS)为0.565 0~0.965 0,平均值为0.716 4;基于GS值进行UPGMA聚类分析,在GS值为0.76处将32个样本分为4组,基本对应供试的4个猕猴桃种类,其中,第Ⅰ组的大多数样本属于美味猕猴桃品种,第Ⅱ组的样本均属于中华猕猴桃品种,第Ⅲ组的样本属于毛花猕猴桃品种,第Ⅳ组的样本均属于软枣猕猴桃品种。分子方差分析结果表明:4个猕猴桃的种间变异占总变异的40.84%,种内变异占总变异的59.16%。研究结果表明:供试的猕猴桃品种间遗传分化程度较高,基因交流频率较低,且总遗传变异的近60%存在于种内,说明供试的猕猴桃品种具有较丰富的遗传多样性。另外,根据10个ISSR引物的扩增结果,筛选出引物UBC818、UBC824、UBC854和UBC895扩增的15个多态性位点构建的DNA指纹图谱可用于供试32个猕猴桃样本的鉴定。
猕猴桃; ISSR标记; 遗传多样性; 聚类分析; DNA指纹图谱
Abstract: Genetic diversity of 32 samples ofActinidiachinensisPlanch.,A.chinensisvar.deliciosa(A. Chev.) A. Chev.,A.arguta(Sieb. et Zucc.) Planch. ex Miq. andA.erianthaBenth. were analyzed by using ISSR marker, and DNA fingerprinting was constructed based on ISSR marker. The results show that 200 bands (loci) are amplified by 10 primers screened with high polymorphic and clear band, in which, there are 195 polymorphic loci with percentage of polymorphic loci (PPL) of 97.50%. The overall averages of polymorphism information content (PIC) of each primer, observed number of alleles (Na), effective number of alleles (Ne), Nei’s gene diversity index (H) and Shannon’s diversity index (I) of samples tested are 0.908 0, 1.980 0, 1.356 9, 0.225 5 and 0.361 3, respectively. The genetic differentiation coefficient (Gst) and gene flow (Nm) of four species inActinidiaLindl. are 0.414 6 and 0.705 9, respectively. The differences inNa,Ne,HandIvalues among 32 samples are extremely significant (P<0.001). The genetic similarity coefficient (GS) among 32 samples tested is 0.565 0-0.965 0 with average of 0.716 4. UPGMA cluster analysis is carried out according to GS value, and 32 samples are divided into four groups at GS value of 0.76, which correspond to the four species inActinidiatested. Among them, most of samples in group Ⅰ belong to cultivars ofA.chinensisvar.deliciosa, samples in group Ⅱ belong to cultivars ofA.chinensis, sample in group Ⅲ belongs to cultivar ofA.eriantha, and samples in group Ⅳ belong to cultivars ofA.arguta. The results of molecular variance analysis show that interspecies variation of four species inActinidiaaccounts for 40.84% of the total variation, while intraspecies variation accounts for 59.16% of the total variation. It is suggested that cultivars ofActinidiaspp. tested have high degree of genetic differentiation and low gene exchange frequency, and nearly 60% of the total genetic variation is existed in species, indicating that there is abundant genetic diversity in cultivars ofActinidiaspp. tested. In addition, 15 polymorphic loci amplified by primers UBC818, UBC824, UBC854 and UBC895 are screened based on amplification result of ten ISSR primers, and DNA fingerprinting is constructed, which can be used to identify 32 samples ofActinidiaspp. tested.
Keywords:Actinidiaspp.; ISSR marker; genetic diversity; cluster analysis; DNA fingerprinting
猕猴桃属(ActinidiaLindl.)植物为多年生藤本,雌雄异株;现有54种21变种[1],绝大部分为中国特有种类,故亦称为中国半特有属[2]。该属部分种类的果实为知名水果,在中国的种植面积和市场需求不断扩大,其中,中华猕猴桃(A.chinensisPlanch.)和美味猕猴桃〔A.chinensisvar.deliciosa(A. Chev.) A. Chev.〕种植最为广泛,软枣猕猴桃〔A.arguta(Sieb. et Zucc.) Planch. ex Miq.〕在部分地区也已开始商业栽培。在猕猴桃种植业发展过程中,人们已经根据不同的需求培育出大量的栽培品种,特别是近年来随着猕猴桃产业的快速发展,异地间的品种交换日趋频繁,导致猕猴桃品种混杂[3],存在“同名异物”或“同物异名”的现象,不利于猕猴桃品种的推广应用和鉴定,因此,有必要对不同猕猴桃品种的遗传特性进行深入研究。
ISSR(inter-simple sequence repeat)分子标记技术[4]具有引物通用性强、利用率高、操作简便和重复性强等优点,在植物的遗传多样性、系统进化、DNA指纹图谱及核心种质构建等方面已得到广泛的应用[5-9],目前,ISSR标记已成功应用于猕猴桃种质资源研究[10-11]。为明晰国产猕猴桃品种的起源,探寻准确区分猕猴桃品种遗传特性的方法,作者借鉴前人的研究结果,以国产32个猕猴桃样本(包括5个品种的雄株)为研究对象,利用ISSR标记进行遗传多样性和亲缘关系分析,并在此基础上构建DNA指纹图谱,以期为猕猴桃种质资源的保护利用和新品种选育等提供科学依据。
1 材料和方法
1.1 材料
供试材料均来源于中国农业科学院郑州果树研究所猕猴桃选种圃(地理坐标为东经113°42′36″、北纬34°42′36″),共4种32个样本(包括27个品种的雌株和5个品种的雄株),分别为美味猕猴桃品种‘徐香’(‘Xuxiang’)、‘金魁’(‘Jinkui’)、‘金魁’雄株、‘皖翠’(‘Wancui’)、‘金硕’(‘Jinshuo’)、‘中猕2号’(‘Zhongmi 2’)、‘海艳’(‘Haiyan’)、‘米良1号’(‘Miliang 1’)、‘海沃德’(‘Hayward’)和‘布鲁诺’(‘Bruno’);中华猕猴桃品种‘翠玉’(‘Cuiyu’)、‘红阳’(‘Hongyang’)、‘黄阳’(‘Huangyang’)、‘黄阳’雄株、‘晚红’(‘Wanhong’)、‘楚红’(‘Chuhong’)、‘早金’(‘Hort16A’)、‘金艳’(‘Jinyan’)、‘琼浆’(‘Qiongjiang’)、‘豫皇1号’(‘Yuhuang 1’)和‘湘吉红’(‘Xiangjihong’);软枣猕猴桃品种‘红宝石星’(‘Ruby star’)、‘红宝石星’雄株、‘软红’(‘Ruanhong’)、‘红贝’(‘Hongbei’)、‘红贝’雄株、‘华红1号’(‘Huahong 1’)、‘华红2号’(‘Huahong 2’)、‘魁绿’(‘Kuilü’)和‘桓优1号’(‘Huanyou 1’);毛花猕猴桃(A.erianthaBenth.)品种‘华特’(‘Huate’)和‘华特’雄株。所有供试植株株龄均为7 a,每个样本随机选取3株,每株采集2枚健康的幼叶,置于-80 ℃超低温冰箱中保存、备用。
主要仪器:Biofuge Primo R型冷冻离心机(美国Thermo Fisher Scientific公司)、PTC-200型 PCR仪(美国Bio-Rad公司)、NanoDrop 1000紫外分光光度计(美国Thermo Fisher Scientific公司)和G:BOX-HR凝胶成像系统(美国Syngene公司)。主要试剂2×TaqMasterMix(含TaqDNA聚合酶、2×TaqPCR buffer、3 mmol·L-1MgCl2和400 μmol·L-1dNTP Mix)和DL2000 DNA Marker均购自北京康为世纪生物科技有限公司;ISSR引物参照加拿大哥伦比亚大学(UBC)公布的序列,由金唯智生物科技(北京)有限公司合成。
1.2 方法
1.2.1 基因组DNA提取 每个样本取3枚幼叶,混合,采用改良CTAB法[12]提取基因组DNA,并用质量体积分数0.8%琼脂糖凝胶电泳和NanoDrop 1000紫外分光光度计检测其质量和浓度。用TE缓冲液将DNA稀释至20 ng·μL-1,于-20 ℃保存、备用。
1.2.2 ISSR-PCR扩增 选用40个ISSR引物进行扩增反应。反应体系总体积10.0 μL,包含0.4 μL DNA、1.0 μL引物、5.0 μL 2×TaqMasterMix和3.6 μL RNase-Free water。扩增程序为:94 ℃预变性5 min;94 ℃变性1 min、退火1 min(退火温度依引物而定)、72 ℃延伸1.5 min,循环40次;最后于72 ℃延伸10 min。扩增产物于4 ℃保存,并用质量体积分数1.5%琼脂糖凝胶电泳分离。
1.3 数据统计及分析
对上述40个ISSR引物的扩增条带进行比较,从中筛选出10个多态性高且条带清晰的引物,并对各引物的扩增条带进行统计分析,有条带记为“1”、无条带记为“0”,并据此构建“1”和“0”矩阵。利用POPGENE 1.32软件进行32个猕猴桃样本的遗传多样性参数分析,计算多态性位点百分率(PPL)、观测等位基因数(Na)、有效等位基因数(Ne)、Nei’s基因多样性指数(H)、Shannon’s多样性指数(I)、基因流(Nm)和遗传分化系数(Gst)以及遗传相似系数(GS)和遗传距离(GD),并利用SPSS 17.0软件对Na、Ne、H和I值进行非参数Kruskal Wallis Test独立样本检验。采用GenALEx 6.5软件进行分子方差分析(AMOVA)。参照黄秀等[13]的方法计算各引物的多态性信息含量(PIC),采用NTSYS-pc 2.0软件构建UPGMA聚类图;同时,参照张林等[14]的方法构建32个猕猴桃样本的DNA指纹图谱,并采用G:BOX-HR凝胶成像系统中的Genetool软件计算各条带的片段长度。
2 结果和分析
2.1 ISSR扩增结果及遗传多样性分析
采用10个多态性高且条带清晰的引物对32个猕猴桃样本进行ISSR分析,扩增结果见表1。由表1可以看出:10个引物共扩增出200个条带(位点),其中,多态性位点有195个,多态性位点百分率(PPL)为97.50%,表明这些引物具有较高的多态性。10个引物中,引物UBC835(2)扩增的位点总数最多(27个),引物UBC820扩增的位点总数最少(14个),平均每个引物扩增的位点总数为20个。引物UBC854的扩增图谱见图1。该引物共扩增出20个条带,扩增出的DNA片段长度为220~2 163 bp,且均为多态性条带,PPL值为100.00%;类似的引物还有UBC815、UBC818、UBC824和UBC835(2),其扩增的位点也均为多态性位点。
表1基于10个ISSR引物对27个猕猴桃品种32个样本的遗传多样性分析1)
Table1Analysisongeneticdiversityof32samplesof27cultivarsofActinidiaspp.basedontenISSRprimers1)
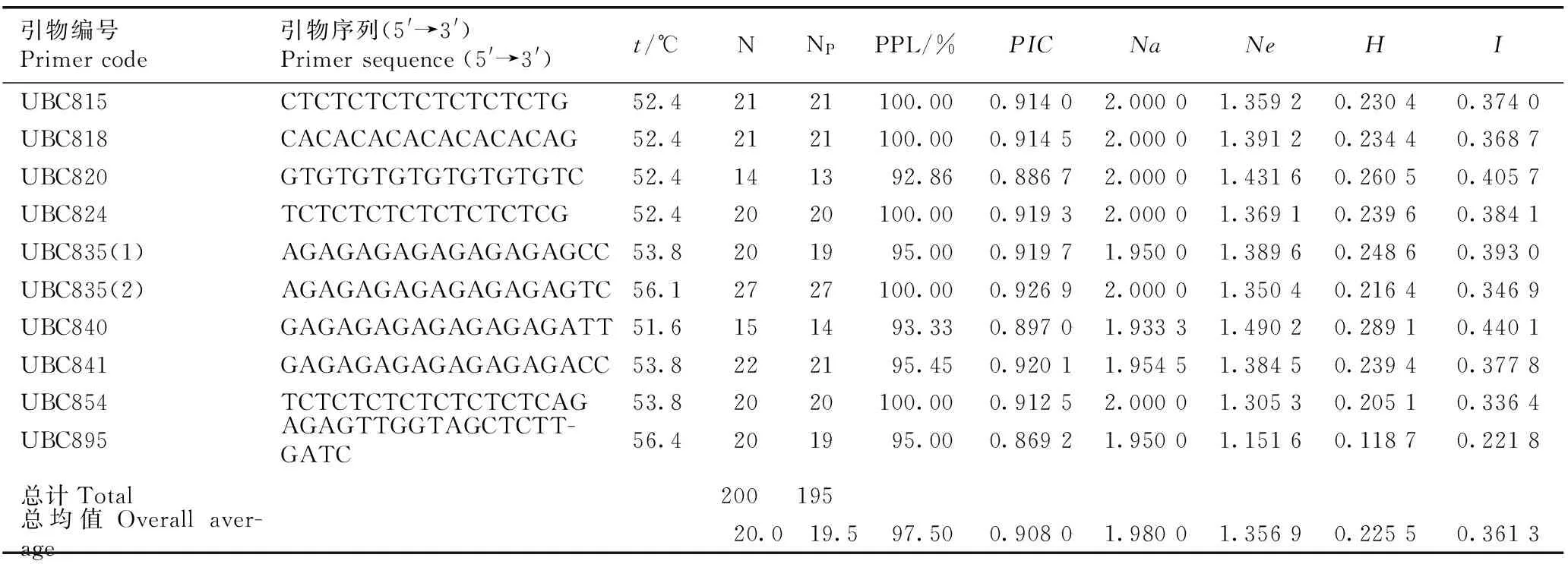
引物编号Primercode引物序列(5'→3')Primersequence(5'→3')t/℃NNPPPL/%PICNaNeHIUBC815CTCTCTCTCTCTCTCTG52.42121100.000.91402.00001.35920.23040.3740UBC818CACACACACACACACAG52.42121100.000.91452.00001.39120.23440.3687UBC820GTGTGTGTGTGTGTGTC52.4141392.860.88672.00001.43160.26050.4057UBC824TCTCTCTCTCTCTCTCG52.42020100.000.91932.00001.36910.23960.3841UBC835(1)AGAGAGAGAGAGAGAGCC53.8201995.000.91971.95001.38960.24860.3930UBC835(2)AGAGAGAGAGAGAGAGTC56.12727100.000.92692.00001.35040.21640.3469UBC840GAGAGAGAGAGAGAGATT51.6151493.330.89701.93331.49020.28910.4401UBC841GAGAGAGAGAGAGAGACC53.8222195.450.92011.95451.38450.23940.3778UBC854TCTCTCTCTCTCTCTCAG53.82020100.000.91252.00001.30530.20510.3364UBC895AGAGTTGGTAGCTCTT-GATC56.4201995.000.86921.95001.15160.11870.2218总计Total200195总均值Overallaver-age20.019.597.500.90801.98001.35690.22550.3613
1)t: 退火温度Annealing temperature; N: 位点总数Total number of loci; NP: 多态性位点数Number of polymorphic loci; PPL: 多态性位点百分率Percentage of polymorphic loci;PIC: 多态性信息含量Polymorphism information content;Na: 观测等位基因数Observed number of alleles;Ne: 有效等位基因数Effective number of alleles;H: Nei’s 基因多样性指数Nei’s gene diversity index;I: Shannon’s多样性指数Shannon’s diversity index.
由表1还可以看出:基于10个引物的ISSR扩增结果分析了32个猕猴桃样本的遗传多样性参数,其中,多态性信息含量(PIC)均值为0.869 2~0.926 9,总均值为0.908 0;观测等位基因数(Na)均值为1.933 3~2.000 0,总均值为1.980 0;有效等位基因数(Ne)均值为1.151 6~1.490 2,总均值为1.356 9;Nei’s基因多样性指数(H)均值为0.118 7~0.289 1,总均值为0.225 5;Shannon’s多样性指数(I)均值为0.221 8~0.440 1,总均值为0.361 3。4个猕猴桃种间的遗传分化系数(Gst)为0.414 6,表明总遗传变异的41.46%存在于种间,58.54%存在于种内。基因流(Nm)为0.705 9,表明4个猕猴桃种间的遗传分化程度较高,基因交流频率较低。
分子方差分析结果表明(表2):4个猕猴桃的种间变异占总变异的40.84%,种内变异占总变异的59.16%,与Gst值的分析结果对应,说明4个猕猴桃种间存在较为丰富的遗传多样性。对Na、Ne、H和I值的检验结果显示:供试的32个猕猴桃样本间的遗传多样性水平存在极显著差异(X2=35.753,P<0.001),表明基于这10个ISSR引物的扩增结果计算的各项遗传多样性参数均能切实反映猕猴桃品种间的遗传多样性水平。

M: DNA marker; 1-3,5-11: 美味猕猴桃品种 Cultivars of Actinidia chinensis var. deliciosa (A. Chev.) A. Chev.; 4,12-21: 中华猕猴桃品种 Cultivars of A. chinensis Planch.; 22-30: 软枣猕猴桃品种 Cultivars of A. arguta (Sieb. et Zucc.) Planch. ex Miq.; 31,32: 毛花猕猴桃品种 Cultivars of A. eriantha Benth. 1: ‘徐香’‘Xuxiang’; 2: ‘金魁’‘Jinkui’; 3: ‘金魁’(雄株)‘Jinkui’(male plant); 4: ‘翠玉’‘Cuiyu’; 5: ‘皖翠’‘Wancui’; 6: ‘金硕’‘Jinshuo’; 7: ‘中猕2号’‘Zhongmi 2’; 8: ‘海艳’‘Haiyan’; 9: ‘米良1号’‘Miliang 1’; 10: ‘海沃德’‘Hayward’; 11: ‘布鲁诺’‘Bruno’; 12: ‘红阳’‘Hongyang’; 13: ‘黄阳’‘Huangyang’; 14: ‘黄阳’(雄株)‘Huangyang’(male plant); 15: ‘晚红’‘Wanhong’; 16: ‘楚红’‘Chuhong’; 17: ‘早金’‘Hort16A’; 18: ‘金艳’‘Jinyan’; 19: ‘琼浆’‘Qiongjiang’; 20: ‘豫皇1号’‘Yuhuang 1’; 21: ‘湘吉红’‘Xiangjihong’; 22: ‘红宝石星’‘Ruby star’; 23: ‘红宝石星’(雄株)‘Ruby star’(male plant); 24: ‘软红’‘Ruanhong’; 25: ‘红贝’‘Hongbei’; 26: ‘红贝’(雄株)‘Hongbei’(male plant); 27: ‘华红1号’‘Huahong 1’; 28: ‘华红2号’‘Huahong 2’; 29: ‘魁绿’‘Kuilü’; 30: ‘桓优1号’‘Huanyou 1’; 31: ‘华特’(雄株)‘Huate’(male plant); 32: ‘华特’‘Huate’.图1 引物UBC854对27个猕猴桃品种32个样本的ISSR扩增图谱Fig. 1 ISSR amplification pattern of 32 samples of 27 cultivars of Actinidia spp. by primer UBC854
表2基于ISSR标记的4个猕猴桃种类的分子方差分析结果
Table2ResultonmolecularvarianceanalysisonfourspeciesinActinidiaLindl.basedonISSRmarker

变异来源Sourceofvariation自由度Degreeoffreedom平方和Sumofsquare均方Meansquare方差Variance方差比例/%Percentageofvariance种间Interspecies3349.669116.55613.05640.84种内Intraspecies28529.48718.91018.91059.16
2.2 UPGMA聚类分析
对32个猕猴桃样本间的遗传相似系数(GS)进行计算,结果表明:32个样本间的GS值为0.565 0~0.965 0,平均值为0.716 4,变幅为0.400 0,说明供试的32个样本间遗传差异较大。其中,品种‘金魁’与其雄株的GS值最大(0.965 0),亲缘关系最近;而品种‘米良1号’与‘桓优1号’、‘湘吉红’与‘桓优1号’、‘桓优1号’与‘华特’雄株间的GS值均最小,仅为0.565 0,亲缘关系最远。
基于上述GS值对32个猕猴桃样本进行UPGMA聚类分析,结果见图2。由图2可以看出:在GS值为0.76处,可将32个猕猴桃样本分为4组。第Ⅰ组包括12个样本,分别为品种‘徐香’、‘海艳’、‘米良1号’、‘中猕2号’、‘华特’、‘金魁’、‘金魁’雄株、‘皖翠’、‘海沃德’、‘布鲁诺’、‘翠玉’和‘金硕’;第Ⅱ组包括10个样本,分别为品种‘红阳’、‘晚红’、‘琼浆’、‘黄阳’、‘早金’、‘黄阳’雄株、‘楚红’、‘金艳’、‘豫皇1号’和‘湘吉红’;第Ⅲ组仅包括 ‘华特’雄株1个样本;第Ⅳ组包括9个样本,分别为品种‘红宝石星’、‘红宝石星’雄株、‘软红’、‘红贝’、‘红贝’雄株、‘华红2号’、‘魁绿’、‘华红1号’和‘桓优1号’。其中,第Ⅰ组的样本除‘华特’和‘翠玉’外均属于美味猕猴桃品种;第Ⅱ组的样本均属于中华猕猴桃品种;第Ⅲ组的样本属于毛花猕猴桃品种;第Ⅳ组的样本均属于软枣猕猴桃品种,该聚类结果基本符合传统分类结果。
对供试的32个猕猴桃样本按照种类进行归类,并计算4个猕猴桃种间的GS值和遗传距离(GD),结果见表3。由表3可以看出:4个猕猴桃种间的GS值为0.780 7~0.926 7,其中,中华猕猴桃与美味猕猴桃的GS值为0.926 7,亲缘关系最近,与美味猕猴桃是中华猕猴桃的一个变种的分类地位一致;毛花猕猴桃与中华猕猴桃、美味猕猴桃和软枣猕猴的GS值分别为0.895 1、0.895 4和0.780 7,相对于软枣猕猴桃,毛花猕猴桃与中华猕猴桃和美味猕猴桃的亲缘关系更近,与上述聚类结果基本一致。
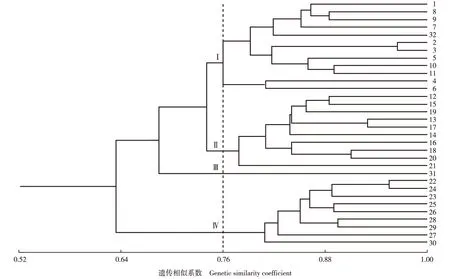
1-3,5-11: 美味猕猴桃品种 Cultivars of Actinidia chinensis var. deliciosa (A. Chev.) A. Chev.; 4,12-21: 中华猕猴桃品种 Cultivars of A. chinensis Planch.; 22-30: 软枣猕猴桃品种 Cultivars of A. arguta (Sieb. et Zucc.) Planch. ex Miq.; 31,32: 毛花猕猴桃品种 Cultivars of A. eriantha Benth. 1: ‘徐香’‘Xuxiang’; 2: ‘金魁’‘Jinkui’; 3: ‘金魁’(雄株)‘Jinkui’(male plant); 4: ‘翠玉’‘Cuiyu’; 5: ‘皖翠’‘Wancui’; 6: ‘金硕’‘Jinshuo’; 7: ‘中猕2号’‘Zhongmi 2’; 8: ‘海艳’‘Haiyan’; 9: ‘米良1号’‘Miliang 1’; 10: ‘海沃德’‘Hayward’; 11: ‘布鲁诺’‘Bruno’; 12: ‘红阳’‘Hongyang’; 13: ‘黄阳’‘Huangyang’; 14: ‘黄阳’(雄株)‘Huangyang’(male plant); 15: ‘晚红’‘Wanhong’; 16: ‘楚红’‘Chuhong’; 17: ‘早金’‘Hort16A’; 18: ‘金艳’‘Jinyan’; 19: ‘琼浆’‘Qiongjiang’; 20: ‘豫皇1号’‘Yuhuang 1’; 21: ‘湘吉红’‘Xiangjihong’; 22: ‘红宝石星’‘Ruby star’; 23: ‘红宝石星’(雄株)‘Ruby star’(male plant); 24: ‘软红’‘Ruanhong’; 25: ‘红贝’‘Hongbei’; 26: ‘红贝’(雄株)‘Hongbei’(male plant); 27: ‘华红1号’‘Huahong 1’; 28: ‘华红2号’‘Huahong 2’; 29: ‘魁绿’‘Kuilü’; 30: ‘桓优1号’‘Huanyou 1’; 31: ‘华特’(雄株)‘Huate’(male plant); 32: ‘华特’‘Huate’.图2 基于ISSR标记分析结果的27个猕猴桃品种32个样本的UPGMA聚类图Fig. 2 UPGMA dendrogram of 32 samples of 27 cultivars of Actinidia spp. based on analysis result of ISSR marker
表3基于ISSR标记分析结果的4个猕猴桃种间的遗传相似系数和遗传距离1)
Table3GeneticsimilaritycoefficientandgeneticdistanceamongfourspeciesinActinidiaLindl.basedonanalysisresultofISSRmarker1)

种类2)Species2)各种间的遗传相似系数和遗传距离GeneticsimilaritycoefficientandgeneticdistanceamongdifferentspeciesACDACAAAEACD—0.92670.82140.8951AC0.0761—0.81090.8954AA0.19680.2096—0.7807AE0.11080.11050.2475—
1)遗传相似系数和遗传距离分别位于横线上、下方 Genetic similarity coefficient and genetic distance are located above and under the line, respectively.
2)ACD: 美味猕猴桃Actinidiachinensisvar.deliciosa(A. Chev.) A. Chev.; AC: 中华猕猴桃A.chinensisPlanch.; AA: 软枣猕猴桃A.arguta(Sieb. et Zucc.) Planch. ex Miq.; AE: 毛花猕猴桃A.erianthaBenth.
2.3 DNA指纹图谱构建
对前述10个ISSR引物的扩增结果进行分析和筛选,选取引物UBC818、UBC824、UBC854和UBC895的扩增位点中具有不同特异性的15个多态性位点,构建了32个猕猴桃样本的DNA指纹图谱,结果见图3。
由图3可见:在引物UBC818扩增的5个多态性位点中,‘红贝’、‘红贝’雄株和‘华特’雄株3个样本的位点具有特异性;在引物UBC824扩增的2个多态性位点中,仅‘华特’雄株的位点具有特异性;在引物UBC854扩增的5个多态性位点中,‘中猕2号’、‘海沃德’、‘布鲁诺’和‘红宝石星’雄株4个样本的位点具有特异性;而在引物UBC895扩增的3个多态性位点中,32个样本的位点均不具有特异性。对4个引物扩增的15个多态性位点进行综合分析,供试的32个样本均具有特异的位点图谱,因此,根据引物UBC818、UBC824、UBC854和UBC895扩增的15个多态性位点构建的DNA指纹图谱可用于供试32个猕猴桃样本的鉴定。

1-3,5-11: 美味猕猴桃品种 Cultivars of Actinidia chinensis var. deliciosa (A. Chev.) A. Chev.; 4,12-21: 中华猕猴桃品种 Cultivars of A. chinensis Planch.; 22-30: 软枣猕猴桃品种 Cultivars of A. arguta (Sieb. et Zucc.) Planch. ex Miq.; 31,32: 毛花猕猴桃品种 Cultivars of A. eriantha Benth. 1: ‘徐香’‘Xuxiang’; 2: ‘金魁’‘Jinkui’; 3: ‘金魁’(雄株)‘Jinkui’(male plant); 4: ‘翠玉’‘Cuiyu’; 5: ‘皖翠’‘Wancui’; 6: ‘金硕’‘Jinshuo’; 7: ‘中猕2号’‘Zhongmi 2’; 8: ‘海艳’‘Haiyan’; 9: ‘米良1号’‘Miliang 1’; 10: ‘海沃德’‘Hayward’; 11: ‘布鲁诺’‘Bruno’; 12: ‘红阳’‘Hongyang’; 13: ‘黄阳’‘Huangyang’; 14: ‘黄阳’(雄株)‘Huangyang’(male plant); 15: ‘晚红’‘Wanhong’; 16: ‘楚红’‘Chuhong’; 17: ‘早金’‘Hort16A’; 18: ‘金艳’‘Jinyan’; 19: ‘琼浆’‘Qiongjiang’; 20: ‘豫皇1号’‘Yuhuang 1’; 21: ‘湘吉红’‘Xiangjihong’; 22: ‘红宝石星’‘Ruby star’; 23: ‘红宝石星’(雄株)‘Ruby star’(male plant); 24: ‘软红’‘Ruanhong’; 25: ‘红贝’‘Hongbei’; 26: ‘红贝’(雄株)‘Hongbei’(male plant); 27: ‘华红1号’‘Huahong 1’; 28: ‘华红2号’‘Huahong 2’; 29: ‘魁绿’‘Kuilü’; 30: ‘桓优1号’‘Huanyou 1’; 31: ‘华特’(雄株)‘Huate’(male plant); 32: ‘华特’‘Huate’.图3 基于4个ISSR引物(UBC818、UBC824、UBC854和UBC895)扩增结果的27个猕猴桃品种32个样本的DNA指纹图谱Fig. 3 DNA fingerprinting of 32 samples of 27 cultivars of Actinidia spp.based on amplification result by four ISSR primers (UBC818, UBC824, UBC854 and UBC895)
3 讨论和结论
ISSR标记具有良好的稳定性和较高的多态性,已经成为研究植物遗传多样性的主流技术之一,应用范围较广[15]。本研究中,利用ISSR标记分析了32个猕猴桃样本的遗传多样性,结果显示:筛选出的10个引物共扩增出200个条带(位点),其中,多态性位点有195个,多态性位点百分率(PPL)达97.50%,高于邹游等[10]和刘娟等[11]对猕猴桃的同类研究结果,也高于采用其他分子标记对猕猴桃的相关研究结果[16-18],这种现象与不同研究者采用的ISSR引物以及供试样本的品种甚至植株生长状况等方面的差异有关。
多态性信息含量(PIC)也是衡量引物多态性信息含量水平(高:PIC>0.50;适中:0.25 从GS值以及聚类分析结果看,基于ISSR标记结果获得的GS值以及聚类分析结果基本可以将供试的32个猕猴桃样本按照亲本来源进行归类,而中华猕猴桃、美味猕猴桃、软枣猕猴和毛花猕猴桃4个种间的GS值也显示其亲缘关系符合传统分类,说明ISSR标记可用于猕猴桃品种的遗传关系研究。但基于ISSR标记的聚类结果与供试猕猴桃品种亲本的传统分类归属也略有差异,例如,‘翠玉’为中华猕猴桃品种,但却与美味猕猴桃的品种聚在同一组中,出现这种结果的原因可能与中华猕猴桃和美味猕猴桃的亲缘关系的复杂性有关。美味猕猴桃曾作为中华猕猴桃的硬毛品种,两者具有较高的遗传相似性[20-21],有学者建议将两者归并为一个种[17],而且在《Flora of China》[22]中已对此进行了分类处理,将美味猕猴桃处理为中华猕猴桃的一个变种,说明二者的亲缘关系很近。另外,毛花猕猴桃品种‘华特’与其雄株并未聚在一起,‘华特’与美味猕猴桃的品种聚在同一组,而其雄株单独成组,品种‘华特’与其雄株均为野生选种,不属于一个姊妹系,两者未能聚在一起可能与此有关,也可能与ISSR标记本身的局限性有关,需要结合形态学以及其他分子标记技术进行深入研究。另外,从品种的育种亲本来源看,供试的美味猕猴桃品种中,品种‘中猕2号’的母本为品种‘米良1号’[23],因此,二者聚在一起;品种‘皖翠’是品种‘海沃德’的自然芽变品种[24],而品种‘布鲁诺’与‘海沃德’均源自1904年新西兰从湖北宜昌引进的同一批种子[25],这3个品种也聚在一起,体现出部分供试样本来源地域一致性的特征。由聚类分析结果还可见:美味猕猴桃品种‘金魁’与其雄株、软枣猕猴桃品种‘红贝’与其雄株均首先聚在一起,而软枣猕猴桃品种‘红宝石星’与其雄株也表现出很近的亲缘关系,与龚俊杰[26]的研究结果类似。 依据形态学特征的品种鉴定很难区分表型极为相似的品种。DNA分子标记具有不受环境因子和时空条件影响且高效、快捷等优点,可直接反映品种间的遗传差异,已成为品种鉴定的有效方法之一。ISSR标记在植物品种鉴定和DNA指纹图谱构建方面都有成功应用,如:郑宇等[27]利用6个ISSR标记产生的8个多态性位点绘制了ISSR指纹图谱,可准确区分比利时杜鹃(RhododendronhybridumHort.)的11个栽培品种(系);索志立等[28]利用4个ISSR引物构建了紫斑牡丹〔Paeoniarockii(S. G. Haw et Lauener) T. Hong et J. J. Li〕与牡丹(P.suffruticosaAndrews)种间杂交后代及其亲本的DNA指纹图谱,从而在DNA分子水平上推测了紫斑牡丹的品种起源,且与早期的形态学观测结果相印证;张林等[14]利用2个ISSR引物构建了DNA指纹图谱,能够准确鉴定62个朱顶红〔Hippeastrumrutilum(Ker-Gawl.) Herb.〕品种。本研究选用4个ISSR引物的15个多态性位点构建了32个猕猴桃样本的DNA指纹图谱,每个样本均具有各自特异的组合位点,可作为猕猴桃品种间分类和鉴定的依据。 综上所述, 供试的32个猕猴桃样本间均具有较丰富的遗传多样性,其遗传关系基本符合传统分类结果,部分品种还体现出一定的来源地域一致性的特征;而利用4个ISSR引物扩增的15个多态性位点构建的DNA指纹图谱可准确区分供试的猕猴桃样本。 [1] 黄宏文. 猕猴桃属——分类·资源·驯化·栽培[M]. 北京: 科学出版社, 2013: 4-10. [2] 董晓莉, 汤浩茹, 甘 玲, 等. DNA分子标记在猕猴桃上的应用[J]. 果树学报, 2005, 22(6): 682-686. [3] 叶凯欣, 罗森材, 梁雪莲, 等. 猕猴桃SSR分析[J]. 生物技术, 2009, 19(3): 39-42. [4] ZIETKIEWICZ E, RAFALSKI A, LABUDA D. Genome finger-printing by simple sequence repeat (SSR)-anchored polymerase chain reaction amplification[J]. Genomics, 1994, 20: 176-183. [5] 赵孟良, 韩 睿, 李 莉. 24个菊芋品种(系)遗传多样性的ISSR标记分析[J]. 植物资源与环境学报, 2013, 22(4): 44-49. [6] 李乃伟, 贺善安, 束晓春, 等. 基于ISSR标记的南方红豆杉野生种群和迁地保护种群的遗传多样性和遗传结构分析[J]. 植物资源与环境学报, 2011, 20(1): 25-30. [7] 李宗艳, 秦艳玲, 蒙进芳, 等. 西南牡丹品种起源的ISSR研究[J]. 中国农业科学, 2015, 48(5): 931-940. [8] 李国田, 张美勇, 相 昆, 等. 基于ISSR标记的16个核桃品种遗传多样性分析及分子身份构建[J]. 核农学报, 2015, 29(10): 1884-1892. [9] 李谋强, 师桂英, 叶树辉, 等. 基于ISSR分子标记数据的兰州百合核心种质构建方法研究[J]. 中国沙漠, 2015, 35(6): 1573-1578. [10] 邹 游, 黄 敏, 侯若彤, 等. ISSR标记技术在猕猴桃遗传研究中的运用[J]. 西南师范大学学报(自然科学版), 2008, 33(1): 111-115. [11] 刘 娟, 廖明安, 谢 玥, 等. 猕猴桃属16个雄性材料遗传多样性的ISSR分析[J]. 植物遗传资源学报, 2015, 16(3): 618-623. [12] 张安世, 邢智峰, 刘永英, 等. 苔藓植物DNA不同提取方法的比较分析[J]. 河南科学, 2009, 27(5): 559-562. [13] 黄 秀, 曾 捷, 聂 刚, 等. 牛鞭草品种EST-SSR指纹图谱构建及遗传多样性分析[J]. 热带亚热带植物学报, 2014, 22(2): 165-171. [14] 张 林, 徐迎春, 成海钟, 等. 基于ISSR标记的62个朱顶红品种的遗传关系分析及指纹图谱构建[J]. 植物资源与环境学报, 2012, 21(4): 48-54. [15] 廖 丽, 王晓丽, 刘建秀, 等. 地毯草种质资源ISSR标记遗传多样性分析[J]. 草业科学, 2016, 33(4): 608-614. [16] 徐小彪, 廖 娇, 黄春辉, 等. 基于EST-SSR标记分析猕猴桃种质遗传关系[J]. 果树学报, 2012, 29(2): 212-216. [17] 贾 兵, 朱立武, 余 兴, 等. 猕猴桃种质资源RAPD分析[J]. 安徽农业大学学报, 2005, 32(3): 381-384. [18] 秦小波, 高继海. 利用AFLP分析西南特色猕猴桃的遗传多样性[J]. 热带亚热带植物学报, 2013, 21(4): 315-322. [19] 徐玉仙, 张微微, 莫海波, 等. 基于EST-SSR标记的莲属种质资源遗传多样性分析[J]. 植物分类与资源学报, 2015, 37 (5): 595-604. [20] 黄宏文, 龚俊杰, 王圣梅, 等. 猕猴桃(Actinidia)属植物的遗传多样性[J]. 生物多样性, 2000, 8(1): 1-12. [21] 谢 鸣, 蒋桂华, 柳国华, 等. 中华猕猴桃与美味猕猴桃生物学特性及生产性能比较[J]. 果树科学, 1995, 12(3): 161-164. [22] WU Z Y, RAVEN P H, HONG D Y. Flora of China: Vol. 12[M]. Beijing: Science Press, 2005: 349-350. [23] 齐秀娟, 林苗苗, 徐善坤, 等. 美味猕猴桃新品种‘中猕2号’[J]. 园艺学报, 2015, 42(S2): 2835-2836. [24] 朱立武, 丁士林, 王谋才, 等. 美味猕猴桃新品种‘皖翠’[J]. 园艺学报, 2001, 28(1): 86. [25] 姚家龙. 新西兰的猕猴桃育种[J]. 国外农学(果树), 1989(1): 29-31. [26] 龚俊杰. 猕猴桃属植物AFLP分析及其系统发育关系的研究[D]. 武汉: 华中农业大学园艺林学学院, 2003: 37-43. [27] 郑 宇, 何天友, 陈凌艳, 等. 比利时杜鹃栽培品种的ISSR分析[J]. 福建农林大学学报(自然科学版), 2011, 40(3): 271-275. [28] 索志立, 张会金, 张治明, 等. 紫斑牡丹与牡丹种间杂交后代的DNA分子证据[J]. 云南植物研究, 2005, 27(1): 42-48. (责任编辑: 郭严冬) GeneticdiversityanalysisandfingerprintingconstructionofcultivarsofActinidiaspp.basedonISSRmarker ZHANG Anshi1,①, HAN Chenpeng2, QI Xiujuan3, ZHANG Zhonghai1 (1. School of Science, Jiaozuo Teachers College, Jiaozuo 454000, China; 2. Zhengzhou Green Museum Administrative Center, Zhengzhou 450000, China; 3. Zhengzhou Fruit Research Institute,Chinese Academy of Agricultural Sciences, Zhengzhou 450009, China),J.PlantResour. &Environ., 2017,26(3): 19-26 S663.4; Q946-33 A 1674-7895(2017)03-0019-08 10.3969/j.issn.1674-7895.2017.03.03 2016-12-22 中国农业科学院科技创新工程专项(CAAS-ASTIP-2015-ZFRI) 张安世(1965—),男,河南博爱人,硕士,教授,主要从事植物分子生物学方面的研究。 ①通信作者E-mail: aszhang1212@163.com
