应用qRT-PCR方法快速定量蓝舌病抗原的研究
2017-10-12廖德芳苗海生李华春寇美玲
廖德芳,苗海生,李华春,高 林,寇美玲,李 乐
(云南省畜牧兽医科学院,云南省热带亚热带动物病毒病重点实验室,云南昆明 650224)
应用qRT-PCR方法快速定量蓝舌病抗原的研究
廖德芳,苗海生,李华春,高 林,寇美玲,李 乐
(云南省畜牧兽医科学院,云南省热带亚热带动物病毒病重点实验室,云南昆明 650224)
在疫苗生产中需要对培养病毒的有效抗原数量进行定量,对其一般采用TCID50测定或噬斑滴定的方法。这些传统方法的缺点是耗时、重复性差异较大。本研究采用qRT-PCR检测蓝舌病病毒含量,并用准确滴定噬斑单位的蓝舌病病毒作为对照,比较待检样品和对照的Ct值,通过线性方程计算待检样品的病毒含量。对7个独立样品的检测结果表明,该方法的准确性和重复性均高于噬斑分析方法,并且可在蓝舌病病毒培养过程中实时检测病毒含量。该方法操作简单、快捷,可在病毒生产过程即时检测病毒含量,在蓝舌病疫苗生产中具有重要意义。
蓝舌病;qRT-PCR;病毒含量
Abstract:Quantitatively amount of cultivated virus in vaccine production was necessary,and the method of TCID50 or plaques titration to quantitative was adopted generally. The shortcomings of these traditional methods were timeconsuming and the repeatability was not strong. The Bluetongue virus content was detected by qRT-PCR,in contrast with accurate titration plaques units of Bluetongue virus as a control in this study. The Ct values of test and control samples were compared,and the concentrations of test samples by the linear equation was estimated. The test results of 7 independent samples showed that the accuracy and repeatability were higher than plaques analysis method. And this method could be applied to real-time detection virus content in the process of virus culture. The method was simple and rapid during the operation,and could detecte virus content in the process of virus culture,which had significance in Bluetongue vaccine production.
key words:Bluetongue;qRT-PCR;virus content
蓝舌病是世界动物卫生组织(OIE)须通报动物疫病,是一种主要由库蠓传播的虫媒病,能够感染多种偶蹄动物。疫苗免疫是控制该病的重要方法。在蓝舌病疫苗生产过程中,为了使疫苗生产标准化,需要对病毒含量进行准确定量,一般采用噬斑单位来表示病毒含量[1]。但是噬斑测定方法不仅费时,而且结果不稳定[2-4]。
实时荧光定量核酸扩增检测系统(qPCR)可对PCR产物进行标记跟踪,实时在线监控反应过程,可以结合相应软件对产物进行分析,计算待测样品模板的初始浓度。该技术因具有特异性强、灵敏度高、速度快等优点,在基因表达水平分析、病原体基因的定性和定量检测等方面得到广泛应用,已经成为当前病毒核酸快速检测的主要方法之一[5-6]。
实时荧光定量RT-PCR的Ct值是指每个反应管内的荧光信号到达设定的域值时所经历的循环数。每个模版的Ct值与该模版的起始拷贝数的对数呈线性关系[7]。本研究应用精确测定噬斑单位的病毒作为对照,将病毒原液进行5倍比稀释,分别提取病毒核酸进行型特异的反转录实时荧光RTPCR(qRT-PCR),检测绘制标准曲线并获得回归方程。利用该方法对8个独立样品进行多次检测,以验证其结果的准确性。
1 材料与方法
1.1 qRT-PCR方法
蓝舌病qRT-PCR在ABI FAST7500上进行。采用一步法RT-PCR TAKARA RR064A试剂盒(大连宝生物),按照试剂盒说明书配制反应液。采用20 µL体系,每个反应加模版 2 µL、引物 0.4 µL、探针 0.4 µL;反应条件为42 ℃反转录5 min,95 ℃灭活10 s,45个循环扩增反应包括95 ℃ 5 s,60 ℃延伸34 s。引物和探针按文献[3]的方法进行。引物和探针如下:
BTVF-MH:
5´-TGGAYAAAGCGATGTCAAA-3´
BTVR-MH:
5´-ACATCATCACGAAACGCTTC-3´
BTVP-MH:
5´-FAM-ARGCTGCATTCGCATCGTACGCBHQ1-3´
在进行PCR前,对核酸模版需95 ℃ 6 min解开蓝舌病RNA双链,将其结果用Ct值表示。
1.2 标准对照和线性相关分析
应用同一批次收获的病毒作为标准对照,进行4次噬斑试验,获得准确的噬斑含量,分装,-80 ℃保存,作为标准对照使用。将标准对照连续5倍比稀释,稀释倍数分别为 1、1/5、1/25、1/125、1/625,用高通量核酸(MagMAX)分别进行核酸提取,用qRT-PCR方法检测各稀释度的病毒,获得Ct值;对每个稀释度重复测定3次,绘制标准曲线,获得回归方程Y=A+⊿Ct/B。其中,Y为待检样品的噬斑单位(log10),A为标准对照的噬斑单位(log10),⊿Ct为待检样品Ct值减标准样品Ct值,B为标准曲线斜率。
1.3 病毒核酸提取
用高通量核酸提取仪进行样品核酸提取(MagMAX EXPRESS),按照说明书进行操作。具体步骤为:50 µL样品中,加130 µL裂解液、20 µL磁珠,放到第1排孔中;加150 µL清洗液,放入第1~3排孔中;加150 µL清洗液放入第2~5排孔中;第6排孔中,加入核酸洗脱液。选择相应的标准操作程序提取病毒核酸。
1.4 样品噬斑测定方法
将病毒10倍比稀释后接种于长满BHK21单层细胞的6孔细胞培养板内。每个稀释度按200 µL量接种于各孔中,吸附30 min后,加入40 ℃预热好的4 mL MEM 1%琼脂糖混合液(含2%胎牛血清),置于CO2培养箱中培养5 d。5 d后,移除覆盖的琼脂,利用96%乙醇固定6孔板中的BHK21细胞,用亚甲基蓝染色干燥。对每个稀释度进行计数,计算病毒的噬斑含量。
1.5 qRT-PCR法检测病毒含量验证
对同一批次病毒液分别进行qRT-PCR试验和噬斑试验检测;每种检测各进行4次,以验证qRT-PCR方法的重复性和准确性。
对7个批次的病毒液分别进行噬斑试验检测和qRT-PCR试验检测,以验证qRT-PCR方法和噬斑试验检测方法间的差异性,应用T-TEST方法进行配对比较。
1.6 qRT-PCR在病毒接种量分析中的应用
先进行BHK21细胞计数,然后将蓝舌病病毒分别接种于2个长满单层BHK21细胞的转瓶中。接种量分别为:第1组接种100 cell/PUF(每100个细胞接种1个噬斑形成单位);第2组接种1 000 cell/PUF。每组每天取上清液进行qRT-PCR检测,并计算病毒含量。
1.7 统计分析
噬斑测定的结果用log10 PUF/dose来表示,1个dose为1 mL;所有qRT-PCR估计结果均表示为噬斑含量log10 PUF/dose。采用平均值、标准差、CV,按标准统计方法进行评价,采用SPSS软件计算;采用P<0.05标准进行显著性比较;由SPSS软件生成统计图。
2 结果
2.1 标准曲线的绘制
对BTV样品进行了4次独立的噬斑含量检测,结果分别为5.0、5.1、5.0、5.0,平均值为5.02。采用准确滴定毒价的病毒,按5倍倍比稀释,测定标准曲线;将病毒稀释成1、1/5、1/25、1/125、1/625共5个稀释度,对每个稀释度均用高通量核酸提取仪提取病毒核酸;每个稀释度设3个重复,进行qRT-PCR检测。检测结果显示:回归曲线的斜率为5.62,相关性(R)为0.98,有效性(EFF%)为50%。综合标准对照和标准曲线结果(图1、图2),得到的直线回归方程为Y=5.02-⊿Ct/5.62。其中,Y为待检样品的噬斑含量,⊿Ct为待检样品的Ct减标准对照的Ct。

图1 标准对照5倍倍比稀释检测Ct值

图2 标准曲线绘制
2.2 qRT-PCR法检测病毒含量验证
重复性和准确性检测结果显示,qRT-PCR方法检测的噬斑含量平均值为104.5,噬斑试验方法检测的结果为104.27(表1)。qRT-PCR方法检测结果的准确性和重复性均高于噬斑测定方法(标准差分别为0.05和0.1,CV分别为1.08%和2.32%)。
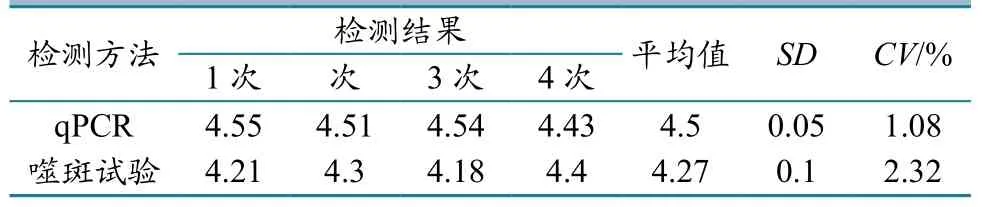
表1 qRT-PCR方法重复性和准确性的分析
差异性检测结果显示,两种方法的平均差异为-0.1(95%置信区间),二者差异在-0.36~0.01,SIG>0.05。因此,两种方法没有显著性区别(表2)。

表2 7个样品的噬斑实验结果和qRT-PCR估计结果的统计学比较(t-test)
2.3 qRT-PCR在病毒接种量分析中的应用
病毒接种量分析结果显示,两组最佳病毒收获时间均为接种后4 d,其中第2组病毒含量最高,达5.4 PUF/mL;2组的毒价均在接种后5 d左右开始下降(图3)。

图3 100 cell/PUF和1 000 cell/PUF接种的对比(SPSS17.0中文版)
3 讨论
应用蓝舌病qRT-PCR方法进行病毒抗原含量测定,能够快速得到病毒含量检测结果。检测结果与传统噬斑分析方法比较,无显著性差异,但其重复性、准确性均高于噬斑分析方法。此外,该方法可在蓝舌病疫苗生产中针对病毒培养进行实时检测病毒含量。目前,部分国家已在生产活疫苗时采用该方法进行抗原定量,并取得了很好的应用效果[8-9]。
传统的病毒含量检测方法中,最常用的是采用稀释核酸的方法来绘制标准曲线,以核酸拷贝数来计算病毒含量。本研究建立的方法是先将病毒稀释再进行核酸提取,进而绘制标准曲线。虽然在数值的相关性上比用稀释核酸法绘制的标准曲线差,但在实际样品的检测中,该方法更接近实际病毒液状态,其准确性更高,误差更低(CV为1%)。同时,采用直接病毒稀释绘制标准曲线,能够减少合成DNA表达的步骤,缩短qPCR定量方法的研究时间。在蓝舌病这种毒株血清型较多的疫病研究中,该方法可将结果快速应用于蓝舌病的26个血清型中,只需要1个滴度标准对照,而不需要每个血清型各表达1个cDNA克隆。
本研究应用qRT-PCR定量方法进行了100 cell/PUF和1 000 cell/PUF接种量的对比,只需2 h便可获得结果。通过数据分析认为,利用1 000 cell/PUF接种量,4 d后收获病毒,效果较好。应用qRT-PCR方法进行病毒抗原含量测定,能够实现即时检测,如进行病毒培养中的生长曲线绘制,而传统方法由于费时费力,很难获得准确结果。因此,该方法在疫苗生产中具有一定的实用价值,可为蓝舌病疫苗生产中病毒接种量的标准化和病毒收获时间的标准化提供了理论依据。
[1] SMITH EM,ESTES M K,GRAHAM D Y,et al. A plaque assay for the Simian rotavirus SAII[J]. J. Gen. Virol.1979,43(3):513-519.
[2] FUKUDA A,SENGUN F,SARPAY H E,et al.Parameters for plaque formation in potency assay of Japanese measles Vaccine[J]. Journal of virological methods,1996,61(2):1-6.
[3] HOFMANN M,GRIOT C,CHAIGNAT V,et al.Bluetongue disease reaches Switzerland[J]. Schweiz Arch Tierheilkd,2008,150(2):49-56.
[4] TODD R,PAMELA K M,DANIEL B J,et al.Development and application of a quantitative RT-PCR potency assay for a pentavalent rotavirus vaccine[J]. Journal of virological methods,2006,131(2):193-201.
[5] 宋志军,宋长绪,杨增岐,等. 猪生殖与呼吸综合征病毒TaqMan荧光定量RT -PCR检测方法的建立[J]. 中国兽医科学,2006,36(2):98-102.
[6] SCHALK J A,VAN D E C,OVELGÖNNE H,et al.Estimation of the number of infectious measles viruses in live virus vaccines using quantitative real-time PCR[J]. Journal of virological methods,2004,117(2):179-187.
[7] HIGUCHI R,FOCKLER C,DOLLINGER G,et al. Kinetic PCR analysis:real-time monitoring of DNA amplifications[J].Biotechnology,1993,11(9):1026-1030.
[8] Roussel Y,Harris A,Ming H L,et al. Novel methods of quantitative real-time PCR data analysis in a murine Helicobacter pylori vaccine model[J]. Vaccine,2007,25(15):2919-2929.
[9] LIU C C,CHANG H W,YANG G,et al. Development of a quantitative enzyme linked immunosorbent assay for monitoring the Enterovirus 71 vaccine manufacturing process[J]. Journal of virological methods,2011,176(1/2):60-68.
(责任编辑:朱迪国)
The Rapid Quantitative Research of Bluetongue Antigen by qRT-PCR
Liao Defang,Miao Haisheng,Li Huachun,Gao Lin,Kou Meiling,Li Le
(Yunnan Tropical and Subtropical Animal Virus Disease Laboratory,Yunnan Animal Science and Veterinary Institute,Kunming,Yunan 650224)
S851.3
A
1005-944X(2017)10-0090-04
10.3969/j.issn.1005-944X.2017.10.024
国家公益性行业(农业)科研专项(201303035);云南省技术创新人才培养对象(2013HB130);云南省科技计划项目(2016FA005)
并列第一作者:廖德芳、苗海生
李 乐
